응력차폐효과 개선을 위한 저탄성계수를 갖는 Zr-xCu 및 Zr-xSi 합금 연구
초록
치과용 생체재료인 지르코늄계 합금은 기존의 상업용 생체재료와 비교하였을 때, 매우 낮은 자화율을 가지며 인체의 뼈와 유사한 수준의 탄성계수를 갖는다. Zr-xCu 및 Zr-xSi 이원합금의 시편을 설계 및 제작하여 탄성계수를 평가하여 다음과 같은 결과를 얻었다.
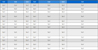
1) 압축시험을 통하여 합금의 응력-변형률 곡선을 얻었으며 Zr-xCu 이원합금은 1291-1411 MPa에 해당하는 압축강도 값을 얻었으며 각각의 시편에서 19.9-20.5 GPa의 탄성계수 값을 보였다.
2) 압축시험을 통하여 합금의 응력-변형률 곡선을 얻었으며 Zr-xSi 이원합금은 1105-1623 MPa에 해당하는 압축강도 값을 얻었으며 각각의 시편에서 22.3-33.1 GPa에 해당하는 탄성계수 값을 보였다.
3) Zr-xCu합금의 경우에는 Cu가 증가함에 따라 항복강도는 거의 비슷하였으나 연신율은 감소하였으며, Zr-xSi 합금의 경우에는 항복강도가 Zr-10%Si가 Zr-1%Si 보다 2배 이상 증가하였으며 연신율은 크게 감소하였다. Zr-xSi 합금의 경우에서 탄성에너지는 Zr-10%Si가 Zr-1%Si 보다 3배 이상 증가하였다.
4) Zr-xCu 및 Zr-xSi 이원합금에서 미세조직적으로 기저부에는 a-Zr과 계면에는 Zr2Cu 및 Zr2Si와 같은 조대한 공정상이 발달하고 합금원소의 첨가에 따라 금속간 화합물인 Zr2Cu 및 Zr2Si 상이 증가하였다.
Abstract
The objective of this study was to fabricate Zr-xCu and Zr-xSi alloys with low elastic modulus for preventing bone resorption in dental biomaterials. Metallic materials are widely used for orthopedic and dental applications due to their superior characteristics of mechanical properties and biocompatibility. Many metals and alloys, such as stainless steel, Co-Cr alloys, and Ti-based alloys are commonly used. Among these dental metallic materials, pure Ti and Ti-6Al-4V alloy have become the most popular metals used for the endosseous parts of the implant, bone plates, and artificial joints due to their excellent specific corrosion resistance and high biocompatibility with natural bone. Stress shield effect results in the reduction in bone density as a result of the removal of typical stress from the bone by an implant. In general, the bone in a healthy person will remodel in response to the loads it is placed under. Therefore, if the loading on a bone decreases, the bone will become less dense and weaker because there is no stimulus for continued remodeling that is required to maintain bone mass. Although Ti-based alloys have been widely used as implant components and devices, its elastic modulus (110 GPa) is much higher than that of natural human bone (10–30 GPa). Serious damage may be easily caused in the human body when the modulus of implant materials does not match the natural bone due to the stress shield effects. Therefore, in recent, persistent efforts have been done to obtain biological hard tissue materials with low elastic modulus to transfer stress to the surrounding bones effectively. The Zr-xCu binary alloy exhibited moderate compressive strength (1291-1411 MPa), yield stress (517-552 MPa), favorable elongation (16.4–49.2%), elastic energy (6.76–7.43 MJ/m3) and low elastic modulus (18.5–23.1 GPa). The Zr-xSi binary alloy exhibited high compressive strength (1105-1623 MPa), yield stress (673-1514 MPa), favorable elongation (6.0–27.2%), high elastic energy (10.2–34.6 MJ/m3) and low elastic modulus (22.3–33.1 GPa). Consequently, Zr-xCu and Zr-xSi binary alloys have the potential to be used as biomaterials with nullifying stress shield effects for biological hard tissue materials.
Keywords:
Biomaterials, Elastic modulus, Zr-xCu binary alloys, Zr-xSi binary alloys, Stress shield effects키워드:
생체재료, Zr-xCU 이원합금, Zr-xSi 이원합금, 탄성계수, 항복강도, 탄성에너지서 론
금속기반 생체용 소재는 외과 및 치과 등의 의료분야에서 다양한 시술부품과 임플란트 재료로 사용되며 인체 경조직 대체용으로 다양하게 응용되고 있다(1-3). 일반적으로 생체재료는 경조직과 결합함에 있어서 독성을 일으켜서 인체에 영향을 미치지 않도록 해야 한다. 특히, 생체조직과 잘 융합되는 생체적합성과 안정성 및 내구성이 매우 중요한 특성이라고 할 수 있다.
기존의 상업용 생체재료로써 금속을 기반으로 하는 소재는 오래 전부터 사용되었으며 귀금속인 금, 크롬과 니켈이 첨가된 오스테나이트강, 티타늄 합금, 코발트-크롬 합금이 널리 사용되고 있다. 최근 생체재료 분야에서 대표적인 금속기반 소재는 순티타늄과 Ti-6Al-4V 합금이다. 이들 티타늄과 그 합금들은 다른 금속보다 화학적으로 우수한 성질을 나타내므로 부식 저항성이 크며 생체적합성이 우수한 것으로 알려져 있다(4-6). 또한 순티타늄과 Ti-6Al-4V 합금은 우수한 화학적 물리적 특성으로 인해 치과용 임플란트, 뼈 플레이트 및 인공 관절뼈 등의 경조직 대체용으로 사용된다(7-9). 특히, 인체 내에 삽입하는 생체재료는 독성에 대한 문제가 매우 중요하다고 생각된다. 대표적인 상용 생체재료인 Ti-6Al-4V 합금에는 고용원소로 첨가된 Al이나 V 원소가 인체 내에서 Ti 기지 금속으로부터 이온화되어 용출되어 인체에 독성을 일으키는 것으로 잘 알려져 있다. 오스테나이트강과 Co-Cr 합금의 경우에는 우수한 기계적 성질과 내산화 및 내부식성을 향상시키는 Ni과 Cr 등의 고용원소가 인체에 알레르기 반응을 일으키는 것으로 보고되고 있다(10, 11). 또한, 기계적인 물성의 경우, 생체재료와 인체의 뼈 사이의 상대적인 탄성계수 차이가 매우 크게 나타난다. 금속기반 생체재료의 일반적인 탄성계수는 대략 수백 GPa 정도로 이는 인체 뼈의 탄성계수 값인 10-30 GPa보다 매우 높은 값을 갖는다. 치과용 임플란트 장치 및 정형외과에 뼈 플레이트 등으로 가장 널리 사용되는 오스테나이트(AISI 316) 강의 탄성계수는 190 GPa, Co-Cr 합금의 탄성계수는 210 GPa이다. 그리고 순티타늄 및 티타늄 합금의 탄성계수는 오스테나이트강 및 Co-Cr 합금보다 낮은 약 110 GPa 정도이지만 여전히 뼈의 탄성계수보다 매우 높다고 할 수 있다(12). 이렇듯 인체에 삽입하는 생체소재와 인체 뼈 사이의 상대적인 탄성계수 차이가 매우 크게 나타나므로 상호 간의 탄성계수 불일치를 일으켜 결국 응력 차폐 효과(stress shield effect)를 유발하게 되고 생체재료가 장기간 인체에 삽입되어 사용될 때 골흡수를 유발할 수 있으며, 생체재료의 파괴 및 체내에서 탈락을 야기할 수도 있다. 따라서 이로 인해 생체재료가 손상되며 금속이온이 체내로 용출 될 위험이 있으며 염증, 바이러스 감염 등과 같은 매우 치명적 부작용이 발생할 수 있다(13, 14).
따라서 본 연구는 금속기반 생체재료의 경우 임플란트를 인체 내에 삽입시 임플란트 소재와 인체 뼈사이의 탄성계수 불일치로 인하여 유발되는 응력 차폐를 방지할 수 있으며 생체친화성이 있는 지르코늄 합금을 설계하고 제작하여 탄성계수를 평가하였다.
재료 및 방법
1. 재료
본 연구에서는 Zr-xCu와 Zr-xSi (x = 0, 1, 4, 7, 10 wt.%)의 공칭 조성을 갖는 지르코늄 이원계 합금을 제작하였다. Zr-xCu와 Zr-xSi 합금 설계를 위해서 상용 지르코늄은 순도 99.99 mass%의 신선(지름 2 mm 길이 300 mm)을 기계 가공하여 팰릿 형태로 준비하였다. 진공 아크용해로에 장입하기 위해서 용해와 취급이 용이하도록 길이 3 mm로 저속 다이아몬드 커팅기를 사용하여 기계가공으로 준비하였다. 무산소동(99.99 mass%) 역시 지름 1.5 mm 길이 300 mm의 신선형태를 입수하여 길이를 3 mm로 기계가공하여 준비하였다. 다결정 실리콘은(99.99 mass%) 역시 지름 1.5 mm 길이를 3 mm로 기계가공하여 준비하였다.
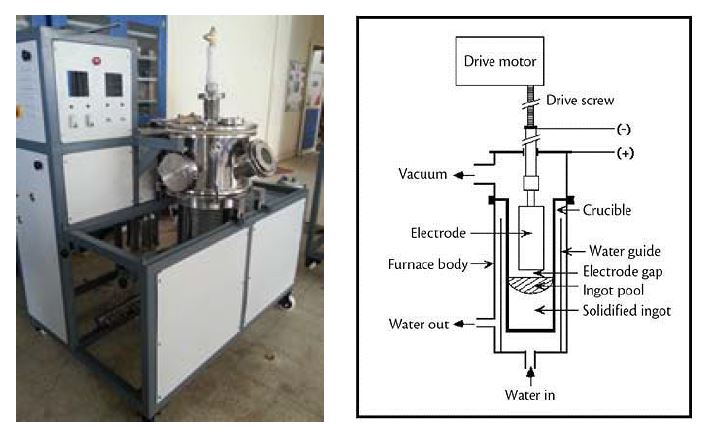
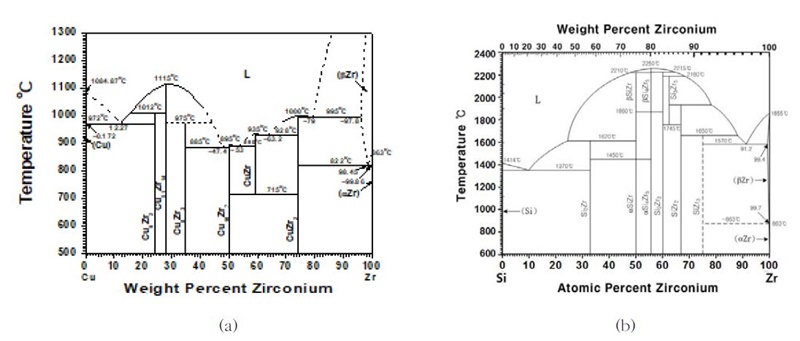
아르콘 가스 분위기의 진공 아크용해로(Arc-melting)를 사용하여 설계조성비를 기준으로 각각 준비한 지르코늄과 무산소동 그리고 실리콘을 용해로에 장입하여 제작하였다. 균일한 합금 조직을 설계하기 위해서 여덟 번 상·하 위치를 반복하면서 재용융처리를 하고 균질화 처리를 진행하였다. Fig. 1에는 본 연구에서 사용한 진공 아크용해로의 사진과 용해로 구조의 개략도를 나타내었다. Fig. 2에서는 Zr-xCu와 Zr-xSi 이원계 합금의 상태도를 나타내며, Zr이 10 at% 에서 80 at% 사이의 범위에서 조성을 갖으면 비정질 Cu-Zr 합금이 생성되며 Zr-rich 비정질 합금은 초전도성을 나타내는 것으로 알려져 있다. 따라서 본 연구에서는 초전도성 비정질 합금의 생성을 방지하기 위해, 최대 10 wt.%의 공칭 조성을 갖는 일련의 합금을 제작하였다. Fig. 3은 아크용해로에 주조된 Zr-xCu와 Zr-xSi 합금의 버튼 모양의 ingot 사진이다.
2. 미세조직 관찰
합금의 표면 미세조직은 Zr-xCu와 Zr-xSi의 버튼형 ingot 시험편을 저속 다이아몬드 커팅기를 사용하여 두께 3 mm로 기계 가공하여 준비하였다. 먼저 표면은 SiC 에머리 페이퍼 #220에서부터 #2000까지의 연마지를 사용하여 기계적 조연마 작업을 실시하였다. 이후 알루미나 페이스트 6 µm, 1 µm, 0.3 µm를 이용하여 미세연마 작업을 하고 최종적으로 진동연마기를 이용하여 SiC 연마액 0.05 µm로 15분간 경면연마를 진행하여 시험편을 준비하는 동안 발생할 수 있는 소성변형 및 잔류응력의 영향을 최소화하여 준비하였다.
표면 미세조직 관찰을 위한 화학적 에칭은 증류수 45 mL, 질산 45 mL 그리고 불산 10 mL (Dist water 45 mL + Nitric acid 45 mL + Hydrofluoric acid 10 mL)를 이용하여 30 ℃에서 약 5초간 에칭액에 시편 전체를 담가 표면부식 처리를 수행하였다. 준비된 시험편은 광학현미경(Optical microscope, OM; Zeiss: Axio Vert. A1, Oberkochen, Germany), 주사전자현미경(Scanning Electron Microscope, SEM; Seron: AIS2000C, Seoul, Korea)을 이용하여 표면 미세조직을 관찰하였다. 복잡한 주조 조직에 대한 다향한 상과 위치에 따른 보다 정밀한 표면 원소 분석을 하기 위하여 전자탐침미소분석시험(Electron Probe Micro Analyser, EPMA; Shimadazu: 1600, Tokyo, Japan)을 이용하여 관찰하였다.
3. 결정상 구조분석
금속기 주조합금은 Fig. 2에 나타낸 평형상태도와 같이 응고 시 재료 내에 온도와 화학적 조성에 따라서 많은 결정상의 조직들이 형성된다. 이들 결정상들은 서로 다른 물리적, 화학적 특성을 나타내므로 이들 결정에 대한 구조분석이 필수적이다. 설계된 시험편의 결정상 구조분석을 위해 X-선 회절분석을 수행하였다. X-선 회절기(X-ray diffraction, XRD; Rigaku: X’pert PRO MPD, Houston, USA)를 이용하여 30°에서 80°까지 스캔간격 0.02°로 유지시간 1 s로 2θ 스캔으로 수행하였다. X-선은 CuKα(λ=1.54060 Å) 타겟 조건으로 튜브 전압 40 kV, 전류 30 mA로 설정하였다. 시험편에 대한 표면 준비과정은 미세조직관찰 시험편의 제작과 동일하게 준비하였다.
4. 탄성계수 측정
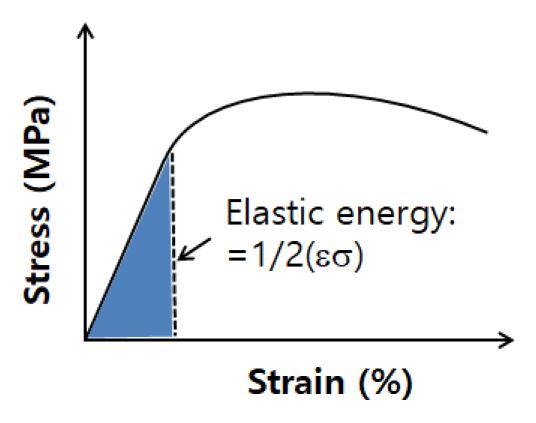
Zr-xCu와 Zr-xSi의 합금원소 첨가에 따른 시험편의 기계적 특성인 압축강도, 연신율 및 영률 등을 측정하기 위해 만능시험기(Universal Testing Machine, UTM; Shimadzu: AG-20 kNX, Kyoto, Japan)를 이용하여 압축시험을 실시하였다. 압축시험편은 폭 3 mm×너비 3 mm×길이 6 mm의 시험편을 와이어 커팅 제작하여 준비하였다. 압축시험은 실온에서 1 mm/min의 크로스헤드 속도를 통하여 하중-변위 곡선으로부터 응력-변형율 곡선을 계산하였다. Fig. 5는 재료의 응력-왜력 곡선이며 재료의 탄성에너지에 대한 개략도이다.
결 과
Fig. 6은 Zr-xCu 이원 합금의 광학현미경을 이용하여 관찰한 미세조직사진이며, Zr은 Fig. 6(a)에서 본 바와 같이 바스켓 위브형태의 미세조직을 갖는 a-Zr의 단상을 보이며, Zr-1%Cu 합금인 Fig. 6(b)에서는 바스켓 위브형태의 간격이 더욱 커져 미세조직이 뚜렷하게 보이는 것을 확인할 수 있다. Fig. 6(c-e)에서 확인되는 미세조직인 회색영역은 a-Zr상, 밝은 백색 영역은 조대한 공정 Zr2Cu상이며, 밝은 영역은 Cu의 첨가량의 증가에 따라 공정 Zr2Cu상 증가 때문이다.

Optical micrographs of Zr-xCu binary alloy; (a) As-cast Zr, (b) Zr-1%Cu, (c) Zr-4%Cu, (d) Zr-7%Cu and (e) Zr-10%Cu.
이러한 미세조직적 특성은 Fig. 7 주사전자현미경 이미지를 통해 더욱 분명하게 확인할 수 있다. Fig. 7(a) 순수 Zr의 이미지로 층상 간격이 좁고 방향성을 가진 바스켓 위브형태의 조직을 나타내고 있다. Fig. 7(b)에서는 1%Cu를 첨가한 Zr-1%Cu 합금의 이미지이며 층간 계면의 간격이 넓어졌으며 층간 계면에 조대한 공정 Zr2Cu 석출상이 존재하였다. Fig. 7(c-e)는 Cu의 첨가 함량이 증가함에 따라 바스켓 위브형태의 조직이 파괴되고 소멸되며, 공정 Zr2Cu 금속간 화합물 영역이 확대되고 조대해지는 것으로 나타났다. 그리고 a-Zr 기지 내에 층상조직이 나타나는데 이는 a-Zr + Zr2Cu의 공정조직으로 구성된다. 이러한 미세조직 관찰을 통하여 Zr2Cu 상은 입계에 분포한다는 것을 확인 하였으며, 결정립 경계 영역의 에너지가 내부 결정립의 에너지보다 높기 때문에 Cu 원자는 결정립계 영역쪽으로 확산이 용이하며 계면에서 금속간 화합물 Zr2Cu를 형성 할 수 있다. 그리고 층 경계에 발달한 공정 Zr2Cu 상을 명확하게 관찰할 수 있다.
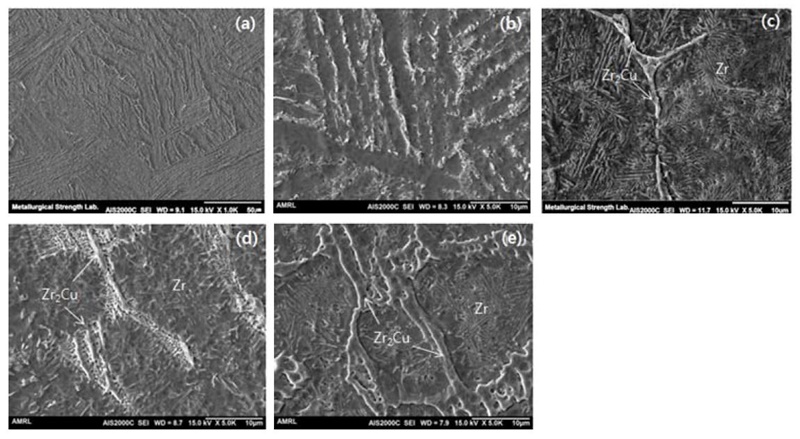
SEM images of Zr-xCu binary alloy; (a) As-cast Zr, (b) Zr-1%Cu, (c) Zr-4%Cu, (d) Zr-7%Cu and (e) Zr-10%Cu.
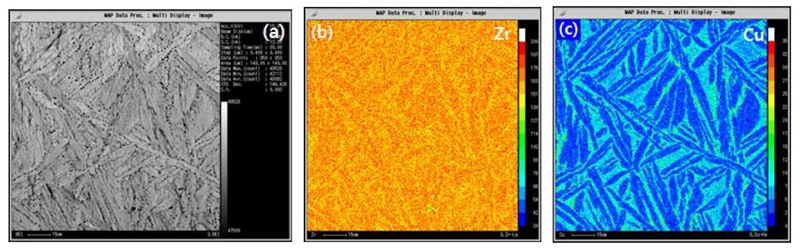
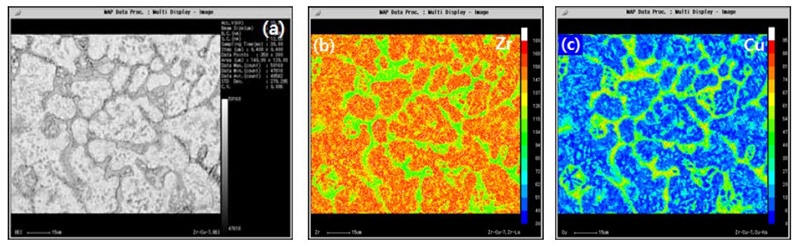
이를 보다 정량적으로 분석하기 위하여 Fig. 8에서는 전자탐침미소분석법인 EPMA를 이용한 각 원소별 이미지 스캔을 실시하였다. 분석결과 미세조직 사진에서 보이는 두 가지의 상(phase)을 확인 하였으며, Fig. 8(a)의 Zr-1%Cu 합금의 합금 맵핑 이미지에서는 바스켓 위브형태의 상을 확인 하였으며, Fig. 9(b) Zr-7%Cu 합금에서는 a-Zr과 Zr2Cu 두가지 상이 존재함을 확인하였다. 특히 Zr기지의 입내로 Cu가 분포하고 있는 것은 이미 언급한 바와 같이 입내에는 a-Zr + Zr2Cu의 공정조직에 의한 Zr2Cu 분간을 나타낸다고 볼 수 있다. Zr2Cu의 화학적 조성은 파장분산 분광 분석기를 통해 66.1 Zr-33.9 Cu mol% 로 측정되었다. Zr2Cu공정상은 계면을 모두 둘러서 원형으로 존재하고 기지부인 a-Zr에는 a-Zr + Zr2Cu의 공정상이 관찰되었다.
Fig. 10은 주조된 Zr-Cu 이원계 합금의 엑스선 회절 분석 (XRD) 프로파일이다. Cu를 첨가하지 않은 Zr에서는 ɑ-Zr 상에 기인하는 회절 피크만이 존재하였다. 그리고 Cu 첨가에 의해 38° 부근에 높은 Zr2Cu 회절 피크가 관찰되었으며, Cu의 함량이 증가함에 따라 피크의 강도도 증가하였다. 이러한 금속간 화합물은 정방정계 Zr2Cu 형 구조를 갖는다. 또한, 이러한 이미지 분석을 통하여 Zr2Cu 상의 분율을 정량적으로 평가하였다. Zr2Cu 상은 Cu 첨가에 따라 크게 증가하였고 15 질량 %Cu에서 약 40% 면적 분율까지 증가한다.
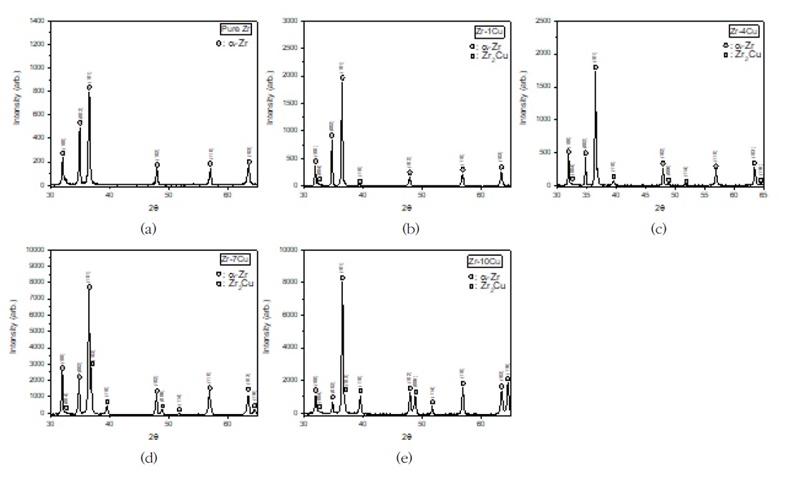
X-ray diffraction profiles of as-cast Zr-xCu binary alloys, which shows the dual phases; (a) pure Zr, (b) Zr-1%Cu, (c) Zr-4%Cu, (d) Zr-7%Cu, (e) Zr-10%Cu.
Fig. 11은 Zr-Si 이원 합금의 미세조직사진을 나타낸다. 순수 Zr은 Si의 첨가에 따른 미세조직과의 비교를 위하여 나타내었다. 이미 설명했듯이 순수 Zr의 경우 바스켓 위브형태의 미세조직을 갖는 a-Zr의 단상이다. Zr-1%Si 합금인 Fig. 12(b)에서는 바스켓 위브형태 조직이 사라지고 수지상정의 미세조직을 나타내었다. Fig. 12(c-e)에서는 a-Zr기지와 판상의 Zr2Si 금속간 화합물을 확인하였으며, Si 함량이 증가함에 따라 공정 Zr2Si 금속간 화합물의 영역이 확장됨을 확인하였다. 이러한 미세조직적 특성은 주사전자현미경 관찰을 통해 더욱 분명하게 확인하였다.

Optical micrographs of Zr-xSi binary alloy; (a) As-cast Zr, (b) Zr-1%Si, (c) Zr-4%Si, (d) Zr-7%Si and (e) Zr-10%Si.

SEM images of Zr-xSi binary alloy; (a) As-cast Zr, (b) Zr-1%Si, (c) Zr-4%Si, (d) Zr-7%Si and (e) Zr-10%Si.
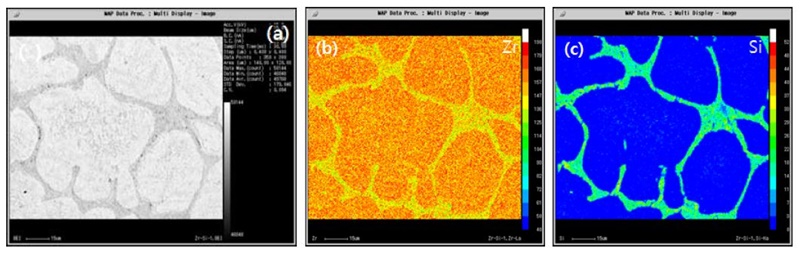
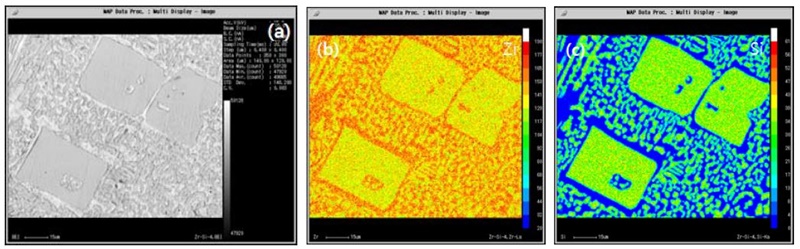
Fig. 12는 각각 Si첨가에 따른 조성별 주사전자현미경의 이차전지 이미지를 나타내었다. Fig. 12(a)는 주조 순수 Zr의 이미지로 좁은 층상 간격과 방향성을 가지고 있으며, 경계에는 매우 작은 석출물이 존재한다. Fig. 12(b)는 1%Si이 함유된 이미지로 Zr 기지를 확인할 수 있으며, Zr + Zr2Si이 입계부분에 석출상으로 나타남을 확인하였다. Fig. 12(c)는 4%Si이 첨가됨에 따라 수지상정의 구조가 사라지고 조대한 판상의 Zr2Si 화합물이 형성되며 Zr 기지에 Zr + Zr2Si의 이차 석출상을 확인하였다. Fig. 12(d-e)의 7%, 10%Si이 첨가되어 Zr2Si의 화합물의 영역이 확대되며 판상의 화합물상이 구상화되어짐을 나타내었다. Fig. 13은 전자탐침미소분석시험을 이용하여 합금 내 표면에서의 원소분포를 분석한 결과이다. Fig. 13(a-c)는 Zr-1%Si 합금을 맵핑한 이미지이다. Fig. 13(a)는 이차전자 이미지로 밝은 영역의 Zr 기지부와 어두운 회색 영역의 Zr2Si 부분이 구분되어진다. Fig. 13(b)는 Zr 원소를 맵핑한 결과로 기지에 Zr기지와 Zr2Si 화합물 영역에 균일하게 분포함을 확인하였으며, Fig. 13(c)의 Si 원소 맵핑 이미지에서는 Si이 화합물 영역에 집중적으로 분포함을 확인하였다. Fig. 14(a-c)는 Zr-4%Si 합금을 맵핑하였으며, Fig. 14(a)는 이차전자 이미지로 밝은 영역의 Zr 기지부와 어두운 회색 영역의 Zr2Si 부분이 구분되어진다. Fig. 14(b) Zr 원소 맵핑 결과로 모든 영역에 균일하게 Zr이 분포함을 확인하였으며, Fig. 14(c) Si 원소 맵핑 이미지에서는 Si가 Zr2Si 화합물 영역과 기지 내 Zr + Zr2Si 구간에 분포함을 확인하였지만, 화합물 경계 구간에서는 Si가 존재하지 않음을 관찰하였다. Zr2Si의 화학적 조성은 파장분산 분광 분석기를 통해 66.1Zr-33.9Si mol%로 측정되었다.
Fig. 15에서는 주조된 Zr-Si 이원계 합금의 엑스선회절 (XRD) 프로파일을 나타낸다. Si를 첨가하지 않은 Zr에서는 ɑ-Zr 상에 기인하는 회절 피크만 존재함을 확인하였다. 그리고 Si 첨가에 의해 35° 부근에서 Zr2Si 회절피크가 높게 관찰되었으며, Si의 함량이 증가함에 따라 회절피크의 강도도 더욱 증가함을 확인하였다. 이러한 이미지 분석을 통하여 Zr2Si 상의 분율을 정량적으로 평가 하였다. Zr2Cu 상은 Cu 첨가에 따라 크게 증가하였고 15 질량 %Cu에서 약 40% 면적 분율까지 증가한다.
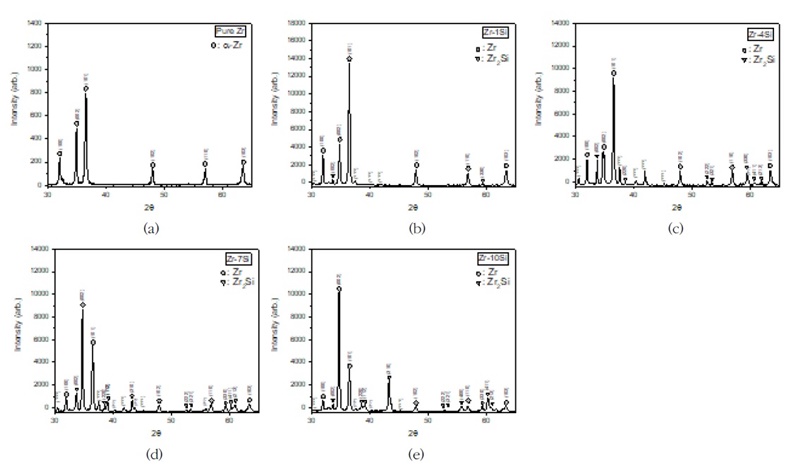
X-ray diffraction profiles of as-cast Zr-xSi binary alloys, which shows the dual phases. (a) Pure Zr, (b) Zr-1%Si, (c) Zr-4%Si, (d) Zr-7%Si, and (e) Zr-10%Si.
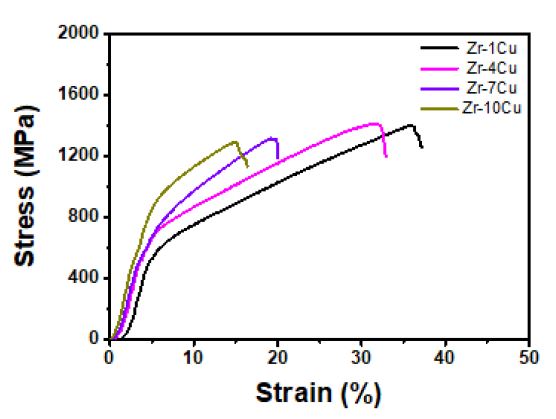
Fig. 16에서는 압축시험을 통한 Zr-xCu 이원계 합금의 응력-변형률 유동곡선을 나타내었다. Table 1에서는 시험을 통해 얻은 데이터로부터 측정한 기계적 특성 값의 결과 데이터를 나타내었다. 압축시험을 통하여 합금의 응력-변형률 곡선을 얻었으며 Zr-xCu 합금은 1291-1411 MPa에 해당하는 압축강도 값을 나타내었고 각각의 시험편에서 19.9-20.5 GPa에 해당하는 탄성계수를 나타내었다. 하지만 Cu의 조성적 차이에 대한 탄성계수의 변화는 크지 않고 미미한 감소를 나타내었다. Cu를 첨가한 합금에서는 압축강도와 연신율 그리고 인성이 감소하였다. 이는 기지인 a-Zr에 상대적으로 경한 Zr2Cu 공정상의 증가에 따른 결과이고 인장하중이 작용 시 a-Zr과 Zr2Cu 계면이 취약해져 균열이 발생하고 연신율과 인성이 감소하게 되었다.
생체 경조직을 대체하는 소재의 경우 고강도 및 낮은 탄성계수는 필수적이고 목적하는 바는 생체용 임플란트재료이다. 탄성변형율과 항복강도, 그리고 응력-변형율 곡선상에서 탄성구역으로 둘러쌓인 영역의 면적은 Fig. 5에서 나타낸 바와 같이 탄성에너지로 표현된다.
여기서, δε 는 탄성에너지, εe는 탄성변형률, σys 는 항복강도, 그리고 E 는 탄성계수이다.
Cu의 함량이 증가함에 따라 탄성에너지는 증가하고 10%Cu에서 최대치를 나타내었다. 반면 인성은 4%Cu 이후 급격하게 감소하였다. Fig. 17에서는 Zr-xCu 합금의 압축시험후 파단면을 주사전자현미경을 이용하여 관찰한 결과를 보여준다. Fig. 17(a)에서 관찰되는 것과 같이 Zr-1%Cu의 경우 파단면은 슬립형상을 나타내고 점차 Cu의 첨가량이 증가함에 따라서 Fig. 17(b-d)에서와 같이 파단면이 전형적인 벽개면 파단으로 발달되고 있다.
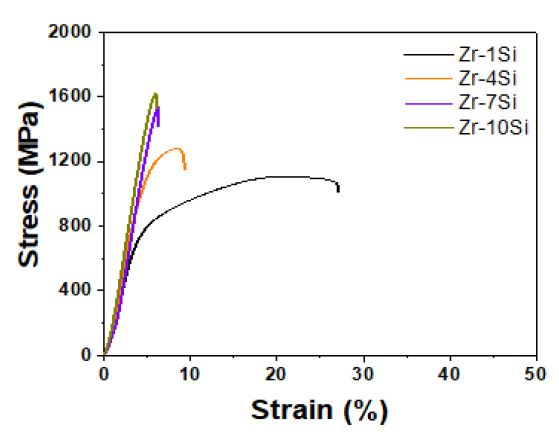
Fig. 18은 압축시험을 통한 Zr-xSi 이원계 합금의 응력-변형률 곡선을 나타내고 있다. Table 2는 시험을 통해 얻은 데이터로부터 측정한 기계적 특성 값의 데이터이다. 압축시험을 통하여 합금의 응력-변형률 곡선을 얻었으며 Zr-xSi 합금은 1105-1623 MPa에 해당하는 압축 강도값을 나타내었고 각각의 시험편에서 22.3-33.1 GPa에 해당하는 탄성계수를 보였다.이러한 탄성계수는 Si 조성적 차이에 따라서 함금원소의 증가함에 따라서 점차 증가하였다. Si를 첨가한 합금에서는 압축강도가 크게 증가하여 10%Si에서는 최대값을 나타내었으나 연신율과 인성은 크게 감소하였다. 특히 항복강도는 합금원소 증가에 따라서 크게 증가하여 10%Si에서는 1%Si에서 비해 2배 이상 증가하였다. 인성은 크게 감소하여 10%Si에서는 초기 인성값의 80%가 감소하였다. 이는 기지인 a-Zr에 상대적으로 경한 Zr2Si 공정상의 증가에 따른 결과이고 인장하중이 작용 시 a-Zr과 Zr2Si 계면이 취약해져 균열이 발생하고 연신율과 인성이 감소하게 되었다. Si의 함량이 증가함에 따라 탄성에너지는 증가하고 10%Si에서 최대치를 나타내었다. 반면 인성은 5%Si 이후 급격하게 감소하였다. Fig. 19는 Zr-xSi 합금의 압축시험후 파단된 파단면을 주사전자현미경을 이용하여 관찰한 결과이다. Fig. 19(a)에서 관찰되는 것과 같이 Zr-1%Si의 경우 파단면은 전형적인 딤플면을 나타내었다. Fig. 19(b)에서는 Zr-4Si에서 딤플면과 벽개면이 동시에 관찰되고 Si 첨가가 증가함에 따라서 Fig. 19(c-d)의 결과처럼 점차 벽개면이 발달하며 균열이 관찰되었다. 특히, Fig. 19(d)에서는 대부분이 벽개면의 파단을 나타내었다.
고 찰
상용화된 금속생체재료는 인체의 뼈보다 일반적으로 높은 탄성계수를 가지고 있다. 대표적으로 가장 많이 사용되는 생체재료인 Ti계 합금은 약 110 GPa의 탄성계수를 가지며, 스테인리스 강과 Co-Cr 합금은 각각 약 190-210 GPa, 210-250 GPa의 상당히 높은 탄성계수 값을 갖는다. 이러한 높은 탄성계수는 인체의 뼈가 가진 탄성계수인 10-30 GPa의 값과 비교하였을 때 수십 배에 해당하는 매우 높은 수치를 나타낸다(15-17). 이러한 인체의 뼈와 생체재료 간의 탄성계수 차이로 인해 재료의 수명 및 인체 뼈의 수명을 단축시키는 결과를 초래하게 된다. 또한, 밀도 차이에 의해 골 흡수 현상이 일어나는데, 이를 응력차폐효과(stress shield effects)라 한다(18-20). 응력차폐효과란 인체의 뼈보다 높은 탄성계수를 갖는 금속 소재의 임플란트가 인체 내에 삽입되면 탄성계수 차이에 의해서 삽입 부위에 받는 하중의 대부분은 임플란트에 가해지게 된다. 이로 인해 삽입 전 존재하던 인체의 뼈가 통상적으로 받아 왔던 인장, 압축, 굽힘 등 힘의 모멘트를 더 이상 받지 않게 된다. 그리고 살아있는 뼈에서는 조골세포(osteoblast)와 파골세포(osteoclast)가 상호작용을 통하여 오래된 뼈 조직을 파괴하고 새로운 조직을 생성해나가는 리모델링 과정을 반복하게 되는데, 임플란트가 식립된 골 주변에서는 모든 스트레스가 임플란트에 집중되므로 인간의 뇌에서 주변의 골이 필요 없는 조직으로 인식되어 파골세포에 의해 흡수되고 약해지게 된다. 이렇게 되면 해당 뼈는 밀도가 낮아지고 나아가 임플란트 주위에 골다공증 등의 합병증이 발생할 수 있다. 이러한 복합적인 요인에 의하여 발생되는 응력차폐효과는 결국 인체 뼈의 약화를 유발하고 외피질 골조직의 밀도를 저하하여 인체 뼈와 인공 임플란트의 결합성을 약화시켜 결국 생체재료의 탈락 또는 파괴로 이어져 수명을 단축시킨다.
일반적인 Ti 합금은 α-Ti, (α+β)-Ti 및 β-Ti 유형의 합금으로 나뉜다(21-26). Ti 및 Ti-6Al-4V ELI와 같은 α 및 (α+β)형 티타늄 합금의 탄성계수는 β형 티타늄 합금의 탄성계수보다 높습니다. 따라서 β형 티타늄 합금은 생체 의학 응용 분야에서 낮은 탄성계수를 갖는 티타늄 합금 개발에 유리하다. 연구자들은 생체친화성이 높고 현재 널리 사용되고 있는 티타늄 합금 중에서 β형 티타늄 합금의 탄성계수(80 GPa)의 수치를 감소시키는데 주목하고 있다. 심한 냉간 가공을 한 다결정 β형 티타늄 합금인 Ti-35Nb-4Si 및 Ti-24Nb-4Zr-7.9Si의 경우 탄성계수가 매우 낮아져 약 40 GPa에 이른다(27). 또한, 용체화 처리를 하여 TNTZ라고 불리는 β형 티타늄 합금인 Ti-29Nb-13Ta-4.6Zr의 탄성계수는 약 60 GPa이다(12). 이렇듯 본 연구에서 설계한 Zr-xCu와 Zr-xSi 합금의 경우, 용체화 처리나 추가적인 소성 변형을 통해서 미세조직을 균질화하고 주조 조직을 연화하여 기계적 강도 특성뿐만 아니라 추가적인 탄성계수 역시 변화시키는 것이 가능할 것으로 생각된다.
응력차폐효과를 피할 수 있는 낮은 탄성계수와 마모 잔해를 줄이기 위한 높은 내마모성, 가혹한 생체 내 환경에서 견디는 높은 내식성 및 피로 저항성을 갖는 새로운 생의학용 합금인 벌크 금속기 유리(bulk metallic glass; BMG)가 연구되고 있다. 최근에 특히 기계적 및 재료적 특성이 우수하기 때문에 BMG에 대한 관심이 높아짐에 따라 Zr계 BMG가 주목을 받고 있다. 다른 합금과 비교하여, Zr계 BMG는 우수한 항복강도, 탄성변형율, 비커스 경도를 나타낸다. 비교적 낮은 소성 변형 및 인성도 가지고 있다. Zr계 BMG의 탄성계수는 인체 뼈에 훨씬 가깝기 때문에 응력차폐 방지에 도움이 된다.
이상의 응력차폐에 대한 문제를 해결하기 위해서는 인체의 뼈와 유사한 탄성계수 값을 갖는 생체재료가 필수적이며 최근에는 지르코늄이 크게 주목받고 있다. 지르코늄은 티타늄과 생체적합성 면에서 유사한 특성을 갖고 있으며, 조밀한 ZrO2 산화물이 형성되어 우수한 골 유착성과 내식성을 가지며 기계적 특성 또한 우수하다. 상용화된 생체재료보다 낮은 탄성계수 값을 가지고 있으므로 연구가 활발히 이루어지고 있다. Nie 등은 Zr-Mo-Ti 합금과 Zr-Si 합금이 인체의 뼈와 유사한 수준의 탄성계수 값을 갖는다고 보고하였으며(28), Morrison 등은 Zr계 BMG의 연구를 통하여 우수한 기계적 특성과 생체적합성을 갖는 지르코늄 금속생체재료에 대해 보고하였다(29).
결 론
본 연구에 사용된 Zr-xCu 및 Zr-xSi 이원합금은 인체의 뼈와 유사한 수준의 탄성계수(15-30 GPa)을 갖는 것을 알 수 있었으며 이는 기존의 티타늄계 합금의 탄성계수보다 더 낮은 값을 보이므로 응력차폐효과면에서 더 유리할 것으로 사료된다.
Acknowledgments
본 논문은 2019년도 조선대학교 연구비 지원을 받았음.
References
-
Chen Q, George T. Metallic implant biomaterials. Mater Sci Eng R: Reports 2015;87:1-57.
[https://doi.org/10.1016/j.mser.2014.10.001]

-
Okazaki Y, Gotoh E. Comparison of metal release from various metallic biomaterials in vitro. Biomaterials 2005;26(1):11-21.
[https://doi.org/10.1016/j.biomaterials.2004.02.005]

-
Okulov IV, Volegov AS, Attar H, Bönisch M, Ehtemam-Haghighi S, Eckert J. Composition optimization of low modulus and high-strength TiNb-based alloys for biomedical applications. J Mech Behav Biomed 2017;65:866-71.
[https://doi.org/10.1016/j.jmbbm.2016.10.013]

-
Helmus MN, Gibbons DF, Cebon D. Biocompatibility: meeting a key functional requirement of next-generation medical devices. Toxicol pathol 2008;36(1):70-80.
[https://doi.org/10.1177/0192623307310949]

-
Hiromoto S, Onodera E, Chiba A, Asami K, Hanawa T. Microstructure and corrosion behaviour in biological environments of the new forged low-Ni Co-Cr-Mo alloys. Biomaterials 2005;26(24):4912-23.
[https://doi.org/10.1016/j.biomaterials.2005.01.028]

-
Narayanan R, Seshadri SK. Anodic oxide coatings on Ti-6Al-4V produced from electrolyte containing Ca and P-Corrosion aspects. J Appl Electrochem 2006;36(4):475-9.
[https://doi.org/10.1007/s10800-005-9099-2]

-
Gepreel MA, Niinomi M. Biocompatibility of Ti-alloys for long-term implantation. J Mech Behav Biomed 2012;20:407-15.
[https://doi.org/10.1016/j.jmbbm.2012.11.014]

- Ratner BD, Hoffman AS, Schoen FJ, Lmons JE. Biomaterials science: An introduction to materials in medicine. Elsevier Academic press Oxford UK, 2004.
-
Sumitomo N, Noritake K, Hattori T, Morikawa K, Sato K, Niinomi M. Experiment study on fracture fixation with low rigidity titanium alloy. J Mater Sci Mater Med 2008;19(4):1581-6.
[https://doi.org/10.1007/s10856-008-3372-y]

-
Gristina AG. Biomaterial-centered infections: microbial adhesion versus tissue itegration. Science 1987;237(4822):1588-95.
[https://doi.org/10.1126/science.3629258]

-
Zhang E, Chen H, Shen F. Biocorrosion properties and blood and cell compatibility of pure iron as a biodegradable biomaterial. J Mater Sci Mater Med 2010;21(7):2151-63.
[https://doi.org/10.1007/s10856-010-4070-0]

-
Niinomi M. Mechanical properties of biomedical titanium alloys, Mater Sci Eng A, 1998;243(1-2):231-6.
[https://doi.org/10.1016/S0921-5093(97)00806-X]

-
Katti KS. Biomaterials in total joint replacement. Colloid Surface B 2004;39(3):133-42.
[https://doi.org/10.1016/j.colsurfb.2003.12.002]

-
Zhou FY, Qiu KJ, Zheng YF, Lin JP. A Comparative in vitro Study on Biomedical Zr-2.5X (X= Nb, Sn) Alloys. J Mater Sci Tech 2014;30(4):299-306.
[https://doi.org/10.1016/j.jmst.2013.12.006]

-
Brunette DM, Tengvalll P, Textor M, Thomsen P. Titanium in medicine: Material science, surface science, engineering, biological responses and medical applications. Springer-Verlag Berlin Heidelberg, 2001.
[https://doi.org/10.1007/978-3-642-56486-4]

-
Cook SD, Weinstein AM, Klawitter JJ. A three-dimensional Finite Element Analysis of a Porous Rooted Co-Cr-Mo Alloy Dental Implant. J Den Res 1982;61(1):25-9.
[https://doi.org/10.1177/00220345820610010501]

- Zardiackas LD, Williamson S. Comparison of Corrosion Fatigue of BioDur 108 to 316L SS and 22Cr-13Ni-5Mn SS. ASTM International, STP1438 2003;194-207.
-
Niinomi M, Nakai N. Titanium-based biomaterials for preventing stress shielding between implant devices and bone. Int J Biomater 2011;836587:1-10.
[https://doi.org/10.1155/2011/836587]

-
Tymofiyeva O, Vaegler S, Rottner K, Boldt J, Hopfqartner AJ, Proff PC, Richter EJ, Jakob PM. Influence of dental materials on dental MRI. Dentomaxillofacial Radiol 2013;42(6):20120271.
[https://doi.org/10.1259/dmfr.20120271]

-
Zhou FY, Wang BL, Qiu KJ, Lin WJ, Li L, Wang YB, Nie FL, Zheng YF. Microstructure, corrosion behavior and cytotoxicity of Zr–Nb alloys for biomedical application. Mater Sci Eng C 2012;32(4):851-7.
[https://doi.org/10.1016/j.msec.2012.02.002]

- Basketter DA, Whittle E, Monk B. Possible allergy to complex titanium salt. Contact Dermatitis 2000;42(5):310-1.
-
Breen DJ, Stoker DJ. Titanum lines: A manifesation of metallosis and tissue response to titanium alloy megaprostheses at the kenn. Clin Radiol 1993;47(4):274-7.
[https://doi.org/10.1016/S0009-9260(05)81138-9]

-
Flatebø RS, Johannessen AC, Grønningsaeter AG, Bøe OE, Gjerdet NR, Grung B, Leknes KN. Host response to titanium dental implant placement evaluated in a human oral model. J Periodontol 2006;77(7):1201-10.
[https://doi.org/10.1902/jop.2006.050406]

-
Long M, Rack HJ. Titanium alloys in total joint replacement-a materials science perspective. Biomaterials 1998;19(18):1621-39.
[https://doi.org/10.1016/S0142-9612(97)00146-4]

-
Murr LE, Quinones SA, Gaytan SM, Lopez MI, Rodela A, Martinez EY, Hernandez DH, Martinez E, Medina F, R.B. Wicker RB. Microstructure and mechanical behavior of Ti-6Al-4V produced by rapid-layer manufacturing, for biomedical applications. J Mech Behav Biomed 2009;2(1):20-32.
[https://doi.org/10.1016/j.jmbbm.2008.05.004]

-
Sicilia A, Cuesta S, Coma G, Arregui I, Guisasola C, Ruiz E, Maestro A. Titanium allergy in dental implant patients: a clinical study on 1500 consecutive patients. Clin Oral Implants Res 2008;19(8):823-35.
[https://doi.org/10.1111/j.1600-0501.2008.01544.x]

-
Li HF, Zhou FY, Li L, Zheng YF. Design and development of novel MRI compatible zirconium-ruthenium alloys with ultralow magnetic susceptibility. Sci Rep 2016;6:24414.
[https://doi.org/10.1038/srep24414]

-
Nie L, Zhan Y, Liu H, Tang C. Novel β-type Zr-Mo-Ti alloys for biological hard tissue replacements. Mater Design 2014;53:8-12.
[https://doi.org/10.1016/j.matdes.2013.07.008]

-
Morrison ML, Buchanan RA, Leon RV, Liu CT, Green BA, Liaw PK, Horton JA. The electrochemical evaluation of a Zr-based bulk metallic glass in a phosphate-buffered saline electrolyte. J Biomed Mater Res A. 2005;74(3):430-8.
[https://doi.org/10.1002/jbm.a.30361]