불소 지속방출 및 생체적합성을 가진 불소 바니쉬의 개발
Abstract
The purpose of this study was to fabricate a biocompatible fluoride varnish with sustained fluoride release, and to compare it with commercial fluoride varnishes. For the experimental fluoride varnish, bis-GMA (BG) or two types of rosin (KR-610: K0, KR-612: K2) were used as bases. Either ethyl acetate or ethanol was added as solvent and 5 wt% NaF was used. 5 mg of experimental F- varnishes and 2 commercial products, Cavity shield (CS) and Flor-opal (FO), were applied on a labial surface of bovine teeth (10 mm × 7 mm). The amount of fluoride release was measured at 1 hr, 2 hrs, 3 hrs, 4 hrs, 8 hrs, 12 hrs, 1 day, 3 days, 5 days, 10 days, 15 days, 20 days and 30 days. MTT test was done with diluted F- varnishes using ethanol. Statistical analysis was done with one-way ANOVA and Duncan multiple range test (α=0.05). BG showed the highest fluoride release at 1 hr (P<0.05), while that of K0 was highest at 2 hrs (P<0.05). From 1 day to 5 days, experimental fluoride varnishes showed higher fluoride release than the commercial products (P<0.05), and there were no significant differences after 5 days (P>0.05). For MTT test, K0 and FO showed higher cell viability than other experimental groups (P<0.05), with no significant differences with K2 (P>0.05). Considering the sustained fluoride release and cell viability of the experimental rosin-based fluoride varnishes compared with commercial products, it will be appropriate for clinical application.
Keywords:
fluoride varnish, fluoride release, cell viability, rosin-basedⅠ. 서 론
치면에 적용된 불소는 치아 경조직의 재광화(remineralization)를 촉진하고 탈회(demineralization)를 억제하여 치아우식을 예방하는 데 효과적이다(Hellig와 Lussi, 2001). Biofilm 내에서 대사에 의해 생성된 당이 pH를 감소시켜 법랑질이 용해된다. 하지만 biofilm에 불소가 존재하고, pH가 4.5보다 낮아지지 않는다면, 표면의 수산화인회석(hydroxyapatite)이 용해됨과 동시에 불화인회석(fluorapatite)이 형성될 수 있다(ten Cate와 Featherstone, 1991). 수산화인회석으로부터 용해된 칼슘과 인은 불화인회석을 형성하여 법랑질 용해를 감소시킨다. 탈회된 법랑질이 잇솔질로 깨끗해지면 타액은 법랑질을 재광화시킬 수 있고, 불소가 존재할 때 이 효과는 향상된다. 결과적으로 우식 유발 환경(cariogenic challenge)에 노출된 후, biofilm fluid 또는 타액 등의 구강 내 환경에 여전히 불소가 존재한다면, 감소된 pH 환경에서도 법랑질에서 상실된 소량의 칼슘과 인은 회복될 수 있다(Cury와 Tenuta, 2009). 우식 과정의 양상인 탈회와 재광화를 촉진하는 pH-cycling 모델을 사용하는 실험에서도 0.03 ppm 보다 많은 불소가 포함되어 있을 때 재광화가 증가한다고 보고하였다(Featherstone, 1999).
불소 도포는 불소함유 치약, 불소 도포용 겔과 폼, 양치액, 그리고 불소 바니쉬를 포함하여 다양한 형태로 이용할 수 있다(Hazelrigg 등, 2003). 전문가 불소 도포의 가장 일반적인 방법은 산성 불화인산(Acidulated phosphate fluoride, APF) 겔을 이용하는 것이다(Seppä 등, 1995). 하지만, APF 겔 적용 후, 얻어진 대부분의 불소는 불화칼슘(Calcium fluoride)을 형성하는 데 소모된다. 형성된 불화칼슘은 물과 타액에 쉽게 용해되며, 구강 내 노출 후 24 시간 안에 소실된다(Rølla 등, 1933).
불소 바니쉬는 레진이나 합성 제재와 함께 사용되는 불소 도포제이다. 치아에 도포되면, 오랫동안 법랑질과 접촉하여 우식을 억제한다(Weintraub, 2003). 불소 바니쉬는 특별한 도구 없이 빠르고 쉽게 적용할 수 있고, 도포 전 전문적인 치아 세정이 필요 없으며, 수분이 있어도 즉시 건조된다. 따라서 영유아를 포함하여 특별한 관리가 필요한 사람에게 안전하게 사용할 수 있다. 또한, 다른 고농도의 도포용 불화물은 10∼15분 경과 후에 구강 내에서 소실되지만, 불소 바니쉬는 비교적 장시간(대개 1일∼7일) 동안 치아표면에 붙어있게 된다(Jin, 2008). 수종의 불소도포제의 평균 우식 감소율을 비교한 Newbrun(2001)의 연구에서 APF 겔이 22%, 2%의 불화나트륨 용액은 29% 그리고 8% 불화주석 용액은 32%의 평균 우식 감소율을 보인 반면, 불소 바니쉬는 38%의 가장 높은 평균 우식 감소율을 보였다.
하지만, 과량의 불소사용은 치아 불소증(dental fluorosis)을 유발할 수 있다. 치아 불소증은 치아 형성기에 발생한 과량의 불소 섭취에 의해 법랑질 발달이 저해되어 반점치나 변색치가 발생하는 치아의 형성 장애이다. Denbesten과 Li(2011)는 상수도 불소화에 사용되는 불소의 농도는 0.7∼1.2 mg/L (보통 1 mg/L)이며, 식수에 1.5 mg/L (1.5 ppm) 이상의 불소가 포함되었을 때, 치아 불소증이 발생한다고 하였다. Mascarenhas(2000)는 0.03∼0.1 mg F/kg body weight 또는 약 0.75∼1.0 mg/day 농도의 불소를 섭취하였을 때, 치아 불소증이 발생할 수 있다고 보고하였다. Mascarenhas(2000)는 0.03∼0.1 mg F/kg body weight 또는 약 0.75∼1.0 mg/day 농도의 불소를 섭취하였을 때, 치아 불소증이 발생할 수 있다고 보고하였다. Beltrán-Aguilar 등(2000)은 불소 바니쉬는 22,600 ppm의 불소를 함유하고 있고, 치아에 도포하였을 때 평균 5.2 mg 의 F-가 적용된다고 하였다. 또한 불소 바니쉬가 도포된 어떠한 환자도 독성 수준을 넘지 않았다고 하였다. APF gel은 불소 바니쉬에 비해 약 절반만큼의 불소를 함유하고 있지만, 구강 내에 도포되는 양은 더 많아서 불소 섭취가 단기간에 일어나며 혈장 불소 농도를 상당히 증가시킬 수 있다(Bawden, 1998). 반면, 불소 바니쉬의 적용은 수시간에 걸쳐 더 적은 양의 불소를 섭취하면서, 불소 독성 반응의 가능성을 제거할 수 있다(Moon 등, 2004).
불소 바니쉬는 다른 불소 제재에 비해 오랫동안 치아에 남아있지만, 첫 7시간 이내에 급격한 불소 방출을 보이고 그 이후로 방출량이 감소한다(Shen과 Autio-Gold, 2002). 또한 몇 가지 불소 바니쉬의 로진 성분은 단시간에 일어나는 작열감 같은 알러지와 연관이 있다(Beltrán-Aguilar 등, 2000). 따라서 치아에 부착되어 오랜 시간 동안 지속적으로 유효한 농도의 불소를 방출하면서, 생체적합성을 가진 새로운 불소 바니쉬의 개발이 필요하다. 이 연구의 목적은 bis-GMA와 로진을 이용한 실험용 불소 바니쉬를 제작하고, 시판용 불소 바니쉬와 실험용 불소 바니쉬의 불소 방출량과 생체적합성을 비교하는 것이다.
Ⅱ. 재료 및 방법
1. 연구재료
Bis-GMA(NK Oligo, EMA-1020, Shin-Nakamura Chemical, Japan)와 두 가지 로진(KR-610, Arakawa, Japan; KR-612, Arakawa, Japan)을 레진 베이스로 사용하여 실험용 불소 바니쉬를 제작하였다. Bis-GMA 65 wt.%, 용매로 ethyl Acetate(SIGMA-ALDRICH, USA) 30 wt.%를 첨가하여 자가중합형 bis-GMA 제재 불소 바니쉬를 제작하였다. 두 가지 로진을 각각 65 wt.%, 용매로 에탄올 30 wt.%를 첨가하여 두 가지 로진 제재 불소 바니쉬를 제작하였다. 세 종류의 실험용 불소 바니쉬는 모두 5 wt.% NaF(Sigma-Aldrich, USA)을 불소의 원료로 사용하여 40℃의 물중탕 하에 기계식 교반기(RW 20 DZM.n, IKA, Germany)로 30분간 혼합하였다.
2. 연구방법
실험용 불소 바니쉬와 시판용 제품을 적용하기 위해, 치관부만 절단된 우치에서 남아있는 치주조직과 치수를 제거하고 치수강에 유틸리티 왁스를 채웠다. 균일한 적용면을 얻기 위해 우치 순면에 10 × 7 ㎜의 테이프를 붙인 후 그 이외의 표면에 매니큐어를 도포하였다. 테이프를 제거한 후 그 부위에 5 ㎎의 불소 바니쉬를 도포하였다. 시편은 각 불소 바니쉬 당 3개씩 준비하였다. 실온에서 10분 간 경화시킨 후, 10 mL의 증류수가 들어 있는 용기에 불소 바니쉬를 도포한 우치를 넣어 37℃, 140 rpm의 진탕항온수조(JSSI-100C, JSR, Cheongwon, Korea)에 보관하였다. 불소 바니쉬 도포 8시간 이후에 우치의 순면에 회전법 동작으로 10회 잇솔질을 하였고, 이후 매 24시간 마다 동일한 방법으로 잇솔질을 시행하였다.
불소 바니쉬를 적용한 우치를 증류수에 보관한 후로 1시간, 2시간, 3시간, 4시간, 8시간, 12시간, 1일, 3일, 5일, 10일, 15일, 20일 그리고 30일에 fluoride ion-selective electrode (9609BNWP, Thermo Scientific™ Orion™, USA)를 사용하여 불소 방출량을 측정하였다. 한 시편당 두 번씩 측정하여 평균값을 취하였고, 같은 방법으로 각각의 불소 바니쉬 당 세 개의 시편을 측정하여 평균을 내었다. 매 측정 시마다 불소 바니쉬가 적용된 우치는 새로운 10 mL의 증류수가 들어 있는 용기에 옮겨졌고, 위와 동일한 방법으로 보관되었다.
두 가지의 실험용 불소 바니쉬(BG와 K0)와 두 가지 시판용 제품(FO와 CS)의 pH를 측정하였다. 불소 방출량을 측정할 때와 동일한 시간에 pH electrode(8102BNUMD, Thermo Scientific™ Orion™, USA)를 사용하여 pH를 측정하였다. 한 시편당 두 번씩 측정하여 평균값을 취하였고, 같은 방법으로 각각의 불소 바니쉬 당 세 개의 시편을 측정하여 평균을 내었다.
실험용 불소 바니쉬와 시판용 불소 바니쉬들을 각각 에탄올에 50:50 비율로 희석하였다. 이렇게 얻어진 용액들과 L929 세포를 이용하여 MTT 시험을 실시하였다. 대조군은 세포와 RPMI 배지만을 사용하였다. 결과값은 대조군의 MTT 환원율을 100%로 표준화하여 백분율로 표시하였다.
통계분석은 SPSS 프로그램(SPSS 12.0; SPSS GmbH, Munich, Germany)을 이용하였다. 불소 바니쉬의 불소 방출량과 누적방출량, 그리고 pH를 Kruskal–Wallis로 신뢰수준 95%에서 분석하였으며, MTT 시험은 각 군을 one-way ANOVA를 사용하여 분석하였다(α=0.05). 사후검정으로는 Duncan multiple range test를 시행하였다.
Ⅲ. 결 과
1. 불소 방출량
우치에 도포된 각각의 불소 바니쉬의 시간대 별 불소 방출량은 Figure 1과 Table 2에 나타내었다. Figure 2는 각 시간대별 불소 방출량을 누적하여 나타낸 그래프이다.
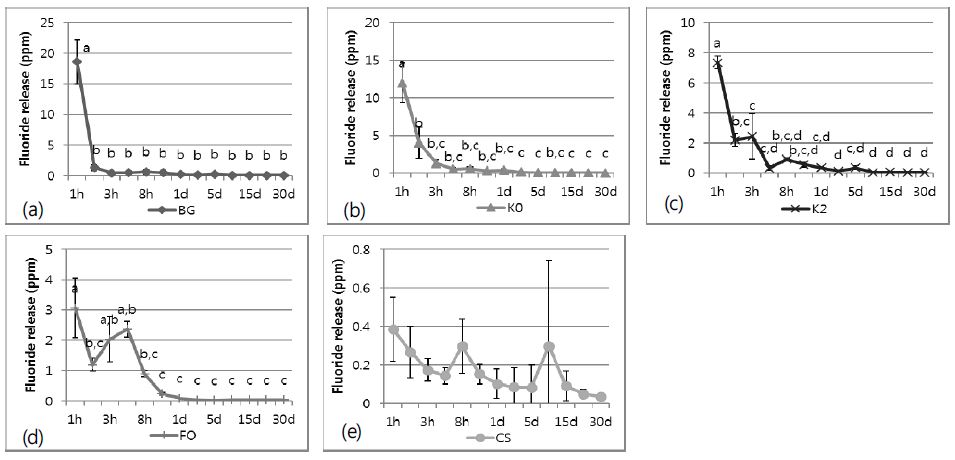
Fluoride release of each fluoride varnish at each time period, (a) bis-GMA based fluoride varnish, (b) KR-610 rosin based fluoride varnish, (c) KR-612 rosin based fluoride varnish, (d) Flor-opal and (e) Cavity shield. Different lowercase letters represent significantly different fluoride release among the time periods by Kruskal-Wallis Test and Duncan multiple range test at ɑ=0.05.

Fluoride release of three experimental fluoride varnishes and two commercial fluoride varnishes used in this study
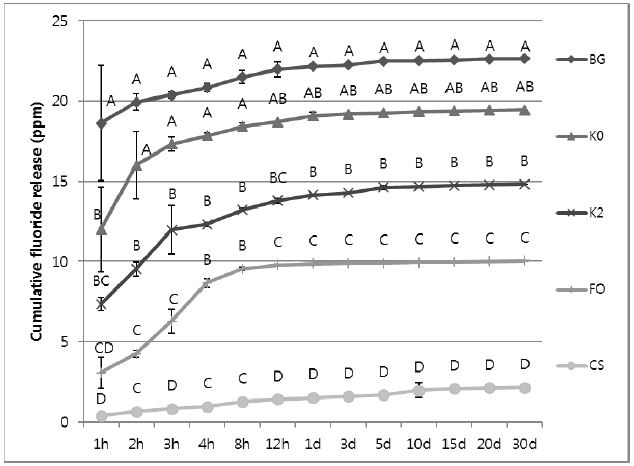
Cumulative fluoride release of each fluoride varnishes used in this study. Different uppercase letters denote significant differences among the materials at each time period by Kruskal-Wallis Test and Duncan multiple range test at ɑ=0.05.
각각의 불소 바니쉬의 시간대별 불소 방출량을 분석해보면, BG는 도포 후 1시간에서 불소 방출량이 가장 높았고(p<0.05), 2시간 후에 통계적으로 유의성 있게 불소 방출량이 감소하였다(p<0.05) (Figure 1). K0는 도포 후 2시간에서 유의성 있게 불소 방출량이 감소하였고(p<0.05), 3일 후에도 불소 방출량의 유의성 있는 감소를 보였다(p<0.05). K2는 K0와 같은 양상으로, 도포 후 2시간과 3일 후에 통계적으로 유의성 있게 불소 방출량이 감소하였다(p<0.05). 시판용 불소 바니쉬 제품들 중에서 FO는 도포 후 2시간과 12시간 후에 통계적으로 유의성 있는 불소 방출량 감소를 보였다(p<0.05). 반면 CS는 실험한 모든 시간대에서 유의성 있는 불소 방출량의 차이를 보이지 않았다(p>0.05).
각 시간대 별로 불소 바니쉬의 종류에 따른 불소 방출량의 차이는 1시간, 2시간, 3시간, 4시간, 1일, 3일 그리고 5일에서 통계적으로 유의성 있는 차이를 보였다(p<0.05) (Table 2). 도포 1시간 후에는 BG의 불소 방출량이 가장 높았고(p<0.05), 2시간 후에는 K0의 불소 방출량이 가장 높았다(p<0.05). 불소 바니쉬 도포 1일에서 5일후까지, 대부분의 실험용 불소 바니쉬의 불소 방출량은 시판용 불소 바니쉬 보다 높았다(p<0.05). 그 이후에는 불소 바니쉬들 간에 유의성 있는 차이가 없었다(p>0.05).
누적 불소 방출량을 비교해 보면, BG가 모든 시간대에서 가장 높은 불소 방출량을 보였다(p<0.05) (Figure 2). 도포 후 12시간 이후부터 K0는 BG와 유의성 있는 누적 불소 방출량의 차이를 보이지 않았다(p>0.05). K2는 12시간 이후부터 K0와 유의성 있는 누적 불소 방출량의 차이가 없었다(p>0.05). FO의 누적 불소 방출량은 그 다음이었고, CS는 가장 낮은 누적 불소 방출량을 보였다(p<0.05).
2. pH
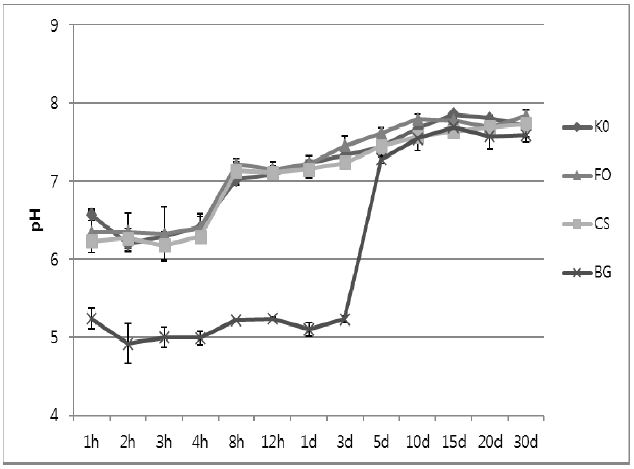
각 시간대별로 측정된 pH는 Figure 3와 Table 3에 나타내었다. BG는 도포 후 3일까지 다른 불소 바니쉬 보다 유의성 있게 낮은 pH를 보였지만(p<0.05), 도포 후 5일에 pH가 상승하여 K0 그리고 CS와 유의성 있는 차이가 없었다(p>0.05).
3. MTT 시험
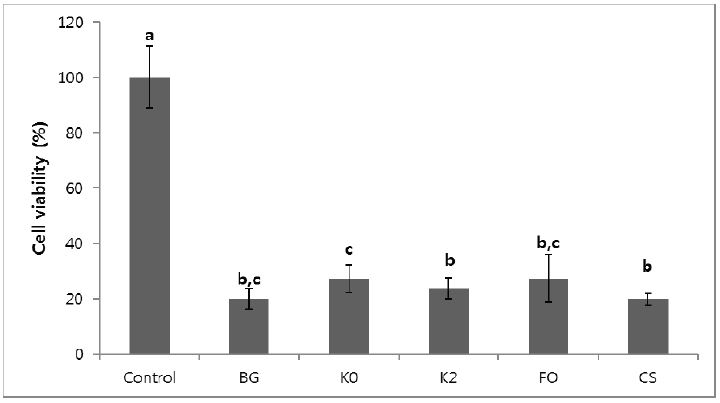
불소 바니쉬의 MTT 시험 결과, 모든 불소 바니쉬는 대조군에 비해 낮은 세포 활성도를 보였다(Figure 4). 실험군 중에서는 K0와 FO이 가장 높은 세포 활성도를 나타내었지만(p<0.05), K2와 유의성 있는 차이는 없었다(p>0.05).
Ⅳ. 고찰
이 연구의 목적은 오랜 기간 동안 지속적으로 유효한 농도의 불소를 방출하면서 생체적합성을 가진 불소 바니쉬를 제작하고, 시중에 시판되는 불소 바니쉬와 이를 비교하는 것이었다. 본 연구에서는 Bis-GMA 등을 사용한 자가중합형 레진을 기질로 하는 실험용 불소 바니쉬와 두 가지의 로진을 각각 기질로 하는 실험용 불소 바니쉬를 제작하였다. 1시간, 2시간, 3시간, 4시간, 8시간, 12시간, 1일, 3일, 5일, 10일, 15일, 20일 그리고 30일에 불소 방출량과 pH를 측정하였다. 또한 각각의 불소 바니쉬는 MTT 시험을 통해 세포 활성도를 평가하였다.
불소 바니쉬의 불소 방출량을 비교해 보면, 도포 후 1시간 후에는 BG가 가장 높은 불소 방출량을 보였지만, 2시간 후에는 K0가 가장 높은 불소 방출량을 보였다(p<0.05). 실험용 불소 바니쉬는 도포 후 1일에서 5일 후까지 시판용 불소 바니쉬보다 대부분 높은 불소 방출량을 보였다. 본 실험에서 사용된 대부분의 불소 바니쉬들은 도포 후 처음 1시간 동안 가장 높은 불소 방출량을 보이고, 이후 몇 차례 유의성 있는 불소 방출량의 감소를 보였다. 그러나 CS는 모든 시간대에서 유의성 있는 불소 방출량의 차이를 보이지 않았다. 누적불소 방출량은 실험용 불소 바니쉬들이 기성 제품보다 유의성 있게 높은 값을 보였다.
BG가 초기에 높은 불소 방출량을 보인 이유는 자가중합형 레진의 중합도가 낮을 때, 불소가 비교적 쉽게 레진 기질을 빠져 나와 유리될 수 있었기 때문이라고 생각된다. 레진의 중합도가 증가한 이후에는 불소가 레진 기질을 뚫고 유리되기 어려워 불소 방출량이 감소한다. 이것은 불소염의 용해도가 낮고, 레진의 견고한 결합과 부족한 친수성 구조 때문이다(Vermeersch 등, 2001). Rawls(1991)의 연구에 따르면, 레진 기질에서 불소가 유리되기 위해서는 일단 물이 이 기질 안으로 분산되어야 하고, 불소염이 용해되어 분산되어 나와야 한다고 보고하였다. 따라서 불소를 오랜 기간 동안 충분히 방출하기 위해서는 레진 조성을 적절하게 조절하여야 한다. 본 연구에서는 오랜 기간 동안 불소를 방출시킬 수 있도록 불소 바니쉬의 조성을 결정하였다. BG는 가장 높은 불소 방출량을 보인 도포 후 1시간 이후를 제외하면, 잇솔질을 시작한 도포 후 8시간 이후에도 통계적으로 유의성 있는 불소 방출량 감소를 보이지 않았다(p>0.05). 이는 자가중합형 레진 기질이 치면과 기계-화학적으로 결합하여, 외부 자극에도 탈락되지 않고 지속적으로 불소를 방출할 수 있었기 때문이라고 생각된다.
K0와 K2 그리고 FO는 모두 수첨 로진(hydrogenated rosin)을 사용하여, CS와 달리 하얀색을 띄었으며, 도포 후 CS 보다 심미적이었다. 또한, K0와 K2 그리고 FO는 CS에 비해 유의성 있게 높은 양의 불소 방출량을 보였다(p<0.05). 일반 로진은 용매내에서 용해(solubility)가 되는 반면, 수첨 로진은 용매내에 분해된 입자들이 관찰되는 분해(disintegration)의 형태를 보인다(Sousa-Neto 등, 1999). 수첨 로진은 로진의 수소화(hydrogenation)로부터 얻어진다. 수소가 첨가되면서 로진내 무기이온들이 포함된 불순물이 제거되고, 불포화된 사슬 화합물의 이중결합은 감소하며, 이러한 결합의 포화(bond saturation)는 입자들의 해리(detachment)를 촉진한다(Sousa-Neto 등, 1999). K0와 K2 그리고 FO의 불소 방출량이 CS보다 높았던 이유는 수첨 로진의 특성으로 인해 기질의 해리가 촉진되어 불소 이온이 좀 더 쉽게 유리될 수 있었기 때문으로 생각된다.
BG와 달리, K0와 K2는 잇솔질을 시작한 8시간 후 한차례 불소 방출량의 감소가 보였다. Featherstone(1999)은 0.03 ppm 보다 많은 양의 불소가 존재할 때 재광화가 촉진된다고 보고하였다. 따라서 본 연구에서는 0.03 ppm을 치아 우식 예방에 유효한 불소 농도로 결정하였다. K0와 K2는 유효 불소 농도인 0.03 ppm 이상의 불소 방출량을 도포 후 30일 까지 유지하였다. 반면, FO는 도포 후 2시간에서 불소 방출량이 감소하였고, 잇솔질을 시작한 8시간 이후에, 도포 후 12시간에서 추가적으로 유의성 있는 불소 방출량의 감소를 보였다(p<0.05). 그 이후로 도포 후 3일과 5일 후에서는 0.03 ppm 이하의 가장 낮은 불소 방출량을 보였다. 따라서 FO는 다른 불소 바니쉬들에 비해 장기간의 우식 예방 효과가 감소 될 것으로 보인다.
CS는 본 연구에서 사용된 불소 바니쉬들 중 가장 낮은 불소 방출량을 보였다. 이 것은 CS와 다른 두 가지 불소 바니쉬를 사용하여 인공타액에 침적 후 유리되는 누적 불소 방출량을 측정한 Shen과 Autio-Gold(2002) 의 연구와 한국에서 시판되는 6가지 불소 바니쉬의 불소 방출량을 비교한 Kim 등(2014) 의 연구 결과와 유사하다. 또한 FO와 CS를 포함하여 4가지의 불소 바니쉬들의 불소 방출량을 비교한 Chau 등(2014) 의 연구 결과에서, FO는 도포 후 31 시간까지 CS 보다 높은 불소 방출량을 보였지만, 그 이후 도포 후 94시간까지 CS가 FO 보다 더 높은 불소 방출량을 나타내었다. 본 연구에서도 이와 비슷한 양상으로, FO의 불소 방출량은 도포 후 1일까지 CS 보다 높았지만, 3일 이후부터는 CS와 유의성 있는 차이가 없었다(p>0.05). CS는 로진을 주요한 기질로써 사용하고 있는데, 이것은 소나무로부터 유래된 100가지 이상의 복합 혼합체이다. 이 성분이 함유된 불소 바니쉬는 도포 시 노란색에서 갈색의 색깔을 띠며, 환자에 따라서는 특유의 냄새에 불쾌감을 느낄 수 있다(Weintraub, 2003). 또한 로진에 의해 CS는 높은 점도를 가지고 있다(Kim 등, 2014). 높은 점도로 인하여 CS에서 다른 불소 바니쉬들에 비해 더 적은 양의 불소가 유리되었을 거라고 생각된다.
불소 바니쉬들의 pH를 비교해 보면, BG는 도포 후 3일까지 약 pH 5의 가장 낮은 pH를 보였고, 5일에서 pH 값이 약 7까지 상승하였다. 반면, 나머지 불소 바니쉬들은 도포 직후부터 약 6.5의 pH를 보였으며, 8시간 만에 pH가 7 이상으로 상승하였다. Gregory-Head와 Curtis(1997)는 구강 내 일반적인 산도는 pH 6.5이며, pH가 1.0씩 낮아질 때마다 치아의 용해도가 7∼8배 증가한다고 하였다. Humphrey와 Williamson (2001)은 타액의 일반적인 pH는 6∼7이며, 타액 분비에 따라 분비량이 적을 때는 pH 5.3에서 많을 때는 pH 7.8의 범위를 가질 수 있다고 하였다. 낮은 pH를 갖는 레진 접착제들의 안전성을 비교한 Schmalz 등(2002)의 연구에서 1.0∼5.2의 pH 값을 갖는 다양한 레진 제재들이 세포독성을 나타내지 않는다고 하였다. 그러나 Sposetti 등(1986)은 5∼7의 pH를 갖는 불소 용액이 치과용 도재 표면을 부식(etch)시키는데 96시간이 걸린다고 보고하였다. 따라서 심미적인 수복물을 위해서는 도재 표면에 손상을 피하기 위해 중성의 불소 용액이 요구된다고 하였다. BG는 3일까지 낮은 pH값을 유지한 반면, 나머지 불소 바니쉬들은 도포 직후부터 구강 내 일반적인 산도인 약 pH 6.5를 나타내었다. 그러므로, BG는 다른 불소 바니쉬에 비해 구강 내 환경에 적합하지 않을 것으로 생각된다. 그러나 본 연구에서는 증류수에서만 불소 바니쉬들의 pH 값을 측정하였으며, 인공타액에서는 이러한 pH의 변화가 달라질 수 있다. 따라서 인공타액에서 불소 바니쉬들의 pH 값을 비교하는 추가적인 연구가 필요하다.
생체적합성을 비교하기 위한 MTT 시험에서 모든 불소 바니쉬들은 대조군보다 낮은 세포 활성도를 보였다. 실험군에서는 K0와 FO가 높은 세포 활성도를 보였고(p<0.05), CS와는 유의성 있는 차이를 보이지 않았다(p>0.05). 본 실험에서 사용된 불소 바니쉬들은 불소의 주원료로 NaF를 사용하고 있다. NaF는 임상적으로 광범위 하게 사용되고 있지만, DNA와 단백질 합성뿐 만 아니라 세포 성장을 억제할 수 있다. Jeng 등(1998)의 실험에서 2 mmol/L (40 ppm)보다 많은 양의 NaF는 oral mucosal fibroblasts에 독성이 있고 단백질 합성과, 세포 ATP level 그리고 미토콘드리아 기능을 투여량에 의존하는 방식(a dose-dependent manner)로 감소시켰다. 따라서, 본 실험에서 사용된 불소 바니쉬들의 대조군 보다 비교적 낮은 수준의 세포 활성도는 NaF의 독성에 의한 것으로 생각된다. 또한, 불소 바니쉬들의 희석에 쓰인 에탄올이 희석된 불소 바니쉬들의 세포 활성도에 영향을 줄 수 있었을 것으로 생각된다. 이에 다양한 용매에 희석된 불소 바니쉬들의 세포 활성도를 차후 더 연구해 볼 필요가 있다. 치과재료의 생체적합성 시험은 3단계로 구분할 수 있다. 제1군은 세포에 대한 독성을 평가하는 시험이고, 제2군은 소형동물을 이용하는 전신독성시험, 유전독성과 매식에 대한 국소 반응시험 등이다. 제3군은 적용시험이라고도 하며, 개와 같은 큰 실험 동물을 이용하여 치과재료를 실제 목적대로 적용하고 기능하도록 한 후, 그 결과를 평가하는 것이다. 산화아연유지놀은 세포 독성시험에서는 심각한 독성을 보여주나, 적용시험에서는 양호한 결과를 나타내는 것으로 알려져 있다. 이 재료의 안전성은 상아질과 이 재료에서 방출되는 물질 사이의 상호관계에 기인한 것으로 여겨진다(Schmalz, 1997). 시판용으로 허가된 불소 바니쉬들도 NaF를 함유하고 있고, K0와 K2는 이와 비슷한 정도의 세포 활성도를 보였다. 따라서, 실험용 불소 바니쉬도 생체적합성에 문제가 없을 것으로 생각된다. 그러나 보다 임상적으로 유효한 결과를 얻기 위해서는 적용시험 등 추가적인 생체적합성 시험 결과가 뒷받침되어야 할 것이다. CS의 기질로 사용된 로진은 몇몇 연구에서 접촉성 알러지원으로 작용한다고 보고되고 있다(Beltrán-Aguilar, 2000; Downs와 Sansom, 1999). K0와 K2 그리고 FO의 경우 수첨 로진을 주요한 레진 기질로 사용하고 있다. Downs와 Sansom(1999)은 수첨 로진은 로진-양성 환자에게 보다 덜한 알러지 반응을 일으킨다고 보고하였다. 따라서, K0와 K2는 임상적으로 로진에 알러지 반응을 보이는 환자들에도 유용하게 적용 할 수 있을 것으로 생각된다.
본 연구에서 불소 바니쉬들의 불소 방출량을 비교해보면, 실험용 불소 바니쉬들은 FO 보다 더 오랫동안 재광화를 촉진하는 유효 농도인 0.03 ppm 이상의 불소를 방출하였다. 처음 1시간 동안 BG의 불소 방출량이 가장 높았지만, 이후에 K0 그리고 K2와 유의성 있는 불소 방출량 차이는 보이지 않았다. pH 측정 결과, BG는 3일까지 약 pH 5의 낮은 산도를 보인 반면, 다른 불소 바니쉬들은 도포 직후부터 구강 내와 유사한 약 pH 6.5이상을 유지하였다. 생체적합성을 비교하기 위한 MTT 시험에서 K0는 FO과 유사한 세포 활성도를 보였고, K2와는 유의성 있는 차이가 없었다.
Ⅴ. 결 론
본 연구에서는 치아에 오래 부착되어 불소를 서서히 유리할 수 있도록 다양한 레진 조성을 이용하여 불소 바니쉬를 제작하였고 이를 시판용 제품들과 비교하였다. 불소 바니쉬들을 구강 내 환경과 유사하게 노출시키기 위해서, 우치에 도포하여 37℃, 140 rpm의 진탕항온수조에 보관하면서 잇솔질을 시행하였다. 또한, 생체적합성을 평가하기 위해 불소 바니쉬 희석액의 MTT 시험을 실시하였다. 각각의 불소 바니쉬의 불소 방출량과 pH 그리고 MTT 시험 결과를 분석하여 다음과 같은 결론을 얻었다.
- 1. 실험용 불소 바니쉬들은 시판용 불소 바니쉬보다 더 많은 양의 불소를 오랫동안 방출하였다.
- 2. 실험용 bis-GMA 제재 불소 바니쉬는 초기 1시간에 가장 높은 불소 방출량을 보였지만, 이후에 실험용 로진 제재 불소 바니쉬와 유의성 있는 차이는 없었다.
- 3. 실험용 bis-GMA 불소 바니쉬의 pH는 초기 3일 동안 약 5의 낮은 산도를 보인 반면, 나머지 불소 바니쉬들은 도포 직후부터 약 6.5의 pH 값을 보였다.
- 4. 실험용 로진 제재 불소 바니쉬와 Flor-Opal은 더 높은 세포 활성도를 보였다
불소 방출량과 pH 그리고 세포 활성도를 함께 고려해 보았을 때, 실험용 로진 제재 불소 바니쉬들은 지속적인 불소 방출과 시판 제품 보다 양호한 생체적합성으로 임상 적용에 적합할 것으로 생각된다.
Acknowledgments
* 이 논문은 2015년도 정부(미래창조과학부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임 (No. 2015R1A2A2A01007393)
References
- Jin, BH., (2008), 불소 바니쉬제품 활용, J Korean Dental Association, 46, p146-149.
-
Bawden, JW., (1998), Fluoride varnish: a useful new tool for public health dentistry, J Public Health Dent, 58, p266-269.
[https://doi.org/10.1111/j.1752-7325.1998.tb03007.x]

- Beltran-Aguilar, ED., Goldstein, JW., Lockwood, SA., (2000), Fluoride varnish: A review of their clinical use, cariostatic mechanism, efficacy and safety, J Am Dent Assoc, 131, p589-596.
-
Chau, NP., Pandit, S., Jung, JE., Jeon, JG., (2014), Evaluation of Streptococcus mutans adhesion to fluoride varnishes and subsequent change in biofilm accumulation and acidogenicity, J Dent, 42, p726-734.
[https://doi.org/10.1016/j.jdent.2014.03.009]

-
Cury, JA., Tenuta, LM., (2009), Enamel remineralization: controlling the caries disease or treating early caries lesions?, Braz Oral Res, 23, p23-30.
[https://doi.org/10.1590/s1806-83242009000500005]

- Denbesten, P., Li, W., (2011), Chronic fluoride toxicity: dental fluorosis, Monogr Oral Sci, 22, p81-96.
-
Downs, AM., Sansom, JE., (1999), Colophony allergy: a review, Contact Dermatitis, 41, p305-310.
[https://doi.org/10.1111/j.1600-0536.1999.tb06178.x]

-
Featherstone, JD., (1999), Prevention and reversal of dental caries: role of low level fluoride, Community Dent Oral Epidemiol, 27, p31-40.
[https://doi.org/10.1111/j.1600-0528.1999.tb01989.x]

- Hazelrigg, CO., Dean, JA., Fontana, M., (2003), Fluoride varnish concentration gradient and its effect on enamel demineralization, Pediatr Dent, 25, p119-126.
- Hellig, E., Lussi, A., (2001), What is the optimum fluoride concentration needed for the remineralization process?, Caries Res, 35, p57-59.
-
Humphrey, SP., Williamson, RT., (2001), A review of saliva: normal composition, flow, and function, J Prosthet Dent, 85, p162-169.
[https://doi.org/10.1067/mpr.2001.113778]

- Jeng, JH., Hsieh, CC., Lan, WH., Chang, MC., Lin, SK., Hahn, LJ., Kuo, MY., (1998), Cytotoxicity of sodium fluoride on human oral mucosal fibroblasts and its mechanisms, Cell Biol Toxicol, 14, p383-389.
-
Kim, HN., Jeong, MS., Kim, SY., Kim, JB., Jeong, SH., (2014), Evaluation of release of fluoride from dental varnishes marketed in Korea, J Korean Acad Oral Health, 38, p131-137.
[https://doi.org/10.11149/jkaoh.2014.38.3.131]

- Mascarenhas, AK., (2000), Risk factors for dental fluorosis: a revies of the recent literature, American Pediatr Dent, 22, p269-277.
- Moon, SK., Lee, JC., Kim, YJ., Lee, SH., Hahn, SH., Jang, KT., (2004), The effect of fluoride varnish and acidulated phosphate fluoride gel on artificial caries lesion – A microcomputed tomographic study, J Korean Acad Pediatr Dent, 31, p212-222.
- Newbrun, E., (2001), Topical fluorides in cares prevention and management: a north americal perspective, J Dent Educ, 65, p1078-1083.
-
Rawls, HR., (1991), Preventive dental materials: sustained delivery of fluoride and other therapeutic agents, Adv Dent Res, 5, p50-55.
[https://doi.org/10.1177/08959374910050010701]

- Rølla, G., Ogarrd, B., Cruz Rde, A., (1993), Topical application of fluorides on teeth : new concepts of mechanisms of interaction, J Clin Periodontol, 20, p105-108.
- Schmalz, G., (1997), Concepts in biocompatibility testing of dental restorative materials, Clin Oral Investig, 1, p154-162.
-
Schmalz, G., Schuster, U., Koch, A., Schweikl, H., (2002), Cytotoxicity of low pH dentin-bonding agents in a dentin barrier test in vitro, J Endod, 28, p188-192.
[https://doi.org/10.1097/00004770-200203000-00011]

- Seppa, L., Leppanen, T., Hausen, H., (1995), Fluoride varnish versus acidulated phosphate fluoride gel a 3-year clinical trial, Caries Res, 29, p327-330.
-
Shen, C., Autio-Gold, J., (2002), Assessing fluoride concentration uniformity and fluoride release from three varnishes, J Am Dent Assoc, 133, p176-182.
[https://doi.org/10.14219/jada.archive.2002.0141]

- Sousa-Neto, MD., Guimaraes, LF., Saquy, PC., Pecora, JD., (1999), Effect of different grades of gum rosins and hydrogenated resins on the solubility, disintegration, and dimensional alterations of grossman cement, J Endod, 25, p477-480.
-
Sposetti, VJ., Shen, C., Levin, AC., (1986), The effect of topical fluoride application on porcelain restorations, J Prosthet Dent, 55, p677-82.
[https://doi.org/10.1016/0022-3913(86)90441-5]

-
ten Cate, JM., Featherstone, JD., (1991), Mechanistic aspects of the interactions between fluoride and dental enamel, Crit Rev Oral Biol Med, 2, p283-296.
[https://doi.org/10.1177/10454411910020030101]

-
Vermeersch, G., Leloup, G., Vreven, J., (2001), Fluoride release from glass–ionomer cements, compomers and resin composites, J Oral Rehabil, 28, p26-32.
[https://doi.org/10.1046/j.1365-2842.2001.00635.x]

-
Weintraub, JA., (2003), Fluoride varnish for caries prevention: comparisons with other preventive agents and recommendations for a community-based protocol, Spec Care Dentist, 23, p180-186.
[https://doi.org/10.1111/j.1754-4505.2003.tb00309.x]