Effects of non-thermal atmospheric pressure air plasma exposure on SLA-treated implant in relation to cellular activity
Surface properties of titanium implants are known as important factors for successful osseointegration. The purpose of this research is to apply recently highlighted non-thermal atmospheric pressure plasma jet (NTAPPJ) on sand blast, large grit, acid etching(SLA) treated Titaniumi surface to improve the hydrophilicity and cellular response. The change in the chemical binding state of SLA-treated Ti before and after the NTAPPJ treatment were determined using field emission scanning electron icroscope, optical surface roughness system, X-ray photoelectron spectroscope, and water contact angle measuring system. MC3T3-E1 cells (murine osteoblastic cell line) attachments and proliferations were examined by the PrestoBlue reagent. This study found that the compressed air-based NTAPPJ treatment on SLA-treated Ti surface significantly increased the hydrophilicity and MC3T3-E1 cell attachments and proliferations. These results suggested that compressed air-based NTAPPJ treatment on the SLA-treated Ti surface had an effect on increasing attachments and proliferations of MC3T3-E1 cell for better osseointegration in vitro.
Keywords:
Cell attachment, Cell proliferation, Non-thermal atmospheric pressure plasma jet, SLA treatment서 론
임플란트의 표면형태는 골유착과 결합조직에 중요한 영향을 끼치는데(Anselme와 Bigerelle, 2006; Meredith 등, 2007), 평활한 표면(smooth surface)보다 거친 표면(rough surface)에서 세포부착이 더 증가한다고 보고되고 있다(Sawase 등, 2008). 또한 표면 조도는 세포의 부착, 증식, 분화와 관련이 있다고 보고된 바 있으며(Uggeri 등, 2010), 기계절삭된 순수티타늄(cp-Ti)에 비해 표면조도가 높은 sand blast large grit acid etching(SLA) 처리된 표면에서 세포 부착 및 증식이 더 활발하다(Gu 등, 2013).
따라서 거친 표면을 가진 임플란트를 식립하였을 때, 세포 부착 및 증식의 활성도가 더 높다(Uggeri 등, 2010). 현재 임상적으로 가장 널리 쓰이는 SLA 처리된 Ti는 거친표면과 미세구조(microstructure) 형태를 띠고 있기 때문에 골성결합(osteointegration)이 뛰어나다. 그러나, SLA 처리된 Ti는 그 표면이 소수성(hydrophobic)이며(Tugulu 등, 2010; Dahotre 등, 2010), 이로 인해 세포부착 활성이 친수성 표면에 비해 낮다는 연구결과가 일각에서 보고되고 있다(Lin 등, 2012). 따라서 표면형태는 우수하나, 가장 큰 단점인 소수성인 표면을 친수성으로 표면개질하면 임상적으로 상당히 안전하고 유용한 임플란트 표면이 될 수 있을 것이다.
플라즈마(plasma)는 흔히 제4의 상(fourth state of matter)이라고 하며, 이는 기존에 고체, 액체, 기체의 3가지 물질 상태에서 추가적으로 에너지를 가하게 되면 생기는 상태로, 이온과 라디칼(radical)로 이루어진 상태를 말한다(McComb, 2010).
기존의 진공상태에서 생성되는 플라즈마와 달리, 상온 대기압 플라즈마는 대기압에서 생성되어, 그 생성비용이 낮고 휴대성이 좋기 때문에 병원 등에서 직접 사용 될 수 있으며, 고온이 아닌 상온에서 생성되기 때문에 열로 인한 인체조직의 훼손이 없고, 열에 민감한 생체재료에도 사용 될 수 있다는 장점이 있다(Morent 등, 2011). 따라서 본 연구에서 SLA Ti 표면을 형태학적으로 유지하면서, 표면조도 변화없이 친수성으로 표면개질하기 위한 기술로 상온 대기압 플라즈마 제트(non-thermal atmospheric pressure plasma jet; NTAPPJ)를 사용하였다. 이러한 상온 대기압 플라즈마를 이용한 연구로는 의과 분야에서 혈액의 응고와 간단한 소독 작용을 보는 연구부터 최근에는 라디칼로 인한 세포의 증식과 암 치료에도 적용되고 있으며, 생체 고분자재료 혹은 생체 세라믹재료에 상온 대기압 플라즈마를 적용하여 친수성을 높게 하고 세포의 증식을 촉진시키는 연구가 진행되고 있다(Morent 등, 2011). 그리고 atmospheric pressure plasma jet을 SLA Ti 표면에 조사하면 접촉각이 작아져 세포가 표면에 넓게 잘 부착될 수 있도록 도와준다는 보고도 있다(Duske 등, 2012; Lee 등, 2013).
현재 상온 대기압 플라즈마를 생체금속에 적용 했을 때 친수성 향상과 그에 따른 세포 부착, 증식 및 분화에 관한 연구는 많이 이루어 지지 않은 상태이므로 이에 대한 연구가 필요하여 본 연구에서 상온 대기압 플라즈마를 사용하여 향후 차세대 임플란트 표면에 대한 기초자료를 마련하고자 한다.
재료 및 방법
1. cp-Ti의 SLA 처리
본 실험에 사용한 cp-Ti는 직경 10 x 10 x 0.4 mm 인 정사각형 형태로, sand grit SiC 연마지로 #400부터 #600, #800, #1200, #2000까지 습식연마 하였다. 각 시편은 아세톤, 알코올, 증류수에 3단계에 걸쳐 각각 15분씩 침전시킨 후, 산화알루미늄(Al2O3) 110 ㎛ 입자를 1 cm의 거리에서 직각으로 0.45 MPa의 압력으로 1분 동안 분사하였다. 그 다음으로 7 % HCl과 27 % H2SO4를 혼합하여 350 ℃에서 5분 동안 침지한 후 증류수로 표면을 세척하였다. 그 후 24시간 동안 실내온도에서 건조 시켰으며, 실험 전 시편을 ethylene oxide(EO) gas로 멸균하였다. 대조군과 실험군은 각각 5개의 시편으로 실험하였다.
2. NTAPPJ 처리
광운대학교 플라즈마 바이오과학 연구센터(Plasma Bio-science Research Center)에서 개발한 장비를 사용하여 상온 대기압 플라즈마 제트(NTAPPJ)를 발생시켜 SLA 처리된 Ti에 조사하였다. 플라즈마 조사구와 SLA 처리된 Ti 시편의 거리는 3 mm로 고정하였으며, 플라즈마 장비의 최대 출력 전압은 2.24 kv, 전류는 1.08 mV이며 압축공기 NTAPPJ는 5 L/min 속도로 각 시편에 0분(SAP0), 2분(SAP2), 10분(SAP10) 씩 조사하였다.
3.NTAPPJ 처리에 따른 표면의 물리학적 특성 변화 관찰
전계방출주사전자현미경(Field Emission Scanning Electron Microscope: FE-SEM, JSM-7100F, JEOL, Japan)으로 SLA 표면이 micro 표면으로 잘 형성되었는지 형태학적 구조를 확인하였으며, NTAPPJ 조사 전과 조사 10분 후 시편의 표면조도 변화를 관찰하기 위해 추가적으로 비접촉 방식의 광학적 표면 조도 측정기(Optical profilometer, GT-X3 BASE, Brucker, Germany)를 사용하였다. VSI 모드에서 렌즈배율을 10배로 하여 측정하였으며, 산술평균조도(Ra)를 기록하였다.
그리고 플라즈마 조사 후 젖음성의 변화정도를 확인하기 위한 접촉각은 상온 대기압 플라즈마를 처리한 즉시 증류수 4 ㎕를 시편 표면에 낙하한 10초 후 비디오 촬영식 접촉각 측정기(Video contact angle measuring device, Phoenix 300, SEO, Korea)로 측정하였다.
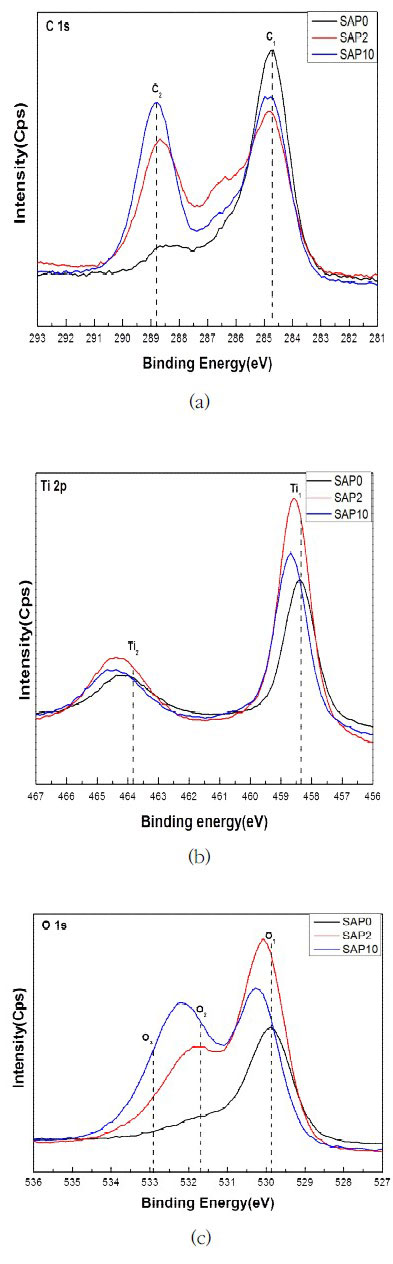
SLA 처리한 티타늄 표면에 플라즈마 조사 후 표면개질된 화학적 결합을 확인하기 위해 X-선 광전자 분광법(X-ray Photoelectron Spectroscopy, XPS)을 이용하여 상온 대기압 플라즈마 조사 전/후의 시편의 원자 구성을 비교/분석하였으며, 친수성과 연관이 있는 산소(oxygen)와 탄소(carbon)의 양을 확인하였다.
4. 조골모세포주(MC3T3_E1) 배양
세포 배양은 Alpha-MEM(LM008-01, Welgene, Korea)배지에 10 % fetal bovine serum(16000, Gibco, USA)과 1 % Penicillin(Lonza walkersille MD USA 0719)을 혼합하여 5 % CO2가 공급되는 37 ℃ incubator에서 배양 시켰다. 본 실험은 3번 계대 배양한 세포를 사용하였다.
5. 세포 부착 및 증식 평가
SLA 시편에서 NTAPPJ 조사 전/후의 세포의 부착(attachment)과 증식률(proliferation)을 평가하기 위해 Prestoblue(Invitrogen, USA)를 사용하여 측정하였다. MC3T3-E1(murine osteoblast)세포를 24–well plates(SPL, Korea)에 SLA 시편을 놓은 후 1x105cells/cm2 을 분주하고 4시간, 24시간, 48시간, 3일, 5일 각각 배양하였다. 각 실험조건의 시간이 경과한 후 phosphate buffer saline (PBS, Gibco, USA)로 두 번에 걸쳐 세척하고 새로운 24–well plates에 시편을 옮겨 담았다. 그리고 해당 plate에 혼합한 배지 90 ㎕와 Prestoblue solutions 10 ㎕를 넣은 후 40분 동안 인큐베이션 하였다. 그 다음 ELISA reader (Epoch, BioTek, USA)를 사용하여 570 nm에서 흡광도를 측정하여 제조회사의 매뉴얼에 따라 결과를 도출하였다.
6. 통계분석
모든 실험은 2회 이상 반복 실험 하였으며, 통계분석은 PASW statistics 18.0 (SPSS Inc., Chicago, IL, USA)을 사용하여 One-Way ANOVA로 통계처리를 하였다. 1종 오류는 0.05로 양측검정하였으며, 사후분석은 Tukey's post test로 검정하였다.
결과 및 고찰
1. 표면 형태 및 표면조도 측정
주사 전자현미경으로 분석된 cp-Ti와 SLA 표면, 그리고 SLA 표면에 공기 NTAPPJ를 10분 동안 조사한 표면은 Figure 1과 같다. SLA 표면에 NTAPPJ 조사하기 전과 후의 형태학적 차이는 없는 것으로 나타났다. 그리고 표면조도를 측정한 결과는 Table 1과 같다. SAP0의 Ra값은 1.74 ± 0.05로 cp-Ti(0.24 ± 0.02)에 비해 그 값이 더 높았으나, SAP10의 표면 조도를 측정한 Ra 값은 1.72 ± 0.08로 SLA 표면에서 공기 NTAPPJ 조사하기 전과 후의 변화는 그룹 간 차이가 없었다(p>0.05). 따라서 NTAPPJ 조사 후 SLA의 고유의 형태는 변하지 않아 본연의 형태를 유지할 수 있는 장점을 확인할 수 있었다.

FE-SEM micrographs of the Ti specimens. (a) cp-Ti, (b) SLA-treated Ti, (c) SLA-treated Ti with NTAPPJ 10 min treatment.
2. 접촉각 측정
플라즈마조사 후 친수성으로 표면개질 된 것을 확인하기 위해 접촉각을 측정하였다. 그 결과 SLA 표면에 플라즈마를 조사하기 전(132.0 ± 6.46o)보다 각각 2분(51.90 ± 5.40o), 10분(10.2 ± 5.95o) 조사 후, 각 집단 간 접촉각이 유의하게 작아졌다(p<0.05). 그러나 선행논문(Lee 등, 2013)과 비교했을 때, 2분 동안 NTAPPJ의 질소가스를 조사한 접촉각(15.34 ± 4.90o)이 2분 동안 압축공기를 조사한 본 연구의 접촉각보다 더 작았다(Table 2).
3. XPS 분석
본 연구에서 SLA 처리한 표면에 플라즈마를 조사하여 표면층에 존재하는 원소를 분석한 결과는 Figure 2와 같다. 산화 피막층에서 관찰되는 C1s의 피크는 표면의 불균형(segregation)에서 비롯된 것이기 때문에 임플란트의 가공과정에서 일어난 오염 때문이라고 알려져 있다(Kasemo와 Lausmaa, 1985). 본 연구에서는 NTAPPJ를 조사한 결과 hydrocarbon(284.8 eV)의 intensity가 SAP2, SAP10 모두 줄어든 것을 확인할 수 있었다(Kang 등, 2009). 그러나 이와 같은 결과는 nitrogen을 이용한 선행연구(Lee 등, 2013)와 동일하지 않았다. 본 연구에서 공기 NTAPPJ를 조사한 결과 C-O peak(288.7 eV)이 급격히 증가하였으며, 이는 전체적인 carbon의 양은 줄지 않았으나, 오히려 C-O peak의 결합에너지가 증가하여 친수성으로 표면개질되어 세포부착에 도움이 될 것이라 예상된다(Aita 등, 2009). Ti2p peak 분석결과 오른쪽 Ti의 Ti2p3/2 피크는 458.3 eV의 결합에너지를 가지고, 왼쪽 Ti의 Ti2p1/2 피크는 463.9 eV의 결합에너지를 가진다. 두 피크의 결합에너지 차이는 5.6 eV이며 이는 Ti가 anatase TiO2에서 Ti4+로 존재하고 있음을 뒷받침해 준다(Kang 등, 2009). O1s peak에서 NTAPPJ를 조사한 후 O1 peak은 격자 산소(Lattice oxygen)가 나타났으며, O2 peak은 H-O group (531.6 eV), O3 peak은 C-O, C=O (532.9 eV)의 결합이 관찰 되었다(Ungvari 등, 2010). 특히 NTAPPJ를 조사 한 후 O1, O2, O3의 peak이 급격히 증가하였다. 이와 같은 결과, SLA 표면에 NTAPPJ를 조사한 후 친수성으로 표면개질이 되었다.
4.MC3T3-E1세포를 이용한 플라즈마 전/후의 세포 부착 및 증식률
SLA 처리된 Ti 임플란트 표면에 플라즈마 조사 시 세포의 부착 및 증식률의 변화를 알아보기 위해 세포실험을 하였으며, 그 결과는 Figure 3과 같다.
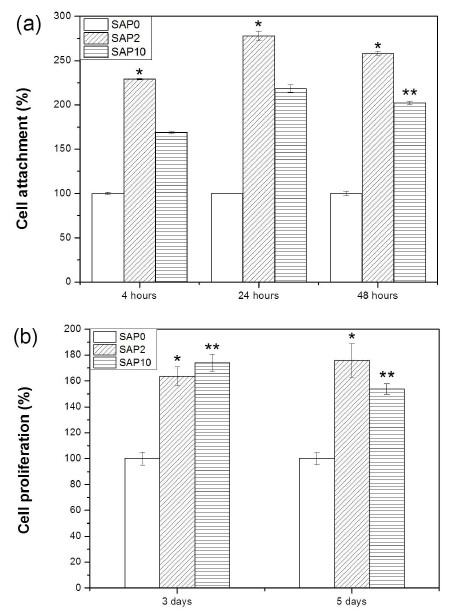
Cell attachment and Proliferation.MC3T3-E1 cellular activity on SAP0, SAP2, SAP10 samples; (a) cell attachment rate, (b) cell pro- liferation. Symbol* mean a significant difference in comparison with the SAP0 samples (P<0.05). Symbol** mean a significant difference in comparison with the SAP0 and SAP2 samples(P<0.05). SAP0; SLAtreated Ti, SAP2; SLA-treated Ti with 2 min NTAPPJ, SAP 10; SLA-treated Ti with 10 min NTAPPJ.
세포 부착은 NTAPPJ를 각각 2분, 10분 조사하여 시간경과(4시간, 24시간, 48시간)에 따라 그 결과를 알아보았다. 그 결과 세 그룹 모두 NTAPPJ를 조사하기 전 보다 조사한 후에 세포 부착률이 증가하였으며, 대조군에 비해 2분 조사한 SLA 표면에서 부착률이 유의하게 증가하였다(p<0.05). 그리고 48시간 후 대조군에 비해 SAP2, SAP10 모두 세포부착률이 유의하게 증가하였으며, SAP2와 SAP10 두 그룹에서도 통계적으로 세포부착률이 유의하게 증가하였다(p<0.05).
또한 세포 증식률에서는 대조군에 비해 3일과 5일 모두 SAP2, SAP10에서 세포가 증가하였으며, SAP2와 SAP10 두 그룹 간에서 세포증식률에 유의한 차이가 있었다(p<0.05). 그러나 본 실험 결과 NTAPPJ 시간에 따른 경향성이 뚜렷하게 나타나지 않았고, 오히려 플라즈마조사를 극대화한 10분이 아닌 2분만 조사하였을 때 세포활성도가 더 높았다. 이것은 XPS 결과와 연결시켜 해석할 수 있다. C1s peak 에서 C1은 AP10 보다 AP2 peak이 확연하게 낮게 나타난 반면 Ti2p 와 O1s peak에서는 T1 과 O1 각각 AP10 보다 AP2 peak이 높았다. 이와 같은 이유로 NTAPPJ 조사 후 표면개질로 인하여 2분 동안 플라즈마 표면 개질한 실험군 보다 10분 동안 플라즈마 표면개질한 시편에서 세포의 초기부착이 감소하였다.
따라서 SLA 처리된 표면에 NTAPPJ를 조사하면 친수성이 증가하여 세포활성도가 우수해 져서 NTAPPJ를 조사하기 전보다 조사 후에 세포부착과 증식률이 대조군보다 유의하게 높아짐을 알 수 있었다(p<0.05). 그러나 nitrogen gas를 사용한 선행연구(Lee 등, 2013)와 compressed air를 사용한 본 실험연구결과 접촉각과 화학기에서 서로 다른 차이가 나타났음을 확인하였으며, 추후 nitrogen과 compressed air NTAPPJ의 조건에 따른 세포활성도를 비교할 필요가 있다.
결 론
SLA 처리된 Ti 임플란트 표면에 상온대기압 플라즈마 제트(compressed-air NTAPPJ)를 조사하여 표면개질 후 표면을 관찰하였고, MC3T3-E1세포를 사용하여 세포부착 및 증식에 관한 연구 결과는 다음과 같다.
1.SLA 처리된 표면에 NTAPPJ를 조사하기 전과 후 형태학적 차이와 표면조도의 차이는 없었다(p>0.05).
2.SLA 처리된 표면에 NTAPPJ 조사하기 전(132.0±6.46)보다 10분 조사 후(10.2±5.95) 접촉각이 낮아져 친수성으로 표면개질 되었다(p<0.05).
3.NTAPPJ 조사 후 SLA 처리된 표면층의 원소를 X-선 광전자 분광법(XPS)으로 분석한 결과, hydrocarbon peak은 감소하였으며, Ti2p와 O1s peak의 결합에너지는 증가하였다.
4.NTAPPJ 조사 후 MC3T3-E1 cell의 세포부착 및 증식률은 대조군(SAP0)보다 실험군(SAP2, SAP10)에서 통계적으로 유의하게 높아(p<0.05), NTAPPJ 조사 하지 않은 표면에 비하여 생체활성도가 우수하였다.
Acknowledgments
이 논문은 2012년도 정부(미래창조과학부)의 재원으로 한국연구재단의 기초연구사업 지원을 받아 수행된 것임(2012R1A1A2008659).
References
-
H Aita, N Hori, M Takeuchi, T Suzuki, M Yamada, M Anpo, T Ogawa, The effect of ultraviolet functionalization of titanium on integration with bone, Biomaterials, (2009), 30(6), p1015-25.
[https://doi.org/10.1016/j.biomaterials.2008.11.004]

- K Anselme, M Bigerelle, Effect of a goldpalladium coating on the long-term adhesion of human osteoblasts on biocompatible metallic materials, Surf Coat Tech, (2006), 200, p6325-6330.
-
DS Lee, Y Moriguchi, K Okada, A Myoui, H Yoshikawa, S Hamaguchi, Improvement of Hydrophilicity of Interconnected Porous Hydroxyapatite by Dielectric Barrier Discharge Plasma Treatment, Plasma Science, IEEE Transactions, (2011), 39(11), p2166-7.
[https://doi.org/10.1109/TPS.2011.2157840]

-
NB Dahotre, SR Paital, AN Samant, C Daniel, Wetting behaviour of laser synthetic surface microtextures on Ti-6Al-4V for bioapplication, Philos Trans A Math Phys Eng Sci, (2010), 368(1917), p1863-89.
[https://doi.org/10.1098/rsta.2010.0003]

-
K Duske, I Koban, E Kindel, K Schröder, B Nebe, B Holtfreter, L Jablonowski, KD Weltmann, T Kocher, Atmospheric plasma enhances wettability and cell spreading on dental implant metals, J Clin Periodontol, (2012), 39(4), p400-7.
[https://doi.org/10.1111/j.1600-051X.2012.01853.x]

-
YX Gu, J Du, MS Si, JJ Mo, SC Qiao, HC Lai, The roles of PI3K/Akt signaling pathway in regulating MC3T3-E1 preosteoblast proliferation and differentiation on SLA and SLActive titanium surfaces, J Biomed Mater Res A, (2013), 101(3), p748-54.
[https://doi.org/10.1002/jbm.a.34377]

-
BS Kang, YT Sul, SJ Oh, HJ Lee, T Albrektsson, XPS, AES and SEM analysis of recent dental implants, Acta Biomater, (2009), 5(6), p2222-9.
[https://doi.org/10.1016/j.actbio.2009.01.049]

- B Kasemo, J Lausmaa, Tissue-integrated prostheses, Osseointegration in clinical dentistry Metal selection and surface characteristics, In:Bråanemark PI, Zarb GA, Albrektsson T(eds.),. Quintessence, Chicago, (1985), p99-116.
-
EJ Lee, JS Kwon, SH Uhm, DH Song, YH Kim, EH Choi, KN Kim, The effects of non-thermal atmospheric pressure plasma jet on cellular activity at SLA-treated titanium surfaces, Current Appli Phys, (2013), 13, pS36-41.
[https://doi.org/10.1016/j.cap.2012.12.023]

-
YH Lin, PW Peng, KL Ou, The effect of titanium with electrochemical anodization on the response of the adherent osteoblast-like cell, Implant Dent, (2012), 21(4), p344-9.
[https://doi.org/10.1097/ID.0b013e31825fed00]

-
GB McCombs, ML Darby, New discoveries and directions for medical, dental and dental hygiene research: low temperature atmospheric pressure plasma, Int J Dent Hyg, (2010), 8(1), p10-5.
[https://doi.org/10.1111/j.1601-5037.2009.00386.x]

-
DO Meredith, MO Riehle, ASG Curtis, RG Richards, Is surface chemical composition important for orthopaedic implant materials?, J Mater Sci Mater Med, (2007), 18, p405-413.
[https://doi.org/10.1007/s10856-006-0706-5]

-
R Morent, N De Geyter, T Desmet, P Dubruel, C Leys, Plasma Surface Modification of Biodegradable Polymers: A Review, Plasma Process Polym, (2011), 8(3), p171-90.
[https://doi.org/10.1002/ppap.201000153]

-
T Sawase, R Jimbo, K Baba, Y Shibata, T Ikeda, M Atsuta, Photo-induced hydrophilicity enhances initial cell behavior and early bone apposition, Clin Oral Implants Res, (2008), 19(5), p491-6.
[https://doi.org/10.1111/j.1600-0501.2007.01509.x]

-
S Tugulu, K Löwe, D Scharnweber, F Schlottig, Preparation of superhydrophilic microrough titanium implant surfaces by alkali treatment, J Mater Sci Mater Med, (2010), 21(10), p2751-63.
[https://doi.org/10.1007/s10856-010-4138-x]

-
J Uggeri, S Guizzardi, R Scandroglio, R Gatti, Adhesion of human osteoblasts to titanium: A morpho-functional analysis with confocal microscopy, Micron, (2010), 41(3), p210-9.
[https://doi.org/10.1016/j.micron.2009.10.013]

-
K Ungvari, I.K Pelsoczi, B Kormos, A Oszko, Z Rakonczay, L Kemeny, M Radnai, K Nagy, A Fazekas, K Turzo, Effects on titanium implant surfaces of chemical agents used for the treatment of peri-implantitis, J Biomed Mater Res, (2010), 94(1), p222-9.
[https://doi.org/10.1002/jbm.b.31644]