Evaluation of osseointegration between the 3D-printed polymeric root analogue implant and alveolar socket of the rat incisor
The aim of this investigation was radiographic and histologic evaluations of the 3D reconstructed root analogue implant(RAI) placed in extraction sockets of maxillary incisor of Sprague-Dawley(SD) rats. Thirteen male 10-week-old SD rats were used in this study. Using a Micro computed tomography(μCT) scan, maxillary incisor images of the SD rat were obtained. CT images of the incisor were converted to the STL(standard triangulation language) format and RAIs were 3D-printed. The replicas were made of ABS(acrylonitrile butadiene styrene) and PLA(polylactic acid). Each replica was coated with titanium for the protection barrier. Surface morphology and thickness of coating were analyzed by the SEM(scanning electron microscope). Incisor replicas were placed into extraction sockets after a tooth extraction. After 4 weeks, rats were sacrificed and radiographic images were taken. Decalcified sections were prepared for a light microscopic study. Incisor replicas fitted into the extraction socket due to its congruence with the socket. Rats were well fed for 4 weeks without the inflammation. Radiographic images did not show any particular evidence of the bone resorption. The histometric evaluation on RAIs of ABS, PLA showed a mean mineralized bone-to-implant contact of 45.3±14.2% and 37.2±5.5%, respectively. The present data suggests that titanium coating enables osseointegration and makes polymer material possible as an dental implant.
Keywords:
3D print, Dental implant, Histology, Osseointegration, Rat, Root analogue implant서 론
치과용 임플란트는 치아 상실을 회복하는 주된 술식의 하나로 1969년 Brånemark 등이 처음 시도하였으며, 현재 치아 상실을 회복하는데 있어 주요한 치과 술식이 되었다. 성공적인 임플란트의 시술을 위해서는 초기안정성이 중요시되며 임플란트 식립시 골-임플란트 사이의 접촉 양상이 안정성에 큰 영향을 주게 된다(신 등, 2012). 특히 발치와에 즉시 식립하는 경우 임플란트의 외형이 발치와에 긴밀하게 적합되지 않으므로 초기안정성은 식립부위의 골질과 골량에 크게 좌우된다. 따라서 발치 후 즉시 식립하기 보다는 어느 정도의 골 치유기간을 허용하여 식립부위의 초기안정성을 확보하는 것이 필요하다는 보고가 있다(Adell 등 1981, Tarnow 등 1993).
최근 3D scanner와 cone beam computed tomography (CBCT)가 발달하여 환자의 악골구조에 대한 공간구조적인 정보를 얻기가 용이해지고 numerically controlled(NC) machining으로 대표되는 절삭가공과 rapid prototyping (RP), 3D printing으로 알려져 있는 적층가공법이 널리 사용되면서 치아의 형태를 그대로 재현하는 치근재현형 임플란트(Root analogue implant, RAI) 시도가 이루어졌다. RAI는 발치하고자하는 치아에 꼭 맞는 형태로 임플란트를 재현하기 때문에 앞서말한 초기안정성이 뛰어나며 치유기간이 짧고 다양한 벡터로 적용되는 구치부의 교합력을 더욱 잘 지지할 수 있다. 그간 보고된 RAI의 경우 모두 임플란트의 성공적인 골유착(osseointegration)을 위해 티타늄과 지르코니아를 재료로 사용하였다.
본 연구에서는 엔지니어링 플라스틱으로 분류되는 ABS (acrylonitrile butadiene styrene)와 생흡수성 고분자인 PLA(polylactic acid)를 재료로 선택하여 RAI를 제작하고 표면에 티타늄 코팅을 시행하여 성공적인 골유착이 일어나는지 생체실험을 통해 확인하였다. 동물모델로서 랫드(rat)의 상악 중절치를 선택하고 3차원 데이터의 취득을 위해 computed-tomography(μCT), 3차원 가공을 위해 3D printer를 사용하였다.
재료 및 방법
1. 실험재료
실험에 사용될 랫드를 전신마취하에 Micro-CT(Skyscan 1176, Bruker-MicroCT, Kontich, Belgium)를 통해 18㎛의 해상도로 스캔하여 랫드의 두개골 영상을 얻었다. 획득한 CT 영상은 CT-Analyser Version 1.13 software (Bruker-MicroCT, Kontich, Belgium)를 이용하여 상악절치 부분의 이미지만을 분리하고 STL(standard triangulation language) 형식으로 저장하였다. 취득한 절치 영상은 Autodesk Meshmixer software(Autodesk Inc., San Rafael, CA, USA)를 이용하여 불필요한 artifact를 제거하고 기하학적으로 안정한 단일 곡면으로 닫힌 구조가 되도록 편집하였다. 재구성된 STL 파일은 slicing software인 Cura 13.04(Ultimaker, Geldermalsen, Netherlands)를 이용하여 3D 프린터가 인식할 수 있는 명령어의 집합인 G-code로 변환되었다.
본 연구에서는 open-source 기반의 3D Printer(NP-Mendel, Opencreators, Seoul, Korea)를 사용하여 랫드의 상악 절치를 출력하였다. 0.25mm의 노즐을 선택하고 z-layer의 수직증가폭을 0.1mm로서 설정하였으며 50mm/s의 속도로 출력하였다. 1.75mm 직경의 필라멘트로 공급되는 열가소성 수지인 ABS(acrylonitrile butadiene styrene)와 PLA(polylactic acid)를 매식재 원료로 사용하였고 RAI의 출력온도로 각각 230℃(ABS)와 185℃(PLA)를 사용하였다.
출력된 RAI는 이온코팅업체(TTIP, Incheon, Korea)에 의뢰하여 직경 20cm 높이 10mm의 grade 2 pure titanium을 target으로 사용하는 plasma sputtering 방식으로 코팅하였다. 코팅된 RAI는 ethylene oxide gas로 소독하여 수술을 위해 준비하였다.
티타늄 코팅의 표면과 두께를 보기위해 각 시편은 액체질소를 이용하여 냉각시킨 후 절단하였다. 주사전자현미경(JEOL JSM 6510, JEOL LTD, Tokyo, Japan)으로 티타늄 코팅표면과 코팅두께를 관찰하였다(Figure 1).
2. 동물실험
13마리의 수컷 Sprague-Dawley rats (체중 250~300g, 10주령)을 1주일간의 순응 기간을 거친 뒤 수술과정을 진행하였다. 티타늄 코팅이 된 ABS, PLA 식립군을 각 6마리로 나누고 어떠한 치료도 하지 않은 1마리로 대조군을 설정하였다. 모든 실험은 단국대학교의 동물실험 윤리위원회(Institutional Animal Care and Use Committee, IACUC)의 사전 승인 이후, 단국대학교 약학대학의 특정항원제어(specific pathogen free, SPF) 실험동물실과 준SPF 환경의 설치류 사육실에서 단국대학교의 표준작업지침(standard of procesures)을 준수하며 진행하였다.
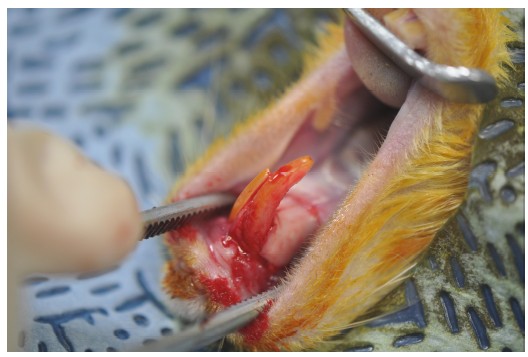
본 연구에서 모든 전신마취는 zoletil(50mg/kg), rumpun (10mg/kg)을 합제하고 근육내 주사하여 이루어졌다. 마취제 주입 후, povidon-iodine 용액과 70% ethyl alcohol으로 살균하고 수술부위를 격리하였다. 2% lidocaine을 시술 부위 피하에 주입한 뒤 랫드의 상악 절치 주위에 피판을 형성하고 rodent luxator를 이용하여 탈구하고 발치하였다(Figure 2). 사전에 준비된 RAI를 랫드의 발치와에 식립하였으며 이후 피판을 4-0 ethilon(Ethicon, LLC., Somerville, NJ, USA)으로 봉합하였다. 식립 후 4주의 치유기간을 거친 뒤 각 동물을 희생하였다.
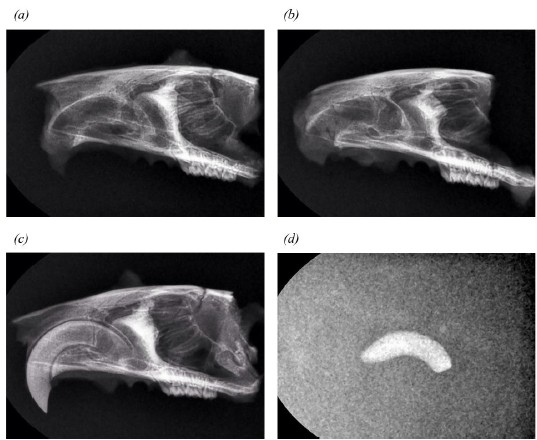
실험 동물은 전신마취 하에 10% neutral buffered formalin을 심장에 perfusion injection하여 희생한 후 상악 두개골을 분리했다. 상악골의 정중선을 기준으로 시상면 절단하였고, 각 절단 부위들을 방사선 촬영하였다.
3. 조직형태학적, 조직계측학적 분석
절단된 샘플들은 10% neutral buffered formalin에 4일 동안 고정시킨 후, RapidCal(BBC Biochemical, Mt Vernon, WA, USA)을 이용해 12시간 동안 탈회 처리했다. 시편을 paraffin wax에 embedding한 후 microtome을 이용하여 10㎛ 두께로 시상면에 평행하게 절단하였다. 절단된 시편은 Hematoxylin & Eosin (H&E)염색을 시행하였다. 염색된 시편을 형광현미경(Eclipse 80i, Nikon, Melville, NY, USA)으로 각 section을 10배, 40배로 촬영하고 관찰하였다.
40배로 촬영된 이미지는 photoshop(Adobe Systems, Inc., San Jose, CA, USA)에서 병합되었으며, 치근단 부위를 제외한 치조골-RAI 경계 길이를 계측하여 총 길이에 대한 골유착 길이의 비율을 구하였다.
결 과
총 13마리 중, 실험군 4마리가 수술 중 사망하였으며, 2 마리가 조직학적으로 계측이 어려운 결과가 나와 제외되었다. 랫드의 좌우 양측 모두에 RAI를 식립하는 것을 원칙으로 하였으나 의도적인 탈구시 파절되거나 발치와가 심하게 손상된 경우 편측 식립하였다. 그 외의 경우 모두 정상적인 치유과정을 거쳤으며, 임상적으로 관찰되는 부종이나 염증, RAI의 동요 등 특이할 만한 합병증은 없었다. 식립 후 최종적으로 관측한 개체는 ABS군에서 4마리, PLA군에서 4마리였다.
1. 방사선학적 평가
랫드의 희생 후 시상면 절단된 조직의 방사선 사진에서 어떠한 골소실 또는 근단부 병변도 확인할 수 없었다(Figure 3). RAI는 방사선 상에서 불투과상으로 나타나 골조직과 구분하기 어려웠다.
2. 조직학적 및 조직계측학적 평가
골유착을 평가하는데 있어 전통적인 조직계측학적인 방법인 골접착 길이 비율(bone contact length ratio, BCLR)을 통해 임플란트의 골유착을 평가하였다(Ko 등, 2010). Table 1에 각 매식체의 골과 임플란트 간 BCLR이 제시되었다. ABS군과 PLA군은 각각 45.3±14.2%와 37.2±5.5%의 골유착 비율을 보였다.

Histometric calculation along the bone-implant interface (bone contact length divided by implant length).
조직학적인 관찰 결과, 골과 RAI 사이의 염증 반응은 관찰되지 않았다. RAI와 접해있는 연조직의 주행방향은 RAI의 표면과 평행하게 주행하였으므로 기존 발치와에 존재하는 치주인대가 RAI 표면에 재부착은 없었다고 할 수 있다. 개재된 연조직의 구성은 혈구, 조골세포와 섬유성 조직의 다양한 구성을 보였으며 이는 특히 치근단 부위에 뚜렷하였다(Figure 4).
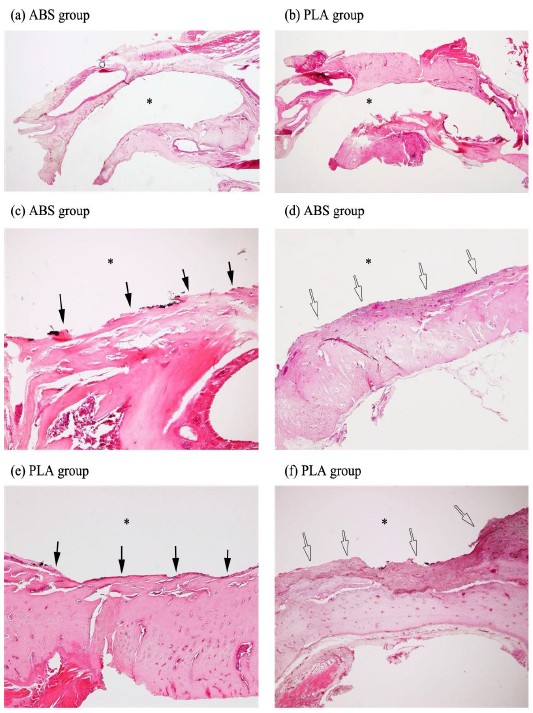
Calcified section stained with hematoxylin and eosin. (a, c, d) ABS; (b, e, f) PLA; (a, b) Representative histologic images of ABS & PLA group at 4 weeks after implatation. (x10); (c, e) Representative histologic images of osseointegration on the surface of ABS, PLA group. Direct contact between the bone and RAI surface is pointed to by black arrow. Trabecular bone is extending to RAI surface. (x40); (d,f) Representitive histologic images of soft tissue contact(white arrow).; Asterisk means the position of RAI.
고 찰
본 연구에서는 고분자의 대표적인 3차원 출력법인 fused deposition modelling(FDM) 3D printer를 이용하여 랫드의 상악 중절치를 출력하였다. 과거 신속조형술(rapid prototyping)로 설명되던 3차원 조형법은 금속, 세라믹, 고분자 등의 적층 기술 특허들이 만료됨에 따라 치의학에서 재조명받고 있는데(Liu 등, 2006), 다양한 조형방식들이 보고되어 있으나, 고분자에 있어서는 FDM, stereolithography(SLA), digital light processing(DLP) 기법들이 존재한다. 이들 중 열가소성 수지를 고온에서 용융하여 정확한 좌표지점에 출력하는 FDM 방식은 구현하기 쉽고 경제적인 출력방법으로 인해 가장 널리 보급되어 있다. FDM 출력 원료로서 역시 가장 많이 보급된 출력재료인 ABS, PLA를 선택하여 치근형태의 매식체(RAI)를 준비하였다.
일반적으로 고분자는 골유착이 필요한 치과용 임플란트로서 적절하지 않다고 보고되어 있다. 1969년 Hodosh는 baboon 원숭이의 치근과 똑같은 모양을 갖는 polymethacrylate implant를 발치와에 식립하여 치과용 고분자 식립체(dental polymer implant)의 가능성을 평가하였다. 당시 Hodosh는 치주인대 조직이 고분자로 재현된 치근에 재결합이 이루어진 것으로 믿었으나 이 시도는 후에 섬유조직의 피막형성(fibrous tissue encapsulation)으로 확인되었다(Kohal 등, 1997). 1983년 Brånemark에 의해 티타늄과 뼈의 골성결합을 이용한 치과용 임플란트 시스템이 성공적으로 소개된 후 치과용 고분자 식립체(dental polymer implant)는 더 이상 보편적인 치료방법으로 생각되지 않았다.
고분자는 생체친화성의 정도에 따라 섬유조직으로 둘러싸여 피막형성이 일어나거나 조직에 의해 흡수가 일어난다. 본 연구에서는 이러한 고분자의 생체 내에서의 특징을 극복하고 골성결합을 유도하기 위해 고분자의 표면에 티타늄 처리를 시행하였다. 그리고 코팅된 RAI의 생체적합도를 확인하기 위해 관리가 용이하고 관찰기간을 단축시킬 수 있는 랫드의 구강 모델을 이용하였다. 과거 Futami와 Fujii의 랫드를 이용한 티타늄 식립체의 구강 모델 연구에서 28~30일 경 골유착을 확인하였으므로 본 연구에서는 4주간의 치유기간 후에 랫드를 희생하였다. 희생 후 동물은 임상적, 방사선학적인 이상 증상이 없었으나 조직학적인 관찰 결과, 100%의 완전한 골성결합은 확인되지 않았다. 특히 이는 치근단 부위에 분명하였는데 랫드의 절치는 일생에 걸쳐 계속 맹출, 성장하므로 이 부위는 치근 발육에 기여하는 조직으로서 발치와의 소파가 부족하다면 연조직으로 잔존하는 것으로 생각된다. 본 연구에서는 치주인대가 초기 골형성에 필요한 골기질 단백질인 collagen type I으로 이루어져 있다는 점에 착안하여 랫드 절치의 발치 후 적극적인 치주조직의 소파를 하지 않았다. 따라서 본 연구에서 치근단 부위는 골접촉 계측에서 제외하였다. 소파하지 않은 치근단 부위가 골성결합의 질에 영향을 미쳤는지는 향후 연구를 통해 살펴볼 필요가 있다.
골유착은 전통적으로 조직학적인 표본을 획득하여 골접촉 길이 비율(BCLR)을 평가한다. 이 방법은 조직학적 결과를 확인하며 동시에 골유착의 양적인 평가를 할 수 있다는 장점이 있다. 하지만 보다 정확한 골유착은 3차원적인 골접촉 면적 비율(bone contact area ratio, BCAR) 를 통해 얻을 수 있을 것이다. 2010년 Ko 등은 μCT와 조직학적인 방법을 통해 치과용 임플란트의 BCLR과 BCAR을 비교하여 통계적인 유의성이 없음을 밝힌바 있다. μCT를 통한 BCAR이 비파괴적이며 복잡한 조직처리과정 없다는 장점이 있으나, 조직반응을 면밀하게 관찰 할 수 없으므로 조직표본을 통한 BCLR 계측을 통해 뒷받침할 필요가 있다. 향후 μCT가 매식체의 골유착을 양적으로 평가하는데 있어 도움이 되리라 사료된다.
본 연구와 달리 성공적인 골성결합이 일어난다고 알려진 티타늄과 지르코니아를 통해 RAI를 실험한 몇몇의 결과가 있다. Kohal 등은 티타늄을 절삭가공하고 원숭이에 적용하였으며 Mangano 등은 지르코니아를 밀링하여 인간의 발치와에 적용하였다. 더불어 Pirker 등은 티타늄을 이용하여 선택적 용융 소결(selective laser sintering) 방식을 이용하여 치아의 형태를 3D printing하고 인간에게 적용한 임상증례를 보고하였다. 이 연구들은 훌륭한 초기안정성을 보이는 RAI의 장점을 확인하였으며 전통적인 치과용 임플란트의 디자인의 대안으로 RAI를 평가하였다.
고분자 재료는 티타늄과 지르코니아처럼 골유착이 확인되는 재료는 아니지만 적은 에너지로 정밀한 적층조형이 가능하며 복합레진처럼 쉽게 심미적인 특징을 재현할 수 있다. 특히 공업용 고분자군인 엔지니어링 플라스틱(engineering polymer)은 인체의 경조직 탄성계수와 유사하므로 의료용 원료로써 다양한 응용 가능성이 있다(Pruitt 2011). 고분자는 지르코니아와는 달리 고온의 소결과정이 필요하지 않으며 티타늄과 달리 치아 색을 재현할 수 있어 심미적이다. 이번 연구에서 표면에 부여된 티타늄 피막이 큰 거부반응 없이 골유착을 보였으므로 고분자를 통해 실제 크기의 심미적인 치관을 갖고 골유착이 가능한 치근을 갖는 전체 치아형태의 매식체(tooth analogue implant, TAI)가 가능하다. 정상 치아의 치근면에 존재하는 치주인대막(periodontal ligament membrane)이 치조골에 치아를 고정하고 치근 흡수를 막는 역할을 하는 것처럼, TAI 표면에 부여된 티타늄 코팅이 골유착성 계면(osseointegrating interface)으로서 발치와에서 매식체를 지지하고 매식체의 원료인 고분자가 생분해(biodegradation)되는 것을 막을 수 있을 것이다. 게다가 고분자는 자체의 심미성으로 원래의 치관의 형태를 일체형으로 재현할 수 있어, 심미성이 요구되는 전치부에서 발치 후 즉시 식립할 수 있는 매식체로써 사용할 수 있을 것이다.
골유착성 계면(osseointegrating interface)이 구강 내 교합력에 장기간 안정할 수 있기 위해서 임상집단의 종적 연구(longitudinal study)가 필요하며 최적의 표면 처리 조건과 적절한 고분자 선택에 대한 근거가 뒷받침 되어야 할 것이다. 이러한 연구는 그간 미비한 편이었으나 Polyamide 계열의 Nylon 680(taulman 3D, St Louis, MO, USA) 같은 FDM printing을 위한 의료용 고분자(medical grade polymer) 재료가 FDA승인 후 시판를 앞두고 있고 인간 치아에 대한 RAI의 임상 증례보고가 성공한 바 있어 TAI의 전망을 밝게 하고 있다(Kohal 등, 1997;Pirker 등, 2011).
요 약
200nm의 티타늄 코팅이 된 열가소성 고분자를 랫드의 상악중절치 발치와에 식립하여 골성결합을 평가하였다. ABS군과 PLA군은 각각 45.3±14.2%와 37.2±5.5%의 골유착을 보였으며 이로서 고분자 기반의 물질도 표면처리를 통해 치과용 임플란트로서 사용될 가능성을 확인할 수 있었다.
References
- 정열 이, 원창 이, 민수 김, 종은 김, 상완 신, 임플란 트의 직경, 길이 및 디자인변화가 임플란트 안정성 지수(ISQ)에 미치는 영향, 대한치과보철학회지, (2012), 50(4), p292-298.
-
PI Brånemark, R Adell, U Breine, BO Hansson, J Lindstro¨m, A Ohlsson, Intra-osseous anchorage of dental prostheses. I. Experimental studies, Scand J Plast Reconstr Surg, (1969), 3, p81-100.
[https://doi.org/10.3109/02844316909036699]

-
CY Ko, D Lim, BH Choi, J Li, HS Kim, Suggestion of New Methodology for Evaluation of Osseointegration between Implant and Bone based on μ-CT Images, International Journal of Precision and Manufacturing, (2010), 11(5), p785-790.
[https://doi.org/10.1007/s12541-010-0093-1]

- P Ducheyne, LA Pruitt, Comprehesive biomaterials, 1st ed, (2011).
- Amsterdam: Elsevier, p373-379.
- KH Fujii N, T Maed, A histological study on tissue responses to titanium implantation in rat maxilla : the process of epithelial regeneration and bone reaction, J Periodontol, (1995), 198, p485-95.
-
T Futami, N Fujii, H Ohnishi, N Taguchi, H Kusakari, H Ohshima, Tissue response to titanium implants in the rat maxilla: ultrastructural and histochemical observations of the bone-titanium interface, J Periodontol, (2000), 71, p287-98.
[https://doi.org/10.1902/jop.2000.71.2.287]

-
HA Hansson, T Albrektsson, PI Branemark, Structural aspects of the interface between tissue and titanium implants, The Journal of prosthetic dentistry, (1983), 50, p108-113.
[https://doi.org/10.1016/0022-3913(83)90175-0]

-
M Hodosh, M Povar, G Shklar, Dental polymer implant concept, J Pros Dent, (1969), 22(3), p371-380.
[https://doi.org/10.1016/0022-3913(69)90200-5]

-
RJ Kohal, MB Hurzeler, LF Mota, G Klaus, RG Cafessee, JR Strub, Custom-made root analogue implants placed into extraction sockets. An experimental study in monkeys, Clin Oral Implants Res, (1997), 8, p386-392.
[https://doi.org/10.1034/j.1600-0501.1997.080505.x]

-
Q Liu, MC Leu, SM Schmitt, Rapid prototyping in dentistry: technology and application, Int J Adv Manuf Technol, (2006), 29, p317-335.
[https://doi.org/10.1007/s00170-005-2523-2]

-
FG Mangano, B Cirotti, RL Sammons, C Mangano, Custom-made, root-analogue direct laser metal forming implant: a case report, asers Med Sci, (2012), 27, p1241-1245.
[https://doi.org/10.1007/s10103-012-1134-z]

-
Moin DA, Hassan B, Mercelis P, Designing a novel dental root analogue implant using cone beam computed tomography and CAD/CAM technology, Clinical Oral Implants, (2011), 24, p25-27.
[https://doi.org/10.1111/j.1600-0501.2011.02359.x]

- W Pirker, A Kocher, Immediate, non-submerged, root-analogue zirconia implant in single tooth replacement, Int J Oral Maxillofac Surg, (2008, 37, p293-295, 10.1016/j.ijom.2007.11.008).
-
W Pirker, D Wiedemann, A Lidauer, A Kocher, Immediate, single stage, truly anatomic zirconia implant in lower molar replacement: A case report with 2.5 years follow-up, Int J Oral Maxillofac Surg, (2011), 40, p212-216.
[https://doi.org/10.1016/j.ijom.2010.08.003]