Effects of plasma surface modification to HA-coated titanium on preosteoblast adhesion and differentiation
Plasma technique has been proposed as a tool to produce a hydrophilic surface to hydroxyapatite (HA)-coated titanium, which is used as dental implant. The objective of this study was to evaluate the effect of plasma treated HA coated titanium on preosteoblast adhesion, proliferation and differentiation. The contact angle of plasma treated HA-coated titanium was lower than that of HA-coated titanium. Cells on HA-coated titanium and plasma treated HA-coated titanium spreaded and proliferated preosteoblast equally. But the MC3T3-E1 preosteoblast cells cultured on plasma treated HA-coated titanium enhanced the ALP activity and the expression of osteocalcin and osteopontin gene. The result demonstrated that atmospheric plasma decreased the contact angle of HA-coated titanium surface and promoted the differentiation of the MC3T3-E1 osteoblast cell by enhancing ALP activity, osteocalcin and osteopontin gene expression
Keywords:
Plasma, HA-coated Titanium, Contact angle, Preosteoblast, Adhesion, Differentiation서 론
치과용 생체재료에 수년 동안 다양한 표면처리를 통하여 세포 부착 및 골유착 증가 등의 효과를 극대화 하고자 하는 노력이 많이 시도되어져 왔다 (Gotfredsen 등, 1990; Jansen 등, 1991; Ikada, 1994; Gustavo 등, 2008; Jimbo 등, 2008; Le Guéhennec 등, 2007). 특히, 치과용 임플란트로 널리 사용되는 타이타늄은 샌드블라스팅 (sandblasting), 산 에칭 (acid etching) 등의 물리화학적 표면 처리 외에도 최근에는 생물학적 활성을 띠는 물질(bioactive substances) 코팅하였을 때, simulated body fluid (SBF) 용액에서 미네랄화를 촉진하는 결과를 보인다고 보고하였다 (Sandrini 등, 2003). Webster 등은 하이드록시아파타이트 (Hydroxyapatite)에 의해 유도되는 나노스케일의 표면에서 골아세포의 증식이 증가된다고 보고 하였으며 (Webster, 2001), 특히 Lee 등도 치과용 타이타늄 임플란트에 하이드록시아파타이트를 코팅하면, 골아세포의 증식을 증진 시키고, 골아세포 분화도 촉진하였으며, 뼈의 해면조직을 이루는 주요 단백질인 콜라젠의 발현도 촉진한다고 보고 하였다 (Lee 등, 2011). 하지만, 타이타늄 임플란트의 표면에 하이드록시아파타이트를 코팅하면, 표면 거칠기는 증가하지만 접촉각이 커지는 단점이 있다 (Lee 등, 2011).
대기압 플라즈마 처리가 치과용 임플란트 금속 젖음성을 증가시켜 세포 퍼짐을 증대시킨다고 보고하고 있다 (Duske 등, 2012). 특히, Zhao 등은 대기압 플라즈마 처리시 타이타늄 표면이 친수성을 띠고 산화층을 형성하여 조직 주위를 둘러싸고 있는 세포와 단백질의 부착을 증가시킨다고 보고하였다 (Zhao 등, 2005). 또한 Cunha 등의 연구 그룹은 치과용 임플란트에 플라즈마 처리의 효과는 염소(sheep)에서의 골유착을 증가시킨다고 보고하였다 (Cunha 등, 2013).
본 연구에서는 치과용 임플란트 재료로 널리 이용되는 타이타늄에 골유착 효과가 우수하다고 보고되어진 하이드록시아파타이트를 코팅한 후, 플라즈마를 처리한 후에도 하이드록시아파타이트 코팅에 의한 골아세포 부착, 증식 및 분화에 미치는 효과가 유지 또는 증진되는지 여부를 세포 및 유전자 수준에서 확인하고자 하였다.
재료 및 방법
시편 제작 및 표면 분석
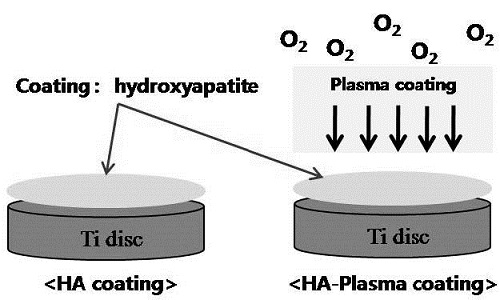
직경 10 mm, 두께 2 mm 크기의 타이타늄 디스크에 Low Temperature High Speed Collision (LTHSC) 방법 (Lee 등, 2011)으로 하이드록시아파타이트를 코팅한 후, 대기압 하에서 아르곤과 산소 기체의 유량을 각각 20 slm, 30 sccm으로 고정하고, 플라즈마를 200W의 세기로 3분 동안 처리하여 하이드록시아파타이트 코팅 시편과 플라즈마 처리된 하이드록시아파타이트 코팅 시편을 준비하였으며, 표면의 친수성 분석을 위해 접촉각을 측정하였다.
세포배양
Mouse 조골모세포인 MC3T3-E1 세포를 10% FBS, 1% penicillin/streptomycin이 첨가된 alpha MEM medium에 37°C 5% CO2 incubator에서 배양하였다. 실험에 사용된 조골모세포는 6~15 번 계대 배양한 세포를 사용하였다. 세포가 배양접시에 가득 자라면 Trypsin-EDTA을 처리하여 부착된 세포를 떼어낸 후, 실험에 사용하였다.
전자현미경을 이용한 세포 형태 관찰
하이드록시아파타이트 코팅 타이타늄과 플라즈마 처리된 하이드록시아파타이트 코팅 타이타늄 시편에 1×103 cell의 농도로 세포를 접종하여 시편 상에서 5일 동안 세포를 배양하였다.
각각의 시편 상에 배양된 세포는 3% glutaraldehyde 용액으로 2시간 동안 전고정(pre fixation)하고, 1% osmium tetroxide(OSO4)로 2시간 동안 후고정을 하였다. 고정 전후에 PBS buffer로 각 10분씩 2회에 걸쳐 세척했다. 이러한 과정을 거쳐 고정된 세포를 30%, 50%, 70%, 80%, 90%, 및 100% 농도의 에탄올 용액을 순차적으로 사용하여 탈수시켰다.
임계점건조를 하기 위하여, CO2 가스와 잘 치환되는 isoamyl acetate 용액을 사용하였다. 먼저 100% 에탄올과 isoamyl acetate가 1 : 1의 비율로 동량 혼합된 용액에 30분 동안 처리한 후, 다음으로 100% 에탄올과 isoamyl acetate가 1 :3의 비율로 혼합된 용액에 3시간 동안 처리하였다. 뒤 이어 임계점 건조를 하였고, 임계점 건조가 끝난 시편은 Pt coating한 후 FE-SEM (JSM-6700F, Jeol, Tokyo, Japan) 이용하여 시편 표면상 세포의 부착 정도를 관찰하였다.
세포증식률
세포 증식율은 mitochondria dehydrogenase에 의해 노란색의 tetrazolium salt가 보라색의 formazan 결정체로 전환되는 원리를 이용한 MTT assay를 통하여 측정하였다. 6 well plate에 하이드록시아파타이트 코팅 시편과 플라즈마 처리된 하이드록시아파타이트 코팅 타이타늄 시편을 놓고, 그 표면위에 MC3T3-E1 mouse osteoblast를 1×103씩 접종하고 2일, 5일간 배양하였다.
시편 위에서 2일, 5일간 배양한 세포에 5mg/mL의 농도로 PBS에 녹인 MTT용액 50 μL를 첨가하고 4시간동안 37°C에서 배양하였다. 4시간 후 MTT 용액이 든 배지를 제거하고 생성된 보라색의 formazan 결정체를 용해시키기 위해 DMSO를 넣고, 피펫팅으로 잘 썩은 후, Sunrise ® microplate reader (Tecan Austria GmbH, Grödig, Austria)를 사용하여 570nm에서 흡광도를 측정하여 세포생존율을 나타내었다.
ALP활성도 측정
조골모세포 분화정도를 측정하기 위하여 MC3T3-E1 세포를 6 well plate에 하이드록시아파타이트 코팅 시편과 플라즈마 처리된 하이드록시아파타이트 코팅 타이타늄 시편을 놓고, 그 표면 위에 MC3T3-E1 mouse osteoblast를 1×103씩 접종하고, 7일과 14일 동안 배양한다. 배양기간 동안 50 μg / μL ascorbic acid와 5 μM β-glycerophosphate를 처리하여 골아세포의 분화를 유도하였다.
세포를 7일과 14일 동안 배양 후, 0.2% triton X-100으로 세포층을 용해시켜 세포부유액을 만든 다음. BSA (bovine serum albumin) stock을 사용하여 얻어진 protein의 농도에 따른 흡광도 검정곡선을 이용하여 단백질 양을 정량하였다.
세포 부유액 (cell lysate)에서 회수한 5 μg의 단백질과 p-nitrophenol (PNP) 을 ALP의 기질인 p-nitrophenol phosphate (PNPP)와 반응시켜 그 활성을 측정하였다.
유전자중합연쇄반응(RT-PCR) 기법을 이용한 분화 표지 유전자 발현 분석
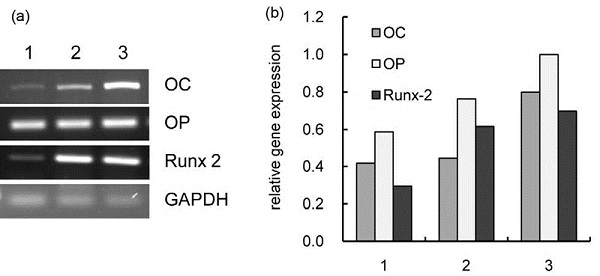
MC3T3-E1 세포를 하이드록시아파타이트 코팅 시편과 플라즈마 처리된 하이드록시아파타이트 코팅 타이타늄 시편 위에서 7일간 배양한 다음, RNA를 분리하고, reverse transcriptase로 역전사하여 cDNA를 합성한다. 합성된 cDNA를 주형으로 하여 유전자중합연쇄반응을 실시하였으며, 반응을 위한 primer 정보는 아래 표에 나타내었다. Osteocalcin (OC), Osteopontin (OP), Runx-2의 유전자의 증폭 반응은 아래 표. 1 과 같이 시행하였다. 유전자중합연쇄반응이 끝난 DNA는 1.5% 아가로즈 겔에서 전기영동한 후, UV 하에서 시각화 하였으며, 각 유전자의 발현량을 internal control인 GAPDH (Glyceraldehyde 3-phosphate dehydrogenase)의 상대적인 양으로 수치화하여 나타내었다.
결 과
1. 접촉각측정
LTHSC 방법(Lee 등, 2011)으로 하이드록시아파타이트 코팅 후 플라즈마 처리하여, 하이드록시아파타이트 코팅 시편과 플라즈마 처리된 하이드록시아파타이트 코팅 시편을 준비하여, 표면의 친수성을 평가하기 위하여 접촉각을 측정하였다. 플라즈마를 처리하지 않은 하이드록시아파타이트 코팅 시편은 약 62o 정도로 측정되었고, 플라즈마를 처리한 이후에는 13o 정도로 접촉각이 감소하였다 (그림. 2). 플라즈마 처리한 하이드록시아파타이트 코팅 시편의 표면이 매우 친수적인 성질을 나타내는 것으로 확인되었다.
2. 골아세포의 접착 및 증식률
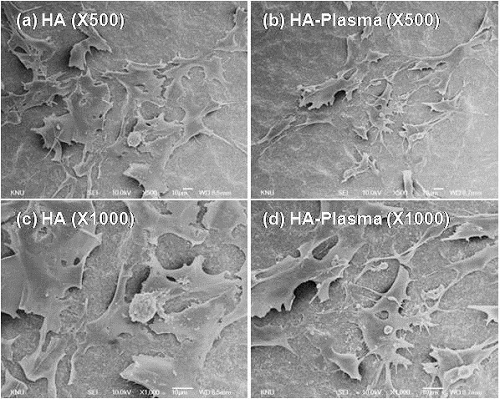
그림. 3는 하이드록시아파타이트 코팅 타이타늄 시편과 플라즈마 처리한 하이드록시아파타이트 코팅 타이타늄 시편에서 5일동안 배양한 MC3T3-E1 세포의 주사전현미경 관찰 사진이다. 저배율(위쪽, 500배)과 고배율(아래쪽, 1000배)로 관찰한 두 시편간의 세포 퍼짐 정도의 차이는 관찰되지 않았다. 두 종류의 시편 모두에서 세포는 잘 부착된 양상을 나타내었다.
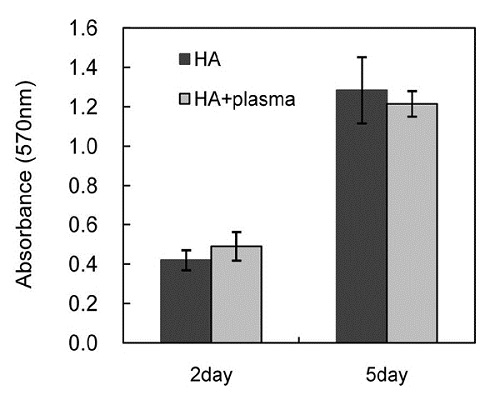
세포 증식률은 그림. 4에서 보는 것과 같이 배양 후 2, 5일 두 개의 시점에서 확인하였다. 플라즈마 처리의 효과는 없으나, 두 시편간의 차이가 적어, 세포증식률은 두 시편의 효과가 비슷한 양상을 보였다.
3. 골아세포의 분화
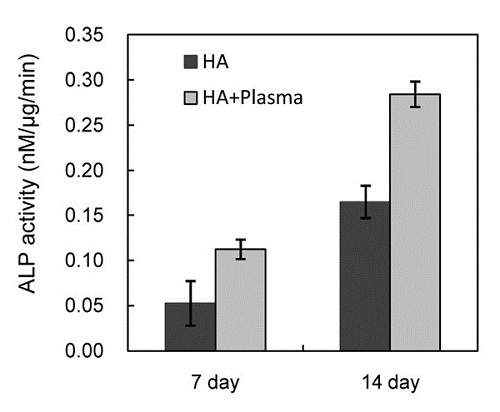
세포의 접착 양상 및 증식률과 다르게, 골아세포의 분화의 척도인 alkaline phosphatase 효소의 활성은 플라즈마 처리시에 크게 증가되었다 (그림. 5). 배양한 지 1주일에 ALP 활성이 증가되어 2주까지 활성이 증가하였다.
골아세포의 분화 표지 인자들의 발현을 나타낸 그림. 6에서는 플라즈마 처리 시에 osteocalcin 및 osteopontin 유전자 발현이 증가하는 결과를 나타내었다. 하지만, 뼈유지에 중요한 역할을 하는 것으로 알려져 있는 Runx-2의 경우, 플라즈마 처리 시 보다 하이드록시아파타이트 코팅만 한 시편에서 더 많이 발현이 증가하였다.
고 찰
타이타늄은 치과용 임플란트 재료로 널리 사용되고 있으나, 최근 수년동안 물리적, 화학적, 생물학적 표면처리를 통하여 그 효과를 극대화 하고자 하는 노력이 많이 시도되어 지고 있다. 이러한 노력의 대부분이 골아세포의 증식과 분화를 촉진시키고, 더 나아가 뼈와의 유착을 효과적으로 증대하고자 하는 것이다. 이에 본 연구에서는 하이드록시아파타이트 처리에 의해 커진 타이타늄 표면의 접촉각을 골아세포와의 친화성을 증대시키기 위하여 플라즈마 처리로 감소시켜 표면의 친수성을 높였다. 표면의 젖음성은 단백질의 흡착, 세포 접착 및 퍼짐에 매우 중요한 역할을 하는 표면 인자이다 (Grinnell, 1978). 재료 표면의 젖음성을 결정하는 접촉각은 표면거칠기와 더불어 세포의 접착에 중요한 역할을 한다. Herrero-Climent 등은 표면의 거칠기가 세포의 기질에 대한 부착을 증가시키고, 동물실험을 통하여 골유착도 증가시킨다고 보고하였다 (Herrero-Climent, 2013).
플라즈마 처리한 하이드록시아파타이트 코팅 타이타늄에서 세포의 부착이 하이드록시아파타이트만 코팅한 타이타늄과 유사한 정도로 나타났으며, 이 효과는 골아세포의 증식에도 영향을 미친 것으로 사료된다.
다수의 저자는 osteocalcin, osteopontin, 및 ALP가 골아세포의 분화의 표지인자로 보고하고 있고 (Price 등, 1985; David 등, 1998; Rodriguez 등, 2003; Choi 등, 2008), 뼈의 대체재료인 apatite가 ALP의 발현을 증가시킨다는 보고가 있어(Inoue 등, 2004), 본 연구에서는 플라즈마 처리에 의한 골아세포의 분화에 관련된 효소의 활성 및 유전자의 발현을 분석하였다. 플라즈마 처리 후, ALP 효소의 활성이 증가하였으며, 또한 osteocalcin 유전자의 발현이 현저히 증가하는 것으로 나타났다. 또한 뼈의 형성 및 흡수의 평형을 유지하는데 중요한 역할을 하는 것으로 보고되어지는 (Handschin 등, 2006) Runx-2의 발현도 하이드록시아파타이트 코팅된 타이타늄 수준으로 발현이 됨을 확인하였다. 이는 플라즈마 처리에 의해 골아세포의 분화에도 영향을 미친 것으로 사료되며, 하이드록시아파타이트가 코팅된 타이타늄에 플라즈마를 처리하면 골아세포의 부착 또는 증식보다는 골아세포의 분화를 더 촉진한다고 할 수 있다. Matsuoka 등은 고농도의 칼슘이온이 미분화골아세포의 ALP 효소의 활성과 osteocalcin의 mRNA 발현을 증가시킨다고 보고하였다 (Matsuoka 등, 1999). 플라즈마 처리에 의해 증가된 골아세포의 분화는 하이드록시아파타이트와 골아세포의 작용으로 칼슘이온이 증가되어 유도되어졌다고 추측할 수 있다.
본 연구의 플라즈마 처리에 의한 골아세포의 분화 촉진효과는 향후 동물 실험 시 골유착을 증가시키는 효과를 보여 줄 것으로 예상되어 치과용 타이타늄에 새로운 표면처리 방법으로 제시될 수 있다고 사료되어 진다.
결 론
본 연구에서는 치과용 임플란트로 널리 사용되고 있는 타이타늄에 뻐세포에 접착과 분화에 효과적인 표면처리를 함으로서 임상적 시술 시 골접합능을 더 향상시키고자 하이드록시아파타이트 코팅된 타이타늄에 플라즈마 처리를 하여 다음과 같은 결론을 얻었다.
1. 하이드록시아파타이트 코팅된 타이타늄 표면의 접촉각은 62o 이었으나, 플라즈마를 처리하였을 때, 크게 감소하여 표면의 친수성이 증가되었다.
2. 골아세포의 접착과 증식률은 하이드록시아파타이트 코팅 타이타늄과 플라즈마 처리한 하이드록시아파타이트 코팅 타이타늄에서 비슷한 수준을 보였다.
3. 골아세포의 분화는 플라즈마 처리한 하이드록시아파타이트 코팅 타이타늄에서 ALP 활성이 시간에 비례하여 증가하였다. 또한 분화 표지 유전자인 osteocalcin와 osteopontin의 발현이 증가되었다.
결론적으로, 하이드록시아파타이트 코팅된 타이타늄에 플라즈마 처리를 하면 표면의 젖음성이 증가되어, 골아세포의 부착 및 증식은 하이드록시아파타이트 코팅된 타이타늄과 같은 수준으로 유도되지만, 골아세포의 분화능은 현저히 증가하여, 플라즈마는 골아세포의 분화를 촉진시킨다고 할 수 있다.
Acknowledgments
이 논문은 2013학년도 경북대학교 학술연구비에 의하여 연구되었음.
References
- K Gotfredsen, E Hjorting-Hansen, E Budtz-Jo¨rgensen, Clinical and radiographic evaluation of submerged and nonsubmerged implants in monkeys, Int J Prosthodont, (1990), 3, p463-9.
-
J. A Jansen, J. P van der Waerden, K de Groot, Fibroblast and epithelial cell interactions with surface-treated implant materials, Biomaterials, (1991), 12, p25-31.
[https://doi.org/10.1016/0142-9612(91)90127-V]

-
Y Ikada, Surface modification of polymers for medical applications, Biomaterials, (1994), 15, p725-736.
[https://doi.org/10.1016/0142-9612(94)90025-6]

- Mendonça Gustavo, B.S Daniela Mendonça, J.L Francisco, o Araga˜, F. Cooper Lyndon, Advancing dental implant surface technology – From micron-to nanotopography Biomaterials, (2008), 29, p3822-3835.
-
R Jimbo, T Sawase, K Baba, T Kurogi, Y Shibata, M Atsuta, Enhanced initial cell responses to chemically modified anodized Ti, Clin Implant Dent Relat Res, (2008), 10, p55-61.
[https://doi.org/10.1111/j.1708-8208.2007.00061.x]

-
L Le Guéhennec, A Soueidan, P Layrolle, Y Amouriq, Surface treatments of titanium dental implants for rapid osseointegration, Dent Mater, (2007), 23(7), p844-54.
[https://doi.org/10.1016/j.dental.2006.06.025]

- E Sandrini, R Chiesa, G Rondelli, M Santin, A Cigada, A novel biomimetic treatment for an improved osteointegration of titanium, J Appl Biomater Biomech, (2003), 1(1), p33-42.
-
TJ Webster, Schadler, LS, RW Siegel, R Bizios, Mechanisms of enhanced osteoblast adhesion on nanophase alumina involve vitronectin, Tissue Eng, (2001), 7, p291-301.
[https://doi.org/10.1089/10763270152044152]

-
KW Lee, CM Bae, JY Jung, GB Sim, TR Rautray, HJ Lee, TY Kwon, KH Kim, Surface characteristics and biological studies of hydroxyapatite coating by a new method, J Biomed Mater Res B Appl Biomater, (2011), 98(2), p395-407.
[https://doi.org/10.1002/jbm.b.31864]

-
K Duske, I Koban, E Kindel, K Schröder, B Nebe, B Holtfreter, L Jablonowski, KD Weltmann, T Kocher, Atmospheric plasma enhances wettability and cell spreading on dental implant metals, J Clin Periodontol, (2012), 39(4), p400-7.
[https://doi.org/10.1111/j.1600-051X.2012.01853.x]

-
G Zhao, Z Schwartz, M Wieland, F Rupp, J Geis-Gerstorfer, D Cochran, B. D Boyan, High surface energy enhances cell response to Ti substrate microstructure, Journal of Biomedical Materials Research. Part A, (2005), 74, p49-58.
[https://doi.org/10.1002/jbm.a.30320]

- A Cunha, RP Renz, E Blando, BR de Oliveira, R Hübler, Osseointegration of atmospheric plasmasprayed titanium implants: Influence of the native oxide layer, J Biomed Mater Res A, (2013, Apr, 9), [Epub ahead of print].
-
F Grinnell, Cellular adhesiveness and extracellular substrata, Int Rev Cytol, (1978), 53, p65-144.
[https://doi.org/10.1016/S0074-7696(08)62241-X]

-
M Herrero-Climent, P Lázaro, J Vicente Rios, S Lluch, M Marqués, J Guillem-Martí, FJ Gil, Influence of acid-etching after grit-blasted on osseointegration of titanium dental implants: in vitro and in vivo studies, J Mater Sci Mater Med, (2013), (in press).
[https://doi.org/10.1007/s10856-013-4935-0]

-
PA Price, Vitamin K-dependent formation of bone Gla protein(osteocalcin) and its function, Vitam Horm, (1985), 42, p65-108.
[https://doi.org/10.1016/S0083-6729(08)60061-8]

- R David, A Villarreal, Sogal, L Joo, Ong, Protein Adsorption and Osteoblast Responses to Different Calcium Phosphate Surfaces, J Oral Implantology, (1998), 24(2), p67-73.
-
R Rodriguez, KH Kim, JL Ong, In vitro osteoblast response to anodized titanium followed by hydrothermal treatment, J Biomed Mater Res, (2030), 65A, p352-358.
[https://doi.org/10.1002/jbm.a.10490]

-
ST Choi, JH Kim, EJ Kang, SW Lee, MC Park, YB Park, SK Lee, Osteopontin might be involved in bone remodelling rather than in inflammation in ankylosing spondylitis, Rheumatology (Oxford), (2008), 47(12), p1775-9.
[https://doi.org/10.1093/rheumatology/ken385]

-
M Inoue, RZ Le Geros, M Inoue, H Tsujigiwa, H Nagatsuka, T Yamamoto, N Nagai, In vitro response of osteoblast-like and odontoblast-like cells to unsubstituted and substituted apatites, J Biomed Mater Res A, (2004), 70(4), p585-93.
[https://doi.org/10.1002/jbm.a.30116]

-
AE Handschin, M Egermann, O Trentz, GA Wanner, HJ Kock, G Zünd, OA Trentz, Cbfa-1 (Runx-2) and osteocalcin expression by human osteoblasts in heparin osteoporosis in vitro, Clin Appl Thromb Hemost, (2006), 12(4), p465-72.
[https://doi.org/10.1177/1076029606293433]

- H Matsuoka, H Akiyama, Y Okada, H Ito, C Shigeno, J Konishi, T Kokubo, T Nakamura, In vitro analysis of the stimulation of bone formation by highly bioactive apatite- and wollastonite-containing glass-ceramic: Released calcium ions promote osteogenic differentiation in osteoblastic ROS17/2.8 cells, J Biomed Mater Res, (1999), 47, p176-188.