Cytotoxicity of gutta-percha points and thermoplastic endodontic obturation materials
This study was purposed to evaluate the cytotoxicity of commercially available 3 types of prefabricated gutta-percha points and 8 types of thermoplastic endodontic obturation materials using MTT tests and agar overlay test.
On MTT test, the Obtura® showed significantly lower cell viability (16.3±0.8% vs. Control; p<0.05), which is over four times lower than those of other tested materials (p<0.05). The Diadent point®, Sure-endo point®, and Diadent Medium® showed rather higher cell viability compared to that of Control (p<0.05).
On agar overlay test, Sure-endo Soft® and Sure-endo Hard® showed a lower cytotoxicity (decolorization index = 2) compared to other tested materials (decolorization index = 3), while all the tested materials ranked as ‘moderate cytotoxic’ (response index = 2/2 or 3/2).
From this study it is demonstrated that the endodontic obturation materials have various degrees of cytotoxicity, and further in vivo biocompatibility evaluation is needed.
Keywords:
Gutta-percha, thermoplastic materials, cytotoxicity, MTT, Agar overlay서 론
근관치료의 성공을 위해서는 정확한 진단과 적절한 치료계획 수립 및 치아형태에 관한 올바른 지식을 토대로 한 근관계의 성형, 세정, 그리고 충전에 바탕을 두고 있다(대한치과근관치료학회, 2011). 발수된 치근관계의 완전한 밀봉을 위해 다양한 재료가 근관충전 재료로서 사용되어 왔다. 그 중 거타퍼챠 포인트는 성형성이 좋고, 조작하기 쉽고, 독성이 적고, 방사선 불투과성이 있고, 열이나 연화제로 제거하기 쉽다는 장점을 가지고 있어(Friedman 등, 1977) 근관충전용 재료로 오랫동안 사용되어 왔다. 최근에는 기성형된 거타퍼챠 포인트(prefabricated gutta-percha point)와 조성은 비슷하고 열을 가해 연화하여 주입기를 사용하여 근관을 충전하는 열가소성 근관충전재료(thermoplastic endodontic obturation materials) 가 근관치료에 중요한 역할을 담당하고 있다.
적절하게 거타퍼챠가 충전된 경우에도 치근단공을 통해 미세누출(Dalat 등, 1994)이 발생하며, 거타퍼챠와 치근단 주위 조직간에 좁은 범위의 접촉이 있게 되지만 이에 따른 문제는 보고되지 않았다. 하지만 술자의 기구 조작 시 근첨 협착부를 넘어가는 경우, 치근단이 완전히 형성되지 않은 미성숙치아에 과도한 수직압이 가해진 경우, 근관형성이 잘못되어 matrix가 형성되지 못한 경우, 치근단의 염증성 흡수가 진행되고 있는 경우에는 근관충전물과 주위 조직 사이에 지속적 접촉이 일어나게 된다(대한치과근관치료학회, 2011). 임상적으로 과충전된 근관충전재에 의한 전신반응은 알려져 있지 않고(Dahl, 2005), 거타퍼챠 콘이 치근단 조직으로 과충전된 후 수년간 노출되더라도 근관치료의 임상적 실패징후를 나타내지 않는 경우도 있다(Weine 등, 2003). 하지만 거타퍼챠의 과충전은 환자에게 수 일 정도 지속되는 불편감을 주고, 치근단 조직에 대한 유해자극으로 작용하여 근단부 상피증식 및 만성염증을 야기함으로써 치근단 조직의 치유를 방해할 수 있다(Seltzer 등, 1973). 따라서, 근관치료 시 사용되는 실러(Briseño 등, 1990; Briseño 등, 1991; Zmener, 2004), 용매 (Vajrabhaya 등, 2004) 및 실버포인트(Holland 등, 1982), Active GP & Resilon (Donadio 등, 2008)등에 대한 세포독성과 생체적합성에 관한 평가가 지속적으로 이루어지고 있다. Serene 등(1988)은 거타퍼챠에 의해 보체계(complement system)가 활성화 되어 염증반응을 유발할 수 있다고 보고하였으며, Onishi 등(1997)은 수산화칼슘의 칼슘이온에 의해 치근단 주위 조직에서 세포사멸이 유발될 수 있다고 보고하였다.
현재까지 보고된 거타퍼챠의 세포독성 및 생체적합성에 대한 연구결과들 간에는 차이가 있다. Olsson 등(1985)은 거타퍼챠를 토끼의 근육조직에 식립하여 조직반응을 관찰하였을 때 아주 약한 정도의 염증반응만을 보였다고 보고하였고, Ranade 등(2003)은 거타퍼챠를 기니피그의 피하조직 내에 식립한 조직반응 실험에서도 초기 7일 후 측정에서만 약한 염증반응을 보였으며 그 이후에는 우수한 생체적합성을 보였다고 하였다. 이와 반대로 Holland 등(1994)은 거타퍼챠와 실버콘을 쥐의 결합조직에 식립한 뒤 1년간 장기관찰한 결과 식립된 거타퍼챠 주위에 두꺼운 캡슐이 형성되었고 주변에 심각한 만성 염증이 나타났음을 보고하였다. 하지만, Khabbaze와 Papadopoulos (1999)는 거타퍼챠가 1 ㎜ 과충전된 제2소구치 증례보고에서 환자가 4년 동안 별다른 자각증상 없이 사용하였고, 치아의 파절로 인해 발치한 뒤 전자현미경으로 관찰한 결과 치근단부에 석회화된 조직이 형성되어있음을 확인하였다. 거타퍼챠의 생체적합성에 대한 다양한 연구에도 불구하고 최근 임상에서 사용이 빈번해지고 있는 열가소성 근관충전재료에 대한 세포적합성 평가에 대한 보고는 희소하여, 본 연구에서는 현재 국내에서 유통되고 있는 기성형 거타퍼챠 포인트 및 열 가소성 근관충전재료의 세포독성을 평가하고자 하였다.
재료 및 방법
1. 실험재료
본 연구에서는 Table 1과 같이 총 3종의 기성형 거타퍼챠 포인트와 8종의 열가소성 근관충전재료를 평가하였다. 상품명을 ‘거타퍼챠’라고 표기하는 이종의 제품들이 여럿 있어서 혼동될 수 있기 때문에, 제조사 및 유형에 따라 실험군의 이름을 명명하였다.
2. 재료 성형 및 세척
각각의 재료는 ISO 10993-12(2009)를 참고하여 지름 5 ㎜, 두께 2 ㎜ 크기의 시편으로 제작하였다. 60℃ 핫플레이트 상에 놓인 테플론 몰드 내에 시편제작에 충분한 양의 재료를 위치시켜 연화 및 가압충전하여 각 실험군 당 8개씩의 시편을 제작하였다. 몰드에서 제거된 시편을 증류수로 3분 동안 초음파 세척한 후, UV에 20분간 노출시켜 살균처리 하였다.
3. MTT 시험을 위한 용출용액 획득
본 연구에서는 100 units/㎖의 페니실린(Sigma, U.S.A.), 100 ㎎/㎖의 스트렙토마이신(Sigma, U.S.A.), 10% fetal bovine serum (Gibco BRL, U.S.A)이 함유된 RPMI1640배지(Gibco BRL, U.S.A)를 배양용액으로 사용하였다. 실험재료의 용출 용액을 얻기 위해 512 ㎕의 RPMI1640배지에 각 시편을 침지하여 37℃에서 24시간 동안 배양하였다. 시편을 넣지 않은 배양용액은 동일한 과정을 거친 후 대조군으로 사용하였다.
4. MTT 시험
MTT 시험은 세포의 기능적인 활성도와 세포생존도(viability)를 평가하는데 널리 이용되는 방법으로 생체재료의 세포독성을 측정하는데 매우 유용하다. L-929세포(mouse fibroblast-like cell; 한국세포주은행)의 단일 세포 부유액을 96well-plate의 각 well에 0.3 x 103 cell/㎖의 농도로 100 ㎕씩 분주하여 37℃, 5% CO2 배양기에서 24시간 동안 배양하였다. 24시간 후 각 well에서 배양용액을 제거하고, 각 시편의 용출 용액을 100 ㎕씩 첨가한 뒤 37℃, 5% CO2 배양기에서 24시간 동안 추가 배양하였다. 24시간이 지난 후 용출용액을 제거하고, MTT 시약(Sigma, U.S.A.)과 배양액이 1:10으로 혼합된 용액을 각각 100 ㎕씩 첨가한 후, 4시간 동안 빛을 차단한 상태로 37℃, 5% CO2 배양기에서 배양하였다. 그 후 배지와 MTT 용액 전부를 제거한 후, 각 well에 DMSO 100 ㎕를 첨가하여 15분 동안 가볍게 진탕해준 뒤, microplate reader(BIO-RAD Laboratories, U.S.A.)를 이용하여 570 ㎚의 파장에서 흡광도를 측정하였으며, 5회 반복실험을 하였다 (ISO 10993-5, 2009).
5. 한천중층시험
배양접시(직경 5 ㎝)에 L-929세포주의 단일세포 부유액을 3 x 105 cell/㎖ 농도로 분주한 후, 37℃, 5% CO2 배양기에서 24시간 동안 배양하였다. 10% FBS를 함유한 RPMI1640 내에 한천이 3 wt.% 포함된 한천배지를 제조한 후, 한천배지가 37℃까지 식으면 배양 세포상에 부어 30분간 응고시킴으로써 한천중층(agar overlayer)을 형성시켰다. 그 후 10% neutral red용액(in PBS)으로 15분간 염색을 시행한 후 양성 대조군 및 음성 대조군과 함께 각 실험군 시편을 한천중층 상에 위치시켰다. 양성 대조군으로는 0.25% Zinc dibutyldithiocarbamate (ZDBC) 폴리우레탄 필름을, 음성 대조군으로는 폴리에틸렌 시트를 사용하였다 (Marciano등, 1989). 37℃, 5% CO2 조건으로 24시간 동안 배양한 후, 시편 하방과 그 주위로 염색이 소실된 부위의 정도를 탈색지수(decolorized index: DI)로, 탈색지역 내의 세포의 사멸 정도를 용해지수(lysis index: LI)로 표시하여 세포독성을 평가하였다 (ISO 7405, 2008).
6. 통계분석
실험결과에 대해 통계프로그램 SPSS 19.0 (SPSS Inc., U.S.A.)을 이용하여 비모수 독립 K-표본 분석 후 Duncan’s 다중범위 사후검정을 통해 통계학적 유의성을 평가하였다. P값이 <0.05일 때 유의한 차이를 나타낸다.
결 과
1. MTT 시험
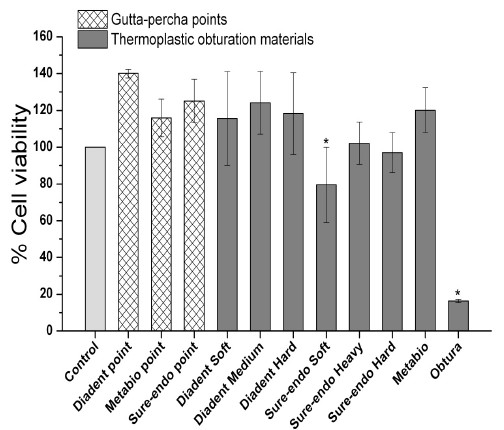
MTT 시험결과 Obtura는 16.3(0.8)%의 세포생존율을 보여 다른 모든 재료들과 비교했을 때 가장 낮은 세포생존율을 보였고(p<0.05), Sure-endo Soft의 경우 79.6 (20.4)%의 세포생존율을 보였다. Obtura와 Sure-endo soft를 제외한 나머지 거타퍼챠 제품들은 대조군과 비슷하거나 또는 오히려 더 높은 세포생존율을 보였다(p<0.05, Table 2, Figure 1). Diadent point, Sure-endo point, Diadent Medium은 세포생존율이 대조군에 비해 각각 140.0(2.4)%, 125.1(11.9)%, 124.1(17.1)%로 유의하게 높은 세포생존율을 보였다(p<0.05, Table 2, Figure 1).

Percent cell viability (%) of root-canal obturation materials after cell culture for 24 h in MTT test
Sure-endo사의 열가소성 거타퍼챠 제품들은 Diadent사나 Meta Biomed사의 열가소성 거타퍼챠 제품에 비해 세포생존율이 더 낮은 경향을 보였다(p>0.05). 특히, Sure-endo Soft는 79.6(20.4)%의 세포생존율을 보여, Obtura보다는 높지만 대조군보다 낮은 세포생존율을 보였다(p<0.05).
2. 한천중층시험 결과
한천중층시험결과 Sure-endo Soft와 Sure-endo Hard는 탈색지수가 ‘2’로서 다른 재료들(탈색지수=3)에 비해 낮은 탈색지수를 보였지만, 모든 재료가 동일하게 중등도의 세포독성을 나타냈다(Table 3, Figure 2).

Exemplary photo of agar overlay test data. In photo (A), decolorization index for Sure-endo Heavy and Sure-endo Soft are 3 and 2, respectively. In photo (B), decolorization index for Diadent Hard and Sure-endo Hard are 3 and 2, respectively. In photos (C) and (D), the lysis index for all the tested groups was ranked as‘2’
고 찰
거타퍼챠는 생체적합성이 뛰어난 재료로 알려져 있으며 현재 근관 충전용으로 널리 사용되고 있는 재료로서 기성형 거타퍼챠 포인트와 열가소성 거타퍼챠의 두 종류가 주로 사용되고 있다. 이 두 종류는 시술 방법에 따라 구분되어 사용되지만 주 구성성분은 거의 비슷하고, 각 제품에 따른 구성성분의 함량 차이와 거타퍼챠 폴리머의 분자량이나 입체구성 형태에 따라 물성에 차이를 보인다(Goodman 등, 1974). 근관충전용 거타퍼챠 재료는 각 제조사마다 성분비가 다르기는 하나 대략 산화아연(zinc oxide) 66.5~84.3%, 트랜스-폴리이소프랜 거타퍼챠 14.5~ 20.4%, 황산바륨(barium sulfates) 0~11.4%, 왁스와 레진 1.2~3.1%, 기타 소량의 색소 및 첨가제로 구성된 것으로 알려져 있다(Gurgel-Filho 등, 2003). 거타퍼챠 폴리머는 세포독성이 없어 생체적합성이 좋다고 알려졌지만, 물리적 성질 조절을 위해 첨가된 다른 성분들에 의해 세포독성이 나타나는 것으로 보고된다(Pascon 등, 1990; Will-ershausen 등, 2004).
거타퍼챠의 생체적합성 평가를 위해 체외실험과 체내실험, 그리고 장기적 임상평가를 할 수 있다. 체외실험은 실제 임상적 상황과 다르다는 단점이 있으나 다른 변수들의 영향을 최소화 시키고 실험과정이 간편하며 재현성이 있고, 저렴하다는 이유로 선호된다(Anusavice, 2006). 본 실험에서는 재료를 일정시간 동안 담근 용출용액을 이용한 MTT 시험과 성형된 재료를 직접 사용한 한천중층시험을 통해 각 거타퍼챠 제품들의 세포독성을 알아보고자 하였다. MTT 시험은 빠르고 높은 재현성을 보이는 시험으로(Wan 등, 1994) 세포의 탈수소효소 활성도를 평가하여 재료의 세포독성 및 세포생존율을 측정하는 방법이다. MTT tetrazolium salt가 세포 안에 침투하면 미토콘드리아에 존재하는 탈수소효소가 MTT tetrazolium salt를 적자색을 띠는 insoluble formazan compound로 환원시킨다. 이때 생성된 formazan의 양을 측정하여 세포의 대사활성도를 평가함으로써 세포생존율을 측정할 수 있다. ISO 10993-5 (2009)에서는 MTT 시험결과 70% 이상의 세포생존율을 보인 경우에는 세포독성이 없는 것으로 판단하고 있으며, Dahl (2005)은 이를 세분화하여 60~90% 까지는 약한 세포독성을 보인다고 판단하였다. 본 연구에서 사용한 한천중층시험은 생체재료에서 용해되는 확산성 성분의 세포독성을 평가하므로 세포독성 및 독성 물질의 확산율을 평가하는데 의미가 있기 때문에 널리 사용된다. 한천중층시험에 사용된 neutral red는 살아있는 세포의 리소좀에 축적되어 적색을 띠지만, 독성물질로 인해 세포의 막기능에 이상이 생기거나 세포사멸이 있으면 neutral red가 소실되어 탈색된다(Lui 등, 2004). 따라서 한천중층시험은 neutral red가 탈색된 범위를 측정(decolorization index)하고, 세포의 사멸 정도를 측정(cell lysis index) 함으로써 재료의 세포독성을 평가할 수 있는 시험이다(Marciano 등, 1989).
MTT 시험결과 Obtura는 16.3(0.8)%의 세포생존율을 보여 다른 모든 실험재료들과 비교했을 때 가장 낮은 세포생존율을 보였고, Sure-endo Soft의 경우 79.6(20.4)%의 세포생존율을 보였다. Obtura와 Sure-endo Soft를 제외한 나머지 거타퍼챠 제품들은 대조군과 비슷하거나 또는 오히려 더 높은 세포생존율을 보였다(p<0.05, Table 2, Figure 1). Brackett 등(2008)도 L-929세포와 Obtura를 72시간 동안 직접 접촉시킨 후 MTT 시험으로 세포독성을 평가한 결과 20% 미만의 낮은 세포생존율을 나타냈다고 보고하였으며, 이러한 세포독성은 Obtura의 주요 구성성분인 산화아연으로부터 아연이온이 용출되어 발생한다고 보고하였다. 또한 Willershausen 등(2000)은 수산화칼슘함유(calcium hydroxide-based) 거타퍼챠를 세가지 세포(nasal fibroblast, gingival fibroblast, epithelial tumor cell)에 접촉시켜 6일 동안 배양한 결과 세가지 세포 모두에서 단백질 합성량이 감소하였다고 보고하였고, Willershausen 등(2004)은 클로로헥시딘(chlorohexidine)이 함유된 거타퍼챠를 치은 섬유아세포(gingival fibroblasts)와 상피암 세포(epithelial tumor cells)에 6일 동안 접촉시킨 후 높은 정도의 세포성장 저해가 발견되었다는 보고를 하였다. 본 연구에서 Obtura 제품이 다른 시험재료들에 비해 4배 이상 낮은 유의한 세포생존율 차이를 보인 것은 주목할만하며, 상용 거타퍼챠 제품에 항생제나 색소와 같은 성분이 소량 포함되었더라도 제품의 설명서에는 자세한 성분비가 표시되어 있지 않기 때문에 명확한 독성의 원인을 규명하기는 어렵다. 하지만 상용 거타퍼챠 제품들의 구성성분 중 산화아연 이외에도 물성에 중요한 영향을 미치는 거타퍼챠나 왁스와 같은 다른 구성성분들의 제품별 차이가 세포독성에 미치는 영향에 대한 추가적인 연구가 필요하다고 생각한다.
MTT 시험결과 특이한 점은 Diadent point, Sure-endo point, Diadent Medium의 세포생존율이 대조군에 비해 각각 140.0(2.4)%, 125.1(11.9)%, 124.1(17.1)%로 유의하게 높은 세포생존율을 보였다는 점이다(p<0.05, Table 2, Figure 1). Vajrabhaya 등(2004)은 거타퍼챠의 연화에 사용되는 chloroform의 독성을 평가하는 연구에서 chloroform을 배양액에 1:800으로 희석시켜 세포를 배양했을 때 chloroform을 함유하지 않는 배양액에서 배양한 대조군에 비해 126.53(6.32)%의 세포생존율을 보였다고 보고하였다. 그들은 이러한 높은 세포생존율의 이유로 희석된 chloroform이 세포증식을 자극하였을 거라고 보고하였다. 이처럼 본 연구에서 일부 제품(Diadent point, Sure-endo point, Diadent Medium)에서는 대조군에 비해 MTT시험 시 더 높은 세포생존율을 보이는 것은 특정 성분에 의해 세포증식이 자극되었기 때문으로 생각된다. 그러나 세포증식의 자극이 실제 임상에서 어떠한 효과를 나타내는지에 대해서는 추가적인 연구가 필요하다.
본 연구에서 평가된 모든 재료들은 한천중층시험 결과 중등도의 세포독성을 보였다. Sure-endo Soft와 Sure-endo Hard는 탈색지수가 ‘2’로서 다른 재료들(탈색지수=3)에 비해 낮은 정도의 세포독성을 보이는 것으로 평가되었는데(Table 3, Figure 2), 이들 재료에 대한 MTT 실험결과를 보면 각각 79.6(20.4)%와 97.1(10.8)%의 세포생존율을 보여 Obtura를 제외하고는 100% 이상의 세포생존율을 보인 다른 재료들에 비해 오히려 낮은 값을 보였다. 이러한 결과를 보면 세포독성 시험 결과를 평가할 때 시험방법에 따른 차이를 주의하여 비교할 필요가 있다고 보며, 세포 생존율이 100% 이상인 재료들로 근관충전할 경우 세포생존율이 낮은 재료들로 충전한 경우에 비해 실제 임상적 근관치료 성공률이 어떠한 차이를 보이는지에 대한 생체내 시험이 필요할 것으로 생각된다.
본 연구의 용출용액을 이용한 MTT 시험결과와 한천중층시험 결과를 비교 분석해보면, 열가소성 근관충전재료 중 하나인 Obtura의 경우 MTT 시험에서는 Obtura 제품의 구성성분 중 일부 용출성 성분이 시험용액에 용출되어서 다른 제품들에 비해 높은 독성을 나타내지만, 한천중층시험의 경우 세포와 시험재료 중간에 존재하는 한천중층에 의해 미량 용출성분에 의한 영향은 차단되어 다른 제품들과 큰 차이를 보이지 않았던 것으로 판단된다. 실제 임상 사용시 치근단 부위에서 거타퍼챠와 조직이 직접 접촉하지 않고 용출되는 경우 주변조직에 미치는 영향이 적으며, 주변 조직액이나 혈류에 의해 그 영향은 더욱 줄어들 것으로 보이나, 장기적으로 직접 접촉을 할 경우 독성을 나타낼 수도 있을 것으로 생각된다.
MTT시험 결과와 한천중층시험 결과 간에 일부 제품에서 일치되지 않는 양상을 보이는 것에 대해, 이들 생체외 시험에 의해서는 평가되지 못한 생체적합성에 대한 영향을 생체내 시험을 통해 치근단 조직에서의 반응, 미량 첨가제에 대한 영향, 사용된 충전방법의 차이에 따른 영향을 평가할 필요가 있다고 본다.
결 론
국내에 유통되고 있는 3종의 기성형 거타퍼챠 포인트와 8종의 열가소성 근관충전재료에 대한 세포독성을 비교분석하기 위해 시험재료의 용출용액을 이용한 MTT 시험과 성형된 재료를 직접 사용한 한천중층시험을 시행하여 다음과 같은 결론을 얻었다.
1. MTT 시험 결과 Obtura는 다른 시험재료들에 비해 4배 이상 유의하게 낮은 세포생존율을 보였으며(p<0.05), Diadent point, Sure-endo point, Diadent Medium은 대조군에 비해 유의하게 높은 세포생존율을 보였다(p<0.05).
2. 한천중층시험 결과 Sure-endo Soft와 Sure-endo Hard는 다른 재료들에 비해 낮은 탈색지수를 보였지만, 모든 재료가 동일하게 중등도의 세포독성을 나타내었다.
이상의 연구에서 근관충전 재료는 제품에 따라 각기 상이한 세포생존율을 보임을 알 수 있었고, 추가적인 생체 적용시험을 통한 안전성 평가가 이루어질 필요가 있다고 본다.
Acknowledgments
연구는 2012년도 식품의약품안전청 용역연구개발과제의 연구개발비 지원(12172의료평501)에 의해 수행되었음.
References
- 대한치과근관치료학회, 최신 근관치료학. 2판. 서울: 덴탈위즈덤 pp. 259, 310-312, 389, (2011).
- KJ Anusavice, Phillips' Science of Dental Materials, 11th ed. St. Louis:Elsevier, (2006), p188-190.
-
E Bodrumlu, M Muglali, M Sumer, T Guvenc, The response of subcutaneous connective tissue to a new endodontic filling material, J Biomed Mater Res B Appl Biomater, (2008), 84(2), p463-467.
[https://doi.org/10.1002/jbm.b.30892]

-
MG Brackett, A Marshall, PE Lockwood, JB Lewis, RLW Messer, S Bouillaguet, JC Wataha, Cytotoxicity of endodontic materials over 6-weeks ex vivo, Int Endod J, (2008), 41(12), p1072-1078.
[https://doi.org/10.1111/j.1365-2591.2008.01471.x]

-
BM Briseño, B Willershausen, Root canal sealer cytotoxicity on human gingival fibroblasts: I. Zinc oxide-eugenol-based sealers, J Endod, (1990), 16(8), p383-386.
[https://doi.org/10.1016/S0099-2399(06)81910-2]

-
BM Briseño, B Willershausen, Root canal sealer cytotoxicity on human gingival fibroblasts: II. silicone-and resin-based sealers, J Endod, (1991), 17(11), p537-540.
[https://doi.org/10.1016/S0099-2399(06)81718-8]

-
S Chogle, AK Mickel, SK Huffaker, B Neibaur, An in vitro assessment of iodoform gutta-percha, J Endod, (2005), 31(11), p814-816.
[https://doi.org/10.1097/01.don.0000158231.32819.cc]

-
JE Dahl, Toxicity of endodontic filling materials, Endod Top, (2005), 12(1), p39-43.
[https://doi.org/10.1111/j.1601-1546.2005.00196.x]

-
DM Dalat, LSW Spångberg, Comparison of apical leakage in root canals obturated with various gutta-percha techniques using a dye vacuum tracing method, J Endod, (1994), 20(7), p315-319.
[https://doi.org/10.1016/S0099-2399(06)80092-0]

-
M Donadio, J Jiang, KE Safavi, Q Zhu, Cytotoxicity evaluation of Active GP and Resilon cones in vitro, Oral Surg Oral Med Oral Pathol Oral Radiol Endod, (2008), 106(1), pe76-e79.
[https://doi.org/10.1016/j.tripleo.2008.03.029]

-
CE Friedman, JL Sandrik, MA Heuer, GW Rapp, Composition and physical properties of guttapercha endodontic filling materials, J Endod, (1977), 3(8), p304-308.
[https://doi.org/10.1016/S0099-2399(77)80035-6]

-
A Goodman, H Schilder, W Aldrich, The thermomechanical properties of gutta-percha: II. The history and molecular chemistry of guttapercha, Oral Surg Oral Med Oral Pathol, (1974), 37(6), p954-961.
[https://doi.org/10.1016/0030-4220(74)90448-4]

-
ED Gurgel-Filho, JPA Feitosa, FB Teixeira, RM De Paula, JBA SilvaF, Souza-Filho, Chemical and X-ray analyses of five brands of dental guttapercha cone, Int Endod J, (2003), 36(4), p302-307.
[https://doi.org/10.1046/j.1365-2591.2003.00653.x]

-
G Holland, A histological comparison of periapical inflammatory and neural responses to two endodontic sealers in the ferret, Arch Oral Biol, (1994), 39(7), p539-544.
[https://doi.org/10.1016/0003-9969(94)90128-7]

-
R Holland, SouzaV, MJ Nery, M Mello, PFE Bernabé, JA Filho, Reaction of rat connective tissue to gutta-percha and silver points. A longterm histological study, Aust Dent J, (1982), 27(4), p224-226.
[https://doi.org/10.1111/j.1834-7819.1982.tb04101.x]

- International Organization for Standardization, ISO 7405. Dentistry – Evaluation of biocompatibility of medical devices used in dentistry. Geneve: Switzerland, ISO, (2008).
- International Organization for Standardization, ISO 10993-5. In: Biological Evaluation of Medical Devices-Part 5: Tests for In Vitro Cytotoxicity. Geneve: Switzerland, ISO, (2009).
- International Organization for Standardization, ISO 10993-12. In: Biological Evaluation of Medical Devices-Part 12: Sample Preparation and Reference Materials. Geneve: Switzerland, ISO, (2007).
-
MG Khabbaz, PD Papadopoulos, Deposition of calcified tissue around an overextended guttapercha cone: case report, Int Endod J, (1999), 32(3), p232-235.
[https://doi.org/10.1046/j.1365-2591.1999.00209.x]

-
U Lohbauer, G Gambarini, J Ebert, W Dasch, A Petschelt, Calcium release and pH-characteristics of calcium hydroxide plus points, Int Endod J, (2005), 38(10), p683-689.
[https://doi.org/10.1111/j.1365-2591.2005.00972.x]

- JN Lui, V Sae-Lim, KP Song, NN Chen, In vitro antimicrobial effect of chlorhexidine-impregnated gutta percha points on Enterococcus faecalis, Int Endod J, (2004), 37(2), p105-113.
-
J Marciano, PM Michailesco, Dental gutta-percha: Chemical composition, X-ray identification, enthalpic studies, and clinical implications, J Endod, (1989), 15(4), p149-153.
[https://doi.org/10.1016/S0099-2399(89)80251-1]

-
B Olsson, A Wennberg, Early tissue reaction to endodontic filling materials, Dent Traumatol, (1985), 1(4), p138-141.
[https://doi.org/10.1111/j.1600-9657.1985.tb00578.x]

- Y Onishi, Y Tanimoto, H Kizaki, Inflammation and apoptosis, Bull Tokyo Dent Coll, (1997), 38(2), p65.
-
EA Pascon, LSW Spångberg, In vitro cytotoxicity of root canal filling materials: 1. Guttapercha, J Endod, (1990), 16(9), p429-433.
[https://doi.org/10.1016/S0099-2399(06)81885-6]

- MP Ranade, A Kamra, A comparative tissue toxicity evaluation of four endodontic materials, Endodontology, (2003), 15, p7-12.
-
S Seltzer, W Soltanoff, J Smith, Biologic aspects of endodontics: V. Periapical tissue reactions to root canal instrumentation beyond the apex and root canal fillings short of and beyond the apex, Oral Surg Oral Med Oral Pathol, (1973), 36(5), p725-737.
[https://doi.org/10.1016/0030-4220(73)90146-1]

-
TP Serene, J Vesely, RJ Boackle, Complement activation as a possible in vitro indication of the inflammatory potential of endodontic materials, Oral Surg Oral Med Oral Pathol, (1988), 65(3), p354-357.
[https://doi.org/10.1016/0030-4220(88)90122-3]

-
U Sjögren, G Sundqvist, PM Nair, Tissue reaction to gutta-percha particles of various sizes when implanted subcutaneously in guinea pigs, Eur J Oral Sci, (1995), 103(5), p313-321.
[https://doi.org/10.1111/j.1600-0722.1995.tb00032.x]

-
L Vajrabhaya, SK Suwannawong, R Kamolroongwarakul, L Pewklieng, Cytotoxicity evaluation of gutta-percha solvents: Chloroform and GP-Solvent (limonene), Oral Surg Oral Med Oral Pathol Oral Radiol Endod, (2004), 98(6), p756-759.
[https://doi.org/10.1016/j.tripleo.2004.05.002]

-
H Wan, R Williams, DP Doherty, DF Williams, A study of the reproducibility of the MTT test, J Mater Sci Mater Med, (1994), 5(3), p154-159.
[https://doi.org/10.1007/BF00053336]

- FS Weine, Endodontic therapy, 6th ed. St Louis: Mosby, (2003), p88-91.
-
B Willershausen, MB Briseño, D Schäfer, R Schulze, Cytotoxicity of root canal filling materials to three different human cell lines, J Endod, (2000), 26(12), p703-707.
[https://doi.org/10.1097/00004770-200012000-00007]

- B Willershausen, BH Hagedorn, H Tekyatan, BB Marroquín, Effect of calcium hydroxide and chlorhexidine based gutta-percha points on gingival fibroblasts and epithelial tumor cells, Eur J Med Res, (2004), 9(7), p345-350.
-
O Zmener, Tissue response to a new methacrylate-based root canal sealer: preliminary observations in the subcutaneous connective tissue of rats, J Endod, (2004), 30(5), p348-351.
[https://doi.org/10.1097/00004770-200405000-00010]