
Effects of Bis-GMA and HEMA on the cytotoxicity of dentin bonding agents
It has been reported that dentin bonding agents (DBA) used in composite resin adhesion have a strong cytotoxicity. Bisphenol A glycidyl methacylate (Bis-GMA) and 2-hydroxyethyl methacrylate (HEMA) are known as the main ingredients in a large number of resin-based DBA. In this study, we quantified Bis-GMA and HEMA in dentin bonding agents by using high performance liquid chromatography (HPLC), and investigated whether these resin monomers were responsible for the cytotoxicity of DBA. In 1 mg of Adper Single Bond 2, Clearfil-SE Bond Adhesive and Adper Scotchbond Multi-Purpose Adhesive, 0.3475, 0.4899 and 0.2717 mg of Bis-GMA were detected, respectively, and 0.1475, 0.3092 and 0.4372 mg of HEMA were detected, respectively. Based on the results of the cytotoxicity, Bis-GMA is likely a major cause of cytotoxicity. In 1mg of Clearfil-SE primer, Adper Scotchbond Multi-Purpose Primer, One-UP Bond F Plus A and One-UP Bond F Plus B, 0.1377, 0.6099, 0.1024 and 0.8595 mg of HEMA were detected respectively. Bis-GMA was not detected in those DBA (detection limit: 5 μM). Based on the results of the cytotoxicity, the cytotoxicity of Clearfil-SE Bond Primer is expected due to HEMA. Adper Scotchbond Multi-Purpose Primer showed low cytotoxicity despite the high amount of HEMA. Therefore, it is assumed that the components that exhibit the antagonic effect on the cytotoxicity of HEMA are included in Adper Scotchbond Multi-Purpose Primer. The result of One-UP Bond F Plus B showed that HEMA is a major cause of cytotoxicity. But, in case of One-UP Bond F Plus A, other cytotoxic ingredients rather than HEMA likely exist. Bis-GMA and HEMA was not detected in Prime & Bond NT, I Bond and G-Bond, in which the other cytotoxic ingredient was assumed included.
Keywords:
Dentin bonding agent, Bis-GMA, HEMA, cytotoxicity, HPLC서 론
심미 수복 치료에 사용되는 레진계 치과생체재료들을 사용함에 있어서 접착은 필수적이며 중요한 요소이다. 법랑질에 대한 접착은 산부식을 통해 치질 표면에 미세 다공성을 형성하고 접착성 단량체가 침투하여 미세기계적으로 우수한 접착이 가능하다 (Li 등. 2013). 이에 비해 상아질은 상아세관이 존재하며 많은 유기물질을 포함하기 때문에 접착을 위해서 치질 표면의 전처리 과정이 필요하다 (Albert, 1990).
상아질 접착은 산부식, 프라이머 처리 및 접착레진 도포 등 세 단계 과정을 거친다 (Baier, 1992). 상아질에 대한 산부식은 표면의 무기성분과 일부 비교원성 단백질을 용해하여 기질의 교원섬유를 노출시킨다. 프라이머는 친수성과 소수성 기능기를 모두 가지고 있는 이중기능성 단량체 (bifunctional monomer)로서, 친수성기는 친수성을 띠는 상아세관 및 교원섬유와 결합하여 혼성층 (hybrid layer)을 만들고, 소수성기는 다음 단계에 적용하는 접착레진 (adhesive)과 결합하게 된다. 혼성층은 접착레진이 탈회 상아질 내의 상아세관과 교원섬유사이의 미세 공간으로 침투하여 결합할 수 있도록 도와주는 역할을 통해 결합력을 크게 증대시킨다 (Armstrong 등, 1998). 접착 레진은 프라이머와 복합레진을 결합하는 역할을 한다. 접착 레진은 bisphenol-A glycidyl dimethacrylate (Bis-GMA)등의 소수성 단량체와 광개시제로 구성되며, 프라이머와 결합하기 위해 약간의 친수성 단량체를 포함하기도 한다.
상아질 접착제는 적용과정 및 방식과 도말층의 처리방법에 따라 분류된다. 과거 1세대부터 3세대 접착제까지는 도말층에 대한 처리가 적절히 이루어지지 못하여 적절한 접착을 얻을 수 없었다 (Bowen 등, 1984; Ishioka 등, 1989). 현재 상용되고 있는 접착제는 접착 과정과 방식에 따라 4세대에서 7세대로 분류하고 있다. 4세대 접착제는 앞서 말한 산부식, 프라이머 처리, 접착레진 도포의 3단계를 각각 따로 적용하는 방식으로, 산부식을 통해 도말층 및 표층 무기질을 제거하고 탈회된 표면에 프라이머를 적용한 후 접착레진을 통해 접착을 얻는다. 4세대 접착제를 통하여 치과 접착에 혁신적인 발전이 이루어졌다. 실험실 결과에 의하면 상아질 결합제의 결합력이 거의 법랑질에서의 결합력과 유사하다 (Swift 등, 1995). 하지만 3단계의 과정에 대한 불편함으로 인하여 접착 과정을 간단히 하려는 연구들이 행해지고 있다. 5세대 접착제는 산부식, 프라이머, 접착레진의 3단계중 프라이머, 접착레진 도포를 하나의 과정으로 합친 형태 (산부식형, total-etching or etch & rinse)와 산부식, 프라이머를 하나의 과정으로 합친 형태 (자가부식형, self-etching adhesive, SEPs)로 나뉜다. 접착과정의 단순화에 대한 지속적인 요구에 따라 1단계 접착제가 개발되었다. 6세대 접착제는 2개의 용기에 따로 보관되어 있는 접착제를 사용전에 혼합하여 적용하는 방식이고 7세대 접착제는 2병을 섞는 과정도 필요 없이 하나의 용기에 포장되어 있다. 이러한 단일 과정의 접착제는 편의성은 증대되었으나 4,5세대 접착제에 비해 결합력이 낮고, 특히 비삭제 치질의 접착에는 한계가 있다 (Kanca, 1997).
편의성과 접착력과 더불어, 상아질 접착제는 직접적으로 치수와 가까운 치질에 적용되기 때문에 높은 생체친화성이 요구된다 (Schedle 등, 1998). In vitro 조건에서 다양한 정도의 세포독성이 나타나는 것으로 보고되어 왔고, 반면에 in vivo 조건에서는 항상 독성을 나타내지는 않는다는 연구 결과도 있다 (Kierklo 등, 2012; Geurtsen 등, 1998). 상아질 접착제의 중합시에 반응하지 않은 모노머나 완전히 중합되지 않은 중합제가 상아세관을 통해 치수조직에 위해 작용을 일으킬 수 있다 (Eliades 등. 1987; Chen 등, 2001). 또한 치질에 적용시 상아질 접착제가 치아 주위의 치은에 직접적으로 접촉될 수 있어서 자극이 되어 염증을 일으킬 수 있다 (Szep 등, 2002).
상아질 접착제의 세포독성의 기전은 아직 명확하게 밝혀지지 않았지만, 연구에 의하면 상아질 접착제의 구성 성분 중 레진 단량체들이 세포독성의 주 원인인 것으로 보인다 (Tang 등, 1999). 상아질 접착제에 포함된 레진 단량체에 대한 많은 연구가 있었고, 그 중 Bis-GMA, HEMA 등이 높은 독성을 가지고 있는 것으로 나타났다 (Hashie 등, 1999; Kaga 등, 2001). In vitro 실험에 의하면 Bis-GMA가 HEMA보다 강한 세포독성을 나타낸다고 보고되었으며 (Geurtsen 등, 1998; Chen 등, 2003), Bis-GMA는 치은 조직과의 접촉을 통해 구강 점막의 자극을 일으킬 수 있다고 알려져 있다 (Polydorou 등, 2007). 상아질은 투과성을 가지고 있기 때문에 중합되지 않은 레진 단량체들이 상아세관을 통해 치수조직에 위해 작용을 일으킬 수 있다 (Bouillaguet 등, 1998). In vivo 연구에서는 레진 수복 후 치수의 괴사나 염증반응들이 보고되고 있다 (Reichl 등, 2006).
Bis-GMA 및 HEMA는 세포 내 활성 산소종 (reactive oxygen species, ROS)의 농도를 증가시켜 단백질의 불활성화, 유전자 변이 등 세포의 다양한 반응을 초래하며, apoptosis 등의 cell death를 야기한다고 밝혀졌다 (Bouillaguet 등, 1996; Martindale 등, 2002; Chang 등, 2010). 또한 ROS의 생성을 증가시켜 세포주기 지연을 유도, 세포의 성장을 억제한다고 알려져 있다 (Krifka 등, 2012). HEMA는 intracellular glutathione (GSH)의 수준을 줄이고 활성 산소종의 증가, cell death를 일으키는 것으로 보고되었다 (Chang 등, 2005).
이에 본 연구에서는 다양한 상아질 접착제의 세포독성을 측정하고, 레진 단량체 성분인 Bis-GMA와 HEMA를 고성능액체크로마토그래피법 (High Performance Liquid Chromatography, HPLC)으로 정량 분석 후, 이 레진 기질들의 세포독성을 측정하여 비교함으로써 이 성분들이 상아질 접착제의 세포독성을 일으키는 주 원인물질인지 규명하고자 하였다.
재료 및 방법
1. 실험재료
본 연구에서는 상아질 접착제로 Adper Single Bond 2 (3M ESPE, St.Paul, MN, USA), Clearfil-SE Bond Adhesive (Kuraray, Tokyo, Japan), Clearfil-SE Bond Primer (Kuraray), Adper Scotchbond Multi-Purpose Adhesive (3M ESPE), Adper Scotchbond Multi-Purpose Primer (3M ESPE), One- UP Bond F Plus A (Tokuyama), One-UP Bond F Plus B (Tokuyama), Prime & Bond NT (Dentsply, Milford, DE USA), i Bond (Heraeus Kulzer, Wehrheim, Germany), G-Bond (GC, Tokyo, Japan)를 사용하였다. 상아질 접착제의 제조사와 주요 성분을 Table. 1에 나타내었다.
bisphenol A-diglycidyl dimethacrylate (Bis-GMA), 2-hydroxyethyl methacrylate (HEMA), triethyleneglycoldimethacrylate (TEGDMA), GMA는 Aldrich (Aldrich Chemical Company, Deisenhofen, Germany)에서 구입하였다. Cell culture medium은 Welgene (Daegu, Korea)에서 구입하였다. 이외에 특별히 언급되지 않은 시약은 모두 Sigma (Sigma Chemical Company, St. Louis. MO, USA)에서 구입하였다.
2. HPLC 측정
상아질 접착제들을 HPLC mobile phase (acetonitrile-water (6:4 v/v))를 이용하여 일정 농도로 희석하였다. 희석한 상아질 접착제 용액 90 ㎕에 internal standard (IS) 용액 (50mM) 10 ㎕을 혼합하여 샘플을 제조하였다. IS로 GMA 용액을 사용하였고 Adper Single Bond 2의 경우 GMA를 포함하고 있었기 때문에 TEGDMA를 사용하였다. HPLC를 이용하여 샘플에 포함되어 있는 Bis-GMA와 HEMA를 정량 분석하였다.
Waters 600E multisolvent devivery system, an auto-sampler model Waters 717plus, a Waters 2487 dual λ absorbance detector (Milford, MA, USA)로 구성된 HPLC 시스템을 사용하였다. Inertsil®
 ODS-SP (5㎛ particle size, 4.6×250mm, GL Science Inc. Tokyo, Japan) 컬럼을 사용하였다. Mobile phase로 acetonitrile 과 DW (60:40 v/v)를 사용하였고, 유속은 1㎖/min 으로 하였다. 샘플 주입량은 50㎕로 하였고, 검출파장은 230nm을 사용하였다.
ODS-SP (5㎛ particle size, 4.6×250mm, GL Science Inc. Tokyo, Japan) 컬럼을 사용하였다. Mobile phase로 acetonitrile 과 DW (60:40 v/v)를 사용하였고, 유속은 1㎖/min 으로 하였다. 샘플 주입량은 50㎕로 하였고, 검출파장은 230nm을 사용하였다.
3. 세포 배양 및 세포 독성 측정
ATCC (Rockville, MD)에서 구매한 L-929 정상생쥐섬유모세포를 사용하여 상아질 접착제와 HEMA 및 Bis-GMA의 세포독성을 관찰하였다. Antibiotic cocktail (100 U/mL penicillin-G and 100 µg/mL streptomycin)을 포함한 10% fetal bovine serum (FBS, Lonza)을 DMEM에 첨가하여 세포배양에 사용하였다. 세포를 37〫 C (5% CO2/95% air) 인큐베이터 안에서 3~4일간 배양하고 배양액은 3일 간격으로 교환했다. 유착된 세포들을 트립신 (0.2% trypsin, 0.02% EDTA)을 이용하여 떼어낸 뒤 96 well plate에 0.8×105 cells/mL의 세포현탁액 100 ㎕를 plating 하고 24시간 배양하였다. 이후 상아질 접착제 희석액과 HPLC 정량결과를 바탕으로 접착제에 포함된 HEMA 및 Bis-GMA로 24시간동안 세포를 처리하여 세포독성을 측정하였다. 처리된 세포는 배양액을 제거하고 phosphate buffered saline (PBS)으로 세척한 후 10% WST-8 (Dojindo; Kumamoto, Japan)을 포함한 DMEM (without phenol red)을 채워주었다. o37C (5% CO2/95% air) 인큐베이터 안에서 1시간동안 배양 후 450nm에서 optical density (OD)를 automated microplate reader (Sunrise, TECAN; Salzburg, Austria)를 사용하여 측정하였다.
4. 통계분석
세포독성을 측정한 수치는 비교대상이 3개 이상인 경우 일원배치분산분석 (oneway Analysis Of Variance : ANOVA)을 사용하였고 2개인 경우 t-test로 분석하였으며 alpha=0.05 수준에서 시행하였다.
결 과
1. 상아질 접착제의 HEMA 및 Bis-GMA 정량결과
레진 단량체인 HEMA와 Bis-GMA의 IS에 대한 검량선을 Fig. 1에 나타내었다. Adper Single Bond 2는 IS로 TEGDMA를 사용하였고 나머지 상아질 접착제들은 GMA를 사용하였다. HPLC를 사용하여 상아질 접착제들에 포함되어 있는 HEMA 및 Bis-GMA를 정량하였다. 본 연구의 분석조건에서 HEMA는 3.6분, Bis-GMA는 15.3분에 각각 검출되었다. 검출된 internal standard (GMA-5.2분, TEGDMA–7.7분)의 면적과 HEMA 및 Bis-GMA의 면적을 비교한 후 검량선에 대입하여 농도를 산출하였다.
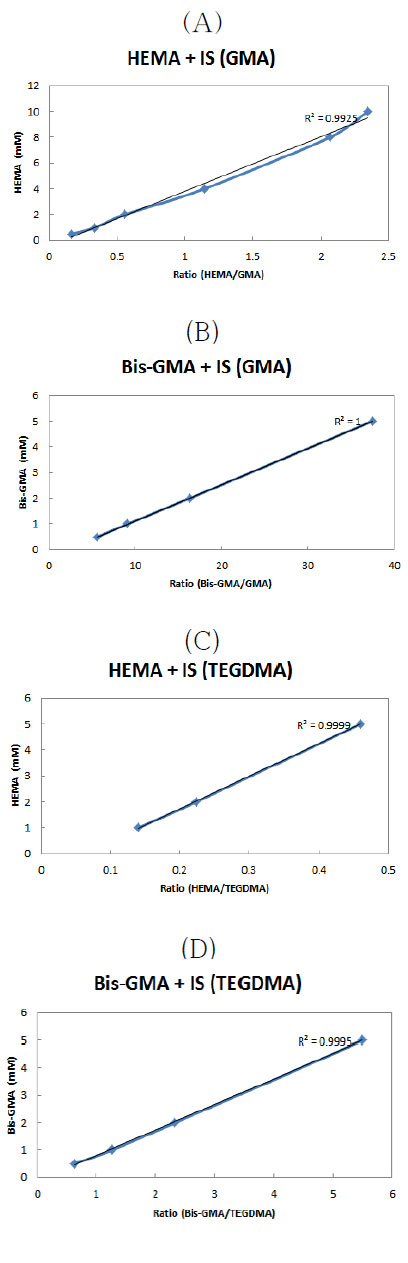
(A,B) Calibration curve of HEMA and Bis-GMA with IS (GMA), (C,D) Calibration curve of HEMA and Bis-GMA with IS (TEGDMA), detection limit : 5μM
Adper Single Bond 2, Clearfil-SE Bond Adhesive, Adper Scotchbond Multi-Purpose Adhesive에서는 HEMA와 Bis-GMA 모두 검출이 되었다. HEMA가 접착제 1mg 당 각각 0.1475 mg, 0.3092 mg, 0.4372 mg 이 검출되었으며, Bis-GMA는 0.3475 mg, 0.2717 mg, 0.4899 mg이 검출되었다 (Fig. 2 A-C). Clearfil-SE Bond Primer, Adper Scotchbond Multi-Purpose Primer, One-UP Bond F Plus A, One-UP Bond F Plus B 에서는 HEMA가 접착제 1 mg 당 각각 0.1377 mg, 0.6099 mg, 0.1024 mg, 0.8595 mg 이 검출되었으며, Bis-GMA는 검출되지 않았다 (detection limit: 5μM) (Fig. 2 D-G). Prime & Bond NT, i Bond 및 G-Bond는 HEMA와 Bis-GMA 모두 검출되지 않았다 (Fig. 2 H-J). HEMA와 Bis-GMA의 정량 결과를 Table 2에 정리하여 나타내었다.
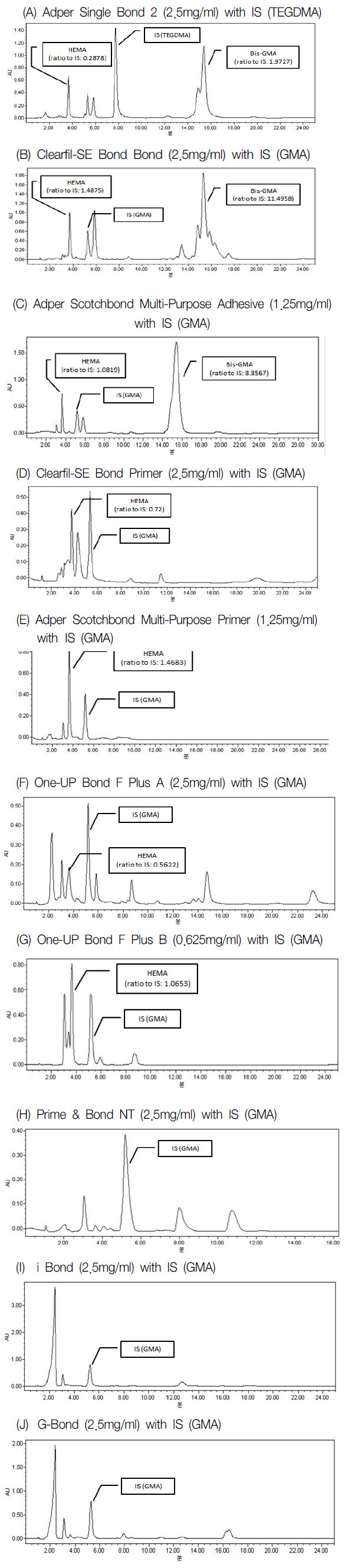
Chromatograms of dentin bonding agents. The chtomatograms is registered at 230 nm with a mobile phase of: 60% acetonitrile/40% DW. (A) Adper Single Bond 2; (B) Clearfil-SE Bond Adhesive; (C) Adper Scotchbond Multi-Purpose Adhesive; (D) Clearfil-SE Bond Primer; (E) Adper Scotchbond Multi-Purpose Primer; (F) One-UP Bond F Plus A; (G) One-UP Bond F Plus B; (H) Prime & Bond NT; (I) i Bond; (J) G-Bond.
2. 상아질 접착제와 레진 단량체의 세포독성
상아질 접착제의 일정 농도에서 나타나는 세포독성과 그 농도 안에 포함되어 있는 HEMA및 BisGMA의 세포독성을 측정하였다. HEMA와 Bis-GMA가 모두 포함되어 있는 Adper Single Bond 2, Clearfil-SE Bond Adhesive, Adper Scotchbond Multi-Purpose Adhesive 의 세포독성과 접착제에 포함된 HEMA와 Bis-GMA의 세포독성 측정 결과, 3개의 상아질 접착제 모두에서 용량 의존적인 세포독성을 보였다. 접착제에 포함된 HEMA는 세포독성을 나타내지 않았으며, Bis-GMA가 상아질 접착제와 유사한 정도의 세포독성을 나타냈다 (Fig. 3 A-C).
Clearfil-SE Bond Primer와 접착제에 포함된 HEMA 모두 용량 의존적인 세포독성을 나타냈다 (Fig. 3D). Adper Scotchbond Multi-Purpose Primer는 매우 높은 농도의 HEMA를 포함했지만 낮은 세포독성을 보였다 (Fig. 3E). One-UP Bond F Plus A는 용량 의존적인 세포독성을 나타냈지만 접착제에 포함된 HEMA는 세포독성을 나타내지 않았고, One-UP Bond F Plus B는 접착제에 포함된 HEMA와 마찬가지로 용량 의존적인 세포독성을 나타냈다 (Fig. 3 F,G). Prime & bond NT, i Bond 및 G-Bond에서는 Bis-GMA와 HEMA 모두 검출되지 않았으며, 일정농도에서 세포독성을 나타내는 것으로 나타났다 (Fig. 3 H-J).
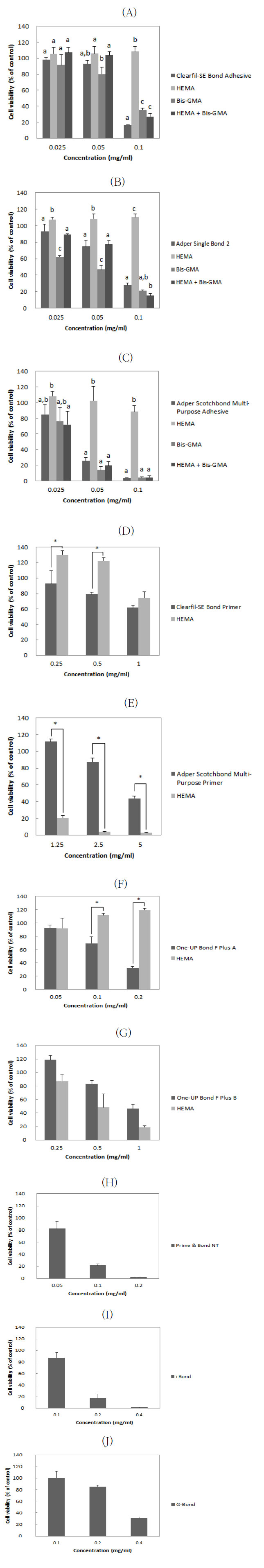
Effect of Dentine bonding agents, HEMA, Bis-GMA on the viability of L-929 cells. The viability of L-929 cells treated with various concentrations of dengine bonding agents, resin monomers for 24h was determined by the WST-8 assay. Data represents the mean (±S.D.) of triplicate experiments per condition and are expressed as a percentage of the respective control values. (A) Adper Single Bond 2; (B) Clearfil-SE Bond Adhesive; (C) Adper Scotchbond Multi-Purpose Adhesive; (D) Clearfil-SE Bond Primer; (E) Adper Scotchbond Multi-Purpose Primer; (F) One-UP Bond F Plus A; (G) One-UP Bond F Plus B; (H) Prime & Bond NT; (I) i Bond; (J) G-Bond. * means statistically significant difference between two groups. (p<0.05)
고 찰
상아질 접착제에 포함된 HEMA와 Bis-GMA를 HPLC를 이용하여 정량한 결과 Adper Scotchbond Multi-Purpose Adhesive에서 가장 높은 농도의 Bis-GMA가 검출되었고 Adper Single Bond 2 > Clearfil-SE Bond Adhesive 순으로 높은 농도의 Bis-GMA를 포함하고 있었다. Scotchbond Multi-Purpose Adhesive에서는 Bis-GMA가 단일 peak로 검출되었으나 Adper Single Bond 2와 Clearfil-SE Bond Adhesive에서는 2개 이상의 peak로 검출되었는데 이는 Bis-GMA의 iso-type인 것으로 판단된다 [27]. HEMA를 포함한 상아질 접착제에서는 One-UP Bond F Plus B > Adper Scotchbond Multi-Purpose Primer > Adper Scotchbond Multi-Purpose Adhesive > Clearfil-SE Bond Adhesive > Adper Single Bond 2 > Clearfil-SE Bond Primer > One-UP Bond F Plus A 순으로 높은 농도의 HEMA가 검출되었다. Clearfil-SE Bond Primer와 One-UP Bond F Plus B에서는 HEMA의 peak가 다른 성분의 peak와 일부 겹쳐져 검출되어 정량에 어려움이 있었지만 큰 오차는 없을 것으로 판단된다. i-Bond와 G-Bond에서는 검출된 시간과 peak의 모양이 매우 유사한 결과를 나타낸 것으로 보아 어떤 성분인지는 밝혀지지 않았지만 동일한 물질을 포함하고 있는 것으로 판단된다.
세포독성 측정 결과, TC50을 기준으로 하여 Adper Scotchbond Multi-Purpose Adhesive > Adper Single Bond 2 = Prime & Bond NT > Clearfil-SE Bond Adhesive > i Bond > One-UP Bond F Plus A > G-Bond > One-UP Bond F Plus B > Clearfil-SE Bond Primer > Adper Scotchbond Multi-Purpose Primer 순으로 높은 세포독성을 나타냈다.
Bis-GMA와 HEMA를 모두 포함하고 있는 상아질 접착제의 경우 Bis-GMA를 많이 포함할수록 세포독성도 높게 나타났다. Adper Scotchbond Multi-Purpose Adhesive에서는 접착제에 포함된 Bis-GMA의 세포독성이 접착제 자체의 세포독성과 유사한 결과를 보여주었으며, HEMA는 독성을 나타내지 않았다. 따라서 Bis-GMA가 세포독성의 주 원인인 것으로 판단된다. Adper Single Bond 2에서는 접착제에 포함된 HEMA는 세포독성을 나타내지 않은 반면, Bis-GMA는 접착제 자체의 세포독성보다 높은 세포독성을 나타냈으며, HEMA와 Bis-GMA를 동시에 적용했을 때 접착제와 유사한 세포독성을 나타냈다. 흥미롭게도 특정농도에서는 HEMA가 Bis-GMA의 세포독성을 감소시키는 결과가 나타났다. Clearfil-SE Bond Adhesive의 경우 0.025, 0.05mg/ml에서는 세포독성을 나타내지 않았으며, 0.1 mg/ml에서는 높은 세포독성을 나타냈고 접착제에 포함된 Bis-GMA에서도 유사한 세포독성이 나타났다. 따라서 Clearfil-SE Bond Adhesive 또한 Bis-GMA가 세포독성의 주 원인인 것으로 판단된다.
Clearfil-SE Bond Primer는 1 mg/ml 농도에서 접착제에 포함된 HEMA의 세포독성과 접착제 자체의 세포독성 사이에 유사성이 나타났다. Adper Scotchbond Multi-Purpose Primer는 강한 독성을 나타내는 매우 높은 농도의 HEMA를 포함하고 있었지만 접착제 자체에서는 세포독성은 낮게 나타났다. 이는 접착제 내에 HEMA의 독성에 길항작용을 하는 성분이 포함되어 있기 때문인 것으로 추측된다. One-UP Bond F Plus A는 용량 의존적인 세포독성을 나타냈지만 접착제에 포함된 HEMA는 세포독성을 나타내지 않았다. 따라서 HEMA가 아닌 다른 성분이 세포독성을 나타내는 것으로 추측된다. One-UP Bond F Plus B는 접착제와 접착제에 포함된 HEMA 모두 용량 의존적인 세포독성을 보였으며, HEMA가 세포독성을 나타내는 주요 원인 물질인 것으로 추측된다. Prime & bond NT, i Bond, G-Bond에서는 HEMA및 Bis-GMA가 검출되지 않았다.
결 론
본 연구 결과 Bis-GMA를 포함한 상아질 접착제에서 Bis-GMA가 세포독성의 주 원인물질인 것으로 밝혀졌다. 하지만 본 연구에서는 상아질 접착제를 중합시키지 않고 직접 용매에 녹여서 정량한 후, 세포독성을 측정하여 실제 임상환경과는 많은 차이가 있다. 실질적으로 임상에서 Bis-GMA가 상아질 접착제가 가진 세포독성의 주 원인인지 알아보기 위해서는 상아질 접착제를 중합시킨 후, 용출되는 물질들을 정량하여 세포독성을 평가할 필요가 있다.
Acknowledgments
본 연구는 2011년도 식품의약품안전청 용역연구개발과제의 연구개발비 지원 (11172미래평501)에 의해 수행된 것임.
References
- HF Albert, Dentin-resin bonding, Adept Rep, (1990), 1, p33-42.
-
SR Armstrong, DB Boyer, JC Keller, JB Park, Effect of hybrid layer on fracture toughness of adhesively bonded dentin-resin composite joint, Dent Mater, (1998), 14, p91-98.
[https://doi.org/10.1016/S0109-5641(98)00014-1]

- RE Baier, Principles of adhesion, Oper Dent, (1992), 5, p1-9.
-
S Bouillaguet, M Virgillito, J Wataha, B Ciucchi, J Holz, The influence of dentine permeability on cytotoxicity of four dentine bonding systems, in vitro, J Oral Rehabil, (1998), 25, p45-51.
[https://doi.org/10.1046/j.1365-2842.1998.00205.x]

-
S Bouillaguet, JC Wataha, CT Hanks, B Ciucchi, J Holz, In vitro cytotoxicity and dentin permeability of HEMA, J Endod, (1996), 22, p244-248.
[https://doi.org/10.1016/S0099-2399(06)80141-X]

- RL Bowen, JD Eick, DA Henderson, DW Anderson, Smear layer: removal and bonding considerations, Oper Dent, (1984), 3, p30-34.
-
HH Chang, MK Guo, FH Kasten, MC Chang, GF Huang, YL Wang, RS Wang, JH Jeng, Stimulation of glutathion depletion, ROS production and cell cycle arrest of dental pulp cells and gingival epithelial cells by HEMA, Biomaterials, (2005), 26, p745-753.
[https://doi.org/10.1016/j.biomaterials.2004.03.021]

-
MC Chang, LI Chen, CP Chan, JJ Lee, TM Wang, TT Yang, PS Lin, HJ Lin, HH Chang, JH Jeng, The role of reactive oxygen species and hemeoxygenase-1 expression in the cytotoxicity, cell cycle alteration and apoptosis of dental pulp cells induced by Bis-GMA, Biomaterials, (2010), 31, p8164-8171.
[https://doi.org/10.1016/j.biomaterials.2010.07.049]

-
RS Chen, CC Liu, WY Tseng, JH Jeng, CP Lin, Cytotoxicity of three dentin bonding agents on human dental pulp cells, J Dent, (2003), 31, p223-229.
[https://doi.org/10.1016/S0300-5712(02)00088-X]

- RS Chen, CC Liuiw, WY Tseng, CY Hong, CC Hsieh, JH Jeng, The effect of curing light intensity on the cytotoxicity of a dentin bonding agent, Oper Dent, (2001), 26, p505-510.
-
GC Eliades, GJ Vougiouklakis, AA Caputo, Degree of double bond conversion in light cured composites, Dent Mater, (1987), 3, p19-25.
[https://doi.org/10.1016/S0109-5641(87)80055-6]

- W Geurtsen, F Lehmann, W Spahl, G Leyhausen, Cytotoxicity of 35 dental resin composite monomers/additives in permanent 3T3 and three human primary fibroblast cultures, J Biomed Mater Res, (1998), 41, p474-480.
-
IA Hashie, A Cosset, JC Franquin, J Camps, In vitro cytotoxicity of one-step dentin bonding systems, J Endod, (1999), 25, p89-92.
[https://doi.org/10.1016/S0099-2399(99)80003-X]

-
Y Imai, M Watanabe, A Ohsaki, Analysis of major components and bisphenol A in Commercial Bis-GMA and Bis-GMA-based Resins using high performance liquid chromatography, Dent Mater J, (2000), 19, p263-269.
[https://doi.org/10.4012/dmj.19.263]

-
S Ishioka, AA Caputo, Interaction between the dentinal smear layer and composite bond strength, J Prosthet Dent, (1989), 61, p180-185.
[https://doi.org/10.1016/0022-3913(89)90370-3]

-
M Kaga, M Noda, JL Ferracane, W Nakamura, H Oguchi, H Sano, The in vitro cytotoxicity of eluates from dentin bonding resins and their effect on tyrosine phosphorylation of L929 cells, Dent Mater, (2001), 17, p333-339.
[https://doi.org/10.1016/S0109-5641(00)00091-9]

- J Kanca, One Step bond strength to enamel and dentin, Am J Dent, (1997), 10, p5-8.
-
A Kierklo, M Pawinska, G Tokajuk, B Poplawska, A Bielawska, Cytotoxicity evaluation of three light-cured dentin adhesive materials on human gingival fibroblasts, ex vivo, Adv Med Sci, (2012), 57, p385-390.
[https://doi.org/10.2478/v10039-012-0038-2]

-
S Krifka, C Seidenader, KA Hiller, G Schmalz, H Schweikl, Oxidative stress and cytotoxicity generated by dental composites in human pulp cells, Clin Oral Investig, (2012), 16, p215-224.
[https://doi.org/10.1007/s00784-010-0508-5]

-
N Li, T Nikaido, S Alireza, T Takagaki, JH Chen, J Tagami, Phosphoric acid-etching promotes bond strength and formation of acid-base resistant zone on enamel, Oper Dent, (2013), 38, p82-90.
[https://doi.org/10.2341/11-422-L]

-
JL Martindale, NJ Holbrook, Cellular response to oxidative stress: signaling for suicide and survival, J Cell Physiol, (2002), 192, p1-15.
[https://doi.org/10.1002/jcp.10119]

-
O Polydorou, R Trittler, E Hellwig, K Kummerer, Elution of monomers from two conventional dental composite materials, Dent Mater, (2007), 23, p1535-1541.
[https://doi.org/10.1016/j.dental.2006.12.011]

-
FX Reichl, S Simon, M Esters, M Seiss, K Kehe, N Kleinsasser, R Hickel, Cytotoxicity of dental composite (co)monomers and the amalgam component Hg2+ in human gingival fibroblasts, Arch Toxicol, (2006), 80, p465-472.
[https://doi.org/10.1007/s00204-006-0073-5]

-
A Schedle, A Franz, X Rausch-Fan, A Spittler, T Lucas, P Samorapoompichit, W Sperr, G Boltz-Nitulescu, Cytotoxic effects of dental composites, adhesive substances, compomers and cements, Dent Mater, (1998), 14, p429-440.
[https://doi.org/10.1016/S0300-5712(99)00018-4]

- EJ Swift, J Perdigao, HO Heymann, Bonding to enamel and dentin: A brief history and state of the art, 1995, Quintessence Int, (1995), 26, p95-110.
-
S Szep, A Kunkel, K Ronge, D Heidemann, Cytotoxicity of modern dentin adhesives – in vitro testing on gingival fibroblasts, J Biomed Mater Res, (2002), 63, p53-60.
[https://doi.org/10.1002/jbm.10083]

- AT Tang, J Li, J Ekstrand, Y Liu, Cytotoxicity tests of in situ polymerized resins: methodological comparisons and introduction of a tissue culture insert as a testing device, J Biomed Mater Res, (1999), 45, p214-222.
