티타니아 나노튜브 기판의 금 나노튜브 제조 및 항균력 평가
초록
본 연구에서는 티타니아 나노튜브 층을 템플릿으로 이용하여 전기영동 증착법으로 금 나노튜브를 제작한 후, 금 나노튜브의 표면 특성분석과 생체 적합성 및 항균효과를 평가하고자 하였다. 구연산염 환원법 및 전기영동 증착법을 이용하여 4 nm와 15 nm의 금 나노입자를 양극산화된 100 nm 티타니아 나노튜브 위에 증착시켜 100 nm 직경의 금 나노튜브를 제작하였다. UV-Vis 분산 분광분석 결과, 4 nm 및 15 nm 금 나노튜브의 증착시간에 따른 최대 광 흡수도 파장들은 702~774 nm 및 753~760 nm 범위를 각각 형성하였으며, 증착시간에 따른 최대 광흡수도 파장의 이동이 관찰되었다. FE-SEM 결과에서는 티타니아 나노튜브의 최상층에 골고루 적층된 금 나노입자가 확인되었고, EDX 결과, 0.1~0.5% 금 함량을 관찰되었다. MTT 세포시험 결과, 배양 24시간, 48시간 후 모든 실험군의 상대 흡광도 값이 70%를 넘어 우수한 생체적합성을 나타내었다. 근 적외선 레이저 광을 이용하여 금 나노튜브의 세균 부착 및 성장에 미치는 효과를 본 결과, 금 나노입자의 코팅한 시간에 관계없이 모두 우수한 항균능을 나타내었다. 따라서 티타니아 나노튜브 템플릿을 이용한 금 나노튜브 코팅기술은 근적외선 레이저를 이용한 원격제어 온열처리가 가능한 티타늄 임플란트 표면처리 기술로의 적용가능성이 우수함을 확인하였다.
Abstract
In this study, gold nanotubes were fabricated by electrophoretic deposition using a titania nanotube layer as a template, and then the surface characteristics, biocompatibility and antibacterial effect of gold nanotubes were evaluated. Gold nanotubes of 100 nm diameter were fabricated by depositing 4 nm and 15 nm gold nanoparticles on anodized 100 nm titania nanotubes by citrate reduction and electrophoretic deposition. As a result of the UV-Vis diffuse spectrophotometer, 4 nm and 15 nm gold nanotubes showed strong absorption at 702~774 nm and 753~760 nm, respectively. Also, the maximum absorption wavelength was shifted to the longer wavelength as the coating time of the gold nanoparticles increased. FE-SEM observation and EDX analysis resulted that 0.1~0.5 wt% gold nanoparticles uniformly were stacked on the top layer of titania nanotubes. As a result of MTT cell test, the relative absorbance value of all experimental groups after 24 hours and 48 hours of incubation exceeded 70% indicating excellent biocompatibility. The effect of the near infrared laser light on the adhesion and growth of gold nanotubes showed excellent antibacterial activity regardless of the coating time of gold nanoparticles. Therefore, it is confirmed that the gold nanotube coating technology based on the titania nanotube template is supposed to be highly applicable to a titanium implant surface treatment technology with the remote control thermal treatment of a near-infrared laser.
Keywords:
Gold nanotubes, Citrate reduction, Electrophoretic deposition, Biocompatibility, antibacterial activity키워드:
금 나노튜브, 구연산 환원법, 티타니아 나노튜브, 생체적합성, 항균능서 론
기존의 항균 처리된 임플란트 관련 연구들은 티타늄 표면에 항균 약물 또는 약물담지 복합체를 코팅함으로서 물리적 충격에 의한 복합체와 티타늄 표면간의 박리현상과 원치 않는 약물 용출 등에 대한 문제점이 발생되고 있다. 이에 티타니아 나노튜브에 약물을 저장하는데 있어서 외부의 물리적 충격으로부터 보호함과 동시에 티타니아의 광촉매 특성을 이용한 약물용출 기능은 자외선뿐만 아니라 적외선에서도 원격제어에 의해 선택적 약물용출이 가능한 다양한 표면처리 기술이 필요하다. TiO2는 큰 밴드 갭(Eg> 3.2eV) 때문에 근 자외선 영역(λ< 380 nm)에서만 빛을 사용할 수 있어 태양 스펙트럼의 많은 부분을 사용하기 위해서는 광촉매의 흡수 능력이 필요하다(Kim 등, 2015b; Liu 등, 2010; Wang 등, 2010). 플라즈몬(plasmon) 광촉매는 고성능 광촉매 설계 기술로, 주로 은(Ag)과 금(Au) 나노입자를 사용하여 반도체 광촉매에 귀금속 나노 입자를 분산시키는 과정으로, 반도체-금속 접합과 국부적인 표면 플라즈몬 공명(Surface plasmonic resonance, SPR)인 주요 효과를 제공한다. 표면 플라즈몬 공명은 나노 크기를 갖는 금속 도체에 존재하는 자유 전자들이 특정 자극에 감응하는 것으로, 유전체 사이(금속 나노입자 표면, 공기, 용매 등)에 빛이 입사되었을 때 특정 에너지의 전자기파와 공명을 일으켜 금속 표면의 자유 전자들이 집단으로 진동하는 현상이다(Huang 과 Ei-Sayed, 2010; Wang, 등 2012). 나노입자를 여기(excitation) 시키면 입자 주위에 전자기장이 형성되어 표면증폭 라만산란(Surface enhanced Raman scattering, SERS)을 일으킬 수 있고(Cao 등, 2002; Jain 등, 2008), 여기된 나노입자 주위로 열을 방출함으로써 광열효과(Photothermal therapy)를 가능하게 한다(Jain 등, 2006; Gormley 등, 2011; Huang 등, 2011). 귀금속 나노입자의 이러한 효과로 인해 플라즈몬 광촉매는 자외선, 가시광선 및 근 적외선 조사 시 광촉매 활성을 크게 향상시킨다.
금 나노입자를 만드는 방법은 다양하게 보고되었다. 그 중 현재까지 널리 쓰이는 방법은 Turkevich 방법으로 수용액 상에서 금이 포함된 염을 구연산염으로 환원시켜 ~20 nm 크기의 금 나노입자를 만드는 방법으로 환원제 종류, 반응 시간, 가열 온도에 따라 금 나노입자의 크기가 달라진다(Turkevich 와 Stevenson, 1951). 구연산나트륨은 금(Au3+)을 환원시키는 환원제 역할과 환원된 금 나노입자 표면에 결합해 음전하(-)를 부여함으로써 수용액상에서 금 나노입자를 안정하게 둘러싸고 있는 안정제 역할을 한다. Yang 등(2003)과 Castro 등(2004)은 구연산나트륨 용액의 양에 따라 합성되는 금 나노입자의 크기가 달라진다고 보고하였다(Yang 등, 2003; Castro 등, 2004). 금 나노입자를 TiO2 나토튜브에 부착시키는 방법으로는 전기영동 증착법(Electrophoretic deposition, EPD)이 사용되는데, 일반적으로 전도성 기판의 한쪽 기판에는 음극(-), 다른 한쪽 기판에는 양극(+) 전압을 인가하여, 용매 또는 용액 내의 전하를 띄는 입자들이 전도성의 반대 극성을 띄는 기판 쪽으로 이동하여 증착되는 현상으로, 증착면의 모양에 제약이 적어 다양한 패턴에 따라서 선택적으로 코팅이 되며, 넓은 범위까지 균일하고 치밀한 연속 층을 형성하는 것이 가능하다(Lee 등, 2009; Kreethawate 등, 2010).
본 연구에서는 양극산화된 티타니아 나노튜브를 기판(template)으로 이용하여 금 나노입자를 전기영동 증착법(Electrophoretic deposition, EPD)으로 기판에 증착시켜 금 나노튜브를 제작한 후, 표면 특성분석과 생체 적합성 및 항균효과를 평가하고자 하였다.
재료 및 방법
1. 티타니아 나노튜브 제작
티타늄 판(Thickness: 250 μm, purity: 99.5%; Alfa-Aesar, MA, USA)을 아세톤, 에탄올, 및 증류수의 순서로 세척한 후, 0.5 wt% 불산(purity: 48%, Sigma, USA)을 전해질 용액으로 하여 20 V, 30분 동안 양극산화 시켜 100 nm 티타니아 나노튜브를 제조하였다. 양극 산화된 나노튜브 시편은 증류수에 세척하였고, 60℃ 오븐에서 24시간 건조하였다.
2. 금 나노입자 합성
금 나노입자 제조는 Turkevich 방법으로 잘 알려진 구연산염 환원법을 이용하였다. Gold(III) chloride trihydrate (HAuCl4·3H2O; Sigma, MO, USA)과 trisodium citrate (HOC(COONa)(CH2COONa)2; Sigma, MO, USA)의 혼합 수용액에 필요에 따라 Sodium borohydride (NaBH4; Sigma, MO, USA)를 첨가하고 2시간 동안 가열 교반하여 금 나노입자를 합성하였다. 합성된 금 나노입자들은 다음 실험 전까지 4℃에서 보관하였다. 본 연구에 사용된 금 나노입자 합성 조건은 표 1에 명시되어있다.
3. 금 나노튜브 제조
합성된 금 나노입자를 티타니아 나노튜브 표면에 부착시키기 위하여 전기영동 증착법을 이용하였다. 구연산염 환원법으로 합성된 20 mL 금 나노입자 수용액, 36 mL 과산화수소수(30%; Sigma, MO, USA), 94 mL 3차 증류수(JT Baker, USA)의 혼합 수용액을 제조한 뒤, 2 V의 전위차를 걸어주어 시간별로 100 nm 나노튜브 표면에 4 nm와 15 nm의 금 나노입자를 코팅시켰다. 코팅된 금 나노튜브는 400℃에서 2시간동안 열처리를 하였다(공기 중 열처리, 승온 및 냉각속도 =1℃/min).
4. 금 나노튜브의 표면특성 분석
금 나노입자가 코팅된 티타니아 나노튜브의 흡수파장을 알기 위하여 확산반사 분광광도계(Diffuse Reflectance UV-VIS-NIR Spectrophotometer: SolidSpec-3700, Shimadz, Japan)를 사용하였다. 금 나노튜브의 형태학적 미세구조는 전계방사 주사전자현미경(Field emission scanning electron microscope(FE-SEM); S4800S, Hitachi & Horiba, Japan)으로 관찰하였고, 화학 조성은 에너지 분산형 X-선 분광기 (Energy Dispersive X-ray Spectrometer(EDX); Oxford instruments Analytical 7582, England)로 분석하였다.
5. 세포배양 및 독성평가
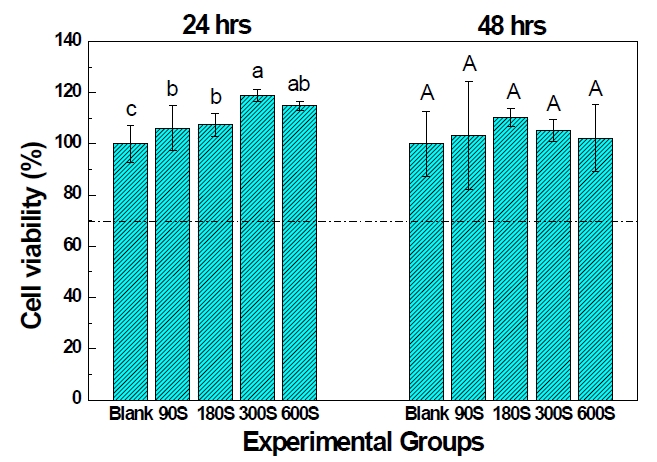
실험에 사용한 L929(mouse fibroblast cell line)는 10% FBS (Gibco BRL, Grand island, N.Y., USA)와 1% antibiotics (Gibco BRL, Grand island, N.Y., USA)가 첨가한 RPMI Medium 1640(Gibco BRL, Grand island, N.Y., USA)배지를 배양액으로 37℃, 5% CO2 incubator에서 배양되었다. 세포의 독성평가는 3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyl- tetrazolium bromide (MTT) assay를 이용하여 측정하였다. 즉 15 nm 금 나노튜브 시편 위에 L929 세포를 12 well plate에 50,000 cells/well의 농도로 분주하고 24시간 및 48시간 배양하였다. 배양 후 MTT(Sigma, MO, USA)용액 100 ㎍/ml을 각 well에 첨가하여 37℃에서 4시간 동안 배양하였다. 4시간 경과 후 MTT에 의해 형성된 formazan을 DMSO (Sigma, USA)로 녹이고 ELISA reader (Spectra MAX 250, USA)를 이용하여 570 nm에서 흡광도를 측정하였다. 흡광도 결과를 바탕으로 blank 대비 광 흡광도가 70% 이상을 나타내는 시편에 대해서 세포독성이 없는 것으로 판정하였다.
6. 항균능 평가
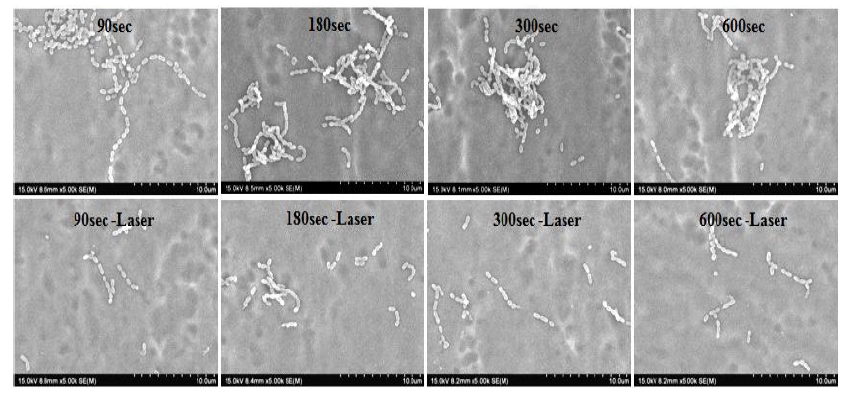
금 나노튜브의 근적외선 레이저 조사에 의한 원격제어 항균능을 평가하기 위해 S. mutans(ATCC 25176)는 Brain heart infusion (BHI, Difco, NJ, USA)액체 배지에 24시간 배양한 후, S. mutans 부유 액의 세균수를 측정하여 1 X 105 CFU/ml로 세균농도를 희석한 후 Brain heart infusion (BHI, Difco, NJ, USA)액체 배지에 100 ㎕씩 접종한 후 균의 성장을 위하여 37℃ incubator에서 24시간 배양하였다. 배양 24시간 후, 의료용 레이저 조사기(OCLA, 808 nm, LVI Technologies Inc. Korea)로 1분간 조사 (Pulse mode; output power 15 W, 1 m/sec, 500 Hz) 후, FE-SEM으로 시편 표면에 존재하는 세균 수 및 분포도를 확인하여 항균능을 평가하였다.
7. 통계분석
MTT 세포독성평가 시험결과는 SPSS Ver. 23.0 (SPSS Inc, IL, USA)을 이용하여 일원배치 분산 분석(One-way ANOVA)를 시행하였다. 사후검정으로 Tukey’s test를 시행하였으며, 유의 수준은 0.05로 설정하였다.
결 과
1. 금 나노입자의 표면관찰
금 나노입자의 형상 변화를 열처리 전, 후 비교하여 확산반사 분광광도계를 이용한 파장별 광 흡수도를 측정한 결과, 4 nm 금 나노튜브의 증착시간에 따른 최대 광 흡수도 파장들은 702~774 nm 넓은 범위를 형성하였고, 증착시간이 증가함에 따라 최대 강 흡수도의 파장대가 장파장으로 이동하는 것을 확인하였다. 이에 반하여 15 nm 금 나노튜브의 증착시간에 따른 최대 광흡수도 파장들은 753~760 nm 범위를 형성하였고, 증착시간에 따른 최대 광흡수도 파장의 미세한 이동이 관찰되었다(Figure 1). 금 나노입자가 코팅 된 티타니아 나노튜브의 FE-SEM 결과, 티타니아 나노튜브의 최상층에 적층된 금 나노입자가 관찰 되었고 EDX 결과, 0.1~0.5 wt%의 금 함량을 확인할 수 있었다(Figure 2, Table 2).
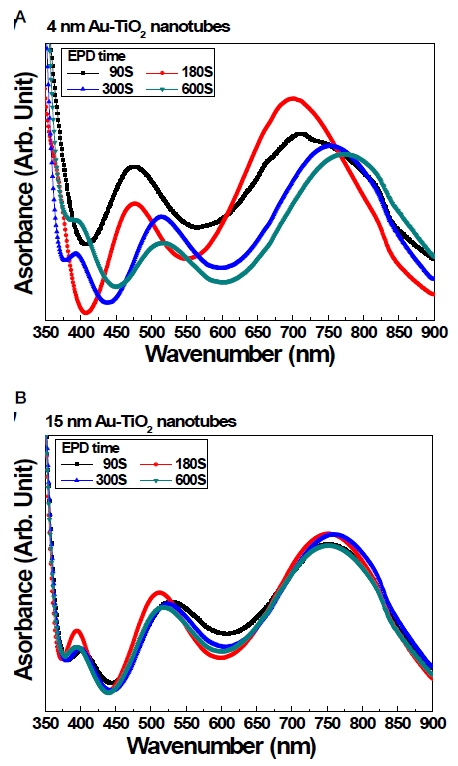
Diffuse Reflectance UV-VIS-NIR Spectra of (A) 4 nm and (B) 15 nm gold nanoparticles coated titania nanotubes.
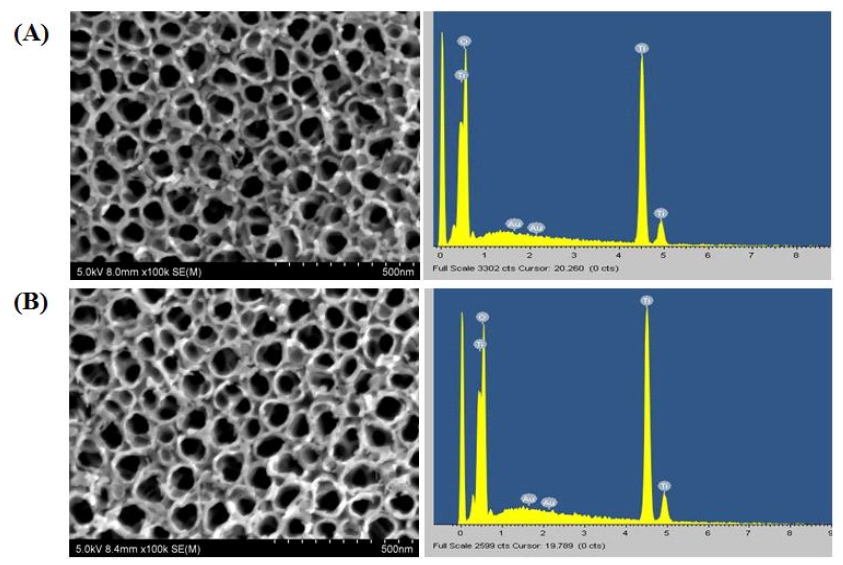
FE- SEM micrographs {4 nm(A), 15 nm(B), ×50,000} and surface elements of gold nanoparticles coated titania nanotubes
2. 세포독성 평가
L929 세포를 이용한 MTT 세포독성 평가 결과, 24시간 배양 후의 실험결과에서는 300초 및 600초 금 나노입자를 코팅한 실험군의 결과가 대조군 결과보다 유의차있게 높게 나타났고(P>0.05), 48시간 배양 후의 결과에서는 실험군 간의 통계적 유의차는 발견되지 않았다(P<0.05). 또한, ISO 10993-5(2009), Biological evaluation of medical device - Part 5에 따라 모든 실험군의 blank 대비 상대 흡광도 값이 70 %를 넘어 본 연구에서 제조된 금 나노튜브는 세포독성이 없는 것으로 확인되었다(Figure 3).
3. 항균능 평가
세균 배양 24시간 후, 808 nm 파장의 근적외선 레이저를 조사한 실험군과 조사하지 않은 실험군 간의 FE-SEM 관찰 결과, 레이저 조사 시간에 상관없이 근적외선 레이저를 조사한 실험군이 레이저를 조사하지 않은 실험군보다 더 많은 세균 사멸이 관찰되어 근적외선 레이저 조사에 의한 금 나노튜브의 항균능이 우수한 것으로 관찰되었다(Figure 4).
고 찰
금 나노입자의 표면 플라즈몬 공명(Surface plasmonic resonance, SPR)과 공명조건인 파장의 빛을 쪼여주면 표면 플라즈몬 공명이 여기 되면서 빛의 흡수가 일어난다. 금 나노입자에 흡수된 에너지는 용매로 방출되어 주변의 온도를 증가시키는 연구가 진행되어 왔다(Link 등, 2000; Lal 등, 2008). 본 연구에서는 티타니아 나노튜브 층을 템플릿으로 전기영동 증착법을 이용하여 4 nm 및 15 nm 금 나노입자가 코팅된 금 나노튜브를 제작하였다. FE-SEM 및 EDX 분설 결과에서 알 수 있듯이 작은 입자인 4 nm 금 나노입자의 초기 코팅 양이 큰 입자인 15 nm 금 나노입자보다 높은 것으로 관찰되었으나, 전기영동 증착시간이 길어질수록 이러한 경향이 두드러지게 관찰되지 않았다. 이는 전기영동 증착법 기반의 금 나노입자의 국소코팅이 증착시간보다는 금 나노입자의 크기에 전위차가 영향을 받는 것으로, Masitas 등(2016)이 보고한 금 나노입자의 크기별 증착에 전위차가 영향을 받는다는 유사한 경향을 나타내었다. 또한, 전기영동 증착에 필요한 금 나노입자의 제한성으로 인하여 특정 시간 이후에는 더 이상 코팅할 금 나노입자가 전기영동 증착용액에 남아 있지 않으므로, 이에 대한 최적의 코팅시간을 찾는 것이 가장 중요하다고 볼 수 있다. 또한, FE-SEM 관찰 결과로는 티타니아 나노튜브 내부로의 금 나노입자 코팅 여부를 확인하기 불가능하므로 이에 때한 추가실험이 필요하다고 판단된다.
금 나노입자의 형상 변화를 열처리 전, 후 비교하여 UV-Vis-NIR 확산반사 분광 광도계를 이용한 파장별 광 흡수도를 측정한 결과, 4 nm 금 나노튜브의 증착시간에 따른 최대 광 흡수도 파장들은 702~774 nm 넓은 범위를 형성하였고, 증착시간이 증가함에 따라 최대 광 흡수도의 파장대가 장파장으로 두드러지게 이동하는 것을 확인하였다. 이에 반하여 15 nm 금 나노튜브의 증착시간에 따른 최대 광흡수도 파장들은 753~760 nm 범위를 형성하였고, 증착시간에 따른 최대 광 흡수도 파장의 미세한 이동이 관찰되었다. Kim 등(2008)은 금 나노로드의 종횡비(aspect ratio)가 커짐에 따라 장파장으로 이동한다고 보고하였고, Njoki 등(2007)은 나노입자 간 또는 금 기판 표면 사이와 금 나노입자의 거리가 근접할수록 혹은 금 나노입자의 크기가 커질수록 장파장 쪽으로 이동한다고 보고하였다. 이번 결과는 열처리로 인해 티타니아 나노튜브에 증착된 금 나노입자 사이의 거리가 더 밀접해지고 금 나노입자의 응집으로 인한 종횡비(aspect ratio)가 커짐에 따라 최대 흡수파장이 장파장으로 이동하는 것으로 유추할 수 있었다. 또한, 금 나노입자 크기나 형태에 따라 세포독성이 차이가 있다는 것이 보고되었는데(Lewinski 등, 2008; Pan 등, 2009; Kim 등, 2015), 세포 농도에 따른 금 나노튜브의 MTT 세포독성 평가 결과, 저 농도(50,000 cells/well)와 고 농도(100,000 cells/well)에서의 배양 24시간, 48시간 후 상대 흡광도 결과는 모든 실험군의 blank 대비 상대 흡광도가 70%를 넘어 금 나노튜브가 세포에 독성이 미치지 않음을 확인할 수 있었다. 마지막으로 근적외선 영역대의 레이저 광을 이용하여 금 나노튜브의 세균 사멸에 미치는 효과를 확인한 결과, 전기영동 증착법 기반의 15 nm 금 나노입자 코팅시간에 관계없이 모두 우수한 세균 사멸이 관찰되었다. 이러한 결과들을 바탕으로 나노튜브 형상으로 코팅된 금 나노입자의 구조적 특이성으로 인하여 금 나노입자의 근적외선 조사에 의한 광열효과(Photothermal effect)를 발현하는 금 나노튜브의 특성은 티타니아의 광촉매 특성을 이용한 자외선뿐만 아니라 적외선 영역에서 원격제어에 의해 선택적 약물용출이 가능한 항균능 임플란트 개발에 대한 응용 가능성이 매우 우수하다고 판단된다.
결 론
본 연구에서는 티타니아 나노튜브 템플릿에 전기영동 증착법으로 금 나노입자를 코팅하여 금 나노튜브를 제작한 후, 금 나노튜브의 표면 특성분석과 생체 적합성 및 항균능을 평가하여 다음과 같은 결과를 얻었다.
- 1. UV-Vis-NIR 확산분산 분광계를 이용하여 금 나노튜브의 파장별 광 흡수도를 측정한 결과, 4 nm 금 나노튜브의 증착시간에 따른 최대 광 흡수도 파장들은 702~774 nm 넓은 범위를 형성하였고, 15 nm 금 나노튜브의 증착시간에 따른 최대 광흡수도 파장들은 753~760 nm 범위를 형성하였으며, 증착시간에 따른 최대 광 흡수도 파장의 이동이 관찰되었다.
- 2. 금 나노튜브의 FE-SEM 결과, 티타니아 나노튜브의 최상층에 적층된 금 나노입자가 두드러지게 관찰되지 않았고, EDX 결과, 4 nm와 15 nm의 금 나노입자 모두 증착 시간에 상관없이 0.1~0.5 wt% 금 함량을 나타내었다.
- 3. 모든 실험군의 blank 대비 상대 흡광도 값이 70%를 넘어 금 나노튜브의 세포독성이 관찰되지 않았고, 근 적외선 레이저 광 조사에 의한 원격제어 항균효과는 금 나노입자 코팅 시간에 관계없이 모두 우수한 항균 사멸이 관찰되었다.
이상의 결과들을 바탕으로 티타니아 나노튜브 템플릿을 이용한 금 나노튜브 제조기술은 우수한 생체친화성과 근 적외선 레이저 조사에 의한 우수한 세균 사멸능을 나타내므로 원격제어 항균이 가능한 차세대 티타늄 임플란트 표면처리 기술로의 적용가능성이 우수함을 확인하였다.
References
- Cao, YC, Jin, R, Mirkin, CA, (2002), Nanoparticles with Raman Spectroscopic Fingerprints for DNA and RNA Detection, Science, 297, p1536-1540.
- Castro, JL, Lopez-Ramirez, MR, Centeno, SP, Otero, JC, (2004), Adsorption of mercaptoacetic acid on a colloidal silver surface as investigated by Raman spectroscopy, Biopolymers, 74, p141-145.
-
Chen, XB, Mao, SS, (2007), Titanium dioxide nanomaterials: synthesis, properties, modifications, and applications, Chem Rev, 107, p2891-2959.
[https://doi.org/10.1021/cr0500535]

-
Gormley, AJ, Greish, K, Ray, A, Robinson, R, Gustafson, JA, (2011), Gold nanorod mediated plasmonic photothermal therapy: a tool to enhance macromole- cular delivery, Int J Pharm, 415, p315-318.
[https://doi.org/10.1016/j.ijpharm.2011.05.068]

-
Huang, P, Bao, L, Zhang, C, Lin, J, Luo, T, (2011), Folic acid-conjugated silica-modified gold nanorods for X-ray/CT imaging-guided dual-mode radiation and photo-thermal therapy, Biomaterials, 32, p9796-9809.
[https://doi.org/10.1016/j.biomaterials.2011.08.086]

- Huang, X, and Ei-Sayed, MA, (2010), Gold Nanoparticles: Optical Properties and Implementations in Cancer Diagnosis and Photothermal Therapy, J Adv Res, 1, p13-28.
- Jain, PK, Huang, X, El-Sayed, IH, El-Sayed, MA, (2008), Noble Metals on the Nanoscale: Optical and Photothermal Properties and Some Applications in Imaging, Sensing, Biology, and Medicine, Acc Chem Res, 41, p1578-1586.
-
Jain, PK, Lee, KS, El-Sayed, MA, (2006), Calculated Absorption and Scattering Properties of Gold Nanoparticles of Different Size, Shape, and Composition: Applications in Biological Imaging and Biomedicine, J Phys Chem B, 110, p7238-7248.
[https://doi.org/10.1021/jp057170o]

- Kim, S, Shuford, KL, Bok, HM, Kim, SK, Park, S, (2008), “Intraparticle surface plasmon coupling in quasi-one-dimensional nanostructures.”, Nano Letters, 8, p800-804.
- Kim, YJ, Yoo, CJ, Lee, U, Yoo, YM, (2015), Cytotoxicity of Gold Nanorods and Nanowires on Cultivated Neural Precursor, J Nanosci Nanotechnol, 15, p5617-5623.
-
Kreethawate, L, Larpkiattaworn, S, Jiemsirilers, S, Bersa, L, Uchikoshi, T, (2010), Application of electrophoretic deposition for inner surface coating of porous ceramic tubes, Surf Coat Technol, 205, p1922-1928.
[https://doi.org/10.1016/j.surfcoat.2010.08.069]

-
Lal, S, Clare, SE, Halas, NJ, (2008), Nanoshell-enabled photothermal cancer therapy: impending clinical impact, Acc Chem Res, 41, p1842-1851.
[https://doi.org/10.1021/ar800150g]

-
Lee, JH, Gil, GY, Yoon, DH, (2009), Fabrication of SiCf/SiC composites using an electrophoretic deposition, J Kor Ceram Soc, 46, p447-451.
[https://doi.org/10.4191/kcers.2009.46.5.447]

-
Lewinski, N, Colvin, V, Drezek, R, (2008), Cytotoxicity of Nanoparticles, Small, 4, p26-49.
[https://doi.org/10.1002/smll.200700595]

- Link, S, Burda, C, Nikoobakht, B, El-Sayed, MA, (2000), Laser-Induced Shape Changes of Colloidal Gold Nanorods Using Femtosecond and Nanosecond Laser Pulses, J Phys Chem, 104, p6152-6163.
-
Liu, G, Wang, LZ, Yang, HG, Chen, HM, Lu, GQ, (2010), Titania-based photocatalysts—crystal growth, doping and heterostructuring, J Mater Chem, 20, p831-843.
[https://doi.org/10.1039/b909930a]

-
Masitas, RA, Allen, SL, and Zamborini, FZ, (2016), Size-Dependent Electrophoretic Deposition of Catalytic Gold Nanoparticles, J Am Chem Soc, 138, p15295-15298.
[https://doi.org/10.1021/jacs.6b09172]

-
Njoki, PN, Lim, I.LS, Mott, D, Park, HY, Khan, B, Mishra, S, Sujakumar, R, Luo, J, Zhong, CJ, (2007), Size correlation of optical and spectroscopic properties for gold nanoparticles, J Phys Chem, 111, p14664-14669.
[https://doi.org/10.1021/jp074902z]

-
Pan, Y, Leifert, A, Ruau, D, Neuss, S, Bornemann, J, Schmid, G, Brandau, W, Simon, U, Jahnen-Dechent, W, (2009), Gold nanoparticles of diameter 1.4 nm trigger necrosis by oxidative stress and mitochondrial damage, Small, 5, p2067-2076.
[https://doi.org/10.1002/smll.200900466]

-
Turkevich, J, Stevenson, PC, Hillier, JA, (1951), Study of the Nucleation and Growth Processes in the Synthesis of Colloidal Gold, Discuss Faraday Soc, 11, p55-75.
[https://doi.org/10.1039/df9511100055]

- Wang, H, Bai, YS, Zhang, H, Zhang, ZH, Li, JH, Guo, L, (2010), Quantumdots-sensitized TiO2 nanorod array on transparent conductive glass photo-electrodes, J Phys Chem, 114, p16451-16455.
-
Wang, H, You, T, Shi, W, Li, J, and Guo, L, (2012), Au/TiO2/Au as a plasmonic coupling photocatalyst, J Phys Chem, 116, p6490-6494.
[https://doi.org/10.1021/jp212303q]

-
Yang, RD, Tripathy, S, Tay, FEH, Gan, LM, Chua, SJ, (2003), Photoluminescence and micro-Raman scattering in Mn-doped ZnS nanocrystalline semiconductors, J Vac Sci Technol, 21, p984-988.
[https://doi.org/10.1116/1.1568350]