Epigallocatechin-3-gallate 함유 β-TCP이식재의 골재생능에 관한 조직계측학적 평가


초록
본 연구에서는 미세다공성 β-tricalcium phosphate (β-TCP)이식재에 녹차엽추출 생리활성물질인 epigallocatechin-3-gallate (EGCG) 결합시 이식재의 골재생능이 증진되는지 확인하기 위해 가토의 두개골 결손모델을 이용하여 골치유 양상을 평가하였다. EGCG가 함유된 이식재의 골치유능을 평가하기 위해 입자형 β-TCP 200 mg에 1 mg (TCP-1군), 10 mg (TCP-10군)의 두 가지 용량으로 EGCG가 적용된 실험군 이식재를 준비하여 EGCG가 결합되지 않은 대조군 β-TCP (TCP-0군)와 비교하여 4주, 8주의 치유기간에서 신생골 형성량을 조직계측학적으로 평가하였다. 가토의 두개골에 형성한 직경 8 mm의 골관통 결손부에 세 종류의 이식재를 충진한 후 치유양상을 평가한 결과 결손부당 1 mg의 EGCG가 적용된 TCP-1군은 다른 두 군에 비해 이식부내에서 현저히 증진된 신생골 형성 결과를 나타내었으며, 재생된 골조직내에서 많은 신생 혈관이 형성된 것을 확인할 수 있었다. TCP-1군은 EGCG를 적용하지 않은 대조군 TCP-0군에 비해 4주, 8주 치유기간에서 현저히 증가된 신생골 면적을 나타내었고(p < 0.05), TCP-10군에 비해서도 이식 8주후 신생골 면적이 증가한 결과를 보였다(p < 0.05). 이에 비해 고용량의 EGCG가 적용된 TCP-10군과 EGCG가 적용되지 않은 TCP-0군 사이에 신생골 형성량에 있어서 유의한 차이는 없었다. 이러한 본 연구의 결과를 통해 단순흡착을 통해 1 mg의 EGCG가 결합된 β-TCP이식재는 가토의 두개골 결손모델의 치유에서 골재생을 촉진하는데 효과적임을 확인할 수 있었다. 따라서 적정용량의 국소적 EGCG적용은 골결손 치료에 사용되는 β-TCP이식재의 골재생능을 증진하는 효과적인 접근법이 될 수 있을 것으로 기대된다.
Abstract
This study investigated the effect of epigallocatechin-3-gallate (EGCG)-loaded microporous β-tricalcium phosphate (β-TCP) bone substitute in the bone healing of rabbit calvarial defects. New bone formation induced by β-TCP incorporating two different dose of EGCG [1 mg EGCG/200 mg β-TCP (TCP-1), 10 mg EGCG/200 mg β-TCP (TCP-10)] was compared with unloaded β-TCP (TCP-0). Calvarial defects 8 mm diameter created in 14 adult male New Zealand White rabbits were filled with three types of bone substitutes. The amount of newly formed bone was evaluated histomorphometrically at 4 and 8 weeks after implantation. The TCP-1 group exhibited increased bone healing capacity and numerous blood vessel formation compared with the other two groups. New bone formation was observed in the cental area of TCP-1 filled defects at 8 weeks. Histomorphometric analysis revealed significantly greater newly formed bone area in the TCP-1 group when compared with unloaded TCP-0 (p<0.05 at 4 and 8 weeks) and 10 mg EGCG-loaded TCP-10 groups (p<0.05 at 8 weeks). No difference was observed in new bone area between TCP-0 and TCP-10 groups. These results suggest that local delivery of 1 mg EGCG to β-TCP bone substitute by simple adsorption promotes bone regeneration in the healing of rabbit calvarial osseous defect and higher EGCG dose (in this study, 10 mg per defect) does not exert any positive effect on bone healing capacity of β-TCP. Thus, local delivery of EGCG to β-TCP bone substitute seems to be an effective approach for the treatment of osseous defects.
Keywords:
Bone substitute, Bone regeneration, EGCG, Histomorphometry, Polyphenol키워드:
골대체재, 골재생, EGCG, 조직계측, 폴리페놀서 론
염증성 질환, 외상, 종양 등의 원인으로 인해 발생한 치아상실과 악골 결손은 구강악안면 영역의 심각한 심미적, 기능적 장애를 유발하며 이를 회복하기 위한 임플란트 치료 및 골재건 수술에서 다양한 종류의 골이식재가 같이 사용된다. 이중에서 합성골 이식재는 동종골 이식재, 이종골 이식재와 비교시 생물학적 안전성의 장점을 지닌다(Mellonig, 1995; Kim 등, 2013; Kwon 등, 2017a, b). 하지만 자가골 이식재, 동종골 이식재와 비교시 골형성능, 골유도능의 기능이 없으므로 술후 예지성 있는 골재생 결과를 기대하기에는 한계가 있다. 이러한 이유로 이식재의 골재생능을 증진하여 임플란트 치료 및 골재건 수술에서 신생골 형성에 필요한 치유기간을 단축하고 예지성 있는 임상결과를 얻기 위해 많은 연구가 이루어져 왔다.
골형성을 촉진하는 것으로 알려진 생리활성물질(biologically active substance)의 이용은 골재생을 개선하기 위한 대표적 접근법의 하나로서 활발한 연구가 이루어져 왔다(Jayakumar 등, 2011; Park 등, 2011; Moshaverinia 등, 2014; Ding 등, 2018). 골형성단백질(bone morphogenetic protein, BMP)을 포함한 성장인자(Jayakumar 등, 2011; Ding 등, 2018), 세포부착을 촉진하는 펩타이드(Moshaverinia 등, 2014)의 적용은 이식재 표면으로의 골형성을 위한 전구세포 및 중간엽줄기세포의 이주 및 초기 부착, 골모세포 분화를 촉진하고 주위 신생 골조직 형성을 유도하여 골재생수술의 결과를 증진하는 효과적인 접근법의 하나로 제시되었다.
최근에는 합병증 발생 가능성이 있는 성장인자외의 다양한 생리활성물질의 적용에 관해서도 활발한 연구가 이루어지고 있다(Rodriguez 등, 2011; Park 등, 2014; Yue 등, 2016). 이러한 맥락에서 항산화작용을 지닌 녹차엽추출물을 이식재의 골치유능을 증진하기 위한 효과적인 후보물질의 하나로 사용하기 위해 여러 연구가 이루어지고 있다(Rodriguez 등, 2011; Mah 등, 2014; Honda 등, 2015; Tominari 등, 2015; Chu 등; 2016). 녹차엽 폴리페놀에 다량으로 함유된 epigallocatechin-3-gallate (EGCG)는 항산화, 항염 등의 다양한 생리활성기능을 지니고 있는 것으로 알려져 있으며(Chu 등, 2017), EGCG처리가 시험관적 실험 및 동물실험에서 골모세포분화 및 골재생을 촉진하는 효과가 있는 것으로도 보고되었다(Rodriguez 등, 2011; Mah 등, 2014; Tominari 등, 2015). 설치류 및 인간의 중간엽줄기세포를 이용한 연구에서 EGCG처리가 알카리성 인산가수분해효소(alkaline phosphatase) 활성도 및 광물화결절 형성을 촉진하는 것으로 알려졌다(Chen 등, 2005; Jin 등, 2014; Mah 등, 2014; Wang 등, 2016). 또한 EGCG가 염증전구물질인 prostaglandin E 생성을 억제하여 치조골흡수를 예방하고 세균 내독소인 지질다당류(lipopolysaccharide, LPS)에 의한 파골세포형성을 억제하는 효과가 있는 것으로 보고되었다(Tominari 등, 2015).
하지만 현재까지 EGCG의 골재생 효과에 관해서는 단지 비교적 적은 수의 연구에서 제한적 실험동물 모델에서만 평가되었고, EGCG 적용농도와 관련한 골형성 효과에 관해서도 비교적 다른 결과가 보고되었다(Rodriguez 등, 2011; Mah 등, 2014; Tominari 등, 2015; Chu 등; 2016; Elder 등, 2017). 현재까지 골형성을 촉진하기 위한 국소적 적용시 적합한 EGCG 용량에 관해서도 명확하게 제시된 것은 없다. 만일 EGCG처리를 통해 예지성 있는 골재생을 기대할 수 있고, 또한 골이식재에 단순한 처리를 통해 개선된 신생골 형성 효과를 얻을 수 있다면 실제 임상환경에서 성장인자 사용시 나타날 수 있는 합병증 발생의 위험성 없이 보다 쉽게 접근할 수 있는 장점이 있을 것이다. 따라서 본 연구에서는 현재 임상에서 골재생 수술에 많이 사용되는 대표적인 합성골 이식재의 하나이면서 생리활성물질의 국소송달에 있어서 효율적인 매개체로 사용되는 입자형 β-TCP이식재에 단순 흡착을 통해 EGCG를 적용시 골재생 효과를 확인하기 위해 가토의 두개골 결손모델에 이식후 신생골 형성을 포함한 골치유 결과를 조직계측학적으로 평가하였다.
재료 및 방법
1. 실험재료
입자크기 150-500μm의 미세다공성 β-TCP (Cerasorb M, Curasan, Germany) 이식재 1 g을 100% 에탄올(Sigma-Aldrich, USA)에 용해한 두 가지 농도의 EGCG(순도 98% 이상, Sigma-Aldrich, USA) 용액 1 mL에 침적하여 이식재 100 mg당 0.5 mg, 5 mg의 EGCG가 함유된 실험군 이식재를 준비하였다. 무균작업 실험대내에서 준비한 EGCG용액을 β-TCP입자표면에 고르게 떨어뜨려 이식재 입자표면 및 내부기공구조로 스며들게 한 후 완전히 건조하였다. 이러한 단순 흡착법을 이용한 EGCG의 국소적 적용은 이식재로부터 며칠 동안 EGCG를 서서히 방출하는 것으로 알려졌으며 입자형 합성골 이식재에 EGCG를 적용하는데 있어서 비교적 효과적인 방법이 될 수 있는 것으로 보고되었다(Rodriguez 등, 2011; Mah 등, 2014). EGCG가 함유된 이식재의 골재생능을 조직계측학적으로 평가하기 위해 실험동물에 준비된 각 두개골 결손부에 200 mg의 β-TCP를 이식하였으므로 다음과 같이 세 군으로 분류하여 연구에 사용하였다.
1) TCP-0 : EGCG처리를 하지 않은 β-TCP이식재 대조군
2) TCP-1 : β-TCP 200 mg당 1 mg의 EGCG가 함유된 실험군
3) TCP-10 : β-TCP 200 mg당 10 mg의 EGCG가 함유된 실험군
2. 동물실험
3.5~4 kg의 웅성 가토(New Zealand white rabbit; 중앙실험동물, 한국) 총 14 마리를 본 실험에 사용하였다. 본 연구는 경북대학교 동물실험윤리위원회의 승인후 시행하였고(승인번호; KNU 2011-96), 실험동물의 관리 및 사용에 관한 미국국립보건원(NIH) 지침(2011)을 준수하여 동물실험을 진행하였다. 실험동물의 마취는 전신마취제인 졸레틸(Vibac, France)과 근육이완제인 럼푼(바이엘코리아, 한국)을 근육주사하여 시행하였다. 이후 수술부위의 면도 및 소독후 시술시 출혈감소를 위하여 1:10만 에피네프린 함유 2% 리도카인(유한양행, 한국)을 시술부위에 추가적으로 피하 주사하였다. 두개골에 시상절개를 시행하고 전층판막을 거상후 두개골을 노출하였다. 수술용 트레핀버를 이용하여 충분한 생리식염수 주수하에 직경 8 mm의 골관통 결손부(transosseous defect)를 실험동물의 전두골 양측에 두 개, 두정골 우측에 한 개씩 형성하여 개체당 총 3개의 결손부를 준비하였다(Figure 1). 형성된 결손부에 TCP-0, TCP-1, TCP-10의 세 가지 종류 이식재 각 200 mg을 각 동물마다 시계방향으로 위치를 바꾸어 가면서 충진하였다. 이후 판막을 원래 위치로 고정한 후 흡수성 봉합사로 골막과 상부 연조직을 각기 이중으로 층별 봉합하였다. 시술후 통증감소 및 감염예방을 위해 바이트릴(바이엘코리아, 한국)과 노빈(바이엘코리아, 한국)을 근육주사하였다.
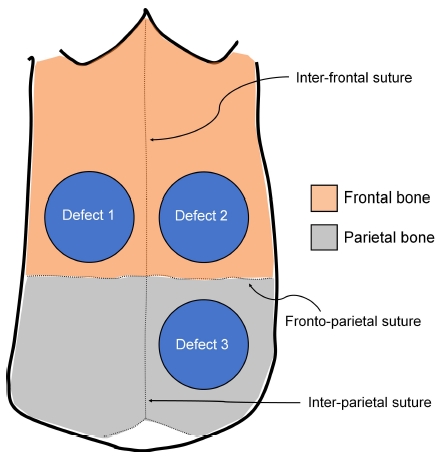
Schematic drawing of defect location in rabbit calvaria. Three transosseous defects (8 mm in diameter) were prepared in the frontal (two defects) and parietal (one defect) bones of each animal. Defects were randomly filled with three different graft materials (TCP-0, TCP-1 and TCP-10) by rotating the position of grafts in a clockwise direction.
3. 조직계측학적평가
실험동물은 이식후 4주와 8주의 치유기간후 평가를 위해 희생하였으며, 각 평가 기간당 7개체씩 전신마취후 희생후 이식부와 주위 조직을 일부 포함하여 조직계측학적평가를 위한 시편제작을 위해 두개골 조직을 적출하였다. 채득한 조직을 4% 중성완충 포름알데하이드로 고정후 10% EDTA (ethylenediaminetetraacetic acid; Sigma-Aldrich, USA)를 이용하여 탈회하였다. 통법에 따라 시편을 에탄올로 탈수시키고 파라핀에 포매하였다. 이후 원래 형성한 결손부 중앙부에 근접하여 조직절편을 이식부 하나당 4개씩 제작한 후 Masson’s trichrome염색을 시행하였다. Masson’s trichrome염색을 통해 교원질의 성숙정도 및 이와 관련한 신생골조직 형성 그리고 골형성 관련 세포 등을 평가하였다. 치유시기에 따라 골모세포를 함유한 진한 푸른색 및 골모세포 및 골세포가 함유된 성숙한 골조직을 나타내는 붉은 색으로 강하게 염색된 부위를 계측하였다. 염색된 조직시편의 평가는 광학현미경(Eclipse Ci; Nikon, Japan)에 연결된 CCD카메라(ProgRes Speed XT core 5; Jenoptik, Germany)를 통해 전송된 영상을 컴퓨터 모니터상에서 확대하여 시행하였다. 조직학적 평가와 더불어 두개골 결손모델에서 EGCG처치가 β-TCP의 골재생능을 증진하는지 확인하기 위해 이식부에서 관찰되는 신생골 형성양을 계측하였다. 40배 배율로 촬영한 조직사진을 이용하여 기본적인 평가를 시행하였고, 필요시 100배 배율에서 촬영한 상을 이미지분석 프로그램(i-Solution; iMTechnology, Korea)을 이용하여 원래 형성한 골결손부내에 충진된 입자형 이식재 주위 그리고 이식재 내부에서 관찰되는 신생골의 면적(mm2)을 계측하였다. 이식부 하나당 4개의 조직시편을 계측하여 평균값을 각 샘플의 측정값으로 사용하였다.
4. 통계적 분석
4주, 8주의 치유기간에서 신생골 형성량에 있어서 군간에 유의한 차이가 있는지 평가하기 위해 one-way ANOVA를 이용하여 유의성을 평가하였고, Tukey 사후분석을 시행하였다. 동일한 군에서 4주, 8주의 치유기간에 따른 신생골 형성량에 관한 통계적 유의성은 Mann-Whitney U test를 이용하여 추가적으로 평가하였다.
결 과
1. 조직학적 관찰
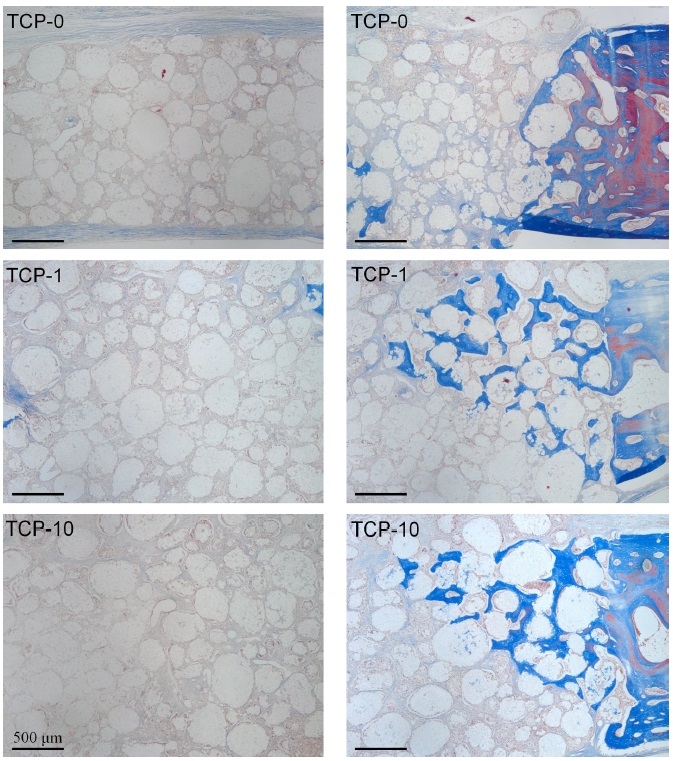
4주 경과후 관찰되는 신생골 형성은 모든 군에서 원래 트레핀을 이용하여 형성한 결손부 변연 인접부에 주로 국한되어 관찰되었다(Figure 2). 1 mg의 EGCG가 함유된 β-TCP를 이식한 군(TCP-1)에서 결손부 변연 인접부에서 신생골 형성이 다른 군에 비해 다소 증가한 양상을 나타내었다. TCP-1군에서 관찰되는 변연부에 존재하는 원래의 골조직에서 기원한 골성장이 인접 이식재를 따라 이식 중앙부를 향해 진행되는 전도성 신생골 성장(osteoconductive new bone growth)의 치유 양상이 다른 군에 비해 다소 활발한 것을 관찰할 수 있었다(Figure 2 and 3). EGCG를 함유하지 않은 TCP-0군과 10 mg의 EGCG가 함유된 TCP-10군 사이에서 신생골형성에서 명확한 차이는 관찰할 수 없었다. 극히 일부의 조직시편에서 결손부 변연에서 유래한 골성장과는 다소 분리된 형태로 결손부의 경막측에서 적은 양의 골형성이 이루어진 소견을 관찰할 수 있었으나 일반적인 소견은 아니었다(Figure 2).
Histological sections of TCP-0, TCP-1 and TCP-10-grafted defects in rabbit calvaria at 4 weeks of healing. Arrow heads indicate original margin of defects created by trephination. Stained with Masson’s trichrome. Scale bar = 1 mm.
결손부 변연에 위치한 이식재 입자는 주위로 신생골 형성이 이루어진 경우 이식재와 골조직이 비교적 긴밀히 접촉하는 양상을 나타내었다(Figure 2 and 3). EGCG를 처치하지 않은 대조군(TCP-0)과 EGCG를 함유한 실험군(TCP-1, TCP-10) 모두에서 이식부 중앙부에서의 신생골 형성은 관찰되지 않았다(Figure 3). 따라서 이식후 4주의 치유기간에서 관찰되는 골치유의 양상은 결손부 변연 인접 골조직에서 유래한 신생골이 이식재를 따라 중앙부를 향해 진행되는 골성장이 주된 것이라 할 수 있다.
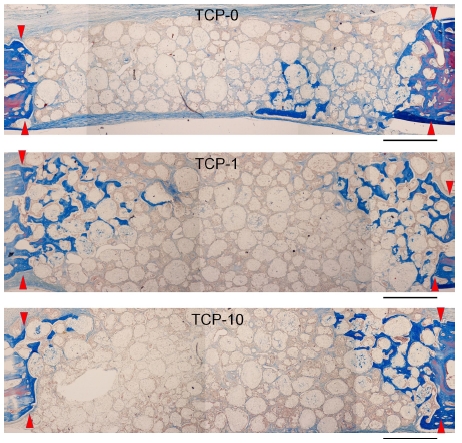
8주 경과후 모든 군에서 4주와 비교시 현저히 증가한 골형성 결과를 나타내었다(Figure 4). 특히 1 mg EGCG가 함유된 β-TCP군(TCP-1)에서 다른 군에 비해 현저히 증가한 골재생 결과를 확인할 수 있었다(Figure 4). TCP-1군의 일부 시편에서 전체 이식부를 양측으로 완전히 연결하는 골재생을 관찰할 수 있었다(Figure 4).
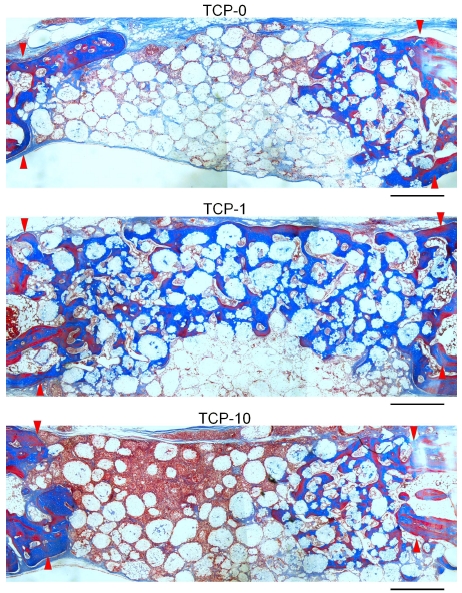
Histological sections of TCP-0, TCP-1 and TCP-10-grafted defects in rabbit calvaria at 8 weeks of healing. Arrow heads indicate original margin of defects created by trephination. Stained with Masson’s trichrome. Scale bar = 1 mm.
하지만 EGCG처치를 시행하지 않은 TCP-0군과 비교적 고농도의 EGCG를 처치한 TCP-10군에서는 이식부 중앙부에서 골형성은 관찰할 수 없었다(Figure 4 and 5). 이에 비해 1 mg의 EGCG가 적용된 TCP-1군에서는 이식 중앙부에서도 상당량의 신생골 형성을 관찰할 수 있었다(Figure 4 and 5). 고배율 조직소견에서 1 mg EGCG가 적용된 TCP-1군에서 이식부 중앙부위에서 관찰되는 신생골조직은 이식재 입자들과 긴밀한 접촉을 이루고 있었고, β-TCP 입자 표면 및 주위로 형성된 골조직이 이식재의 다공성 구조를 따라 각 이식재 입자내로 내성장이 활발히 이루어짐을 확인할 수 있었다(Figure 5). TCP-1군에서 이식 중앙부에 위치한 각 β-TCP입자의 내부 미세공극(pore space)내에서 골모세포가 개재된 신생골 형성을 관찰할 수 있었다(Figure 5). 이와 더불어 TCP-1군에서 이식중앙부에서 관찰되는 골조직은 무수한 신생 혈관 형성을 동반한 것을 확인할 수 있었다(Figure 5).
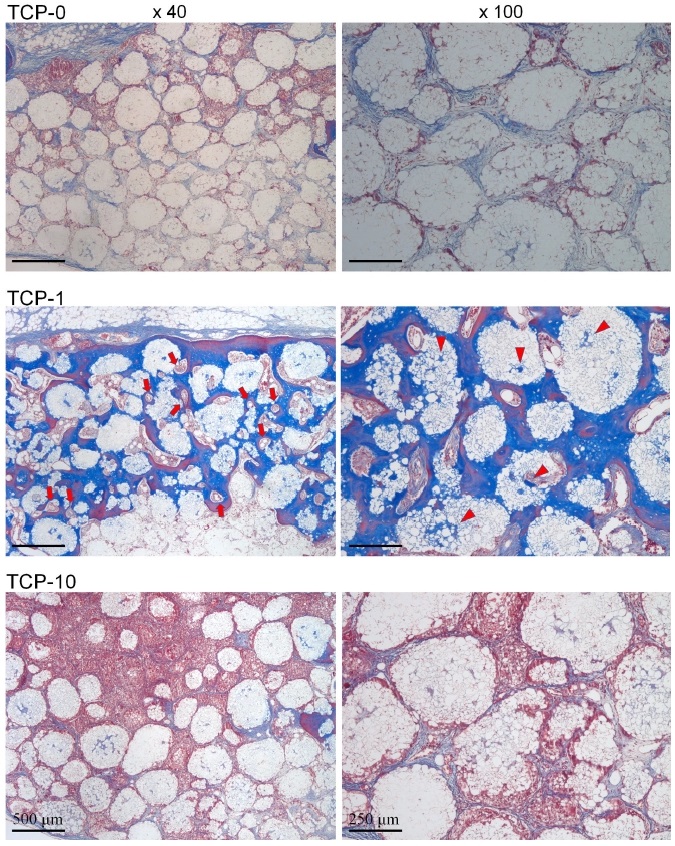
High magnification images of 8-week histological sections of TCP-0, TCP-1 and TCP-10 grafted defects in the central area at magnifications of ×40 (left) and ×100 (right). Arrows indicate blood vessels formed in newly formed bone tissue of TCP-1 grafted defect. Arrow heads indicate newly formed bone in internal micropores of TCP-1 bone substitute. Stained with Masson’s trichrome.
결손부 변연 인접부위에서는 모든 군에서 4주에서와 비교시 상당히 증가된 신생골 형성을 나타내었다(Figure 4 and 6). 골형성이 동반한 부위에 위치한 대부분의 β-TCP 입자들은 모든 군에서 주위 골과 긴밀한 접촉을 이루고 있었으며, 각 이식재 입자내 미세공극에서도 골모세포가 개재된 신생골의 내성장을 확인할 수 있었다(Figure 6).
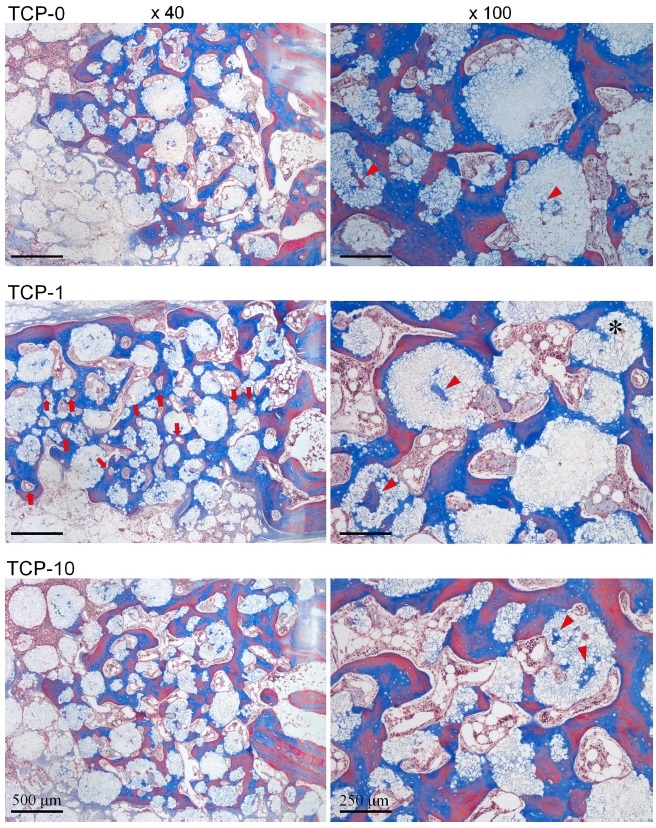
High magnification images of 8-week histological sections of TCP-0, TCP-1 and TCP-10 grafted defects in area close to the original defect margin at magnifications of ×40 (left) and ×100 (right). Arrows indicate blood vessels formed in newly formed bone tissue of TCP-1 grafted defect. Arrow heads indicate newly formed bone in internal micropores of β-TCP. Stained with Masson’s trichrome.
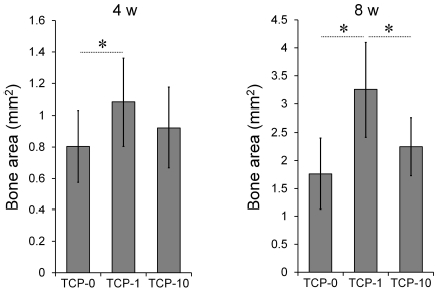
2. 조직계측학적 평가
4주에서 신생골 형성량은 EGCG 적용군에서 다소 증가된 양상을 나타내었다(Figure 7). 1 mg EGCG를 적용한 TCP-1군에서 EGCG처치를 시행하지 않은 TCP-0군에 비해 증가한 신생골 형성량(골면적, mm2)을 나타내었으며, 통계학적으로 유의한 차이가 있었다(p<0.05; Figure 7). 하지만 TCP-0군과 TCP-10군 사이, 그리고 EGCG를 처치한 두 군 사이(TCP-1, TCP-10)에서 통계학적으로 유의한 차이는 없었다. 8주에서 신생골 형성량은 4주와 비교시 모든 군에서 현저히 증가하였다(p<0.05). 8주에서 계측한 골면적(mm2)을 4주에서의 값과 비교시 EGCG를 처리하지 않은 대조군 TCP-0군에서는 2.2배, 1 mg의 EGCG를 함유한 TCP-1군에서 3배, 그리고 비교적 고용량의 10 mg EGCG를 함유한 TCP-2군에서는 2.4배 증가한 평균값을 나타내었다. 8주에서 신생골 형성량은 TCP-2군이 TCP-1군에 비해 약간 증가한 평균값을 나타내었으나 통계적 유의성은 없었다(Figure 7). 각 결손부당 1 mg의 EGCG가 적용된 β-TCP이식군(TCP-1)에서 다른 두 군에 비해 현저히 증가된 골면적값을 나타내었다(p<0.05; Figure 7).
고 찰
본 연구에서는 미세다공성 구조를 지닌 입자형 β-TCP이식재에 녹차엽 폴리페놀 생리활성물질인 EGCG 결합시 골재생 효과를 확인하기 위해 가토의 두개골 결손부 모델에서 조직계측학적 분석을 통해 평가하였다. 두개골 결손부의 골치유에 있어서 이식된 β-TCP의 신생골 형성능이 EGCG의 결합을 통해 증진됨을 확인할 수 있었다.
두개골 조직의 해부학적 특성은 하악골과 유사하며(Sirola, 1960; Frame, 1980), 이러한 이유로 실험동물에 형성한 두개골 결손모델은 특히 치의학영역에서 골재생기법 또는 이식소재의 골재생능을 평가하는데 있어서 유용하게 사용되고 있다. 본 연구에서는 EGCG가 결합된 합성골 이식재를 구강악안면 영역의 골재생수술에 사용시 기대할 수 있는 골형성 증진효과를 확인하기 위해 가토의 두개골 결손부에 1 mg, 10 mg의 두 가지 용량으로 EGCG가 적용된 β-TCP를 이식후 골치유 양상을 평가하였다. 조직계측학적 평가 결과 1 mg의 EGCG를 적용한 군에서 EGCG 처치를 시행하지 않은 대조군 β-TCP, 그리고 이보다 높은 용량인 10 mg의 EGCG를 적용한 군에 비해 4주, 8주의 치유기간 둘 다에서 이식부에서 관찰되는 신생골 형성이 현저히 증가한 것을 확인할 수 있었다. 가토의 두개골에 형성한 8 mm직경의 골관통 결손부에서 EGCG/이식재 복합체의 골치유를 평가한 본 연구결과에서 결손부당 1 mg의 EGCG를 단순흡착을 통한 국소적 적용은 β-TCP이식재의 골재생능을 증진하는 데 효과적인 것으로 나타났다.
EGCG를 이식재의 골재생능을 증진하기 위해 사용하기 위한 비교적 초기 연구에서 Rodriguez 등(2011)은 다양한 농도의 EGCG를 입자형 α-TCP이식재에 단순 흡착을 통해 결합한 후 백서 두개골 결손부에 이식후 골재생능을 평가하였다. 연구결과 결손부당 14 mg의 α-TCP이식재에 0.2 mg의 EGCG적용시 이보다 저농도 그리고 고농도의 EGCG와 비교시 더 우수한 골재생 결과를 얻을 수 있는 것으로 나타났다. 14 mg의 α-TCP에 0.4 mg의 EGCG를 적용한 군은 EGCG를 처치하지 않은 α-TCP군과 비교시 치유 2주 및 4주에서 골재생 결과에 있어서 차이가 없었다. 신생골 형성량에 있어서 0.1 mg, 0.2 mg EGCG 적용군 사이에서 유의한 차이는 보고되지 않았다. 해당 연구에서 사용한 EGCG 농도를 본 실험에서 사용한 용량으로 환산하였을 경우 α-TCP에 0.1 mg, 0.2 mg EGCG를 적용한 조건은 200 mg β-TCP당 약 1.4 mg, 2.8 mg 정도의 EGCG적용용량에 해당된다. 물론 본 연구와 Rodriguez 등(2011)의 실험에 사용된 TCP의 조성 및 미세구조의 차이, 그리고 실험동물에서의 차이로 인해 적용농도를 단순히 비교하는 것은 다소 무리가 있다. 하지만 최소 두 연구의 결과는 골재생을 증진하기 위해 단순히 고농도의 EGCG를 적용하는 것이 적절하지 않다는 것을 시사한다. 본 연구에서는 EGCG의 결합후 β-TCP이식재로부터의 방출거동에 관한 평가를 시행하지 않아 여기에 관해 향후 추가 분석이 필요하다. 또한 다른 골결손부 모델 및 다양한 조성의 이식재를 이용한 추가연구를 통해 EGCG 국소적용의 골재생 효과에 관한 체계적인 평가 및 확인이 필수적이다. 하지만 최소 본 연구의 결과를 통해 하악골과 유사한 해부학적 구조를 지닌 두개골 결손모델에서 단순 흡착을 통한 EGCG의 국소송달은 입자형 β-TCP이식재의 골재생능을 증진할 수 있는 접근법이 될 수 있음을 확인할 수 있었다.
EGCG의 사용과 관련하여 고농도의 EGCG적용이 골형성을 저해할 수도 있다는 보고도 있다(Mah 등, 2014). 이상인산칼슘(macroporous biphasic calcium phosphate, MBCP) 이식재에 다양한 농도의 EGCG를 치조골 세포와 혼합하여 백서의 피하이식부에 이식후 평가한 연구에서 0.1 mg의 EGCG가 함유된 이식재군에서 이소성 골형성(ectopic bone formation)이 증가한 것으로 나타났다(Mah 등, 2014). 이보다 고농도인 0.5 mg, 1.5 mg의 EGCG를 적용한 경우 EGCG처치를 시행하지 않은 대조군에 비해 오히려 현저히 감소된 골형성 결과를 보였다. 고농도의 EGCG처리가 골모세포분화의 중요한 전사인자인 Runx2 발현을 저해하는 반면, 저농도의 EGCG는 이식부에서 Runx2에 의해 유도되는 골모세포분화를 촉진하여 골형성을 증진할 수 있는 것으로 보고되었다(Mah 등, 2014). 보다 이전의 시험관적 연구는 고농도의 EGCG가 phosphatidylinositol 3-kinase/Akt 신호전달경로에서 인산화를 저해함으로서 세포사멸을 유도할 수도 있는 것으로 보고하였다(Natsume 등, 2009). 하지만 고농도 EGCG적용시 골재생 과정에서 나타날 수 있는 부정적 효과를 보고한 Mah 등(2014)의 연구와는 달리 본 연구결과와 Rodriguez 등(2011)의 연구에서는 특정 농도 이상의 고용량 EGCG처치가 골재생을 증진하지는 않지만 골치유 또한 저해하지는 않는 것으로 나타났다. 적용농도와 이에 따른 골재생의 결과와 관련하여 이러한 비교적 다른 결과는 각 연구에 사용된 실험 조건의 차이에서 기인한 것으로 보인다. 예를 들어 EGCG를 세포와 직접 혼합하여 사용할 경우 이식재내에서 세포활성에 영향을 미쳤을 수도 있고, 연구에 사용된 이식재의 조성 및 미세구조의 차이 그리고 이로 인한 EGCG 적용시 나타나는 생물학적 효과, 여기에 실험동물 모델에 따른 대사 차이 등 다양한 원인을 들 수 있을 것이다. 물론 본 연구에서는 가토의 두개골 결손부에 1 mg EGCG, 그리고 이보다 고용량인 10 mg의 EGCG가 적용된 두 군을 실험군으로 사용하였다. 따라서 1 mg이하의 저용량 및 중간 농도의 EGCG적용시 골재생 결과에 관해서는 추가적인 연구가 필요할 것이다. 현재까지 골재생을 증진하기 위한 최적의 국소적 EGCG적용용량을 평가하기 위한 실험동물에서의 연구결과는 매우 제한적이다. Mah 등(2014)은 0.1 mg의 EGCG적용시 증진된 이소성 골형성 결과를 나타내며 이보다 높은 0.5 mg, 1.5 mg의 EGCG 적용시 이소성 골형성을 저해하는 것으로 보고하였지만 이는 단지 백서의 이소성 골형성 평가모델의 결과이며 이를 가토의 두개골 결손모델에서 적용시 1 mg이하의 저용량 EGCG에서 동일하게 우수한 골재생 효과를 지닐 것으로 기대할 수는 없을 것이다. 따라서 본 연구의 결과와 이전에 보고된 연구결과(Rodriguez 등, 2011; Mah 등 2014)를 직접적으로 비교하는 것은 실험동물의 골대사 차이 및 평가 모델에서의 근본적 차이가 있기에 한계가 있다. 하지만 이식재의 골재생능을 증진하기 위한 EGCG의 국소적 적용시 적정 용량과 관련하여서는 향후 체계적인 평가가 필요하다.
최근에는 고농도 EGCG처치시 골재생과정에서 긍정적인 효과를 보고한 연구결과도 다수 있다(Tominari 등, 2015; Chu 등, 2016; Elder 등, 2017). Chu 등(2016)은 콜라젠막에 다양한 농도로 EGCG를 결합하여 세포증식능과 염증관련 사이토카인 발현을 평가하였다. 결과 저농도 EGCG적용시 골모세포유사세포의 세포증식은 증가하였지만 고농도의 EGCG적용시 가장 우수한 항염증 효과를 보이는 것으로 나타났다. 다른 연구에서는 고농도의 EGCG처리가 세균 내독소인 LPS에 의한 염증성 골흡수를 현저히 감소시키는 긍정적인 효과가 있는 것으로 나타났다(Tominari 등, 2015). 백서 두개골조직을 이용한 기관배양(organ culture) 실험에서 90μM의 EGCG처치가 이보다 저농도 EGCG처치에 비해 LPS에 의한 골흡수를 현저히 감소시키며 하악골을 이용한 기관배양실험에서도 고농도 EGCG적용시 치조골 흡수가 감소되는 동일한 효과를 보였다(Tominari 등, 2015).
따라서 현재까지의 다양한 연구결과를 종합해 볼 때, 골재생을 촉진하기 위한 최적의 EGCG적용농도에 관해서는 다소 논란이 있다고 볼 수 있다. 임플란트 식립 및 이식재를 이용한 골재건 수술후 최종적으로 양호한 골재생의 결과를 얻기 위해서는 생물학적 치유과정의 초기단계부터 골재생의 최종단계까지 다양한 세포가 모두 관여하여 영향을 미치며 이들 각 단계들에서 조화된 세포/조직반응이 요구된다(Brown 등, 2012; Terheyden 등, 2012; Drager 등, 2016; Lee 등, 2016, Park 등, 2018). EGCG의 골재생 효과와 관련하여 현재까지 보고된 제한적인 연구결과들을 살펴볼 때 EGCG처치는 초기 염증반응, 파골세포에 의한 골흡수, 그리고 골형성세포에 의한 골재생을 포함한 각 치유단계에서 최적의 반응을 유도하기 위해서는 다른 처치 농도가 필요할 수도 있음을 시사한다. 따라서 EGCG처리를 통해 각 치유단계에 관여하는 다양한 세포반응에 미치는 효과에 관한 이해와 더불어 골재생 효과 그 자체와 관련하여서도 특히 적정 용량 및 적용법에 관해 보다 명확한 기준을 얻기 위해서는 향후 보다 체계적인 연구가 필요할 것이다. 그럼에도 불구하고 본 연구의 결과는 미세다공성 구조를 지닌 합성골 이식재인 입자형 β-TCP에 EGCG를 적용시 하악골과 유사한 가토의 두개골결손모델의 치유에서 신생골 형성을 촉진하는 효과가 있는 것을 확인할 수 있었다. 결론적으로 단순 흡착에 의한 EGCG의 국소적 적용은 β-TCP 이식재의 골재생능을 증진할 수 있는 효과적인 접근법이 될 수 있을 것으로 기대된다.
결 론
본 연구에서는 미세다공성 구조를 지닌 입자형 β-TCP이식재에 녹차엽추출 생리활성물질인 EGCG 적용시 이식재의 골재생능이 증진되는지 확인하기 위해 가토의 두개골 결손모델을 이용하여 골치유 양상을 이식후 4주, 8주에서 조직계측학적으로 평가하였다. 결손부당 1 mg의 EGCG가 적용된 TCP-1군은 다른 두 군에 비해 현저히 증진된 신생골 형성능을 나타내었다. 이에 비해 고용량의 EGCG가 적용된 TCP-10군은 EGCG가 적용되지 않은 대조군과 비교시 골재생에 있어서 차이가 없는 것으로 나타났다. 따라서 본 연구를 통해 단순흡착을 통해 1 mg의 EGCG가 결합된 입자형 β-TCP이식재는 가토의 두개골 결손부에 이식시 골재생을 촉진하는데 효과적임을 확인할 수 있었다. 합성골 이식재를 포함한 골대체재에 국소적 적용을 위한 최적의 EGCG용량에 관해서는 향후 체계화된 추가적인 연구가 필요하지만 본 연구의 결과는 고용량에 비해 적정용량의 국소적 EGCG적용이 골결손 치료에 사용되는 β-TCP이식재의 골재생능을 증진하는 효과적인 접근법이 될 수 있음을 제시한다.
Acknowledgments
* 이 논문은 2015학년도 경북대학교 복현학술연구비에 의하여 연구되었음.
References
-
Brown, BN, Ratner, BD, Goodman, SB, Amar, S, Badylak, SF, (2012), Macrophage polarization: an opportunity for improved outcomes in biomaterials and regenerative medicine, Biomaterials, 33, p3792-3802.
[https://doi.org/10.1016/j.biomaterials.2012.02.034]

-
Chen, CH, Ho, ML, Chang, JK, Hung, SH, Wang, GJ, (2005), Green tea catechin enhances osteogenesis in a bone marrow mesenchymal stem cell line, Osteoporos Int, 16, p2039-2045.
[https://doi.org/10.1007/s00198-005-1995-0]

-
Chu, C, Deng, J, Xiang, L, Wu, Y, Wei, X, Qu, Y, Man, Y, (2016), Evaluation of epigallocatechin-3-gallate (EGCG) cross-linked collagen membranes and concerns on osteoblast, Mater Sci Eng C Mater Biol Appl, 67, p386-394.
[https://doi.org/10.1016/j.msec.2016.05.021]

-
Chu, C, Deng, J, Man, Y, Qu, Y, (2017), Green tea extracts epigallocatechin-3-gallate for different treatments, Biomed Res Int, 2017, 5615647.
[https://doi.org/10.1155/2017/5615647]

- Ding, Y, Wang, X, (2018), Long-term effects of bone morphogenetic protein-2-loaded calcium phosphate on maxillary sinus lift surgery for delayed and simultaneous dental implantation, J Craniofac Surg, 29, pe58-e61.
-
Drager, J, Sheikh, Z, Zhang, YL, Harvey, EJ, Barralet, JE, (2016), Local delivery of iron chelators reduces in vivo remodeling of a calcium phosphate bone graft substitute, Acta Biomater, 42, p411-419.
[https://doi.org/10.1016/j.actbio.2016.07.037]

- Elder, S, Clune, J, Walker, J, Gloth, P, (2017), Suitability of EGCG as a means of stabilizing a porcine osteochondral xenograft, J Func Biomater, 8, pE43.
- Frame, JW., A convenient animal model for testing bone substitute materials, J Oral Surg, 38, p176-180.
-
Honda, Y, Tanaka, T, Tokuda, T, Kashiwagi, T, Kaida, K, Hieda, A, Umezaki, Y, Hashimoto, Y, Imai, K, Matsumoto, N, Baba, S, Shimizutani, K, (2015), Local controlled release of polyphenol conjugated with gelatin facilitates bone formation, Int J Mol Sci, 16, p14143-14157.
[https://doi.org/10.3390/ijms160614143]

-
Jayakumar, A., Rajababu, P, Rohini, S, Butchibabu, K, Naveen, A, Reddy, PK, Vidyasagar, S, Satyanarayana, D, Pavan Kumar, S, (2011), Multi-center, randomized clinical trial on the efficacy and safety of recombinant human platelet-derived growth factor with β–tricalcium phosphate in human intra-osseous periodontal defects, J Clin Periodontol, 38, p163-172.
[https://doi.org/10.1111/j.1600-051x.2010.01639.x]

- Jin, P, Wu, H, Xu, G, Zheng, L, Zhao, J, (2014), Epigallocatechin-3-gallate (EGCG) as a pro-osteogenic agent to enhance differentiation of mesenchymal stem cells from human bone marrow: an in vitro study, Cell Tissue Res, 356, p381-390.
- Kim, Y, Nowzari, H, Rich, SK, (2013), Risk of prion disease transmission through bovine-derived bone substitutes: a systematic review, Clin Implant Dent Relat Res, 15, p645-653.
- Kwon, YD, Seok, S, Lee, SH, Lim, BS, (2017a), Comparison of physical properties between paste type mineral trioxide aggregates (MTA) and powder-liquid mix type MTA, Korean J Dent Mater, 44, p11-20.
- Kwon, YD, Seok, S, Lee, SH, Lim, BS, (2017b), Comparison of intraosseous implantation between paste type mineral trioxide aggregates (MTA) and powder-liquid mix type MTA, Korean J Dent Mater, 44, p229-246.
-
Lee, CH, Kim, YJ, Jang, JH, Park, JW, (2016), Modulating macrophage polarization with divalent cations in nanostructured titanium implant surfaces, Nanotechnology, 27, 085101.
[https://doi.org/10.1088/0957-4484/27/8/085101]

-
Mah, YJ, Song, JS, Kim, SO, Lee, JH, Jeon, M, Jung, UW, Moon, SJ, Kim, JH, Choi, HJ, (2014), The effect of epigallocatechin-3-gallate (EGCG) on human alveolar bone cells both in vitro and in vivo, Arch Oral Biol, 59, p539-540.
[https://doi.org/10.1016/j.archoralbio.2014.02.011]

- Mellonig, JT, (1995), Donor selection, testing, and inactivation of the HIV virus in freeze-dried bone allografts, Pract Periodontics Aesthet Dent, 7, p13-22.
- Moshaverinia, A, Chen, C, Xu, X, Akiyama, K, Ansari, S, Zadeh, HH, Shi, S, (2014), Bone regeneration potential of stem cells derived from periodontal ligament or gingival tissue sources encapsulated in RGD-modified alginate scaffold, Tissue Eng Part A, 20, p611-621.
- Natsume, H, Adachi, S, Takai, S, Tokuda, H, Matsushima-Nishiwaki, R, Minamitani, C, Yamauchi, J, Kato, K, Mizutani, J, Kozawa, O, Otsuka, T, (2009), Epigallocatechin gallate attenuates the induction of HSP27 stimulated by sphingosine 1-phosphate via suppression of phosphatidylinositol 3-kinase/Akt pathway in osteoblasts, Int J Mol Med, 24, p197-203.
-
Park, JW, Kim, YJ, Jang, JH, An, CH, (2011), MC3T3-E1 cell differentiation and in vivo bone formation induced by phosphoserine, Biotechnol Lett, 33, p1473-1480.
[https://doi.org/10.1007/s10529-011-0565-0]

-
Park, JW, Kim, JM, Lee, HJ, Jeong, SH, Suh, JY, Hanawa, T, (2014), Bone healing with oxytocin-loaded microporous β-TCP bone substitute in ectopic bone formation model and critical-sized osseous defect of rat, J Clin Periodontol, 41, p181-190.
[https://doi.org/10.1111/jcpe.12198]

-
Park, JW, Han, SH, Hanawa, T, (2018), Effects of surface nanotopography and calcium chemistry of titanium bone implants on early blood platelet and macrophage cell function, BioMed Res Int, 2018, 1362985.
[https://doi.org/10.1155/2018/1362958]

- Rodriguez, R, Kondo, H, Nyan, M, Hao, J, Miyahara, T, Ohya, K, Kasugai, S, (2011), Implantation of green tea catechin α-tricalcium phosphate combination enhances bone repair in rat skull defects, J Biomed Mater Res Part B: Appl Biomater, 96, p263-271.
- Sirola, K, (1960), Regeneration of defects in the calvaria: an experimental study, Ann Med Exp Biol Fenn, 38, p1-87.
-
Terheyden, H, Lang, NP, Bierbaum, S, Stadlinger, B, (2012), Osseointegration-communication of cells, Clin Oral Implants Res, 23, p1127-1235.
[https://doi.org/10.1111/j.1600-0501.2011.02327.x]

-
Tominari, T, Matsumoto, C, Watanabe, K, Hirata, M, Grundler, FMW, Miyaura, C, Inada, M, (2015), Epigallocatechin gallate (EGCG) suppresses lipopolysaccharide-induced inflammatory bone resorption, and protects against alveolar bone loss in mice, FEBS Open Bio, 5, p522-527.
[https://doi.org/10.1016/j.fob.2015.06.003]

- Wang, D, Wang, Y, Xu, S, Wang, F, Wang, B, Han, K, Sun, D, Li, L, (2016), Epigallocatechin-3-gallate protects hydrogen peroxide-induced inhibition of osteogenic differentiation of human bone marrow-derived mesenchymal stem cells, Stem Cells Int, 2016, 7532798.
-
Yue, X, Niu, M, Zhang, T, Wang, C, Wang, Z, Wu, W, Zhang, Q, Lai, C, Zhou, L, (2016), In vivo evaluation of a simvastatin-loaded nanostructured lipid carrier for bone tissue regeneration, Nanotechnology, 27, 115708.
[https://doi.org/10.1088/0957-4484/27/11/115708]