양극산화와 석회화 순환 처리에 의해 표면개질된 Ti-6Al-4V 합금 임플란트의 생체활성도 및 골유착 평가
초록
본 연구에서는 양극산화와 석회화 순환처리된 Ti–6Al–4V 합금 임플란트의 생체활성도와 골유착을 조사하였다. Ti-6Al-4V 합금 임플란트 표면에 수산화인회석(Hydroxyapatite; HAp) 분말을 사용하여 분사처리(Resorbable Blasting Media, RBM)를 한 후, 양극산화처리와 순환침적처리를 통해 나노튜브 타이타늄 산화층(TiO2)와 HAp 석출물을 형성하였다. 생체활성도를 조사하기 위해 표면처리된 임플란트를 유사체액 내에서 3일간 침적하고서 표면형상을 조사하였으며, 표면처리가 골결합에 미치는 영향을 조사하기 위해, RBM 처리한 임플란트와 RBM 처리-양극산화처리-석회화순환처리(RACP)를 시행한 임플란트를 쥐의 양쪽 tibia diaphysis의 원심쪽에 식립한 후, 4주 후 임플란트를 제거할 때의 토크를 측정하였다. RACP 처리된 임플란트의 표면에서는 SBF 3일 침적 후 골유사 아파타이트가 석출된 것이 관찰되었다. 또한, RBM 처리군 보다 RACP 처리군에서 removal torque가 유의하게 높게 나타났으며, RBM 처리군의 표면에서는 신생골과 임플란트 사이의 계면 파절을 보였지만, RACP 처리군에서는 신생골의 응집파절 및 신생골과 임플란트 사이의 계면파절이 혼재하는 양상을 보였다.
Abstract
The aim of this study was to examine the bioactivity and osseointegration of Ti-6Al-4V alloy implant which was modified by an anodic oxidation and a cyclic precalcification treatments. After blasting treatment using HAp (Hydroxyapatitie; HAp) powder which is resorbable blasting media (RBM) on the surface of Ti-6Al-4V alloy implants, the anodic oxidation treatment and the cyclic precalcification treatment were conducted to form nanotube TiO2 layer and HAp precipitation respectively. The surface morphology of the surface-treated Ti-6Al-4V alloy implant was investigated after immersion in the simulated body fluid(SBF) for 3 days to investigate the bioactivity. To investigate the effect of surface treatment on bonding between the implant and bone, RBM treated implant and RBM-anodization-cyclic precalcification(RACP) treated implant were placed on the distal side of both tibia diaphysis of rats, and then the removal torque of the implant was measured after 4 weeks. On the surface of RACP treated group, bone-like apatite precipitation was observed after immersion in SBF for 3 days. The removal torque was significantly higher in the RACP treated group than in the RBM treated group. The interfacial fracture between the implant and the new bone was observed in the RBM treated group, but both the cohesive fracture at the new bone and the interfacial fractures between the implant and the new bone were observed in the RACP treated group.
Keywords:
Ti-6Al-4V alloy implant, nanotubular TiO2, cyclic precalcification treatment, bioactivity, removal torque키워드:
Ti-6Al-4V 합금 임플란트, 나노튜브 TiO2, 석회화순환처리, 생체활성, 제거토크서 론
순 타이타늄과 몇몇 타이타늄 합금은 우수한 내부식성과 생체적합성을 가지고 있고, 생체에 매식되었을 때 표면에 인산칼슘이 석출되어 골과 결합이 일어나는 골유착(osseo-integration)의 특성을 나타내므로 치과 및 정형외과용 임플란트 재료로서 널리 사용되고 있다 (1, 2). 타이타늄의 이러한 골유착 특성은 대기 중에서 표면에 자발적으로 생성되는 비반응성 타이타늄 산화층(TiO2) 형성의 결과이다. 임플란트의 기계가공과 멸균과정에서 생성되는 TiO2 rutile 구조는 화학적, 열역학적으로 안정하기 때문에 생체 내에서 거의 독성반응을 보이지 않지만, 생체 불활성이기 때문에 생체활성 재료에 비해 골유착 기간이 길게 소요되는 문제점을 가지고 있다 (3).
표면처리기술에 나노기술이 접목되면서 임플란트 소재분야에서는 Ti, Nb, Zr 등과 같은 밸브금속 표면에 산화물 나노튜브층을 형성하는 많은 연구가 이루어졌으며, 양극산화처리법은 그의 유용한 수단의 하나로서 평가되고 있다 (4, 5). 양극산화처리 방법은 다양한 형상을 가지는 타이타늄 임플란트 표면에 균일한 나노튜브 TiO2 층을 형성할 수 있을 뿐만 아니라 전해질 수용액의 조성 또는 인가전압과 전류를 조절하여 나노튜브의 길이와 직경을 제어할 수 있고, 저비용으로 다량의 임플란트에 대한 표면처리가 가능하여 경제적인 장점을 가지고 있다 (4, 6). 또한 양극산화처리하여 형성된 나노튜브 TiO2 층은 타이타늄 모재와 화학적으로 결합되어 있으므로 임플란트 표면과 산화피막층 사이의 결합력이 높다 (7, 8).
생체불활성을 가진 타이타늄 표면에 생체활성을 부여하기 위해 생체활성을 가진 세라믹 재료를 타이타늄 표면에 코팅하는 방법이 도입되어 임플란트 매식 초기에 골유착을 촉진시킬 수 있게 되었지만 타이타늄 표면과 코팅층 사이의 결합력이 약해 코팅층의 박리나 파괴에 의해 임상 적용 시 성공률이 저하되는 단점을 가지고 있다 (9, 10). 따라서, 최근에는 생체활성물질을 코팅한 것과 같은 효과를 가지면서도 높은 피막 안정성을 갖는 임플란트 표면처리 방법에 대한 관심이 증가되고 있으며, 그의 가장 효과적인 방법의 하나로서 인산염과 칼슘 이온을 함유하는 수용액에 침적하여 인산칼슘의 석출을 유도하는 석회화 순환처리법(cyclic precalcification)이 검토되고 있다 (11-13).
본 연구에서는 Ti–6Al–4V 합금 임플란트의 생체활성도를 개선하기 위해서 수산화인회석(hydroxyapatite; 이하 HAp) 분말을 사용하여 분사처리(RBM 처리, 대조군)를 한 후 양극산화 처리를 통해 임플란트 표면에 나노튜브 TiO2 층을 형성한 다음 인산염과 칼슘이온을 함유하는 용액에서 석회화 순환처리를 통해 인산칼슘 층을 형성(RACP 처리, 시험군) 후 열처리를 통해 인산칼슘층의 구조를 안정화하여, 이러한 표면처리가 임플란트의 생체활성도와 골유착에 미치는 영향에 대하여 조사하였다.
재료 및 방법
1. 나노튜브 TiO2 층 형성을 위한 양극산화 처리
본 연구에서 시편은 직경 5㎜ Ti-6Al-4V 합금봉(Kobe Steel Ltd, Japan)으로 제작한 직경 2㎜×길이 3.5㎜ 임플란트(KJMEDTECH Co, Ltd, Korea)를 사용하였다 (Fig. 1 (a)). 평균입경이 100 – 150㎛와 90㎛ 이하인 HAp 분말(MCD powder, Hi-Med, USA)을 50 : 50으로 혼합한 후 임플란트 표면에서 10㎜ 떨어진 위치에서 4기압의 압력으로 분사처리(Resorbable Blasting Media, RBM)를 하였다. 분사처리 표면은 2 vol.% HNO3 수용액으로 10분간 산세처리를 하였고, 아세톤과 알코올 용액에서 각각 5분간 초음파 세척한 다음 증류수로 세척하여 양극산화처리 전까지 50℃의 건조기에서 보관하였다.

SEM image (a) of experimental Ti-6Al-4V alloy implant specimen and X-ray image (b) of rat tibias placed with titanium implants.
임플란트의 표면층에 형성된 산화물을 제거를 위해 HNO3 : HF : H2O를 12 : 7 : 81로 혼합한 용액에 10초 동안 산세처리 한 후 3차 증류수로 세척하고 건조하여 양극산화 처리에 사용하였다. 양극산화처리를 위한 전해질 수용액은 ethylene-glycol에 H2O 20wt.%와 NH4F 1wt.%를 첨가하여 준비하였다. 준비한 시편과 백금판을 DC 정전원 장치(Inverter Tech Co, Ltd., Korea)의 양극과 음극에 각각 연결하고 두 전극이 서로 마주하도록 약 20㎜로 간격으로 고정한 후 전해액에 위치시켰으며, 전압 25V, 전류밀도 20㎃/㎠으로 설정한 상태에서 60분간 양극산화처리를 하였다. 양극산화처리 후 3차 증류수에서 20초간 초음파 세척하였으며, 50℃의 건조기에 보관하였다.
2. 석회화 순환처리
나노튜브 TiO2 층 형성 후 HAp 석출 촉진을 유도하기 위해 상온에서 0.05 M NaH2PO4 수용액과 Ca(OH)2 포화수용액을 준비한 다음 온도를 90℃로 올려서 각각 침적시간 1분의 조건으로 20회 순환침적처리를 시행하였다. 이후 나노튜브 TiO2 층과 석출된 인산칼슘층의 구조적 안정화를 위해 표면처리된 임플란트를 전기로(Ajeon Industrial Co, Ltd, Korea)에 넣고 승온속도 10℃/min으로 500℃까지 올려 2시간 동안 유지하였다.
3. 유사체액 침적시험
생체활성도를 조사하기 위해 유사체액(simulated body fluid: SBF)을 Hanks balanced salt solution (H2387, Sigma Chemical Co, USA)에 0.185g/ℓ calcium chloride dihydrate, 0.09767g/ℓ magnesium sulfate, 0.350g/ℓ sodium hydrogen carbonate을 첨가하여 제조하였으며, 1N HCl 수용액을 사용하여 pH를 7.4로 조절하였다. 석회화 순환처리한 임플란트를 120℃에서 20분 동안 고압멸균처리한 다음 SBF에 3일간 침적하고서 HAp의 석출 양상을 조사하였다.
4. 시험동물에 대한 임플란트 매식
대조군으로는 RBM 처리한 임플란트 5개를 사용하였고, 시험군으로는 RBM 처리-양극산화처리-석회화순환처리(RACP)를 시행한 임플란트 5개를 사용하였으며, 매식 24시간 전에 EO 가스 멸균처리를 실시하였다. 시험동물로는 10주된 수컷 Wistar rats 5마리를 사용하였다. 쥐의 양쪽 tibia diaphysis의 원심쪽에 각각 대조군과 시험군 임플란트 1개씩을 식립하였다 (Figure 1 (b)). Ketamine과 xylazine을 각각 80~100㎎/㎏과 10~20㎎/㎏ 주사하여 전신마취를 시행하고, epinephrine (1:100,000)이 첨가된 2% lidocaine으로 수술 부위의 부가적인 국소마취를 시행하였다. 수술 부위의 털을 면도하고 betadine scrub을 사용하여 소독한 다음 전층판막으로 거상하였다. Tibia diaphysis에 임플란트 매식 부위를 직경 1.5㎜ 수술용 드릴로 깊이 4㎜까지 관통한 다음 임플란트를 식립하였으며, 연조직을 흡수성 봉합사로 봉합하고 amoxacillin 항생제를 경구내로 1㎖/㎏ 투약하였다.
5. Removal torque 측정 및 임플란트의 표면관찰
임플란트 매식 4주 후 시험동물을 희생시킨 후 임플란트를 제거할 때의 토크를 0.1 N㎝의 정밀도를 갖는 디지털 토크 게이지(9810P, Aikoh Engineering Co, Japan)로 측정하였다. Removal torque 측정 후 제거된 임플란트의 표면을 FE-SEM과 EDS로 분석하였다.
결 과
1. 임플란트 표면 관찰
Figure 2는 Ti-6Al-4V 합금제 임플란트를 양극산화 처리한 표면(a), 양극산화처리 후 석회화 순환처리한 표면(b) 및 SBF 용액에 3일간 침적한 표면의 FE-SEM 사진이고, Table 1은 그의 EDS 분석 결과이다. RBM 처리 후 양극산화처리한 표면에 생성된 나노튜브들은 완전한 자기정렬 형태를 이루며 치밀한 구조로 생성된 양상을 보였다(a). 석회화 순환처리한 표면에서는 인산칼슘의 석출물이 나노튜브층을 뒤덮고 있는 양상이 관찰되었으며(b), SBF 3일 침적 후 골유사 아파타이트의 석출 초기에 관찰되는 돌기상이 치밀한 구조로 생성되었으며(c), Ca/P의 원자비는 1.6±0.1을 보였다 (Table 1).

FE-SEM images of Ti-6Al-4V alloy implants. (a) anodized (100K); (b) cyclic precalcified (10K), (c) immersed in SBF solution for 3 days (5K).
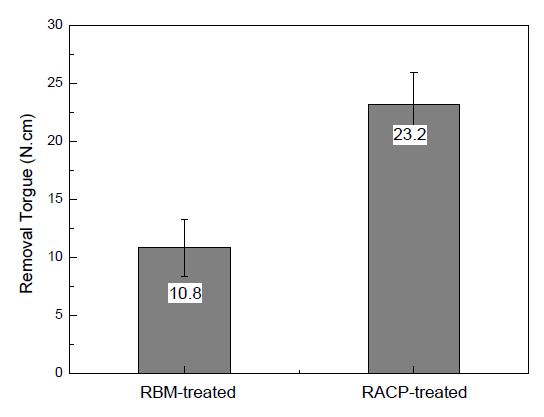
Figure 3은 RBM 처리군과 석회화 순환처리군 임플란트를 시험쥐에 4주간 매식한 다음 removal torque를 측정한 결과이다. RBM 처리만을 시행한 대조군 임플란트에서는 (10.8±2.5)N.cm, RACP 처리한 임플란트군에서는 (23.2±2.8)N·cm로 유의하게 높은 결과를 보였다 (P<0.05).
Figure 4는 removal torque 측정 후 임플란트 표면을 FE-SEM으로 관찰한 사진이고 Table 2는 그의 EDS 분석 결과이다. RBM 처리군의 표면에서는 주로 신생골과 임플란트 사이의 계면에서 파절이 일어난 양상을 보였지만, RACP 처리군의 표면에서는 신생골의 응집파절과 계면파절이 혼재하는 양상을 보였으며 Ca와 P의 함량이 RBM 처리군에 비해 상대적으로 높게 나타났다.
고 찰
임플란트용 타이타늄 합금은 생체적합성이 우수할 뿐만 아니라 높은 내식성 및 기계적 성질을 가지고 있어 치과용 임플란트 소재로 많이 사용되고 있다. Ti-6Al-4V 합금은 α+β형의 대표적인 타이타늄 합금으로서 높은 강도가 요구되는 부위의 임플란트 생체재료로 이용되고 있다. 그렇지만 합금 성분 중에는 인체 유해성분인 V와 Al과 같은 원소가 포함되어 있으므로 1990년대 중반부터 학계를 중심으로 이 합금의 표면처리 또는 대체용 합금 소재의 개발에 관한 연구가 이루어져 왔다 (14, 15).
임플란트의 표면층에 골유착능을 향상시키고 생체적합성을 개선하기 위해 임플란트 표면을 마이크로/나노 구조로 개질시키는 방법이 연구되어 오고 있다. 임플란트의 나노구조의 표면은 보다 넓은 표면적을 제공함으로써 골유착에 보다 효과적인 것으로 보고된 바 있다 (16). 또한 TiO2와 HAp와 같은 생체 세라믹의 표면에서도 전형적인 마이크로구조를 이루는 표면에 비해서 나노구조의 표면에서 조골세포의 증식이 촉진되는 것이 보고된 바 있다 (17, 18). 임플란트 표면에 형성된 나노튜브는 다양한 생체활성물질 또는 약물 등을 담지할 수 있는 공간으로 이용될 수 있다. 나노튜브 안에 담지된 약물 또는 생체활성물질들은 임플란트 매식 부위에만 한정적으로 작용하여, 약물을 복용으로 야기될 수 있는 전신적인 부작용을 감소시킬 수 있는 점 등을 들 수 있다 (19, 20).
타이타늄 임플란트의 표면에 생체활성을 향상시켜 골전도성을 개선하기 위한 많은 방법들이 연구되고 있다 (21-24). 그 중에서 석회화 전처리법은 뼈의 주성분인 인산염과 칼슘 이온을 함유하는 수용액을 이용하여 임플란트 표면에 형성된 TiO2 층과 수용액 내 이온들 사이의 산-염기 반응 유도를 통해 임플란트 표면에 생체활성을 부여함으로 써 인체 내에서 골유사 아파타이트의 석출을 촉진한다 (11, 25). 한편 Kodama 등 (12)은 실온에서 0.02 M NH4H2PO4 수용액과 Ca(OH)2 포화 수용액에 대한 20회의 순환침적 후 37℃의 유사체액에 2일과 7일 동안 침적한 결과, HAp의 석출이 빠르게 가속되었다고 보고하였다. 본 연구에서는 90℃의 0.05 M NaH2PO4 수용액과 90℃ Ca(OH)2 포화수용액에 각각 1분을 주기로 20회의 순환침적처리를 한 다음 유사체액에 3일 동안 침적한 결과, 임플란트 표면에서 골유사 아파타이트의 석출 초기에 나타나는 돌기상이 관찰되어 생체활성이 개선된 결과를 보이며 Ca와 P의 유의한 농도의 증가를 보였다 (P<0.05). 또한 본 연구에서는 직경 2 ㎜×길이 3.5 ㎜의 Ti-6Al-4V 합금제 임플란트 시편을 준비한 다음 나노튜브를 형성하고 상기의 절차에 따라 석회화 순환처리를 한 다음 쥐의 경골에 매식하고서 removal torque를 측정한 결과, 무처리군과 석회화 순환처리군에서 각각 10.8±2.5N·cm와 23.2±2.8N·cm로서 석회화순환처리군에서 유의하게 높은 결과를 보여 골과의 결합력이 크게 개선된 결과를 보였으며, 파면관찰 결과에서도 RBM 처리군에서는 신생골과 임플란트 사이의 계면파절을 보인 반면 석회화 순환처리를 시행한 RACP군에서는 계면파절과 신생골 내 응집파절 양상이 혼재된 양상을 골과의 결합력이 개선되었음을 확인할 수 있었으며, RACP군의 제거한 임플란트 표면에서 Ca와 P의 함량은 RBM 처리군에 비해 상대적으로 높게 나타났다.
결 론
본 연구에서는 Ti–6Al–4V 합금제 임플란트의 생체적합성과 생체활성도를 개선할 목적으로 HAp 분말을 사용하여 RBM 처리를 한 다음 ethylene-glycol에 H2O 20wt%와 NH4F 1 wt%를 첨가하여 준비한 전해질 용액에서 25 V 전압을 60분 동안 인가하여 양극산화 나노튜브 TiO2 층을 형성하였다. 양극산화 처리 후 나노튜브 TiO2 층의 생체활성도를 개선하기 위해 90℃의 0.5 M NaH2PO4 수용액과 90℃의 Ca(OH)2 포화 수용액을 준비한 다음 침적시간 1분을 주기로 하여 각각 20회 순환침적처리를 실시하고 피막층의 안정화와 불순물 제거를 위해 500℃의 전기로에서 2시간 동안 열처리하였다. 이후 생체활성도를 조사하기 위해 유사체액에 3일간 침적한 후 아파타이트의 석출 양상을 조사하였고, 표면처리가 골결합에 미치는 영향을 조사하기 위해 준비한 임플란트를 시험쥐의 경골에 매식하고서 4주가 경과한 후 removal torque를 측정한 결과, 다음과 같은 결론을 얻었다.
1. RBM 처리 후 양극산화 처리한 표면에서는 나노튜브 TiO2들이 완전한 자기정렬 형태를 이루며 치밀한 구조로 생성된 양상을 보였다.
2. 석회화 순환처리한 표면에서는 인산칼슘 석출물이 덩어리상으로 석출되어 나노튜브층을 뒤덮었으며, SBF 3일 침적 후 골유사 아파타이트 석출 초기단계에 관찰되는 돌기상이 치밀하게 석출되어 활성도가 개선된 양상을 보였다.
3. RBM 처리군과 RACP 처리군(RBM 처리-양극산화처리-석회화순환처리) 임플란트를 쥐의 경골에 4주간 매식했을 때의 removal torque는 각각 10.8±2.5N·cm와 23.2±2.8N·cm로서 석회화순환처리군에서 유의하게 높게 나타났으며 (P<0.05), 제거한 임플란트의 파면분석 결과, RBM 처리군의 표면에서는 신생골과 임플란트 사이의 계면 파절을 보였지만, RACP 처리군에서는 신생골의 응집파절 및 신생골과 임플란트 사이의 계면파절이 혼재하는 양상을 보였다.
Acknowledgments
이 논문은 정부 (미래창조과학부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(No. 2016R1A2B4011697).
References
-
Puleo, D, Nanci, A, Understanding and controlling the bone–implant interface, Biomaterials, (1999), 20(23-24), p2311-21.
[https://doi.org/10.1016/s0142-9612(99)00160-x]

-
Pattanayak, DK, Yamaguchi, S, Matsushita, T, Nakamura, T, Kokubo, T, Apatite-forming ability of titanium in terms of pH of the exposed solution, Journal of The Royal Society Interface, (2012), 9(74), p2145-55.
[https://doi.org/10.1098/rsif.2012.0107]

- Brånemark, PI, Zarb, GA, Albrektsson, T, Tissue-integrated prostheses: Osseointegration in Clinical Dentistry, Chicago, Quintessence Publ. Co., (1985), p117-28.
-
Macak, JM, Tsuchiya, H, Ghicov, A, Yasuda, K, Hahn, R, Bauer, S, et al. , TiO2 nanotubes: Self-organized electrochemical formation, properties and applications, Current Opinion in Solid State and Materials Science, (2007), 11(1-2), p3-18.
[https://doi.org/10.1016/j.cossms.2007.08.004]

-
Sieber, I, Hildebrand, H, Friedrich, A, Schmuki, P, Formation of self-organized niobium porous oxide on niobium, Electrochemistry Communications, (2005), 7(1), p97-100.
[https://doi.org/10.1016/j.elecom.2004.11.012]

- Moon, Y, Lee, M, Song, K, Bae, T, Characteristics of TiO2 nanotubes on Ti-6Al-4V alloy, Korean Journal of Dental Materials, (2008), 35(4), p339-48.
-
Aninwene, GE II, Yao, C, Webster, TJ, Enhanced osteoblast adhesion to drug-coated anodized nanotubular titanium surfaces, International Journal of Nanomedicine, (2008), 3(2), p257.
[https://doi.org/10.2147/IJN.S2552]

-
Zhu, X, Chen, J, Scheideler, L, Altebaeumer, T, Geis-Gerstorfer, J, Kern, D, Cellular reactions of osteoblasts to micron-and submicron-scale porous structures of titanium surfaces, Cells Tissues Organs, (2004), 178(1), p13-22.
[https://doi.org/10.1159/000081089]

-
Wang, B, Lee, T, Chang, E, Yang, C, The shear strength and the failure mode of plasma‐sprayed hydroxyapatite coating to bone: The effect of coating thickness, Journal of Biomedical Materials Research, (1993), 27(10), p1315-27.
[https://doi.org/10.1002/jbm.820271012]

-
Fini, M, Cigada, A, Rondelli, G, Chiesa, R, Giardino, R, Giavaresi, G, et al. , In vitro and in vivo behaviour of Ca-and P-enriched anodized titanium, Biomaterials, (1999), 20(17), p1587-94.
[https://doi.org/10.1016/s0142-9612(99)00060-5]

-
Wen, H, Wolke, J, De Wijn, J, Liu, Q, Cui, F, De Groot, K, Fast precipitation of calcium phosphate layers on titanium induced by simple chemical treatments, Biomaterials, (1997), 18(22), p1471-8.
[https://doi.org/10.1016/s0142-9612(97)82297-1]

-
Kodama, A, Bauer, S, Komatsu, A, Asoh, H, Ono, S, Schmuki, P, Bioactivation of titanium surfaces using coatings of TiO2 nanotubes rapidly pre-loaded with synthetic hydroxyapatite, Acta Biomaterialia, (2009), 5(6), p2322-30.
[https://doi.org/10.1016/j.actbio.2009.02.032]

-
Nguyen, TDT, Moon, SH, Oh, TJ, Park, IS, Lee, MH, Bae, TS, The effect of APH treatment on surface bonding and osseointegration of Ti‐6Al‐7Nb implants: An in vitro and in vivo study, Journal of Biomedical Materials Research Part B: Applied Biomaterials, (2015), 103(3), p641-8.
[https://doi.org/10.1002/jbm.b.33210]

-
Cai, Z, Shafer, T, Watanabe, I, Nunn, ME, Okabe, T, Electrochemical characterization of cast titanium alloys, Biomaterials, (2003), 24(2), p213-8.
[https://doi.org/10.1016/s0142-9612(02)00293-4]

-
Eisenbarth, E, Velten, D, Müller, M, Thull, R, Breme, J, Biocompatibility of β-stabilizing elements of titanium alloys, Biomaterials, (2004), 25(26), p5705-13.
[https://doi.org/10.1016/j.biomaterials.2004.01.021]

-
Yang, Y, Oh, N, Liu, Y, Chen, W, Oh, S, Appleford, M, et al. , Enhancing osseointegration using surfacemodified titanium implants, JOM, (2006), 58(7), p71-6.
[https://doi.org/10.1007/s11837-006-0146-1]

-
Webster, TJ, Ergun, C, Doremus, RH, Siegel, RW, Bizios, R, Enhanced functions of osteoblasts on nanophase ceramics, Biomaterials, (2000), 21(17), p1803-10.
[https://doi.org/10.1016/s0142-9612(00)00075-2]

-
Flemming, R, Murphy, CJ, Abrams, G, Goodman, S, Nealey, P, Effects of synthetic micro-and nanostructured surfaces on cell behavior, Biomaterials, (1999), 20(6), p573-88.
[https://doi.org/10.1016/s0142-9612(98)00209-9]

-
Yao, C, Webster, TJ, Prolonged antibiotic delivery from anodized nanotubular titanium using a co‐precipitation drug loading method, Journal of Biomedical Materials Research Part B: Applied Biomaterials, (2009), 91(2), p587-95.
[https://doi.org/10.1002/jbm.b.31433]

-
Bae, IH, Yun, KD, Kim, HS, Jeong, BC, Lim, HP, Park, SW, et al. , Anodic oxidized nanotubular titanium implants enhance bone morphogenetic protein‐2 delivery, Journal of Biomedical Materials Research Part B: Applied Biomaterials, (2010), 93(2), p484-91.
[https://doi.org/10.1002/jbm.b.31606]

- Chung, H, Won, D, Bae, T, Lee, M, Effect of potassium hydroxide treatment of titanium implant on the precipitation of calcium phosphate and tissue compatibility, Korean Journal of Dental Materials, (2001), 28(3), p223-33.
-
Hanawa, T, Asami, K, Asaoka, K, Microdissolution of calcium ions from calciumion-implanted titanium, Corrosion Science, (1996), 38(9), p1579-94.
[https://doi.org/10.1016/0010-938x(96)00053-4]

-
Hanawa, T, Ukai, H, Murakami, K, Asaoka, K, Structure of surface-modified layers of calcium-ion-implanted Ti– 6Al–4V and Ti–56Ni, Materials Transactions, JIM, (1995), 36(3), p438-44.
[https://doi.org/10.2320/matertrans1989.36.438]

-
Kokubo, T, Miyaji, F, Kim, HM, Nakamura, T, Spontaneous formation of bonelike apatite layer on chemically treated titanium metals, Journal of the American Ceramic Society, (1996), 79(4), p1127-9.
[https://doi.org/10.1111/j.1151-2916.1996.tb08561.x]

- Ma, Q, Li, M, Hu, Z, Chen, Q, Hu, W, Enhancement of the bioactivity of titanium oxide nanotubes by pre-0 calcification, Materials Letters, (2008), 62(17-18), p3035-8.