나노 크기 수산화인회석과 삼인산칼슘을 첨가한 실험용 불소바니쉬의 재광화 효과
초록
이 실험의 목적은 불소바니쉬 단독과, 불소바니쉬에 나노 크기의 수산화인회석과 나노크기의 삼인산칼슘을 첨가한 후, 탈회/재광화 사이클링 하에서 재광화 정도를 비커스 경도로 평가하는 것이다. 불화나트륨 5 wt%를 함유한 로진제재의 실험용 불소바니쉬를 제작하였다(EX). 실험용 불소바니쉬에 나노 수산화인회석(HA+EX)과 나노 삼인산칼슘(TC+EX)을 각각 10 wt%씩 넣어 제작하였다. 기성품인Casein phosphopeptide-amorphous calcium phosphate (CP: Tooth mousse, GC, Japan)는 비교를 위해 사용되었다. 대조군은 아무런 처리도 하지 않았다. 우치 전치부를 아크릴릭 레진에 포매한 후 우식유발 용액에 72시간 노출시킨 후, EX, HA+EX, TC+EX, CP를 시편에 도포하였다. 탈회/재광화 사이클은 각각1시간/23시간으로 구성되었고, 20일까지 반복하였다. 재광화 정도를 평가하기 위해 시험 전과 각 처치 후 비커스 경도를 측정하였다. 각 군의 재료들을 도포한 지 24시간 후 CP군이 가장 높은 경도값을 보였고(p<0.05), 다른 군들은 통계적으로 유의한 차이가 없었다(p>0.05). 탈회/재광화 사이클링 10일 후, TC+EX군이 가장 높은 경도값을 보였지만(p<0.05) HA+EX군과는 차이가 없었다(p>0.05). 탈회/재광화 사이클링 20일 후, TC+EX군은 가장 높은 경도값을 보였고, HA+EX군과 EX군이 그 다음으로 높았다(p<0.05). 결론적으로10 wt%의 나노 삼인산칼슘이 첨가된 실험용 불소바니쉬 군이 탈회/재광화 사이클하에서 법랑질을 가장 효과적으로 재광화시켰다.
Abstract
The purpose of this study was to evaluate the remineralization effect of experimental fluoride varnish mixed with nano-tricalcium phosphate (TCP) and nano-hydroxyapatite (HA) on bovine teeth under demineralization and remineralization cycling by Vickers hardness. After fabrication of rosin-based experimental fluoride varnish with 5 wt% of NaF (EX) in the laboratory, 10 wt% of nano-hydroxyapatite (HA+EX) and nano-TCP (TC+EX) were mixed, respectively. Casein phosphopeptide-amorphous calcium phosphate (Tooth mousse) (CP) was used for comparison. Bovine incisors were impregnated by acrylic resin and exposed to caries inducing solution for 72 hours. EX, HA+EX, TC+EX, and CP were applied on the surface of bovine teeth. The specimens were immersed in a demineralization solution for 1 hour and in a re-mineralization solution for 23 hours and the cycle was repeated for 20 days. Vickers hardness was measured at baseline and after each treatment. CP group showed the highest hardness value at 24 hours after application of each material (p<0.05) and the other groups were not significantly different (p>0.05). On the 10th day of de-/re-mineralization cycling, the TC+EX group showed the highest hardness value (p<0.05), but not significantly different from the HA+EX group (p>0.05). On the 20th day, the TC+EX group kept the highest hardness value, followed by HA+EX and EX groups (p<0.05). In conclusion, experimental fluoride varnish with 10 wt% of nano-TCP showed higher remineralization effect on the enamel of bovine teeth during the de/re-mineralization cycling.
Keywords:
Remineralization, Demineralization, Hydroxyapatite, Tricalcium phosphate, Vickers hardness, Fluoride varnish키워드:
재광화, 탈회, 수산화인회석, 삼인산칼슘, 비커스 경도, 불소바니쉬서 론
치아우식은 치태에 있는 세균이 탄수화물을 대사해 유기산을 만들고, 치아 표면을 탈회해 생기는 병소이다(1). 재광화 과정은 치아우식의 자연적인 회복 과정으로서 우선적으로는 타액에 있는 칼슘과 인산이온의 공급으로 이루어지며, 불소의 공급은 재광화를 도울 수 있다(2). 불소를 치아 표면 적용하여 형성된 불화인회석(fluoriapatite, Ca10(PO4)6F2)은 치아를 구성하는 성분인 수산화인회석(hydroxyapatite, Ca10(PO4)6(OH)2)보다 산에 대한 용해도가 낮아 수산화인회석이 용출되는 pH 5.5 이하에서 법랑질 표면 탈회를 억제하며 재광화를 촉진시키고, 이로 인해 법랑질 표면의 경도를 증가시킨다(3, 4). 불소는 불소용액, 불소겔, 불소폼, 불소 치약 등의 형태로 치아 표면에 국소적으로 적용될 수 있다(5). 하지만 용액, 겔, 폼 형태는 쉽게 삼킬 수 있어 불소 부작용에 노출될 우려가 있고 효과의 지속시간이 짧다(6). 이러한 단점을 해결하기 위해 치아에 얇은 형태로 오랫동안 남아있어 불소를 지속적으로 방출하는 불소바니쉬가 개발되었다(7).
칼슘과 인산이온의 공급은 법랑질을 구성하는 무기질 성장을 촉진해 재광화에 영향을 준다(8). 치아 표면에 칼슘과 인산이온을 공급하기 위해 casein phosphopeptide—amorphous calcium phosphate (CPP-ACP), 수산화인회석, 삼인칸칼슘(tricalcium phosphate, Ca3(PO4)2) 등이 사용된다. CPP-ACP의 치아 표면 도포는 높은 농도의 칼슘과 인산이온을 안정적으로 공급하기 때문에 법랑질 재광화에 효과적이다(9). 수산화인회석은 뼈와 치아의 주요 성분으로 생체친화적이기 때문에 골 이식 재료 등으로 널리 사용되었다(10). 또한 삼인산칼슘은 인체의 경조직과 유사한 특성을 가지고 있고, 타액의 칼슘과 인산이온을 증가시켜 탈회에 저항하는 능력을 가지고 있는 것으로 알려져 있다(11). 최근 치아 표면을 재광화시키기 위해서 나노 크기의 삼인산칼슘과 수산화인회석이 포함된 재광화 물질들이 사용되고 있다(12, 13). 나노 크기의 입자들은 마이크로 크기의 입자들과 비교해보았을 때 결정의 크기가 작아져 전체 구성 중 표면적의 비율이 증가하여 마이크로 입자들과는 다른 열역학적, 광학적, 전기적, 화학적 성질이 나타난다(14). 때문에 마이크로 크기 삼인산칼슘, 수산화인회석 입자에 비해 나노 크기 삼인산칼슘, 수산화인회석 입자는 칼슘과 인 이온을 더 빠르게 방출한다(15).
법랑질의 재광화 정도를 평가하는 방법은 표면미세경도측정이나 횡단미세방사선법, 편광현미경을 이용한 관찰이 있다(16–18). 그 중 미세경도를 측정하는 방법은 무기질 소실의 관찰이 불가능하고, 시편의 표면을 손상시키는 단점이 있지만, 치아의 미세경도와 무기질 손실량이 선형적 관계를 이루는 것으로 밝혀지면서 치아 표면의 재광화 정도를 측정하기 위해 널리 사용되고 있다(19). 이전에 치아를 탈회 시킨 후 나노 크기의 수산화인회석을 넣은 구강세정제 혹은 치약을 적용하여 치아표면을 재광화 시키고 이를 미세경도로 측정한 논문들이 발표된 바 있다(12, 20, 21). 하지만 불소바니쉬에 나노 사이즈의 수산화인회석과 나노 사이즈의 삼인산칼슘을 넣어 재광화 효과를 비교한 논문은 거의 없었다.
본 실험의 목적은 불소바니쉬에 나노 크기 수산화인회석과 삼인산칼슘과 같은 재광화 물질을 첨가하여 물질이 법랑질 재광화 효과를 증진시키는지를 알아보는 것이다.
재료 및 방법
1. 시편 제작
우식이 없는 우치 전치부를 준비해 치수를 제거하고 치수강을 유틸리티 왁스로 채웠다. 우치 순면에 10×7 mm 테이프를 붙이고, 나머지 부분에 매니큐어를 도포하였다. 매니큐어 건조 후, 교정용 아크릴릭레진(Ortho-Jet, Lang Dental, USA)에 포매하고 테이프를 제거해 건전한 우치의 법랑질면을 노출시켰다(n=15). 시편은 증류수에 넣어 37℃ 드라이 오븐(FO-600M, JEIO TECH, Daejeon, Korea)에서 24시간 보관하였고, 이후 시편의 표면에 대해 비커스 경도(MXT70, Matsuzawa, Akita-shi, Japan)를 측정하고 주사전자현미경(JSM-6360, Jeol Ltd., Tokyo, Japan)으로 500배율로 관찰하였다.
2. 인공우식 유발
인공우식 유발 용액은 8.7 mmol/L CaCl2, 8.7 mmol/L KH2PO4, 0.05 ppm F from NaF, and 75 mmol/L acetic acid (pH=4.0)의 조성으로 사용하였다(22). 시편은 우식유발용액에 넣은 상태로 진탕 배양기(JSSI-100C, JS Research Inc., Korea)에서 37℃, 100 rpm조건 하에 3일 보관하였다. 이후 시편의 표면에 대해 비커스 경도를 측정하고 주사전자현미경으로 관찰하였다(23).
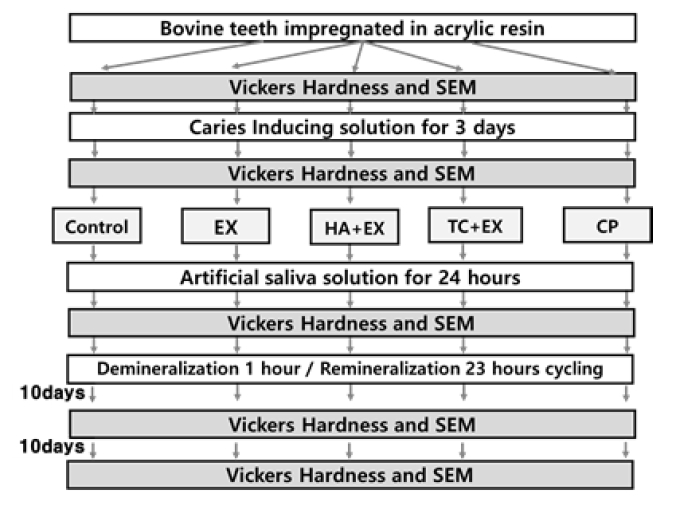
Diagram of the experiment. Vickers hardness was measured and the surface was observed by SEM 24 hours after impregnation of the bovine tooth, 3 days after caries inducing, 24 hours after applying remineralization agents, 10 days, and 20 days after re/demineralization cycling. EX: Experimental fluoride varnish, HA+EX: EX with 10 wt% nano-hydroxyapatitie, TC+EX: EX with 10 wt% nano-tricalcium phosphate, CP: Casein phosphopeptide–amorphous calcium phosphate
3. 재광화 물질 도포
실험용 불소바니쉬(Experimental Varnish; EX)는 45 wt% 로진(KR-610, Arakawa, Japan), 50 wt% 에탄올(Absolute ≥ 99.7%, Merck), 5 wt% NaF를 넣어 90℃에서 물중탕하여, hot plate (RCH-3, Tokyo Rikakikai Co. Ltd., Tokyo, Japan)위에서 over-head stirrer (RW20DZM.n, IKA Korea Ltd, Seoul, Korea)로 30분동안 240 rpm의 속도로 혼합하여 제작하였다(23).
EX군에 나노 입자 수산화인회석(nanopowder, <200 nm, Sigma-aldrich, USA) 10 wt%를 혼합해 HA군을 제작하였다. EX에 나노 크기 삼인산칼슘(nanopowder, <200 nm, Sigma-aldrich, USA) 10 wt%를 혼합해 TC군을 제작하였다. 치아의 재광화 효과를 비교하기 위해 GC Tooth Mousse (GC Co., Japan)를 사용하였다. CO군은 아무 처치도 하지 않았다. 실험군의 분류는 Table 1과 같다.
재광화 물질은 시편의 노출된 법랑질 부분에 50 mg 도포 후 건조하였다. 이후 인공타액(0.4 g NaCl, 0.4 g KCl, 0.795 g CaCl2·2H2O, 0.78 g NaH2PO4·2H2O, 0.005 g Na2S· 9H2O, and 1.0 g NH2CONH2 in 1000 mL distilled water (pH=7))을 제작하고(24), 인공타액에 넣어 진탕 배양기에서 37℃, 100 rpm, 24시간 보관하였다. 이후 시편의 표면에 대해 비커스 경도를 측정하였고, 주사전자현미경으로 관찰하였다.
4. 탈회/재광화 사이클링
시편은 진탕 배양기에서 37℃, 100 rpm조건에으로 탈회 용액에 1시간 동안, 재광화용액에 23시간동안 보관되었다. 탈회 용액은 2.0 mmol/L CaCl2, 2.0 mmol/L KH2PO4, and 75 mmol/L acetic acid (pH=4.3) 조성으로 제작되었다. 재광화 용액은 1.2 mmol/L CaCl2, 0.72 mmol/L K2HPO4, 2.6 mol/L F, and 50 mmol/L HEPES buffer (pH=7.0) 조성으로 제작되었다(22). 용액은 매일 교체되었다. 탈회/재광화 사이클링 10일, 20일 이후 비커스 경도를 측정하였고, 표면을 주사전자현미경으로 관찰하였다(23).
5. 비커스 경도 분석 및 주사전자현미경 관찰
시편 포매 24시간 후, 3일동안 인공우식 유발시킨 후, 재광화 물질 도포 24시간 후, 탈회/재광화 사이클링 10일, 20일 후 비커스 경도를 측정하고, 우치 표면을 주사전자현미경으로 관찰하였다.
비커스 경도계(MXT70, Matsuzawa, Japan)로 400 gf의 하중을 20초 동안 시편의 우치 표면에 압입하여 압흔을 형성하였고, 대각선의 길이를 측정해 비커스 경도를 구하였다. 비커스 경도 시험은 대면각이 136°인 정사각뿔 다이아몬드를 이용해 시편의 표면을 눌러 생긴 압흔의 대각선 평균길이와 압흔 하중(P = kgf)으로 경도를 구한다. 계산식은 다음과 같다.
HV = (2P×Sin 360°/2)d2 = 1.854×P/d2sd
P : 압흔의 하중(kgf)
d : 대각선의 평균길이(mm)
우치 시편의 표면은 주사전자현미경(JSM-6360, Jeol Ltd., Tokyo, Japan)을 사용하여 500배율로 관찰하였다.
6. 통계 분석
통계 분석은 SPSS프로그램(SPSS 22.0; IBM, Armonk, NY, USA)을 이용하여 분석하였다. 시편의 경도는 신뢰수준 95% 수준으로 Kruskal-Wallis분석을 하였고, 사후검정으로 Duncan’s multiple range test를 실시하였다.
결 과
1. 우치 시편의 비커스 경도
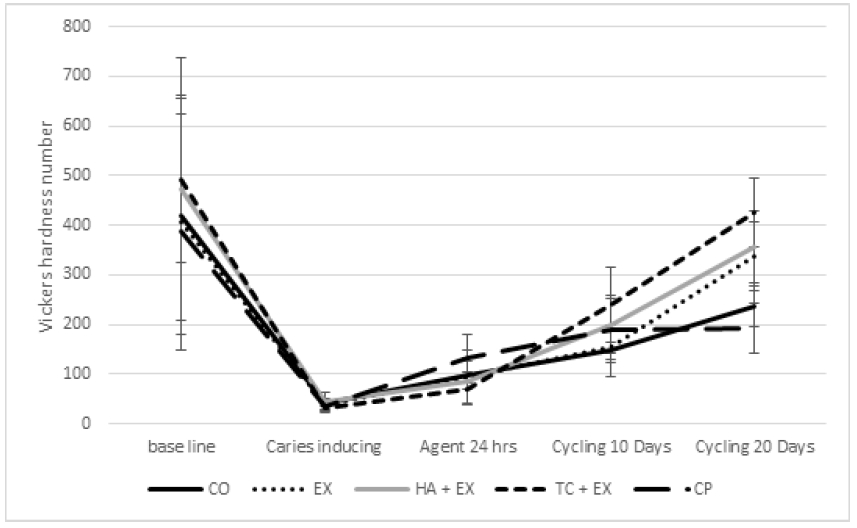
시편 포매 후(Baseline), 인공우식 유발 후(Caries inducing), 재광화 물질을 적용하고 24시간 후(Agent 24hrs), 탈회/재광화 사이클링 10일 후와 20일 후(Cycling 20 Days)의 비커스 경도는 Table 2와 Figure 2와 같다. 시편을 포매 후의 모든 시험군간의 비커스 경도 차이가 없어서 Baseline은 같았다는 것을 알 수 있다(P>0.05). 인공우식 유발 후 모든 군에서 인공우식 유발 전보다 비커스 경도값은 baseline에 비해 유의성있게 90.4~93.8% 감소하였지만 (P<0.05), 시험군 사이의 차이는 없었다(P>0.05). 재광화 물질을 적용한 지 24시간 후 CP군이 통계적으로 다른 군들보다 높은 경도값을 보였고(P<0.05), 다른 군들은 통계적인 차이가 없었다(P>0.05). 탈회/재광화 사이클 10일 후 TC+EX군이 가장 높은 경도값을 보였지만(P<0.05), HA+EX군과는 통계적으로 유의성있는 차이가 없었다(P>0.05) 탈회/재광화 사이클 20일 후 TC+EX군은 가장 높은 경도값을 보였고(P<0.05), 그 다음은 HA+EX와 EX군 이었고(P<0.05), CP는 대조군과 차이가 없었다(P>0.05).

Vickers hardness of bovine tooth surface expressed as mean and standard deviation in the parenthesis
2. 주사전자현미경 관찰
아무런 처치도 하지 않은 시편 우치의 표면(Baseline)과 우식 유발한 뒤의 표면(Caries inducing)을 주사전자현미경으로 관찰한 결과는 Figure 3과 같다. 재광화 물질을 도포하고 나서 24시간 후(Agent 24 hrs)와, 탈회/재광화 사이클링 10일(Cycling 10 Days), 20일 후(Cycling 20 Days)의 표면을 주사전자현미경으로 관찰한 것은 Figure 4와 같다.
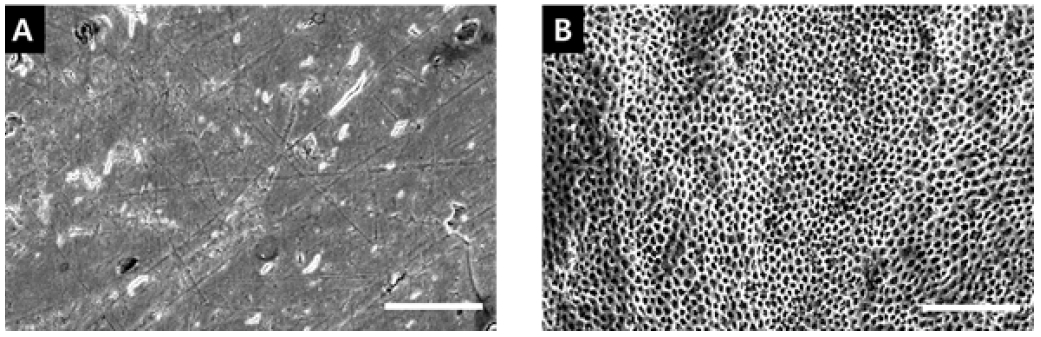
Scanning electron microscopic images of bovine tooth surface (×500), (A) at baseline, (B) after caries inducing (Scale bar = 50 μm).
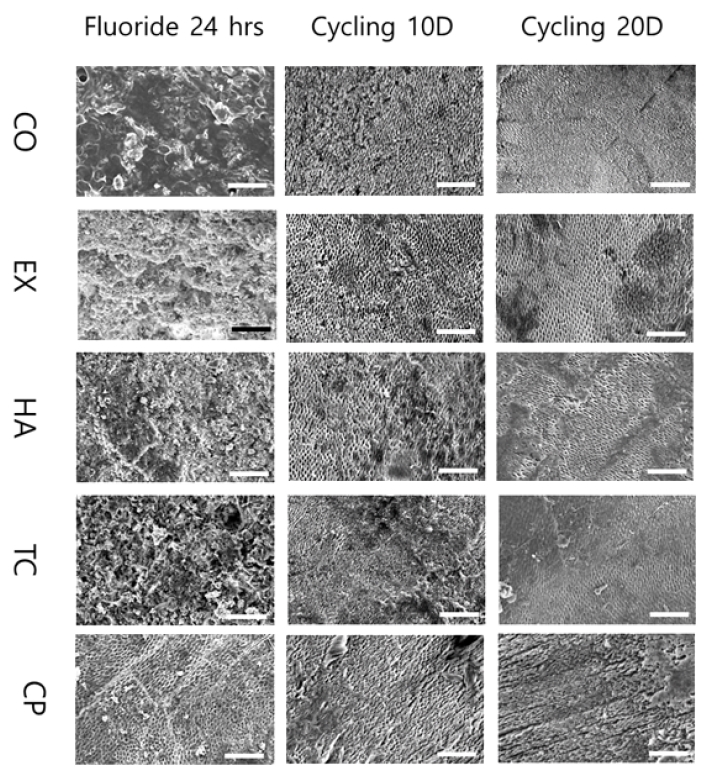
Scanning electron microscopic images after applying remineralization agents and de/re-mineralization cycling (×500). CO: control, EX: experiment fluoride varnish, HA+EX: experimental fluoride varnish with 10 wt% nano-hydroxyapatite, TC+EX: experimental fluoride varnish with 10 wt% of nano-tricalcium phosphate, CP: Casein phosphopeptide–amorphous calcium phosphate (Scale bar = 50 μm).
Baseline에 비해 인공우식 유발 후 탈회된 법랑질 표면이 관찰되었다(Figure 3). 재광화 물질 도포 24시간 후 에는 EX군은 물질로 덮여있는 양상을 보였고, HA와 TC에서는 물질이 덮여있고 구형의 CaF2 입자가 관찰되었다(Figure 4). 20일 후에는 부분적으로 재광화 물질들이 떨어져나가 법랑질 표면이 관찰되었다. TC+EX군에서는 재광화된 것으로 추정되는 평활한 표면을 볼 수 있었고, CP군은 대조군과 차이를 보이지 않았다(Figure 4).
고 찰
본 연구에서는 나노 크기 수산화인회석과 삼인산칼슘의 재광화 능력을 알아보고자 우치 법랑질에 인공우식을 유발시킨 후, 재광화 물질을 도포하고 탈회/재광화 사이클링을 거쳐 비커스 경도를 측정하였다. 그 결과 나노크기 삼인산칼슘이 함유된 불소바니쉬의 재광화 능력이 가장 좋았다.
본 실험에서는 불소 바니쉬의 재광화 능력을 증가시키기 위해 나노 입자의 수산화인회석과 삼인산칼슘을 사용하였다. TC+EX군은 탈회/재광화사이클링 10일과 20일에서 가장 높은 재광화 효과를 보였고, 탈회/재광화 사이클링 20일 후 표면경도는 baseline 만큼 회복이 되었다. TC+EX군의 표면경도는 탈회/재광화 사이클링 10일 후에서는 HA+EX와 차이를 보이지 않았지만, 20일에서는 가장 컸다. 삼인산칼슘은 수산화인회석보다 빠르게 분해 되는데 이로 인해 치아 표면으로 칼슘과 인산 이온을 충분하게 공급할 수 있기 때문이라고 생각된다(25).
EX군은 CO군은 탈회/재광화 사이클링을 거친 후 표면경도가 증가하였다. EX군은 CO군과 비교해 보았을 때, 사이클링 후 더 높은 비커스 경도를 보였다. 이는 탈회/재광화 사이클링을 거치며 CO군과 EX군 모두 재광화가 일어나지만 EX군의 불소 성분이 재광화를 촉진시켰기 때문에 더 높은 표면경도를 보인 것으로 생각된다(26). 본 실험에서 사용된 불소바니쉬는 30일 동안 치아우식예방에 필요한 유효불소농도를 방출하기 때문에 20일 사이클링하에서도 재광화 효과를 보일 수 있다(27). 탈회/재광화 사이클링 20일 이후 EX 군보다 나노 입자크기 삼인산칼슘이 포함된 TC+EX군의 표면경도가 더 높았다. 이로 인해 불소의 존재가 재광화를 촉진시키지만, 불소와 더불어 칼슘과 인산을 충분히 공급할 수 있도록 삼인칸칼슘을 첨가한 것이 법랑질 재광화에 더욱 효과적임을 알 수 있었다.
나노 입자는 기존의 마이크로의 입자와 비교했을 때 보다 넓은 표면적을 가지기 때문에 빠르게 칼슘과 인을 방출할 수 있다(22). 나노 수산화인회석은 치아나 뼈와 유사한 생체적합성을 가지고 있는 재료로(28), 탈회된 법랑질에 침착하거나 탈회된 인회석 나노구조에 침착해 법랑질 재광화를 촉진할 수 있다(12). 또한 구강 내의 칼슘을 공급해주면서 재광화를 촉진할 수 있다(29). Huang 등에 따르면, 나노 수산화인회석을 증류수에 넣어 12일동안의 재광화 효과를 비교해본 결과 10 wt%까지는 유의성 있는 재광화 효과를 관찰할 수 있었다(20). 나노 수산화인회석의 농도가 높아질수록 칼슘과 인 이온의 방출이 증가하여 재광화능력이 올라가지만 15%는 구강세정제나 치약에 쓰기 높은 농도이고, 통계적으로 15 wt%와 유의성 있는 차이가 없는 10 wt%가 적절한 농도로 계산되었다. 본 실험에서는 10 wt%의 나노 수산화인회석이 첨가된 불소바니쉬는 첨가되지 않은 불소바니쉬에 비해 재광화 능력이 증가되지 않았다. 실험에서 사용된 불소바니쉬의 로진 성분은 내부 물질을 서서히 방출하는 전달체 역할을 하게 되므로 재광화에 가장 효과적인 나노 수산화인회석의 농도는 다를 것이라 생각된다(27).
Casein phosphopeptide amorphous calcium phosphate (CPP-ACP)는 우유에서 채취한 β-casein을 분해한 CPP와 인산칼슘인 ACP를 결합시킨 화합물이다(30). CPP-ACP의 항우식 효과는 많은 실험과 임상에서 확인되었기 때문에 치약, 구강양치액, 크림제재 등 다양한 재료에 첨가되어 시판되고 있다(31). 본 실험에서는 CPP-ACP가 10%가량 함유된 Tooth Mousse (GC corp, Japan)을 사용해 불소바니쉬와 재광화 정도를 비교하였다. 재광화 물질을 처리한 다음 24시간 후, CP군의 비커스 경도 값이 가장 높았다. ACP는 구강 내 높은 용해도를 가지는데, CPP가 이를 안정화시켜 저장고 역할을 해 구강 내에 칼슘과 인 이온을 과포화 시켜 치아의 탈회를 예방하고 재광화를 촉진시킨다(32). ACP의 높은 용해도로 칼슘과 인산이 충분히 용출되기 때문에 초기 법랑질 표면의 높은 경도값을 보였다고 생각된다. CP군은 재광화 물질 처리 후와 비교했을 때 탈회/재광화 사이클링 이후 경도가 유의성있게 증가하지 않아서 20일의 탈회/재광화 사이클링 이후는 불소바니쉬가 포함된 군들(EX, HA+EX, TC+EX군)보다 낮은 재광화 효율을 보였다. 본 실험에서 사용한 불소바니쉬는 CPPACP 보다 접착력이 강하고, 30일 이상의 유효한 농도의 불소를 방출하기 때문에(26) 20일 이후의 재광화능력은 실험용 불소바니쉬가 함유된 군들이 더 뛰어나다고 할 수 있다.
주사전자현미경으로 각각의 처치 후 치아 표면을 관찰한 결과, 불소바니쉬를 도포한 후 24시간 후, 치아 표면은 불소바니쉬로 덮여 있었고 구형의 CaF2 입자를 관찰할 수 있었다(33). 탈회/재광화 사이클링 10일 후, 탈회된 법랑질 표면은 거칠어진 표면으로 나타났다 20일 후에는 거칠어진 모습이 줄어들어 재광화 된 모습을 확인할 수 있었다. 20일 후, TC+EX군이 가장 평활한 표면을 보여 가장 재광화가 많이 일어난 것을 관찰할 수 있었는데, 이는 비커스 경도 결과와 일치함을 확인할 수 있었다.
본 실험에서는 비커스 경도 측정을 통해 인공 법랑질 우식병소의 재광화를 관찰하였다. 이는 병소 표면의 재광화 과정을 관찰할 수 있었지만, 심부에서의 재광화 과정과 병소의 깊이에 따른 재광화 과정을 관찰할 수 없었다. 이를 위해서는 편광 현미경 또는 공초점현미경을 이용한 방법으로 추가적인 관찰이 필요하다. 본 실험에서는 인공타액과 탈회/재광화 사이클링으로 구강 환경을 재현하고자 하였지만 실제 타액과 비교해 본다면 본 실험에서 사용한 인공타액은 단백질과 효소가 빠져 있다. 또한 실제 구강 환경은 세균이 탄수화물을 대사하여 유기산을 배출하고, 세균막을 형성하는 등 복잡한 생물학적 과정이 얽혀 있으므로 이런 방해인자들로 인해 실험실 내 보다는 과정이 복잡하고 재광화시간이 오래 걸린다(34). 그러므로 향후 추가연구에서는 실제 사람을 대상으로 한 임상실험도 필요하다고 생각된다.
결 론
실험용 불소바니쉬는 인공우식에 대한 재광화 효과를 보였고, 이 불소바니쉬에 10 wt% 나노 크기 삼인산칼슘의 혼합은 탈회/재광화 용액 내에서 20일간의 사이클링 후 가장 뛰어난 재광화 효과를 보였다.
Acknowledgments
이 성과는 2018년도 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(No. 2018R1A2B6002088).
References
-
Selwitz RH, Ismail AI, Pitts NB. Dental caries. Lancet. 2007;369(9555):51–9.
[https://doi.org/10.1016/S0140-6736(07)60031-2]

-
Featherstone J. Dental caries: a dynamic disease process. Aust Dent J. 2008;53(3):286–91.
[https://doi.org/10.1111/j.1834-7819.2008.00064.x]

-
Gao SS, Zhang S, Mei ML, Lo ECM, Chu CH. Caries remineralisation and arresting effect in children by professionally applied fluoride treatment - a systematic review. BMC Oral Health. 2016;16(1):1–9.
[https://doi.org/10.1186/s12903-016-0171-6]

-
Cury JA, De Oliveira BH, Dos Santos APP, Tenuta LMA. Are fluoride releasing dental materials clinically effective on caries control? Dent Mater. 2016;32(3):323–33.
[https://doi.org/10.1016/j.dental.2015.12.002]

-
Weyant RI, Tracy SL, Anselmo T, Beltrán-Aguilar ED, Donly KJ, Frese WA, et al. Topical fluoride for caries prevention. J Am Dent Assoc. 2013;144(11):1279–91.
[https://doi.org/10.14219/jada.archive.2013.0057]

-
Ekstrand J, Koch G, Lindgren LE, Petersson LG. Pharmacokinetics of Fluoride Gels in Children and Adults. Caries Res. 1981;15(3):213–20.
[https://doi.org/10.1159/000260517]

-
Autio-Gold JT, Courts F. Assessing the effect of fluoride varnish on early enamel carious lesions in the primary dentition. J Am Dent Assoc. 2001;132(9):1247–53.
[https://doi.org/10.14219/jada.archive.2001.0367]

-
Langhorst SE, O’donnell JNR, Skrtic D. In vitro remineralization of enamel by polymeric amorphous calcium phosphate composite: Quantitative microradiographic study. Dent Mater. 2009;25(7):884–91.
[https://doi.org/10.1016/j.dental.2009.01.094]

- Sakaguchi R, Ferracane J, Powers J. Craig’s Restorative dental materials. 14th Editi. Mosby, Inc; 2019.
-
Wang H, Li Y, Zuo Y, Li J, Ma S, Cheng L. Biocompatibility and osteogenesis of biomimetic nano-hydroxyapatite/polyamide composite scaffolds for bone tissue engineering. Biomaterials. 2007;28(22):3338–48.
[https://doi.org/10.1016/j.biomaterials.2007.04.014]

-
Karlinsey RL, MacKey AC, Walker ER, Frederick KE. Surfactant-modified β-TCP: Structure, properties, and in vitro remineralization of subsurface enamel lesions. J Mater Sci Mater Med. 2010;21(7):2009–20.
[https://doi.org/10.1007/s10856-010-4064-y]

-
Huang S, Gao S, Cheng L, Yu H. Remineralization potential of nano-hydroxyapatite on initial enamel lesions: An in vitro study. Caries Res. 2011;45(5):460–8.
[https://doi.org/10.1159/000331207]

-
Hong YW, Kim JH, Lee BH, Lee YK, Choi BJ, Lee JH, et al. The effect of nano-sized β-tricalcium Phosphate on remineralization in glass ionomer dental luting cement. Key Eng Mater. 2007;361–363:861–4.
[https://doi.org/10.4028/www.scientific.net/KEM.361-363.861]

-
Zafar MS, Alnazzawi AA, Alrahabi M, Fareed MA, Najeeb S, Khurshid Z. Nanotechnology and nanomaterials in dentistry. Advanced Dental Biomaterials. Elsevier Ltd; 2019;477–505 p.
[https://doi.org/10.1016/B978-0-08-102476-8.00018-9]

-
Xu H, Weir M, Sun L. Nanocomposites with Ca and PO4 release: Effects of reinforcement, dicalcium phosphate particle size and silanization. Dent Mater. 2007;23(12):1482–91.
[https://doi.org/10.1016/j.dental.2007.01.002]

-
Toumba KJ, Curzon MEJ. A clinical trial of a slow-releasing fluoride device in children. Caries Res. 2005;39(3):195–200.
[https://doi.org/10.1159/000084798]

-
Marini I, Checchi L, Vecchiet F, Spiazzi L. Intraoral fluoride releasing device: A new clinical therapy for dentine sensitivity. J Periodontol. 2000;71(1):90–5.
[https://doi.org/10.1902/jop.2000.71.1.90]

-
Borges AB, Yui KCK, D’Avila TC, Takahashi CL, Torres CRG, Borges ALS. Influence of remineralizing gels on bleached enamel microhardness In different time intervals. Oper Dent. 2010;35(2):180–6.
[https://doi.org/10.2341/09-117-L]

-
Featherstone JDB, Ten Cate JM, Shariati M, Arends J. Comparison of artificial caries-like lesions by quantitative microradiography and microhardness profiles. Caries Res. 1983;17(5):385–91.
[https://doi.org/10.1159/000260692]

-
Huang SB, Gao SS, Yu HY. Effect of nano-hydroxyapatite concentration on remineralization of initial enamel lesion in vitro. Biomed Mater. 2009;4(3):0–5.
[https://doi.org/10.1088/1748-6041/4/3/034104]

- Mielczarek A, Michalik J. The effect of nano-hydroxyapatite toothpaste on enamel surface remineralization. An in vitro study. Am J Dent. 2014;27 (6):287–90.
-
Weir MD, Chow LC, Xu HHK. Remineralization of demineralized enamel via calcium phosphate nanocomposite. J Dent Res. 2012;91(10):979–84.
[https://doi.org/10.1177/0022034512458288]

- 손주리, 신윤정, 정건희, 최신재, 오승한, 배지명. Effect of fluoride varnishes on the surface hardness of bovine teeth under demineralization/remineralization cycling. 대한치과의사협회지. 2020;58(6):324–35.
-
Iijima M, Hashimoto M, Kohda N, Nakagaki S, Muguruma T, Endo K, et al. Crystal growth on bioactive glass sputter-coated alumina in artificial saliva. Dent Mater J. 2013;32(5):775–80.
[https://doi.org/10.4012/dmj.2013-120]

-
Zhang H, Li X, Wen J, Zhao C. Preparation and characterisation of HA/TCP biphasic porous ceramic scaffolds with pore-oriented structure. Ceram Int. 2017;43(15):11780–5.
[https://doi.org/10.1016/j.ceramint.2017.06.014]

-
김아진, 손주리, 오승한, 배지명. 실험용 불소바니쉬가 우치의 비커스 경도에 미치는 영향. 대한치과재료학회지. 2016;43(1):81–90.
[https://doi.org/10.14815/kjdm.2016.43.1.81]

-
신경수, 김아진, 오승한, 배지명. 불소 지속방출 및 생체 적합성을 가진 불소 바니쉬의 개발. 대한치과재료학회지. 2017;44(1):21–31.
[https://doi.org/10.14815/kjdm.2017.44.1.021]

-
Lee SY, Kwon HK, Kim BI. Effect of dentinal tubule occlusion by dentifrice containing nano-carbonate apatite. J Oral Rehabil. 2008;35(11):847–53.
[https://doi.org/10.1111/j.1365-2842.2008.01876.x]

-
Yamagishi K, Onuma K, Suzuki T, Okada F, Tagami J, Otsuki M, et al. A synthetic enamel for rapid tooth repair. Nature. 2005;433(7028):819–819.
[https://doi.org/10.1038/433819a]

-
Reynolds EC. Remineralization of enamel subsurface lesions by casein phosphopeptide-stabilized calcium phosphate solutions. J Dent Res. 1997;76(9):1587–95.
[https://doi.org/10.1177/00220345970760091101]

-
Wierichs RJ, Stausberg S, Lausch J, Meyer-Lueckel H, Esteves-Oliveira M. Caries-preventive effect of NaF, NaF plus TCP, NaF plus CPP-ACP, and SDF varnishes on sound dentin and artificial dentin caries in vitro. Caries Res. 2018;52(3):199–211.
[https://doi.org/10.1159/000484483]

-
Ranjitkar S, Rodriguez JM, Kaidonis JA, Richards LC, Townsend GC, Bartlett DW. The effect of casein phosphopeptide-amorphous calcium phosphate on erosive enamel and dentine wear by toothbrush abrasion. J Dent. 2009;37(4):250–4.
[https://doi.org/10.1016/j.jdent.2008.11.013]

-
Zhou SL, Zhou J, Watanabe S, Watanabe K, Wen LY, Xuan K. In vitro study of the effects of fluoride-releasing dental materials on remineralization in an enamel erosion model. J Dent. 2012;40(3):255–63.
[https://doi.org/10.1016/j.jdent.2011.12.016]

-
Cate JMT. In vitro studies on the effects of fluoride on de- and remineralization. J Dent Res. 1990;69(2):614–9.
[https://doi.org/10.1177/00220345900690S120]