진공 열처리 과정이 금 나노입자가 코팅된 티타니아 나노튜브의 가시광 원격제어 약물용출 및 항균 활성에 미치는 효과 평가
초록
본 연구의 목적은 진공 열처리 과정이 티타니아 나노튜브 표면에 코팅된 금 나노입자의 가시광 원격제어 항균약물 용출 및 항균능에 미치는 영향에 대해서 평가하는 것이다. 100 nm 직경의 티타니아 나노튜브 위에 금 나노입자를 플라즈마 코팅한 후, 진공 열처리 과정을 통하여 균질하게 구형화된 금 나노입자-티타니아 나노튜브 시편을 제작하였다. 확산반사 자외선-가시광선-근적외선 분광광도 측정 결과, 진공 열처리된 금 나노입자-티타니아 나노튜브는 400에서 650 nm의 가시광선 영역에서 강한 광 흡수도를 나타내었다. 전계방출 주사전자현미경 관찰에서는 금 코팅시간이 1분에서 9분으로 증가할수록 나노입자의 크기는 5.59±1.05 nm에서 56.93±10.91 nm로 증가하였고, 종횡비도 1.01±0.31에서 1.55±0.47로 증가하였다. 항균약물(0.1% 테트라사이클린이 포함된 폴리락트산)이 코팅된 금나노입자-티타니아 나노튜브의 가시광선(파장 550 nm) 조사 전·후의 항균약물 용출거동 평가 및 Streptococcus mutans 균을 이용한 항균시험 결과, 가시광 조사를 시행한 실험군의 약물 용출량이 광조사를 하지 않은 대조군의 약물 용출량보다 유의성 있게 높았다(P<0.05). 또한, 가시광 조사를 시행한 시험군에서 유의성 있는 항균효과를 나타내었다(P<0.05). 따라서, 진공 열처리를 이용하여 구형화 시킨 금 나노입자-티타니아 나노튜브 표면처리기술로 가시광 원격제어 약물 용출 기능을 가진 항균성 임플란트 재료로서 가능성이 있다고 사료된다.
Abstract
The purpose of this study was to evaluate the effect of vacuum heat treatment on the visible light remote-controlled drug release and consequent antimicrobial activity of gold nanoparticles coated on the surface of titania nanotubes. After the plasma coating of gold nanoparticles on a titania nanotube with a diameter of 100 nm, a homogeneously spherical gold shaped nanoparticle deposited on titania nanotube specimen was prepared through a vacuum heat treatment process. From the measurement of the diffuse reflective ultraviolet-visible-near-infrared spectrophotometer, the vacuum heated gold nanoparticles-titania nanotubes showed strong light absorption at the range of 400 to 650 nm. From the observation of field emission scanning electron microscopy, the size of the nanoparticles increased from 5.59±1.05 nm to 56.93±10.91 nm, and the aspect ratio also increased from 1.01±0.31 to 1.55±0.47, as the gold coating time increased from 1 minute to 9 minutes, respectively. From the results of antimicrobial drug elution test and the antibacterial test using Streptococcus mutans, before and after the visible light (wavelength 550 nm) irradiation of the antimicrobial drug (a polylactic acid containing 0.1% tetracycline) coated specimen, the drug elution value of the experimental group subjected to visible light irradiation was significantly higher than that of the control group without light irradiation (P<0.05). Also, significant antibacterial effect was evident in the experimental group subjected to visible light irradiation (P<0.05). Therefore, the study concluded that there is a possibility as an antimicrobial implant material with a visible light remote control drug elution function with the surface treatment technology of gold nanoparticles-titania nanotubes spheroidized using vacuum heat treatment.
Keywords:
Gold nanoparticle, Titania nanotube, Vacuum heat-treatment, Visible light remote control, Antimicrobial effect키워드:
금 나노입자, 티타니아 나노튜브, 진공 열처리, 가시광 원격제어, 항균효과서 론
나노 복합 소재는 오염 물질 분해를 위한 반도체 광촉매 등 다양한 분야의 다기능 응용이 가능하다. 티타니아(TiO2)는 무독성, 저비용, 장기간 동안 광 부식에 대한 내성이 뛰어나고, 효율적인 광촉매 활성으로 인해 수년 동안 관심을 끌고 있다(1). 하지만 티타니아의 넓은 밴드 갭(~3.2 eV)으로 인해 광촉매 활성을 갖기 위해서는 에너지가 큰 자외선 부근의 빛(파장, λ≤388 nm)을 필요로 한다(2, 3). 이러한 한계를 줄이기 위해 티타니아 표면에 금(Au)나노입자를 도입하여 가시광선 영역에서도 광촉매 활성이 향상됨을 보고하였다(4-6). 금속 나노입자는 형태와 크기(size)에 따라 나노입자의 특성이 크게 영향을 미치게 되는데, Niu와 Xu 등은 서로 다른 형태의 금속 나노입자는 형태에 따라서 촉매 활성도가 크게 달라진다고 보고하였고(7), Andras 등은 백금(Pt) 나노입자의 크기가 촉매 활성에 매우 큰 영향을 미친다는 것을 보고하였다(8). 이처럼 나노입자의 형태와 크기 제어는 금속 나노입자 응용 분야에서 매우 중요하다.
나노 구조의 귀금속은 귀금속(Au, Pt, Ag) 나노입자가 표면 플라즈몬 공명 효과를 나타낼 수 있도록 표면 전자의 집합적인 일관된 진동을 가질 수 있다고 보고하였다(9,10). 표면 플라즈몬은 외부 자극으로부터 금속과 유전체 사이에서 발생하는 공명으로 인해 전자들의 집단적 진동을 가지며(11-13), 금속 나노입자의 표면에 빛이 조사되면 표면의 플라즈몬이 특정한 파장의 빛을 흡수 또는 산란하는 공명 현상이 나타난다. 여기에서 국부적인 표면 플라즈몬 공명이 일어나는 파장은 나노입자의 크기, 모양 및 주변 유전체 재료에 크게 의존한다고 보고하였다(14). Kim 등은 금 나노입자가 가시광선 영역에서 국부적인 표면 플라즈몬 공명의 특성을 나타내고 형태와 크기 제어를 통하여 국부적인 표면 플라즈몬 공명특성을 보이는 빛의 파장을 조절할 수 있다고 보고하였다(15).
나노 구조에 귀금속 입자를 증착하는 방법 중 물리적인 방법인 스퍼터링은 대량 생산을 할 수 있고, 스퍼터링의 시간과 기판과의 거리에 따라 박막의 두께를 조정할 수 있다는 장점이 있다(16-18). Borges 등과 Koneti 등은 나노 플라즈모닉 박막 특성을 나노입자의 증착 후 열처리를 통해 나노입자의 분포 및 크기와 밀접한 관련이 있음을 보고하였고(19, 20), Kim 등도 금 나노입자의 박막 증착 후 진공 열처리를 통해 구형의 금 나노입자로 형성된 플라즈모닉 금속과 반도체의 광촉매의 활성을 보고하였다(21).
이에 본 연구에서는 100 nm 직경의 티타니아 나노튜브 위에 금 나노입자를 플라즈마 코팅한 후, 진공 열처리 과정을 통하여 균질하게 구형화된 금 나노입자-티타니아 나노튜브 시편을 제작하여, 진공 열처리 과정이 티타니아 나노튜브 표면에 코팅된 금 나노입자의 플라즈모닉 광촉매 효과 기반의 가시광 원격제어 항균약물용출 및 이에 따른 항균 기능에 미치는 영향에 대해서 평가하고자 한다.
재료 및 방법
1. 금 나노입자-티타니아 나노튜브의 시편 제작
두께 250 μm의 티타늄 판(250 μm thick, 5×5 cm2, 99.5%; Hyundai Titanium Co., Incheon, Korea)을 아세톤, 에탄올, 및 증류수의 순서로 세척한 후, 티타늄 판을 0.5 wt.% 불산(purity: 48%, Sigma-Aldrich, St. Louis, MO, USA)을 전해질 용액으로 하여 20 V, 30분 동안 양극산화 시켰다. 양극산화 완료 후, 시편을 증류수에 세척하고, 60 ℃ 오븐에서 24시간 건조한 후, 400 ℃에서 3시간 동안 열처리를 하여 100 nm 티타니아(TiO2) 나노튜브를 제작하였다(공기 중 열처리, 승온 및 냉각속도 = 1 K/min). 열처리된 티타니아 나노튜브 표면에 플라즈마 이온 증착기(Ion sputter, E-1030, Hitachi Co., Tokyo, Japan)를 이용하여 금 나노입자를 코팅하였다(진공도 6.0 Pa, 전류 10 mA, 코팅시간 1, 3, 5, 7 및 9분). 금 나노입자 코팅 완료 후, 시편을 400 ℃에서 1시간 동안 진공 열처리하여(Dekema Austromat, Dekema GmbH, Freilassing, Germany; 진공 <20 mbar; 승온 및 냉각속도 = 1 K/min) 나노튜브 위에 코팅된 금 나노입자의 상분리 과정을 통한 구형화 작업을 진행하였다(21).
2. 표면특성 분석
금 나노입자의 흡수파장을 알기 위하여 확산반사 자외선-가시광선-근적외선 분광광도계(Diffuse Reflectance UV-VIS-NIR Spectrophotometer: SolidSpec-3700, Shimadze, Kyoto, Japan)를 사용하였고, 티타니아 나노튜브 위에 코팅된 금 나노입자의 미세구조 및 형태는 전계방사 주사전자현미경(Field emission scanning electron microscope: FE-SEM, S4800, Hitachi&Horiba Co., Tokyo, Japan)으로 관찰하였다. 측정된 FE-SEM 이미지를 바탕으로 입자크기를 Image J 소프트웨어(Version 1.53h, NIH, Bethesda, USA)로 분석하여, 코팅시간에 따른 입자의 크기와 종횡비를 계산하였다.
3. 세포독성평가
세포의 독성평가는 3-(4,5-dimethylthiazol-2-yl)-2, 5-diphenyl-tetrazolium bromide (MTT) assay를 이용하여 측정하였다. 즉 시편 위에 인간 중간엽 줄기세포(human mesenchymal stem cell; hMSC, Lonza Co., Morristown, USA)를 24 well plate에 각각 1×104 cell/well을 분주하고 24시간, 48시간 배양하였다. 배양 후 MTT (Sigma- Aldrich, St. Louis, MO, USA)용액 100 μg/ml을 각 well에 첨가하여 37 ℃에서 4시간 동안 배양하였다. 4시간 경과 후 MTT에 의해 형성된 formazan을 DMSO (Sigma-Aldrich, USA)로 녹이고 ELISA reader (Spectra MAX 250, Molecular devices, Sunnyvale, CA, USA)를 이용하여 570 nm에서 흡광도를 측정하였다.
4. 항균 약물 복합체 코팅 및 약물 방출량 측정
금 코팅된 티타니아 나노튜브 위에 항균약물은 전기방사장치(ESR-100, Nano NC Co., Seoul, Korea)를 이용하여 코팅하였다. DMSO에 용해된 테트라사이클린(Tetracycline, Sigma, USA)과 테트라하이드로퓨란(Tetrahydrofuran, Junsei, Kanto, Japan)에 용해된 폴리락트산(Polylactic acid: PLA; Sigma, USA)과 함께 혼합하여 테트라사이클린 0.1%가 포함된 폴리락트산 항균약물(PLA/0.1% tetracycline)을 제조하였다. 전압 10 kV, 유출속도 100 μL/min, 분사 노즐과 시편과의 거리 15 cm의 전기방사 조건에서 시편 위에 1분 동안 앞서 제조된 항균약물을 코팅하였다. 항균용액이 코팅된 시편을 1×1 cm2 크기로 자르고, 24 well plate에 증류수 1 ml을 넣은 후 37 ℃ incubator에서 30분, 1시간, 6시간, 24시간, 48시간동안 보관 후 각각의 측정 시간에 용출액을 꺼내어 ELISA microplate reader (Spectra MAX 250, Molecular devices, Sunnyvale, CA, USA)를 이용하여 362 nm의 파장에서 흡광도를 측정하여 담지 시간 변화에 따른 항균약물의 용매 내 용출량을 계산하였다. 또한 550 nm 파장을 갖는 광 조사기(150W Halogen Lamp; OSL2 high-intensity fiber light source, Thorlabs, Shanghai, China)를 이용하여, 항균 약물이 코팅된 시편에 1분간 조사 후, 37 ℃ 배양기에서 30분과 1시간 동안 보관 후 용출액을 꺼내어 흡광도를 측정하여 가시광 조사에 의한 항균약물 용출량 변화를 계산하였다.
5. 항균시험
항균효과를 평가하기 위해 S. mutans (ATCC 25175, American Type Culture Collection, Manassas, USA)는 brain heart infusion (BHI, Difco, Sparks, MD, USA) 액체 배지에 24시간 배양한 후, S. mutans 부유액의 200 μL를 5 mL의 BHI 액체 배지에 접종하여 6시간 동안 2차 배양을 하였다. 2차 배양 후 S. mutans 부유액의 세균수를 1 ×105 CFU/ml로 희석하고 고체 아가 배지에 접종한 후, 항균약물이 코팅된 시편을 올려놓고 37 ℃ 배양기에서 24시간 배양하였다. 항균약물이 코팅된 실험군 시편에 광 조사기를 이용하여 1분간 광 조사한 후, 24시간 동안 배양하여 광 조사를 하지 않은 대조군과 광 조사를 시행한 실험군 배지에서 S. mutans colony의 저해된 크기(mm)를 3회 반복 측정하여 항균 능력을 평가하였다.
6. 통계분석
통계분석은 SPSS 프로그램(Statistical Product and Service Solutions Version 22.0; IBM Co., Armonk, NY, USA)을 이용하여 paired t-test를 시행하였으며, 유의 수준은 0.05로 설정하였다.
결 과
1. 진공 열처리 기반의 금나노입자-티타니아 나노튜브 표면관찰
금 나노입자-티타니아 나노튜브의 확산반사 자외선-가시광선-근적외선 스펙트럼을 분석한 결과, 티타니아-나노튜브는 370 nm 이하 파장에서 광흡수를 보였고, 진공 열처리된 금 나노입자-티타니아 나노튜브는 가시광선인 400~650 nm 영역에서 광흡수도를 나타내었다(Figure 1). 또한, 이전 연구와의 분석결과 비교에서도 진공 열처리한 시편의 광흡수의 강도가 진공 열처리하지 않은 시편의 강도에 비하여 높은 값을 나타내었다(22). 금 나노입자가 코팅된 티타니아 나노튜브의 전계방출 주사전자현미경 관찰 결과, 금 코팅시간이 1분에서 9분으로 증가할수록 나노입자의 크기는 5.59±1.05 nm에서 56.93±10.91 nm로 증가하였고, 종횡비도 1.01±0.31에서 1.55±0.47로 증가하였다. 나노입자의 형태는 코팅 1분시 작은 구형의 나노입자 형태를 띄고 있으며 코팅 7분 이상부터 나노입자가 커지면서 나노입자의 밀도가 감소되고 타원체로 변화되는 것이 관찰되었다(Figure 2, Table 1). 따라서, 진공 열처리에 따른 금 나노입자의 구형화가 잘 이루어지고, 본 연구에서 사용된 광 조사기(파장 550 nm)에 가장 적합한 광흡수도를 나타내는 5분 코팅한 금 나노입자 시편을 최적 실험군으로 설정하여 세포독성평가, 가시광 원격제어 약물용출량 측정 및 항균효과를 평가하였다.
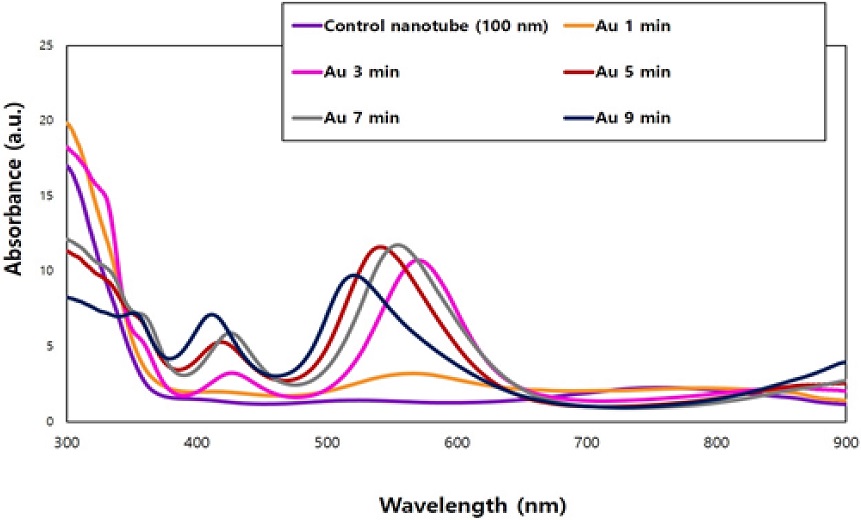
UV diffuse reflectance spectra of gold nanoparticles (GNPs)-TiO2 nanotubes with various gold sputtering periods. The electron absorption spectra of GNPs-TiO2 nanotubes showed 400~650 nm wavelength ranges.

FE-SEM images of Control TiO2 nanotubes-100 nm (a) and GNPs-TiO2 nanotubes with 1 min (b), 3 min (c), 5 min (d), 7 min (e) and 9 min (f) of gold sputtering (top: plain view, bottom: oblique view).
2. 세포독성 평가
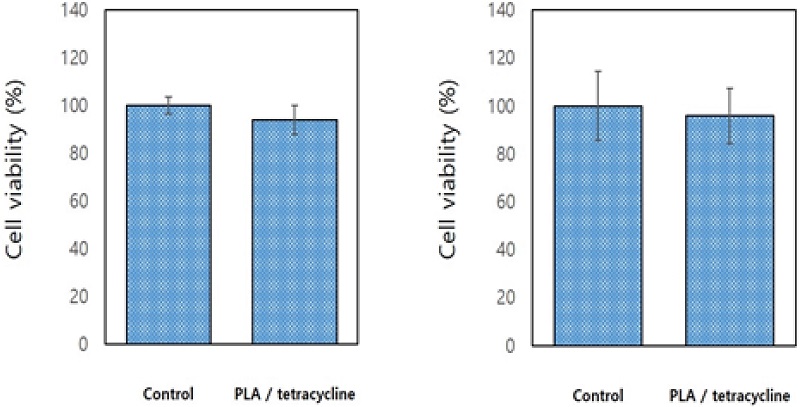
금 나노입자-티타니아 나노튜브 위에 항균약물이 코팅된 시편의 세포 배양 24시간과 48시간 후의 세포 독성 평가 결과, 순수 티타니아 나노튜브 대조군 결과와 항균약물(PLA/0.1% tetracycline)을 담지한 실험군 결과 간의 통계적 유의차는 없었다(P>0.05, Figure 3).
3. 약물 용출량 측정
금 나노입자 함유 항균약물의 시간에 따른 약물용출 결과는, 대조군인 폴리락트산이 포함되지 않은 항균약물(0.1% tetracycline)은 측정 30분과 1시간 이내에 급속하게 용출되는 초기 대량방출의 거동을 나타내었고, 실험군인 폴리락트산이 포함된 항균약물(PLA/0.1% tetracycline)은 측정 30분에서 48시간까지 서방형 유리(sustained release)의 약물용출 거동을 나타내었다(Figure 4). 광 조사기(550 nm)를 이용한 1분간 광 조사 후에 유리된 항균약물(PLA/0.1% tetracycline)의 용출량을 광 조사 30분 및 60분 뒤에 측정한 결과, 광 조사를 하지 않은 대조군에 비하여 광 조사를 한 실험군에서 유의성 있게 증가되는 것이 확인되었다(P<0.05, Figure 5).
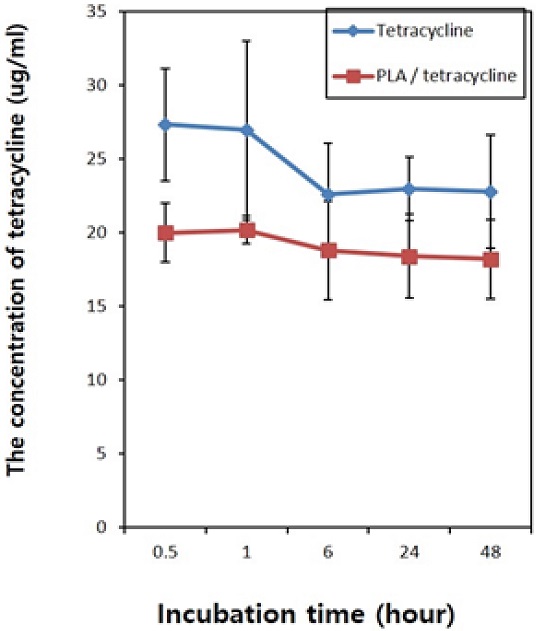
The release amounts of antibacterial drug as a function of incubation time in Tetracycline mixed with or without PLA. The control group with tetracycline shows only an initial burst of drug release in the incubation period. However, experimental groups with PLA show sustained release of drugs as a function of incubation time.
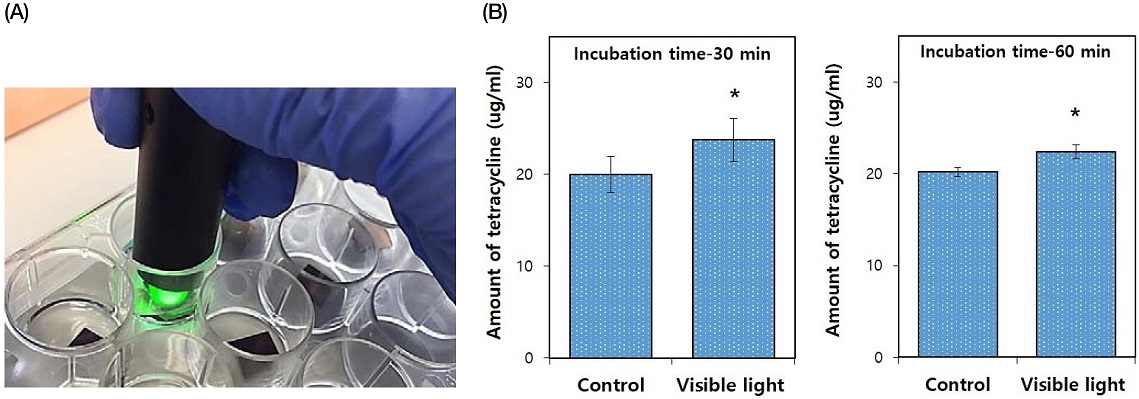
Photograph of visible light irradiation on PLA / tetracycline coated GNPs-TiO2 nanotubes (Au 5 min, A) and drug released concentration of PLA/tetracycline coated GNPs-TiO2 nanotubes (Au 5 min) with or without visible light irradiation (B). All data were expressed as means ± standard deviations. *significance between groups (P<0.05).
4. 항균효과
광 조사기를 이용한 S. mutans 균의 항균시험(agar diffusion test) 결과, 광 조사를 하지 않은 항균약물 담지 대조군에 비해 광 조사한 항균약물 담지 실험군에서 유의성 있는 항균능을 나타내었다(P<0.05, Figure 6).
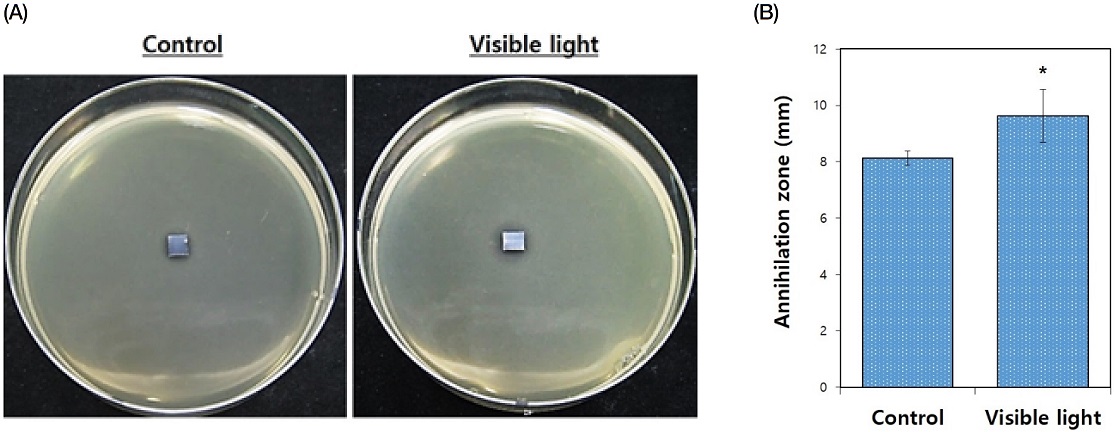
Photographs of antibacterial agar diffusion tests using Streptococcus mutans (A) and results of zone diameter analysis for dead Streptococcus mutans in the presence of PLA/tetracycline coated GNPs-TiO2 nanotubes (Au 5 min) without or with visible light irradiation (B). All data were expressed as means ± standard deviations. *Significance between groups (P<0.05).
고 찰
금속 나노입자의 티타니아 표면 코팅에 의해서 자외선 조사에서만 발현되는 티타니아 광촉매 효과가 가시광선 조사에 의해서도 발현되는 플라즈모닉 광촉매 효과는 나노입자의 형태와 크기에 따라 크게 달라지기 때문에 나노입자의 응용은 형태와 크기 제어가 요구된다(8, 23). 이에 티타늄 소재 임플란트 표면에 국소적 표면 플라즈몬 공명 특성을 나타내는 크기와 형태 제어가 가능한 임플란트 소재의 표면처리기술을 목적으로 본 연구에서는 균일한 티타니아 나노튜브를 제작한 후 표면에 플라즈몬 재료로 금을 선택하였다.
확산 반사 자외선-가시광선-근적외선 스펙트럼 분석을 통하여 진공 열처리된 금 나노입자-티타니아 나노튜브는 400에서 650 nm의 가시광선 파장영역에서 진공 열처리하지 않은 이전 연구의 결과보다 더 강한 광흡수도를 나타내는 것을 확인할 수 있었다. 전계방출 주사전자현미경 관찰을 통하여 금 코팅 시간이 증가할수록 입자의 크기와 종횡비가 다소 증가하는 것이 확인되었고, 진공 열처리 과정을 통하여 입자의 균질한 구형화가 진행된 것이 관찰되었다. 또한, 진공 열처리된 시편에서는 근적외선 영역의 광흡수가 관찰되지 않았는데, 이는 플라즈마 코팅 기반의 수직적 적층에 따른 봉형의 금 나노입자가 진공 열처리 과정을 통하여 구형화 됨으로써 봉형의 금 나노입자의 장축에서 발생되는 근적외선 영역의 광흡수가 소멸된 것으로 사료된다(24). 일반적으로 구형의 금 나노입자는 수십에서 100 nm까지 다양한 크기에 대해 약 528 nm의 공명을 갖는 것으로 알려져 있고(25), 길쭉한 막대 모양인 금 나노로드는 광학적 특성이 크게 변할 수 있다고 보고되었다(26-28). 따라서, 진공 열처리 과정이 플라즈마 코팅된 봉형의 금 나노입자를 균질한 구형입자로 바꿔줌으로써 가시광선 영역에서의 광흡수를 좀 더 극대화하고, 이에 따라 가시광선 플라즈모닉 광촉매 효과를 좀 더 향상시킬 것으로 판단된다. 또한, 진공 열처리 조건 변화에 따른 금 나노입자의 크기와 밀도의 최적화에 대한 추가적인 연구가 필요 하다고 사료된다.
항균성 물질이 함유된 임플란트는 약물의 지속성이 제한적이므로 반영구적 항균성 임플란트 개발이 필요하다. 그러므로 초기 약물의 대량 용출을 제어할 수 있는 항균성 임플란트 표면에 코팅 할 매개체로 본 연구에서는 생분해성 고분자 물질 중 하나인 폴리락트산(PLA)를 선택하였고(29), 항생제로는 테트라사이클린을 이용하여 서방형 유리를 발현하기 위하여 폴리락트산과 테트라사이클린을 함께 혼합한 항균 약물 복합체(PLA/0.1% tetracycline)를 금 나노입자-티타니아 나노튜브 표면에 코팅하였다. 세포독성평가를 통하여 본 연구에서 제작한 항균약물 담지 시편의 세포독성은 발견되지 않아 생체적합성이 우수한 것으로 확인되었다. 시편의 담지시간 변화에 따른 약물 용출량 측정 결과, 0.1% 테트라사이클린만 담지시킨 대조군은 1시간 이내에 대량 용출되는 거동을 나타내었고, 항균 약물 복합체(PLA/0.1% tetracycline)를 담지한 실험군에서는 48시간까지 본 연구에서 계획했던 대로 서방형의 약물 용출 거동을 나타내었다. 또한, 광 조사기 조사 전과 후의 약물 용출량 측정 결과, 광 조사를 하지 않은 항균약물 담지 대조군에 비하여 광 조사한 항균약물 담지 실험군에서 약물 용출량이 유의성 있게 증가되었다(P<0.05). 따라서, 본 연구에서 제조되어 시편 표면에 코팅된 항균약물 복합체는 나노튜브 내부에 잘 담지되어 초기 대량 방출을 방지할 수 있었고, 가시광 조사에 의한 광 원격제어 약물 용출 기능을 가지고 있음을 알 수 있었다.
광 조사 전과 후의 S. mutans 균의 항균시험(agar diffusion test) 결과, 광 조사를 하지 않은 항균약물이 코팅된 대조군에 비해 광 조사한 항균약물이 코팅된 실험군에서 유의성 있는 항균능을 나타내었다(P<0.05). 이러한 결과를 바탕으로 가시광 조사에 의한 금 나노입자와 티타니아 나노튜브 간에 형성되는 플라즈모닉 광촉매 효과에 의한 원격제어 약물용출이 잘 이루어지고 있음을 확인할 수 있었다. Li 등은 티타늄 임플란트 표면에 코팅된 플라즈몬 나노입자의 국소적 표면 플라즈몬 공명이 세균의 호흡과 전자 이동의 방해를 초래하여 세균이 사멸된다고 보고하였는데(30), 광 원격제어 항균약물 용출에 따른 세균 사멸과 플라즈모닉 광촉매 효과에 의한 세균 사멸에 대한 시너지 작용에 대한 연구가 추가적으로 더 필요하다고 사료된다.
결 론
티타니아 나노튜브 표면에 진공 열처리과정을 통하여 구형화 된 금 나노입자는 근 적외선 광 파장대가 아닌 가시광선 영역에서 광조사에 의한 원격제어 약물 용출 기능 및 항균 활성 효과가 우수한 플라즈모닉 광촉매 효과를 발현할 수 있는 항균성 임플란트 재료의 표면처리기술로서 가능성이 있다고 사료된다.
Acknowledgments
이 논문은 2020학년도 원광대학교의 교비지원에 의해 수행됨.
References
-
Zhang J, Xu Q, Feng Z, Li M, Li C. Importance of the relationship between surface phases and photocatalytic activity of TiO2. Angew Chem Int Ed Engl. 2008;47(9):1766-9.
[https://doi.org/10.1002/anie.200704788]

-
Zhou K, Zhu Y, Yang X, Jiang X, Li C. Preparation of graphene–TiO2 composites with enhanced photocatalytic activity. New J Chem. 2011;35(2):353-9.
[https://doi.org/10.1039/C0NJ00623H]

-
Cowan AJ, Durrant JR. Long-lived charge separated states in nanostructured semiconductor photoelectrodes for the production of solar fuels. Chem Soc Rev. 2012;42(6):2281-93.
[https://doi.org/10.1039/C2CS35305A]

-
Boccuzzi F, Chiorino A, Manzoli M. Au/TiO2 nanostructured catalyst: pressure and temperature effects on the FTIR spectra of CO adsorbed at 90 K. Surf Sci. 2002;10:513-8.
[https://doi.org/10.1016/S0039-6028(01)02000-3]

-
Konova P, Naydenov A, Venkov C, Mehandjiev D, Andreeva D, Tabakova T, et al. Activity and deactivation of Au/TiO2 catalyst in CO oxidation. J Mol Catal A. 2004;213(2):235-40.
[https://doi.org/10.1016/j.molcata.2003.12.021]

-
Stiehl JD, Kim TS, McClure SM, Mullins CB. Formation of molecularly chemisorbed oxygen on TiO2-supported gold nanoclusters and Au from exposure to an oxygen plasma jet. J Phys Chem B. 2005;109(13):6316-22.
[https://doi.org/10.1021/jp044553y]

-
Niu W and Xu G. Crystallographic control of noble metal nanocrystals. Nano Today. 2011;6(3):265-85.
[https://doi.org/10.1016/j.nantod.2011.04.006]

-
Andras S, Fudong L, Xiaojun C, Christopher MT, Hailiang W, Kwangjin A, et al. Comparing the catalytic oxidation of ethanol at the solid−gas and solid−liquid Interfaces over size-controlled Pt nanoparticles: Striking differences in kinetics and mechanism. Nano Lett. 2014;14(11):6727-30.
[https://doi.org/10.1021/nl5035545]

-
Zhang Z, Wang W, Gao E, Sun S, Zhang L. Photocatalysis coupled with thermal effect induced by SPR on Ag-loaded Bi2WO6 with enhanced photocatalytic activity. J Phys Chem C. 2012;116(49):25898-903.
[https://doi.org/10.1021/jp309719q]

-
Rayalu SS, Jose D, Mangrulkar PA, Joshi M, Hippargi G, Shrestha K, et al. Photodeposition of Aunps on metal oxides: Study of SPR effect and photocatalytic activity. Int J Hydrogen Energy. 2014;39(8):3617-24.
[https://doi.org/10.1016/j.ijhydene.2013.11.120]

- Cao G. Nanostructures and Nanomaterials: Synthesis; properties and applications. Imperical College Press. 2004;126(44):14679-80.
-
Sinani VA, Podsiadlo P, Lee J, Kotov NA, Kempa K. Gold nanoparticles with stable yellow-green luminescence. Int J Nanotechnol. 2007;4(3):239-51.
[https://doi.org/10.1504/IJNT.2007.013471]

-
Chen H, Cheng H, Lee J, Kim JH, Hyun MH, Koh K, et al. Surface plasmon resonance spectroscopic chiral discrimination using self-assembled leucine derivative monolayer. Talanta. 2008;76(1):49-53.
[https://doi.org/10.1016/j.talanta.2008.02.001]

-
Kelly KL, Coronado E, Zhao LL, Schatz GC. The optical properties of metal nanoparticles: The influence of size, shape, and dielectric environment. J Phys Chem B. 2003;107(3):668-77.
[https://doi.org/10.1021/jp026731y]

-
Kim DY, Li W, Ma Y, Yu T, Li ZY, Park OO, et al. Seed-mediated synthesis of gold octahedra in high purity and with well-controlled sizes and optical properties. Chem Eur J. 2011;17(17):4759-64.
[https://doi.org/10.1002/chem.201100365]

-
Nie M, Sun K, Meng DD. Formation of metal nanoparticles by short-distance sputter deposition in a reactive ion etching chamber. J Appl Phys. 2009;106(5):54314-24.
[https://doi.org/10.1063/1.3211326]

-
Sharma VK, Yngard RA, Lin Y. Silver nanoparticles: Green synthesis and their antimicrobial activities. Adv Colloid Interface Sci. 2009;145(1):83-96.
[https://doi.org/10.1016/j.cis.2008.09.002]

-
Staszek M, Siegel J, Polivkova M, Svorcik V. Influence of temperature on silver nanoparticle size prepared by sputtering into PVP-glycerol system. Mater Lett. 2017;186(1):341-4.
[https://doi.org/10.1016/j.matlet.2016.10.036]

-
Borges J, Pereira RMS, Rodrigues MS, Kubart T, Kumar S, Leifer K, et al. Broadband optical absorption caused by the plasmonic response of coalesced Au nanoparticles embedded in a TiO2 matrix. J Phys Chem C. 2016;120:16931-45.
[https://doi.org/10.1021/acs.jpcc.6b03684]

-
Koneti S, Borges J, Roiban L, Rodrigues MS, Martin N, Epicier T, et al. Electron tomography of plasmonic Au nanoparticles dispersed in a TiO2 dielectric matrix. ACS Appl Mater Interfaces. 2018;10(49):42882-90.
[https://doi.org/10.1021/acsami.8b16436]

-
Kim H, Choi C, Khamwannah J, Noh SY, Zhang Y, Seong TY, et al. Plasmonic Au nanoparticles on 8 nm TiO2 nanotubes for enhanced photocatalytic water splitting. J Renew Sustain Energy. 2013;5:053104:1-10.
[https://doi.org/10.1063/1.4821177]

-
Moon KS, Jeoung CG, Bae JM, Oh S. In vivo evaluation of infrared LASER mediated drug release of PLA-tetracycline complexes coated gold nanoparticle-titania nanotubes with mouse. Korean J Dent Mater. 2017;44(1):33-41.
[https://doi.org/10.14815/kjdm.2017.44.1.033]

-
Moon KS, Bae JM, Oh S. Diffuse reflection characterization and visible light mediated antibacterial effect of Pt-TiO2 nanotubes. Korean J Dent Mater. 2020;47(2):93-104.
[https://doi.org/10.14815/kjdm.2020.47.2.93]

-
Moon KS, Bae JM, Jin S, Oh S. Infrared-mediated drug elution activity of gold nanorod-grafted TiO2 nanotubes. J Nanomater. 2014;750813:1-8.
[https://doi.org/10.1155/2014/750813]

-
Link S, El-Sayed MA. Spectral properties and relaxation dynamics of surface plasmon electronic oscillations in gold and silver nanodots and nanorods. J Phys Chem B. 1999;103(40):8410-26.
[https://doi.org/10.1021/jp9917648]

-
Link S, El-Sayed MA. Shape and size dependence of radiative, non-radiative and photothermal properties of gold nanocrystals. Int Rev Phys Chem. 2000;19(3):409-53.
[https://doi.org/10.1080/01442350050034180]

- Bohren CF, Huffman DR. Absorption and Scattering of Light by Small Particles; John Wiley: New York, 1983.
-
Sonnichsen C, Franzl T, Wilk T, von Plessen G, Feldmann J, Wilson O, et al. Drastic reduction of plasmon damping in gold nanorods. Phys Rev Lett. 2002;88(7):077402:1-4.
[https://doi.org/10.1103/PhysRevLett.88.077402]

- Khang G, Lee HB. Methods of Tissue Engineering A. Atala and R. Lanza, Editors, Academic Press, San-Diego, California, Chap. 2001;67:771-2.
-
Li J, Zhou H, Qian S, Liu Z, Feng J, Jin P, et al. Plasmonic gold nanoparticles modified titania nanotubes for antibacterial application. Appl Phys Lett. 2014;104(26):261110-5.
[https://doi.org/10.1063/1.4885401]