치주 조직 재생을 위한 3D 프린터로 제작된 흡수성 차폐막의 물리적 및 생분해성 특성
 ; Kyoung-Jin Seo1, 2, †
; Kyoung-Jin Seo1, 2, † ; Youn Wook Chun3
; Youn Wook Chun3 ; Seung Won Lee3
; Seung Won Lee3 ; Sung Min You3
; Sung Min You3 ; Bum-Soon Lim4
; Bum-Soon Lim4 ; Jae-Sung Kwon1, 2, *
; Jae-Sung Kwon1, 2, *
초록
본 연구의 목적은 치주 조직의 유도 재생에 사용되는 3D 프린터로 제작된 흡수성 차폐막의 물리적 및 생분해성 특성을 비교하는 것이었다. 세 가지 유형의 3D 프린터로 제작된 흡수성 차폐막(β-TCP가 함유되지 않은 제품 2종과 β-TCP가 함유된 제품 1종)이 고려되었다. 3D 프린터로 제작된 흡수성 차폐막의 형태와 성분 구성은 EDS (energy-dispersive X-ray spectroscopy)와 함께 주사 전자 현미경(FE-SEM)으로 분석되었다. 기공도 및 기공 크기는 Micro-CT를 사용하여 측정하였다. 또한 인장 강도, 생분해성 시험이 수행되었다. 통계적 분석은 인장 강도에서 일원배치분산분석(one-way ANOVA)을 시행하였고, 사후분석으로 Tukey’s test를 시행하였다(p<0.05). EDS 분석을 통한 SEM 이미지의 결과는 모든 그룹에서 C, O가 존재하는 격자 구조의 선형 층을 보여주었다. 일부 그룹에서는 Ca, P에서 약간의 차이가 있었다. 인장 강도는 모든 그룹에서 유의한 차이를 보였으며(p<0.05), 생분해성은 β-TCP를 함유한 그룹이 가장 빠른 분해율을 보였다. 따라서, 본 연구의 결과는 3D 프린터로 제작된 흡수성 차폐막이 임상 사용을 위한 다양한 물리적 및 생분해성 성질을 가지고 있으며, 이러한 정보는 관련 제품의 향후 개발 및 제품의 임상 적용을 위해 고려되는 사항으로 유용할 것이라고 사료된다.
Abstract
The purpose of this study was to compare physical and biodegradable properties of 3D printed resorbable membranes that are used for guided tissue regenerations in periodontal tissues. Three types of 3D printed membranes (two types of non β-TCP and one type of β-TCP) were considered. The form and element compositions of 3D printed membranes were analyzed by field-emission scanning electron microscopy (FE-SEM) with energy-dispersive X-ray spectroscopy (EDS). Porosity and pore size were measured using Micro-CT. Also, tensile strength, biodegradability tests were performed. Statistical analyses were carried in tensile strength and cell viability test (p<0.05). The result of SEM images with EDS analyses showed linear layers of lattice structure with presence of C and O in all groups. There was a slight difference in Ca and P among some groups. Tensile strength was significantly different among all groups (p<0.05), and biodegradability showed that the group containing β-TCP resulted in the fastest degradation rate. Therefore, the results of this study concluded that the 3D printed resorbable membrane has variable physical and biodegradable properties for clinical use, where such information would be useful to be considered for the future development of related products and clinical application of the products.
Keywords:
3D Printing, Membrane, Guided tissue regeneration, Tensile strength, Degradation키워드:
3D 프린팅, 차폐막, 치주 조직 재생, 인장 강도, 생분해성서 론
1950년대에 Hurley와 Basset에 의해 처음 설명된 조직유도재생술(Guided Tissue Regeneration; GTR)은 손상된 치주조직의 구조와 기능을 재건하기 위한 효율적인 방법으로, 지난 수십 년 동안 개발되었으며 현재 점점 더 많은 관심을 받고 있다(1-3). GTR 차폐막의 종류는 일반적으로 흡수성과 비흡수성, 2가지로 분류된다. 비흡수성 차폐막은 생체 내에서 흡수가 되지 않아 차폐막의 제거를 위한 2차 수술을 시행해야 하며, 이때 차폐막이 조기에 노출되면 조직 감염과 골손실을 초래할 수 있다는 단점이 있다(4-7). 이러한 이유로 현재에는 흡수성 차폐막이 가장 일반적으로 사용되고 있다.
흡수성 차폐막의 주요 소재로는 교원질, polylactic acid (PLA), polyglycolic acid (PGA) 등이 있다(8-11). PLA는 가수분해 되면서 젖산(lactic acid)이 방출되어 체내에 잔존하게 되고 주변 환경을 산성으로 만드는 단점이 있다. 이러한 단점을 보완하기 위해 polycaprolactone (PCL)의 사용이 고려되어 왔고, 임상에서 사용되기 시작하였다(12-14). PCL은 가수분해의 과정과 citric acid cycle 대사과정을 통해 CO2와 H2O로 최종 분해되어, 삽입 후 2년 이내에 생분해 되고 이식부위에 잔여물이 남아있지 않게 된다. 이는 뼈가 재생되는 5~6개월 동안 유지가 가능하여 차폐막 사용에 적합하다고 알려져 있다. 또한, PLA보다 긴 생분해 시간을 감소시켜 주기 위해 β-TCP을 함유하여 제작하기도 하며 이를 통해 생체 활성이 증가한다는 연구가 보고되고 있다(15-17).
차폐막은 대부분 수작업 방법을 통해 제작되어 왔다. 이러한 제작 공정은 과정이 복잡하고 제작 시간이 오래 걸리며, 기공의 크기를 조절하지 못한다는 단점을 가지고 있다(18). 이러한 단점을 해결하기 위해 3D 프린팅 방식이 도입되어, FDM (Fused Deposition Modeling), DLP (Digital Light Processing), SLA (Stereo-Lithography Apparatus), LOM (Laminated Object Manufacturing) 및 SLS (Selective Laser Sintering) 방식 등이 사용되었다(19-22). 이 중, FDM 방식은 다양한 생분해성 원재료를 사용하여 환자 개개인의 이식부위에 적합한 크기나 형상 제작이 용이하며, 기공의 크기가 균일하고 조절이 가능하다는 장점을 가지고 있어 일반적으로 가장 많이 사용되고 있다(23-25). 균일한 기공의 크기는 분해 속도를 균일하게 하고, 다공성 구조의 얇은 막 형태는 주변 조직으로부터의 영양공급이 가능하게 한다고 보고되어 왔다(19, 26, 27). 이러한 이유로 3D 프린터로 제작된 맞춤형 차폐막이 증가되고 있는 추세이지만, 3D 프린터로 제작된 흡수성 차폐막의 물리적 및 생물학적 특성에 대해 연구한 논문은 부족한 실정이다.
따라서 본 연구의 목적은 현재 국내에서 시판되고 있는 FDM 방식의 3D 프린터로 제작된 PCL 혹은 β-TCP가 함유된 PCL 재질의 흡수성 차폐막 제품의 표면 형상 및 성분, 기공도, 인장강도, 생분해성을 평가함으로써 이를 기반으로 3D 프린터로 제작된 흡수성 차폐막의 물리적 및 생분해성 특성을 파악하고자 한다.
재료 및 방법
1. 연구 재료
본 연구에서는 최근까지 국내에서 시판되고 있는 3D 프린터로 제작된 흡수성 차폐막 3종을 선택하여 시험하였다(Table 1). 3종의 제품 모두 PCL로 구성되었으며, β-TCP가 함유되지 않은 제품 2종과 β-TCP가 함유된 제품 1종을 사용하였다.
2. 표면 및 성분 평가
표면 및 성분 평가를 위한 시편은 10 × 10 mm의 크기로 절단하여 준비하였다. 시편 단면을 Pt 코팅 처리하고 Scanning Electron Microscope (FE-SEM, JSM-7100F, JEOL Ltd., Tokyo, Japan)를 이용하여 시편의 표면을 관찰하였고 EDS를 이용하여 성분을 분석하였다. SEM의 경우, 15 kV에서 60배율로 관찰하였다.
3. 기공도 및 기공 크기 평가
그룹에 따른 기공도 및 기공 크기를 평가하기 위해 micro-CT (SKYSCAN 1076, Bruker, Billerica, MA, USA)를 이용하여 각 시편을 측정하였고, 시편은 10 × 10 mm의 크기로 절단하여 시험하였다. 시편은 높이와 너비가 스캔 평면에 평행하도록 배치되었다. 분해능은 18 µm로 설정되었고 0.5 mm 알루미늄 필터, 0.5°회전 단계, 360°회전 각도와 함께 측정되었다.
4. 인장강도
인장강도는 ASTM D 624를 참고하여 수행되었다. 각 시편들은 ±0.01 mm의 정밀도를 가진 측정기로 두께를 측정하고, Figure 1과 같이 바지 모양으로 잘라 준비하였다. 준비된 시편들은 각 그룹당 3개씩 만능 재료 시험기(Instron 5942, Instron, Norwood, MA, USA) 장비를 사용하여 인장강도를 측정하였다. 시편을 지그에 고정시키고 50 mm/min의 속도로 인장력을 가하여 최대 인장력(N)을 기록하였다. 인장강도의 값(Ts, MPa)은 다음의 공식 [1]으로 계산하여 측정하였다.
| [1] |
여기에서, F 는 인장력을 가함에 따라 기록된 최대 강도(N), d는 시편의 두께(mm)를 나타낸다.
5. 생분해성
생분해성 평가는 ISO 13781에 따라 시행하였다.
일반분해 실험을 위해 각 그룹당 시편 3개를 준비하였다. 각 질량을 0.1 mg 단위까지 측정하고 pH 7.4의 phosphate-buffered saline (PBS)에 넣어 (37±1) ℃의 항온수조에서 보관하였다. 이 때, PBS의 부피는 시편 부피의 최소 20배가 넘게 맞춰주었다. 30일 동안 보관하였고, 7일 간격으로 꺼내어 진공 상태에서 건조 시킨 후, 시편의 질량 감소량을 0.1 mg 단위로 측정하여 기록하였다.
가속분해 실험을 위해 각 그룹당 시편 3개를 준비하였다. 각 질량을 0.1 mg 단위까지 측정하고 5 mol/L 농도의 수산화나트륨용액에 넣어 (37±1) ℃의 항온수조에서 보관하였다. 이 때, 5 mol/L 농도의 수산화나트륨용액의 부피는 시편 부피의 최소 20배가 넘게 맞춰주었다. 30일 동안 보관하였고, 7일 간격으로 꺼내어 진공 상태에서 건조시킨 후, 시편의 질량 감소량을 0.1 mg 단위로 측정하여 기록하였다.
6. 통계분석
통계분석은 SPSS 프로그램(IBM SPSS Statistics 25.0, IBM Co., Armonk, NY, USA)을 이용하였다. 3D 프린터로 제작된 흡수성 차폐막의 인장강도를 비교하기 위해 일원배치분산분석(one-way ANOVA)을 시행하였고, 사후분석으로 Tukey’s test를 시행하였다. 이때, 통계적 유의 수준은 0.05로 설정하였다.
결 과
1. 표면 및 성분
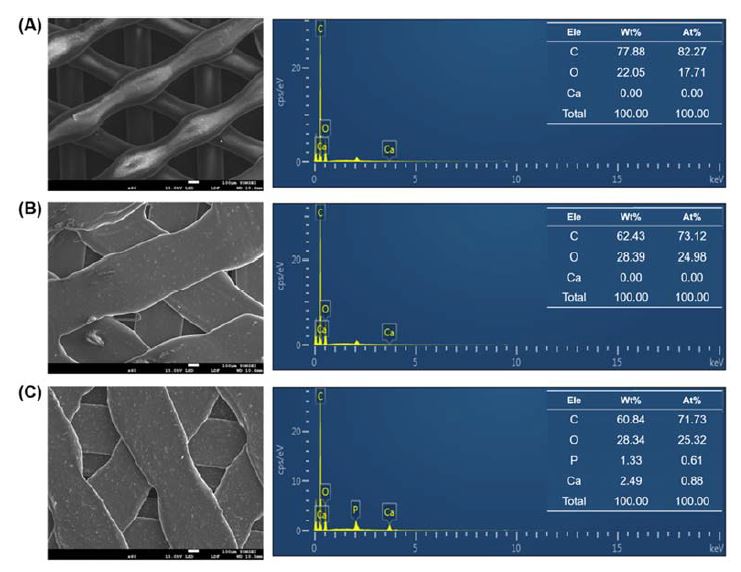
Figure 2는 SEM을 사용하여 PCL40, PCL30, PCL30@β-TCP 시편을 관찰한 사진과 EDS로 분석한 성분을 나타낸 그래프이다. SEM 이미지의 결과, 모든 그룹에서 격자구조로 선형의 층이 관찰되었다. PCL40은 좁고 둥근 입체적인 형태를, PCL30과 PCL30@β-TCP은 넓고 납작한 형태를 나타내어 그룹 간에 차이가 있음을 확인하였다. 또한 PCL30@β-TCP은 선형의 층 안에서 작은 입자 형태가 전체적으로 관찰되었고, 이는 β-TCP가 함유되었음을 알 수 있었다.
EDS 분석의 경우, 각 시편에서 적층 형태가 무너지지 않고 균일한 부분을 선택하여 분석하였다. PCL40은 상대적으로 탄소(C)와 산소(O)의 함유량이 높게 나타났다. PCL30은 PCL40과 마찬가지로 탄소(C)와 산소(O)를 함유하고 있음을 확인하였다. 마지막으로 PCL30@β-TCP은 PCL30과 동일한 원소를 가지고 있으며 추가적으로 인(P)과 칼슘(Ca)을 함유하고 있는 것을 확인할 수 있었다.
2. 기공도 및 기공 크기
Micro-CT로 측정된 3D 프린터로 제작된 흡수성 차폐막의 기공도 및 기공 크기 결과는 Table 2와 Figure 3에 나와있다. PCL40, PCL30, PCL30@β-TCP의 기공도는 각각 88.17%, 80.42%, 79.61%로 PCL40이 가장 높은 기공도를 나타낸 것을 확인할 수 있었다. 기공의 크기는 PCL30이 519.63 µm로 가장 큰 값을 나타냈고, PCL30@β-TCP이 508.78 µm로 가장 작은 값을 나타내었다.
3. 인장강도
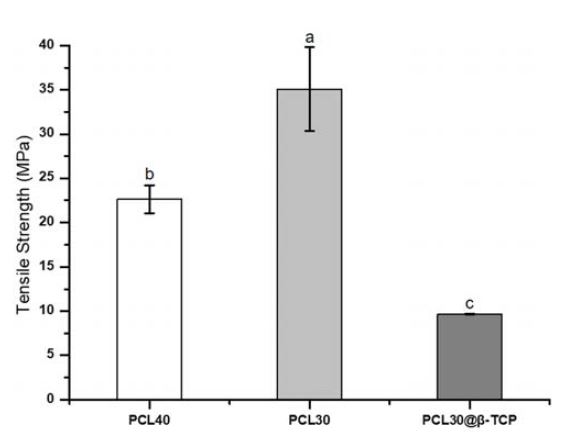
3D 프린터로 제작된 흡수성 차폐막의 인장강도 결과는 Figure 4에서 볼 수 있듯이, PCL30이 (35.08±4.76) MPa로 가장 높은 값을 보였다. PCL40은 (22.64±1.58) MPa이었고 PCL30@β-TCP은 (9.69±0.04) MPa로 그 뒤를 이었으며, 각 그룹 간에 유의한 차이가 있었다(p<0.05).
4. 생분해성
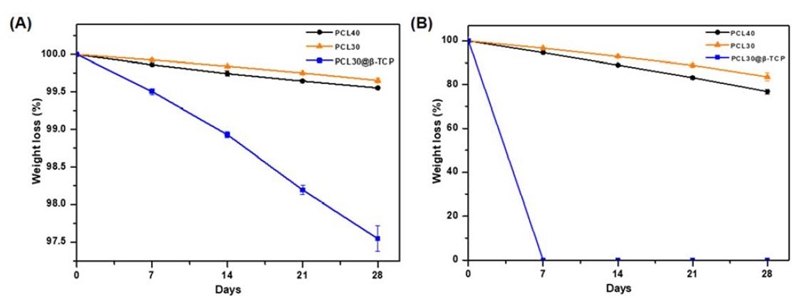
PCL40, PCL30, PCL30@β-TCP의 일반적인 분해능(degradation rate)을 실험하기 위하여 37 ℃의 PBS에 침지하여 4주 동안 무게의 감소량을 측정하였다. 실험 결과 Figure 5A에서 보는 것처럼 PCL40, PCL30, PCL30@β-TCP시편 모두 4주동안 무게가 감소하였지만 PCL40과 PCL30은 비교적 적은 무게 손실이 일어난 반면(약 0.05%) PCL30@β-TCP은 약 2.5%의 무게 손실이 일어난 것이 확인되었다. 또한, PCL40, PCL30, PCL30@β-TCP의 가속분해 분해능(degradation rate)을 실험하기 위하여 37 ℃의 5 mol/L 농도의 수산화나트륨용액에 침지하여 시편의 무게 감소량을 측정하였을 때에도 PCL40과 PCL30은 20% 이하의 무게 손실이 일어났지만, PCL30@β-TCP는 1주일(7일) 뒤 모든 시편이 분해되어 시편의 형태가 없었다(Figure 5B).
고 찰
이상적인 차폐막은 구강 내에서 골형성 기간 동안 유지되어야 할 뿐만 아니라 주변 연조직 세포가 골 결손부로 들어오는 것을 차단하여야 하므로, 공간 유지, 생체적합성 등 적절한 물리적 및 생물학적 특성을 가져야 한다(28). 이는 맞춤형으로 3D 프린팅되어 체어 타임을 단축시킬 수 있는 다양한 형태의 차폐막에도 적용되며, 본 연구에서는 3가지 다른 형태의 치주 조직 재생을 위한 3D 프린터로 제작된 흡수성 차폐막의 물리적 및 생분해성 특성을 고려하였다.
본 연구에서 사용된 3가지 다른 형태의 3D 프린터로 제작된 흡수성 차폐막의 경우 제조사와 성분에 따라 그 성상이 다르다는 것을 SEM을 통해 확인하였다(Figure 2). 이는 3D 프린팅에 사용되는 원재료의 지름 및 녹는점, 그리고 사용되는 프린터의 특성에 따라 다를 것으로 사료된다. 특히 원재료의 특성에 있어 β-TCP가 함유된 시편인 PCL30@β-TCP의 경우 EDS에서 Ca와 P가 존재함을 확인하여 해당 성분으로 구성된 β-TCP의 존재를 확인하였다(Figure 2).
3D 프린팅으로 제작되는 차폐막의 경우 기공도와 기공의 크기를 조절할 수 있으며 이는 연조직의 성장 억제와 경조직의 재생 등에 관여한다고 알려져 있다. 연구 결과에 따라 기공도는 크게 차이가 없었지만 위와 마찬가지로 제조사와 성분에 따라 그 차이가 확인되었다(Table 2, Figure 3). 또한, 기공의 크기는 시편에 따라 508.78 µm에서 519.63 µm로 기존 연구의 결과로 볼 때 다공성 및 압축 강도는 유지되고 세포 침투 및 영양 공급을 용이하게 하는 적절한 기공 공간으로 예측된다(29-31).
이러한 기공의 특성은 차폐막의 기계적 성질에 영향을 준다고 알려져 있다. 실제로 기공의 크기가 가장 큰 PCL30에서 가장 큰 인장강도가 측정되었고 기공의 크기가 가장 작은 PCL30@β-TCP에서 가장 작은 인장강도가 측정되었다(Figure 4). 또한, PCL30@β-TCP의 인장강도가 낮은 것은 열을 이용하여 고체로 제작하는 고분자에 반해 세라믹 재료인 β-TCP 파우더가 첨가된 고분자의 경우 원재료에 열을 가하는 3D 프린팅 과정 중 공극이 생겨 밀도가 감소하였기 때문에 기계적 강도가 떨어진 것이라고 판단된다(32). 이는 기존 연구의 β-TCP 함유량에 따른 PCL의 기계적 특성 연구 결과와 동일한 경향성이었음을 알 수 있다(33).
흡수성 차폐막은 최소 4주 동안 뼈와 조직의 구조와 기능을 복원하고 구조를 유지할 수 있어야 하며 기존 연구에 따르면 일반적으로 상용화되고 있는 흡수성 차폐막의 인장강도는 3.5 MPa에서 22.5 MPa 범위를 갖고 있다고 알려져 있다(5). 본 연구에 사용된 3D 프린터로 제작된 흡수성 차폐막의 기계적 강도를 보기 위해 실험한 인장강도 값은 (9.69±0.04) MPa에서 (35.08±4.76) MPa로 임상에서 사용이 적절할 것으로 사료된다.
PCL (polycaprolactone)은 지난 30년 동안 의료 분야에서 가장 널리 사용되어온 재료로 가수분해의 과정과 citric acid cycle 대사과정을 통해 분해되며 분해 속도가 비교적 느리다고 알려져 있다(19). PCL이 완전히 분해되기까지는 약 2년이 소요되는 것으로 알려져 있으며, 가속분해 실험을 통해 단기간의 분해 정도와 분해 속도를 평가하고 있다. 따라서 본 연구에서는 인산완충용액을 사용한 일반분해와, 수산화나트륨용액을 사용한 가속분해 모두를 진행하였다. 실제로 본 연구에서 PCL로 구성된 PCL40 및 PCL30 시편의 경우 일반 및 가속 노화 모두에서 분해 속도가 느림을 확인할 수 있었다. 또한 이러한 PCL의 분해 속도를 높이고 생체 활성을 향상시키기 위해 β-TCP가 첨가된 생분해성 소재와 다양한 형태의 β-TCP가 연구되었다(34-36). 본 연구에서 5 mol/L 농도의 수산화나트륨용액을 사용하여 β-TCP가 함유된 생분해성 차폐막의 가속분해를 실험한 결과 β-TCP를 함유하지 않은 시편에 비해 β-TCP를 함유한 시편이 빠르게 생분해 되었고 7일만에 완전 분해되었다.
결 론
3D 프린터로 제작된 흡수성 차폐막은 제조사와 사용된 원재료의 특성에 따라 성상, 기공 크기 및 기공도가 다름을 확인하였고 이에 따라 인장 강도와 생분해성 속도가 다름을 확인하였다. 이에 3D 프린터로 제작된 흡수성 차폐막의 임상적 사용에서 제품의 물리적 및 생분해성 성질이 고려되어야 한다.
Acknowledgments
본 연구는 2020년도 식품의약품안전처의 연구개발비(20172MFDS364)로 수행되었으며 이에 감사드립니다.
References
-
Hurley LA, Stinchfield FE, Bassett AL, Lyon WH. The role of soft tissues in osteogenesis. An experimental study of canine spine fusions. J Bone Joint Surg Am. 1959;41:1243-54.
[https://doi.org/10.2106/00004623-195941070-00007]

-
Tayebi L, Rasoulianboroujeni M, Moharamzadeh K, Almela TKD, Cui Z, Ye H. 3D-printed membrane for guided tissue regeneration. Mater Sci Eng C Mater Biol Appl. 2018;84:148-58.
[https://doi.org/10.1016/j.msec.2017.11.027]

-
Song C, Li S, Zhang J, Xi Z, Lu E, Zhao L, Cen L. Controllable fabrication of porous PLGA/PCL bilayer membrane for GTR using supercritical carbon dioxide foaming. Appl Surf Sci. 2019;472:82-92.
[https://doi.org/10.1016/j.apsusc.2018.04.059]

-
Hur YS, Kwon YH, Lee MS, Park JB, Herr Y. Clinical comparison of resorbable and nonresorbable Barrier in guided tissue regeneration of human intrabony defects. J Korean Acad Periodontol. 1999;29(1):193-207.
[https://doi.org/10.5051/jkape.1999.29.1.193]

-
Zhang HY, Jiang HB, Ryu JH, Kang HJ, Kim KM, Kwon JS. Comparing properties of variable pore-sized 3D-printed PLA membrane with conventional PLA membrane for guided bone/tissue regeneration. Materials (Basel). 2019;12(10):1718.
[https://doi.org/10.3390/ma12101718]

-
Gentile P, Chiono V, Tonda-Turo C, Ferreira AM, Ciardelli G. Polymeric membranes for guided bone regeneration. Biotechnol J. 2011;6(10):1187-97.
[https://doi.org/10.1002/biot.201100294]

-
Jang JW, Kim J, Kook MS, Lee KY. Evaluation of gellan gum/glycol chitosan bioabsorbable membrane for guided bone regeneration. Polymer-Korea. 2018;42(5):874-81.
[https://doi.org/10.7317/pk.2018.42.5.874]

-
Lim SC, Kwon YH, Lee MS, Park JB. The effects of bone morphogenetic protein-4 and resorbable membrane on the regeneration of periodontal tissues. J Korean Acad Periodontol. 2000;30(4):757-77.
[https://doi.org/10.5051/jkape.2000.30.4.757]

-
Ryu HC, Kwon YH, Park JB, Herr Y. Histologic study on tissue response of various resorbable membranes in rats. J Korean Acad Periodontol. 2002;31(1):91-109.
[https://doi.org/10.5051/jkape.2001.31.1.91]

-
Abe GL, Sasaki JI, Katata C, Kohno T, Tsuboi R, Kitagawa H, Imazato S. Fabrication of novel poly(lactic acid/caprolactone) bilayer membrane for GBR application. Dent Mater. 2020;36(5):626-34.
[https://doi.org/10.1016/j.dental.2020.03.013]

-
Dos Santos VI, Merlini C, Aragones Á, Cesca K, Fredel MC. In vitro evaluation of bilayer membranes of PLGA/hydroxyapatite/β-tricalcium phosphate for guided bone regeneration. Mater Sci Eng C Mater Biol Appl. 2020;112:110849.
[https://doi.org/10.1016/j.msec.2020.110849]

-
Garlotta D. A literature review of poly (lactic acid). J Polym Environ. 2001;9(2):63–84.
[https://doi.org/10.1023/A:1020200822435]

-
Madhavan Nampoothiri K, Nair NR, John RP. An overview of the recent developments in polylactide (PLA) research. Bioresour Technol. 2010;101(22):8493-501.
[https://doi.org/10.1016/j.biortech.2010.05.092]

-
Amorim PA, d’Avila MA, Anand R, Moldenaers P, Puyvelde PV, Bloemen V. Insights on shear rheology of inks for extrusion-based 3D bioprinting. Bioprint. 2021;22:e00129.
[https://doi.org/10.1016/j.bprint.2021.e00129]

-
Seyyed KH, Amir HB, Sadegh H, Arvin BS, Behnam A. 3D printed PCL scaffold reinforced with continuous biodegradable fiber yarn: A study on mechanical and cell viability properties. Polym Test. 2020;83:106347.
[https://doi.org/10.1016/j.polymertesting.2020.106347]

-
Ngiam M, Liao S, Patil AJ, Cheng Z, Chan CK, Ramakrishna S. The fabrication of nano-hydroxyapatite on PLGA and PLGA/collagen nanofibrous composite scaffolds and their effects in osteoblastic behavior for bone tissue engineering. Bone. 2009;45(1):4–16.
[https://doi.org/10.1016/j.bone.2009.03.674]

-
Arafat MT, Lam CXF, Ekaqutra AK, Wong SY, He C, Hutmacher DW, Li X, Gibson I. High performance additive manufactured scaffolds for bone tissue engineering application. Soft Matter. 2011;7:8013-22.
[https://doi.org/10.1039/c1sm05793f]

-
Kikuchi M, Koyama Y, Yamada T, Imamura Y, Okada T, Shirahama N, Akita K, Takakuda K, Tanaka J. Development of guided bone regeneration membrane composed of beta-tricalcium phosphate and poly (L-lactide-co-glycolide-co-epsilon-caprolactone) composites. Biomaterials. 2004;25(28):5979-86.
[https://doi.org/10.1016/j.biomaterials.2004.02.001]

-
Asa'ad F, Pagni G, Pilipchuk SP, Giannì AB, Giannobile WV, Rasperini G. 3D-printed scaffolds and biomaterials: Review of alveolar bone augmentation and periodontal regeneration applications. Int J Dent. 2016;1239842.
[https://doi.org/10.1155/2016/1239842]

-
Obregon F, Vaquette C, Ivanovski S, Hutmacher DW, Bertassoni LE. Three-dimensional bioprinting for regenerative dentistry and craniofacial tissue engineering. J Dent Res. 2015;94(9 Suppl):143S-52S.
[https://doi.org/10.1177/0022034515588885]

-
Chia HN, Wu BM. Recent advances in 3D printing of biomaterials. J Biol Eng. 2015;9(1):1-14.
[https://doi.org/10.1186/s13036-015-0001-4]

-
Jindal P, Juneja M, Bajaj D, Siena FL, Breedon P. Effects of post-curing conditions on mechanical properties of 3D printed clear dental aligners. Rapid Prototyp J. 2020;26(8):1337-44.
[https://doi.org/10.1108/RPJ-04-2019-0118]

-
Won JY, Park CY, Bae JH, Ahn G, Kim C, Lim DH, Cho DW, Yun WS, Shim JH, Huh JB. Evaluation of 3D printed PCL/PLGA/β-TCP versus collagen membranes for guided bone regeneration in a beagle implant model. Biomed Mater. 2016;11(5):055013.
[https://doi.org/10.1088/1748-6041/11/5/055013]

-
Gagan B, Desh BS, Harpreet SV, Abhinav D, Abhishek B. Microstructural characterization, applications and process study of various additive manufacturing process: A review. Mater Today. 2020;26(2):833-7.
[https://doi.org/10.1016/j.matpr.2020.01.048]

-
Maia-Pinto MOC, Brochado ACB, Teixeira BN, Sartoretto SC, Uzeda MJ, Alves ATNN, Alves GG, Calasans-Maia MD, Thire RMSM. Biomimetic mineralization on 3D printed PLA scaffolds: on the response of human primary osteoblasts spheroids and in vivo implantation. Polymers (Basel). 2021;13(1):74.
[https://doi.org/10.3390/polym13010074]

- Bartee BK, Carr JA. Evaluation of a high-density polytetrafluoroethylene (n-PTFE) membrane as a barrier material to facilitate guided bone regeneration in the rat mandible. J Oral Implantol. 1995;21(2):88-95.
-
Lee JY, Kim YK, Yun PY, Oh JS, Kim SG. Guided bone regeneration using two types of non-resorbable barrier membranes. J Korean Assoc Oral Maxillofac Surg. 2010;36(4):275-9.
[https://doi.org/10.5125/jkaoms.2010.36.4.275]

-
Dahlin C, Linde A, Gottlow J, Nyman S. Healing of bone defects by guided tissue regeneration. Plast Reconstr Surg. 1988;81(5):672-6.
[https://doi.org/10.1097/00006534-198805000-00004]

-
Li Y, Zhang Z. Sustained curcumin release from PLGA microspheres improves bone formation under diabetic conditions by inhibiting the reactive oxygen species production. Drug Des Devel Ther. 2018;12:1453–66.
[https://doi.org/10.2147/DDDT.S154334]

-
Murphy CM, Duffy GP, Schindeler A, O'brien FJ. Effect of collagen-glycosaminoglycan scaffold pore size on matrix mineralization and cellular behavior in different cell types. J Biomed Mater Res A. 2016;104(1):291–304.
[https://doi.org/10.1002/jbm.a.35567]

-
Li L, Li J, Guo J, Zhang H, Zhang X, Yin C, Wang L, Zhu Y, Yao Q. 3D Molecularly functionalized cell-free biomimetic scaffolds for osteochondral regeneration. Adv Funct Mater. 2019;29(6):1807356.
[https://doi.org/10.1002/adfm.201807356]

-
Ha SW, Kim JY. Fabrication of blended PCL/β-TCP scaffolds by mixture ratio of β-TCP using polymer deposition system. J Korean Soc Precis Eng. 2014;31(9):791-7.
[https://doi.org/10.7736/KSPE.2014.31.9.791]

-
Guarino V, Ambroiso L. The synergic effect of polylactide fiber and calcium phosphate particle reinforcement in poly ε-caprolactone-based composite scaffolds. Acta Biomater. 2008;4(6):1778-87.
[https://doi.org/10.1016/j.actbio.2008.05.013]

-
Yeo A, Rai B, Sju E, Cheong JJ, Teoh SH. The degradation profile of novel, bioresorbable PCL–TCP scaffolds: An in vitro and in vivo study. J Biomed Mater Res A. 2008;84(1):208-18.
[https://doi.org/10.1002/jbm.a.31454]

-
Bae JM, Shin SJ, Son JL, Oh S. Remineralization effect of experimental fluoride varnish with nano-sized hydroxyapatite and tricalcium phosphate. Korean J Dent Mater. 2020;47(3):131-41.
[https://doi.org/10.14815/kjdm.2020.47.3.131]

-
Son JL, Im S, Gim DH, Oh S, Bae JM. Sustained antibacterial effects of antibacterial agents against Streptococcus mutans applied on hydroxyapatite disc. Korean J Dent Mater. 2020;47(4):245-52.
[https://doi.org/10.14815/kjdm.2020.47.4.245]