순환석회화전처리에 의해 인산칼슘을 코팅한 Mg mesh의 골재생능 평가
 ; Seo-Young Kim1
; Seo-Young Kim1 ; Jeong-Hui Ji1
; Jeong-Hui Ji1 ; Yong-Seok Jang1
; Yong-Seok Jang1 ; Woo-Yong Jeon2
; Woo-Yong Jeon2 ; Min-Ho Lee1
; Min-Ho Lee1 ; Tae-Sung Bae1, *
; Tae-Sung Bae1, *
초록
본 연구는 생체환경에서 Mg 메쉬의 용해 억제 및 생체활성도 개선을 위해 시행되었다. 생체환경에서 Mg 메쉬의 용해를 억제하기 위해 40 wt% HF 수용액에 2시간 동안 침지하여 보호 코팅층을 형성하였다. 이후 Mg 메쉬에 생체활성을 부여하기 위해 90 ℃ Ca(NO3)2·4H2O와 Na2HPO4 혼합 수용액에 30분 동안 침지하는 수열처리 및 90 ℃에서 유지되는 0.06 M NH4H2PO4 수용액과 0.011 M Ca(OH)2 수용액에서 20회 순환 석회화전처리를 한 다음 100 ℃와 400 ℃에서 열처리를 하였다. 이후 표면층 원소의 동정을 파악하기 위해 X-선 회절분석을 시행하였고, 또한 생체환경에서 용해도 및 생체활성도를 조사하기 위해 SBF 침지시험을 실시하였다. 또한 임플란트 식립부에서 일어나는 초기의 골흡수를 억제하기 위해 이반드로네이트를 탑재한 다음 방출 특성을 조사하였다. 또한 Mg 메쉬의 매식이 생체에 미치는 영향 및 골재생능에 미치는 영향을 평가하기 위해 시험쥐의 두부에 결손부를 형성하고 Mg 메쉬를 4주 동안 매식한 다음 혈중의 염증성 사이토카인의 변화 및 신생골의 부피와 밀도를 조사하였다. 이상의 시험을 통해 다음과 같은 결론을 얻었다.
1. 수열처리한 표면에서는 침상의 인산칼슘이 석출되었지만 순환 석회화전처리한 표면에는 미세한 과립상의 인산칼슘이 클러스터 상으로 석출이 되었으며, SBF 침지 후 HA 석출의 초기단계에서 관찰되는 돌기상이 석출되어 생체활성도가 개선된 결과를 보였다.
2. 37 ℃ SBF 10 mL에 7일 동안 침지했을 때의 pH 변화는 수열처리와 순환 석회화전처리 후 순수 Mg에 비해 크게 감소되었다.
3. 이반드로네이트의 탑재 처리 시, 순환 석회화전처리 후 100 ℃에서 열처리한 그룹(CP-H1)에서 6일 동안에 걸친 방출을 보였다.
4. 혈중 IL-1β와 IL-6는 순환 석회화전처리 후 400 ℃에서 열처리한 그룹(CP-H4)를 제외하고는 모든 시험 그룹에서 무처리 대조 그룹에 비해 유의하게 낮게 나타났다(P<0.05).
5. micro-CT 분석 결과, 신생골의 부피와 밀도는 순환 석회화전처리 후 100 ℃에서 열처리한 그룹(CP-H1)에서 통계학적으로 유의하게 높게 나타났다.
이상의 결과로 미루어볼 때, 생체환경에서 Mg 메쉬의 용해 억제 및 생체활성도의 개선을 위해서 불소 보호피막층을 형성하고 순환 석회화전처리를 하여 인산칼슘을 석출하는 것은 골재생 유도의 유용한 수단이 될 수 있을 것으로 생각된다.
Abstract
Surface treatment was conducted to reduce dissolution of Mg mesh and to improve bioactivity in physiological environment. Mg mesh was immersed in 40 wt% hydrofluoric (HF) solution for 2 hours to form a protective coating layer. Then, hydrothermal treatment was performed in a mixed solution of Ca(NO3)2·4H2O and Na2HPO4 at 90 ℃ for 30 minutes, and cyclic precalcification treatment was conducted by soaking in each 0.06 M NH4H2PO4 solution and 0.011 M Ca(OH)2 solution in turn at 90 ℃. Immersion test was performed in simulated body fluid (SBF) to investigate solubility and bioactivity. Release characteristics were investigated after loading ibandronate to suppress initial bone resorption. Bone regeneration ability was evaluated through micro-CT analysis and conforming inflammatory cytokines levels in blood. Fine granular calcium phosphate-based materials were precipitated as clusters on the surface treated in cyclic precalcification. Agglomerated calcium phosphate precipitates on the surface were observed after SBF immersion. pH in SBF during immersion increased slowly in hydrothermal treatment and cyclic precalcification groups compared to pure Mg group. Release of ibandronate occurred over 6 days in cyclic precalcification treatment group (CP-H1). IL-1β and IL-6 were significantly lower than those of untreated group in all test groups except for the group (CP-H4) that was heat-treated at 400 ℃ after pretreatment with circulating calcification. As a result of micro-CT analysis, the new bone volume and density were significantly higher in the CP-H1 group. It was concluded that cyclic precalcification treatment after formation of fluorine protective layer on Mg mesh could retard the dissolution and enhanced bone regeneration ability.
Keywords:
Magnesium, Cyclic precalcification, Calcium phosphate, Bone regeneration키워드:
마그네슘, 순환석회화전처리, 인산칼슘, 골재생서 론
골절의 수술 시 종래 정형외과 영역에서는 임플란트 재료로서 스테인리스 강(316L), 티타늄 합금(Ti-6Al-4V) 및 코발트-크롬 계 합금과 같은 재료가 널리 사용되었다. 그러나 이들 재료가 임플란트로서 적용되었을 때 세포독성을 보이는 원소(예: 코발트, 크롬, 니켈 및 바나듐)가 방출되므로 인체조직에 잠재적으로 유해한 것으로 간주할 수 있다(1, 2). 또한 이들 재료로 제작된 임플란트들은 골의 치유가 완료된 후 제거를 위한 2차적인 외과적 처치가 요구된다. 이에 비해 마그네슘과 그의 일부 합금은 밀도와 탄성계수가 인간의 뼈에 가까워서 응력차폐의 영향이 상대적으로 크게 감소할 뿐만 아니라 뼈의 치유과정에서 생분해가 일어나므로 골의 회복 후 제거를 해야 하는 2차적인 수술이 필요하지 않아 환자의 부담을 줄일 수 있다(3). 그렇지만 그의 지나치게 빠른 생분해 속도는 임상 적용을 제한하는 주된 문제점으로 지적되고 있다.
골절 치료의 과정에서 뼈 조직의 복구는 일반적으로 3~7일 동안 지속되는 초기의 염증단계와 이어지는 3~4개월의 치유기간으로 구성된다. 따라서 임플란트가 치유가 완료될 때까지 기능하기 위해서는 적어도 12주 동안 신체 내에서 유지되어야 한다(4, 5).
생체재료로서 순수 마그네슘과 그의 합금에 대한 많은 연구가 수행되었지만 생체의 높은 염화물 환경에서 일어나는 그의 빠른 분해는 임상적용에 있어서 주된 장애 요인이 되고 있다. 마그네슘의 생분해 속도의 조절과 골전도성의 개선을 위해 합금 원소를 첨가하거나, 안정적인 보호 코팅층을 형성하거나, 생체 활성의 세라믹 코팅층을 형성하는 등의 여러 가지 방법들이 검토되어 왔다. 원소의 합금은 어떤 범위에서 마그네슘 합금의 분해속도를 늦출 수는 있지만 임상적 요구를 충족하기에는 많은 한계를 보였다. 이에 비해 생분해가 가능한 고분자 재료나 세라믹 재료의 치밀한 코팅층을 형성하는 것은 마그네슘의 내식성 개선에 크게 기여한다. 마이크로 아크 산화(MAO)(6, 7), 졸-겔 코팅(8), 물리적 전환 코팅과 화학적 전환 코팅에 의해 Mg 계 재료의 부식 저항성을 개선하려는 시도가 여러 문헌에서 보고되었다. 이들 기술 중 화학적 전환 코팅은 적용이 간편하고 기판의 형상이 불규칙한 경우에도 효과적으로 균일한 코팅을 형성할 수 있다. 화학적 전환에 의해 인산마그네슘(MgP)(9, 10), 인산칼슘(CaP)(11, 12)과 같은 인산염 코팅이 Mg 계 생체재료의 부식 억제를 위해 검토되었다. 그러나 이러한 인산염 전환 코팅에 대한 부식 거동과 생체적합성에 대해서는 충분히 검토되지 못하였다.
하이드로젤(hydrogel)은 수용성 고분자가 물리적 또는 화학적인 결합에 의해 3차원적인 망상구조를 이룬 친수성 물질로서 다량의 물을 흡수하여 팽윤이 되지만 물에 녹지 않고 그 형태를 유지한다. 하이드로젤은 높은 수분 함량, 다공성의 구조, 상대적으로 부드러운 물성, 우수한 생체적합성, 그리고 세포외 기질과의 물리적 유사성 등으로 인해 약물전달시스템, 조직공학 지지체(scaffold), 바이오센서 등의 생체의료분야에서 광범위하게 개발 응용되고 있다. 또한 하이드로젤의 다공성 구조는 약물이 서서히 방출되게 하므로 약물전달분야에서 응용되기도 한다(13, 14). 하이드로젤 중에는 온도, 산도 광 또는 환경적인 요인에 의해서 그 형태가 변화하는 것도 있다(15-17). Pluronic F-127은 친수성의 폴리에틸렌옥사이드(polyethylene oxide; PEO)와 소수성의 폴리프로필렌옥사이드(polypropylene oxide; PPO)로 이루어진 PEO-PPO-PEO 삼중블록 공중합체로서 상온에서는 액체상태이지만 체내와 유사한 환경에서는 겔화되는 특성을 보이므로 주입형 젤(injectable gel) 시스템의 적용 시 약물전달이나 조직공학을 포함하는 다양한 분야에서 생체응용이 고려되고 있다(18-20).
골다공증 치료제 중의 하나인 bisphosphonate 계열의 약물은 칼슘 및 hydroxyapatite에 대하여 높은 친화력을 가지므로 골에 용이하게 부착이 되고, 골 흡수가 진행되는 과정에서는 파골세포 내로 유입되어 기능을 떨어뜨려서 골 흡수를 강력하게 억제할 뿐만 아니라 종국에는 사멸(apoptosis)을 유발하는 것으로 알려져 있다(21). 치과분야에서 치조골 흡수가 증가된 시험동물 모델에 bisphosphonate 계 약물인 alendronate를 투여하였을 때 골 소실이 감소되고 골 밀도가 증가하는 긍정적인 효과를 나타냈다(22, 23). 생체 내(in vivo) 연구에서 임플란트에 국소적으로 bisphosphonate를 탑재하는 경우 탑재처리하지 않은 경우에 비해 골생성이 촉진되어 조기에 더 높은 골-임플란트 접촉(bone-to-implant contact)을 보였다고 하였다(24, 25).
본 연구에서는 순수 Mg 포일을 사용하여 메쉬 시편을 시험제작한 다음 40 wt% HF 수용액에 침지하여 보호 코팅층을 형성한 다음 생체활성을 부여하기 위해 수열처리와 순환석회화처리에 의해 CaP 코팅층을 형성한 다음 세포독성시험, SBF에서의 부식 거동 및 생체활성도를 조사하였다. 또한 표면처리한 Mg 메쉬와 하이브리드 젤 시편에 bisphosphonate 계의 약물인 ibandronate를 탑재 처리한 후 in vitro 상에서의 방출 특성을 조사하였다. 이후 시험쥐의 두개골에 골결손부를 형성하고서 표면처리한 Mg 메쉬와 하이브리드 젤 시편을 겹쳐 적용하고서 골재생에 미치는 영향에 대하여 조사하였다.
재료 및 방법
1. Mg mesh 시편의 준비
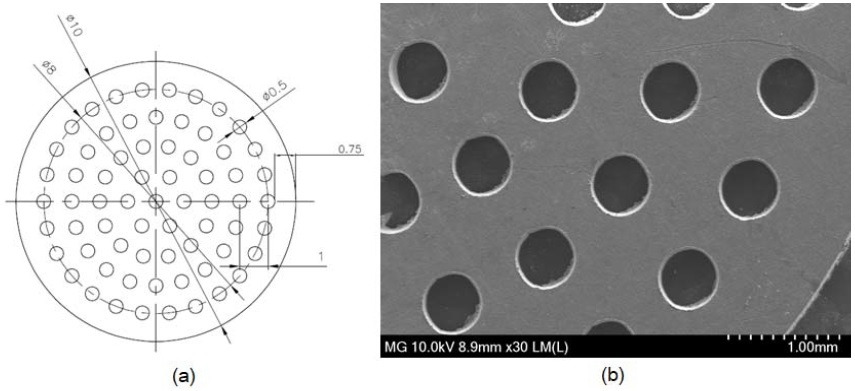
Figure 1과 같이, 동물시험용의 Mg 메쉬는 시험쥐의 두부에 대한 critical defect size가 직경 8 mm 인 점을 고려하여 유지부 포함 직경 10 mm로 디자인하였고, 시험용 메쉬에는 체액의 이동이 가능하도록 직경 8 mm 원형부 내에 직경 0.5 mm 원형 hole 67개가 형성되도록 디자인하였다. Mg 메쉬 제작용의 소재로는 두께 0.1 mm Mg 포일(99.9% Mg, as rolled, Goodfellow, Huntingdon, England)을 사용하였고 메쉬 내 구멍(hole)은 레이저 가공기(LF-30, Legens, Incheon, Korea)로 가공하였다.
2. Mg 메쉬 시편의 표면처리
제작된 Mg 메쉬 시편에 보호성 코팅층을 형성하기 위해 실온에서 40 wt% HF 수용액에 2시간 동안 침지한 다음 3차 증류수로 세척하고 40 ℃ 건조기에서 24시간 이상 건조한 다음 시험에 사용하였다.
50 mL 증류수에 Ca(NO3)2·4H2O 25 g/L와 NH4H2PO4 25 g/L을 준비한 다음 Ca(NO3)2·4H2O 용액에 Na2HPO4 용액을 드롭방식으로 첨가하여 혼합을 하고 1 M HNO3로 pH를 4로 조절하였다. 이후 30 mL 용기에 전체 용적비의 70%를 채운 다음 HF 처리한 Mg 메쉬 시편을 침지하고 80 ℃에서 30분 동안 유지하였다.
HF 처리한 Mg 메쉬 시편을 37 ℃ 0.5 vol% 실리카 수용액에 5분 동안 침지 한 다음 90 ℃ 0.06 M NH4H2PO4 수용액과 0.011 M Ca(OH)2 수용액에 대하여 1분을 주기로 하여 침지하는 방식으로 20회 순환 석회화전처리(cyclic pre-calcification treatment)를 시행하였다.
수열처리와 순환 석회화전처리의 완료 후 열처리 온도의 영향을 조사하기 위해 무작위로 2개의 군으로 분류한 다음 승온 속도 10 ℃/min으로 온도를 각각 100 ℃와 400 ℃로 올려서 2시간 동안 유지하였다.
3. Mg 메쉬의 유사체액 침지시험
Mg 메쉬 시편들의 부식 거동을 조사하기 위해 준비한 시편들을 37 ℃ SBF 용액(simulated body fluid) 10 mL에 침지하고서 5% CO2 분위기의 배양기에서 7일 동안 유지하며 pH 변화를 조사하였다. 또한 생체활성도를 조사하기 위해 37 ℃ SBF 용액에 1일과 3일 동안 침지하고서 CaP의 석출 양상을 조사하였다. SBF는 Hank’s 용액(H2387, Sigma-Aldrich, St. Louis, MO, USA)에 calcium chloride dihydrate 0.185 g/L, magnesium sulfate 0.09767 g/L, sodium hydrogen carbonate 0.350 g/L를 첨가하여 제조하였으며, 1N HCl 수용액을 사용하여 pH를 7.4로 조절하였다. 생체활성도 시험 시는 준비한 시편들을 120 ℃에서 20분 동안 고압멸균처리를 하고서 시험에 사용하였으며, SBF 용액은 이온의 농도와 pH 변화의 영향을 줄이기 위해 매일 교환하였다.
4. 광경화형 하이브리드 젤 차폐막 시편의 준비
본 연구에서는 하이브리드 젤 차폐막의 제조를 위해 2-Hydroxyethyl methacrylate (HEMA, 97%, Sigma-Aldrich) 87 wt%, methacrylic anhydride (MA, 94%, Sigma-Aldrich) 2 wt%, (PEO)99(PPO)67(PEO)99 (Pluronic F127, Sigma-Aldrich) 2 wt%, 그리고 2,2-dimethoxy-2-phenylacetophenone (DMPAP 99%, Sigma-Aldrich) 1 wt%를 혼합하고 광중합하여 직경 10 mm × 두께 0.2 mm의 하이브리드 젤(hybrid gel) 시편을 제작하였다. Pluronic F127을 4 ℃ 물에 8:2 비율로 혼합하고 30분 이상 교반하여 성분들이 완전히 용해된 것을 확인한 시편 제작에 사용하였다. 준비한 시료를 마이크로 피펫을 사용하여 실리콘 틀(mold)에 붓고서 파장 365 nm UV를 10분 동안 조사하였다. 이후 차폐막 내 미반응 모노머의 용출을 유도하기 위해 증류수 100 mL에 침지하고 3일 동안 교반을 하였으며 증류수는 매일 1회 교환하였다.
5. Ibandronate 탑재 처리 및 방출성 시험
Ibandronate는 피하주사용으로 제공되는 1 vial Unibone (Unimed) 3 mL를 3등분하여 이반드론산나트륨수화물이 1.125 mg/mL로 희석된 용액을 시험에 사용하였다. 원판상의 하이브리드 젤 시편(HG)과 90 ℃ 순환 석회화전처리 후 100 ℃에서 열처리(CP-H1)을 준비한 ibandronate 용액 1 mL에 24시간 동안 침지하여 탑재처리를 한 다음 3차 증류수 1 mL에 24시간 동안 침지하는 방식으로 7일에 걸쳐서 침지를 반복하고서 이반드로네이트의 방출량을 HPLC (High Performance Liquid Chromatography) 시스템(1260, Agilent Technologies, Santa Clara, CA, USA)으로 7일 동안에 걸쳐서 정량적으로 측정하였다.
6. 시험 시편의 표면 분석
표면처리한 Mg 메쉬 시편의 SBF 침지 후 형태학적 미세구조의 변화를 고해상도 전계방출 주사전자현미경(HR FE-SEM, S800, Hitachi, Tokyo, Japan)으로 관찰하였고, 원소의 농도 변화를 X-선 스펙트럼(EDS, Bruker, Billerica, MA, USA)으로 분석하였다. 또한 표면처리한 시편의 피막층에 존재하는 원소의 결정구조를 X-선 회절기(Dmax Ⅲ-A type, Rigaku, Tokyo, Japan)로 조사하였다.
7. 시험동물 매식
시험쥐에 대한 매식시험은 시험동물에 관하여 규정한 헬싱키 선언의 원칙을 준수하였다. 본 연구는 전북대학교 동물실험 윤리위원회의 승인을 받아 수행되었다(JBNU 2021-029). 시험동물로는 총 20 마리의 8 주령, 체중 (230±20) g의 수컷 쥐(Sprague-Dawley rat)를 사용하였다. 시험쥐는 온도와 습도가 일정하게 유지되는 동물사육실에서 1주일 동안 기초사육을 한 다음 시험에 사용하였다. 본 연구에서 시험동물에 대한 매식시험은 무처리 그룹(UT), 수열처리 후 100 ℃ 열처리 그룹(HT-H1)과 수열처리 후 400 ℃ 열처리 그룹(HT-H4), 순환 석회화전처리 후 100 ℃ 열처리 그룹(CP-H1) 및 순환 석회화전처리 후 400 ℃ 열처리 그룹(CP-H4)의 5개 그룹을 대상으로 하였다.
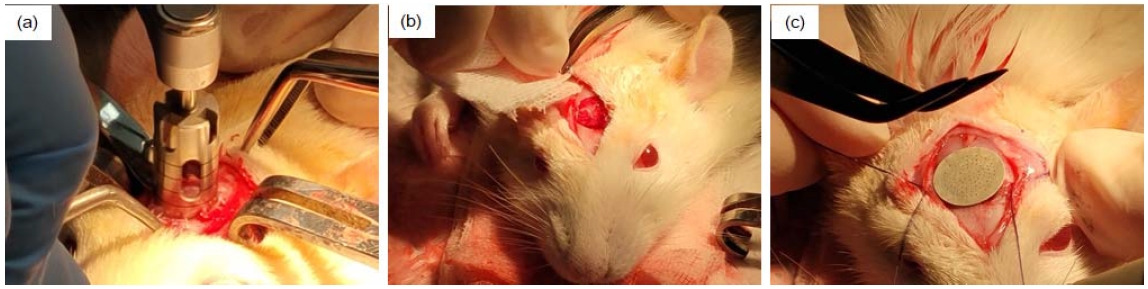
각각의 시험쥐에 ketamine 0.7 mL/kg과 xylazine HCl 0.2 mL/kg을 근육 내에 주사하여 전신마취를 유도한 다음 epinephrine (1:100,000)이 첨가된 2% lidocaine으로 수술 부위의 부가적인 국소마취를 시행하였다. 해당 두개 부위의 털을 면도하여 제거하고 betadine scrub으로 소독을 하였고, 해당 부위를 메스로 수직절개하고서 calvarial에 부착되어 있는 골막을 분리하였다. 이후 근관치료용 모터(X-SMARTTM, Dentsply, York, PA, USA)에 외경 8 mm trephine bur를 장착하고 회전속도 400 rpm, 회전력 5 N㎝ 조건에서 critical defect size 인 직경 8 mm 크기의 원형 결손부를 형성하였다. 이후 준비한 Mg 메쉬 시편과 하이브리드 젤 시편으로 덮은 다음 골막과 피부를 흡수성 봉합사로 봉합하였다(Figure 2). 이후 2차 감염 방지를 위해 4 mL aminoglycoside 항생제를 3일 동안 근육 주사하였다.
8. 혈액 분석
4주가 되었을 때 각각의 쥐에 Zoletil 0.06 mL/100 g과 Rompun 0.04 mL/100 g을 근육 내에 주사하여 전신마취를 유도하고 심장 윗부분을 소독한 다음 cardiac puncture를 하여 약 2 mL의 혈액을 EDTA 처리된 튜브에 채혈하고 EDTA가 잘 섞이도록 교반을 하였다. 이후 20분 동안 원심분리를 하여 혈장을 분석용 튜브로 옮기고 분석이 이루어질 때까지 –20 ℃에서 보관하였다.
분리된 혈장 내의 pro-inflammatory cytokine의 분비량을 측정하기 위해 interluekin-1β (IL-1β) 및 interleukin-6 (IL-6)의 분비량을 ELISA kit (Quantikine, R&D Systems, Mineneapolis, MI, USA)으로 검사하였다. 반응액의 발색 정도는 (FLUOstar Omega, BMG Labtech, Ortenberg, Germany) 로 450 nm에서 흡광도를 측정하여 cytokine 농도로 정량화하였다.
9. µ-CT 분석
4주가 경과하였을 때 시험쥐를 희생시킨 다음 메쉬를 포함하는 부위를 (20×20) mm 크기로 적출하고서 10% 중성완충 포르말린 용액에 2일간 침지하여 고정을 하였다. 이후 골밀도와 골량을 정량적으로 분석하기 위해 마이크로 CT (µ-CT) (Skyscan 1076, Skyscan, Aartselaar, Belgium)로 메쉬를 포함하는 시편 블록을 스캔하였다. X-ray tube의 전압과 전류는 각 각 100 kV와 100 µA 그리고 노출시간은 240 ms 이었다. 관심영역(regions of interest)인 직경 8 mm 두개 결손부의 경계를 따라서 차폐막 하방의 모든 조직을 포함하는 범위로 경계를 지었다. CTvox 프로그램(Skyscan)을 이용하여 3차원 영상을 구축하였고, CTAn software(Skyscan)를 이용하여 골부피(bone volume, BV)와 골밀도(bone mineral density, BMD)를 분석하였다.
10. 통계적 분석
시험군 사이의 통계적 유의성은 one-way ANOVA와 Tukey-multiple comparisons test로 검증하였다. 모든 분석은 0.05 유의수준에서 SSP Win 25.0 program (SPSS Inc, Chicago, IL, USA)을 이용하여 분석하였다.
결 과
Figure 3은 90 ℃ 수열처리 후 100 ℃에서 2시간 동안 열처리한 시편(HT-H1)과 400 ℃에서 2시간 동안 열처리한 시편(HT-H4)의 고해상도 주사전자현미경 사진이다. 수열처리한 표면에서는 침상의 인산칼슘 석출물들이 치밀한 구조로 석출된 양상을 보였다.

HR FE-SEM images of specimens heat-treated at 100 ℃ (HT-H1; a, b) and 400 ℃ (HT-H4; c, d) for 2 hours after hydrothermal treatment. (a) ×10k, (b) ×50k, (c) ×10k, (d) ×50k.
Figure 4는 90 ℃ 순환 석회화전처리 후 100 ℃에서 2시간 동안 열처리한 시편(CP-H1)과 400 ℃에서 2시간 동안 열처리한 시편(CP-H4)의 고해상도 주사전자현미경 사진이다. 순환 석회화전처리한 표면에서는 미세한 알갱이 구조의 인산칼슘 석출물들이 덩어리(cluster)를 이루며 석출된 양상을 보였다.

HR FE-SEM images of specimens heat-treated at 100 ℃ (CP-H1; a, b) and 400 ℃ (CP-H4; c, d) for 2 hours after cyclic precalcification treatment. (a) ×10k, (b) ×50k, (c) ×10k, (d) ×50k.
Figure 5는 90 ℃ 수열처리 후 100 ℃에서 열처리한 시편(HT-H1)과 400 ℃에서 열처리한 시편(HT-H4) 및 90 ℃ 순환 석회화전처리 후 100 ℃에서 열처리한 시편(CP-H1)과 400 ℃에서 열처리한 시편(CP-H4)의 X-선 회절분석 결과이다. 무처리 Mg 표면(a)에서는 Mg 피크만이 관찰되었지만, 수열처리한 표면에서는 Mg 피크 이외에도 CaH2, CaPO3 및 calcium phosphate hydrate 피크가 함께 관찰되었다. 또한 순환 석회화처리한 표면에서는 Mg 피크 이외에도 octa calcium phosphate 피크가 함께 관찰되었다.
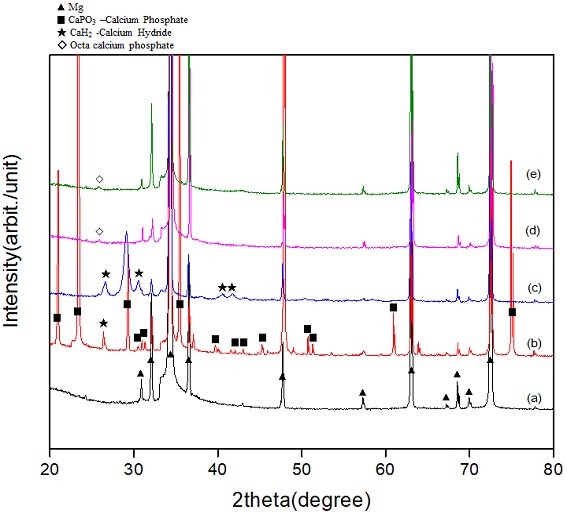
X-ray diffraction analysis results of the test groups. (a) Untreated (UT), (b) heat-treated at 100 ℃ after hydrothermal treatment (HT-H1), (c) heat-treated at 400 ℃ after hydrothermal treatment (HT-H4), (d) heat-treated at 100 ℃ after cyclic precalcification treatment (CP-H1), (e) heat-treated at 400 ℃ after cyclic precalcification treatment (CP-H4).
Figure 6은 무처리 Mg 메쉬, 90 ℃ 수열처리 후 100 ℃에서 열처리한 시편(HT-H1) 및 90 ℃ 순환 석회화전처리 후 100 ℃에서 열처리한 시편(CP-H1)을 37 ℃ SBF 10 mL에 침지하고 7일 동안에 걸쳐서 pH 변화를 조사한 것으로, 무처리 Mg 메쉬가 표면처리 Mg 메쉬에 비해서 pH가 빠르게 상승되었고, 표면처리한 Mg 메쉬들의 경우에는 유사한 양상을 보였다. 하지만 6일째로부터 수열처리한 그룹이 순환 석회화전처리한 그룹에 비해서 더 빠른 상승을 보였다.
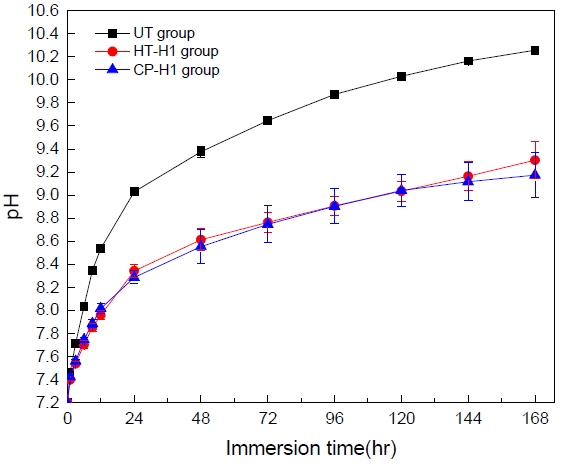
Changes of pH when immersed in 10 mL of 37 ℃ SBF for 7 days. (UT: untreated, HT-H1: heat-treated at 100 ℃ after hydrothermal treatment, CP-H1: heat-treated at 100 ℃ after cyclic precalcification treatment).
Figure 7은 90 ℃ 수열처리 후 100 ℃에서 2시간 동안 열처리한 시편(HT-H1)및 400 ℃에서 2시간 동안 열처리한 시편(HT-H4)을 SBF에 3일 동안 침지하고서 관찰한 HR FE-SEM 사진이고, Table 1은 그의 EDS 분석 결과이다. HT-H1 표면에서는 HA 석출의 초기단계에서 관찰되는 돌기상 인산칼슘이 치밀한 구조로 석출이 되며 Ca/P 원자비 1.07을 보였지만 HT-H4 표면에서는 Mg만 검출이 되고 Ca와 P는 검출되지 않았다.

HR FE-SEM images of specimens immersed in SBF for 3 days after hydrothermal treatment at 90 ℃. (a, b) heat-treated at 100 ℃ (HT-H1), (c ,d) heat-treated at 400 ℃ (HT-H4). (a) ×10k, (b) ×50k, (c) ×10k, (d) ×50k.
Figure 8은 90 ℃ 순환 석회화전처리 후 100 ℃에서 2시간 동안 열처리한 시편(CP-H1)및 400 ℃에서 2시간 동안 열처리한 시편(CP-H4)을 SBF에 3일 동안 침지하고서 관찰한 HR FE-SEM 사진이고, Table 2는 그의 EDS 분석 결과이다. CP-H1 표면에서는 HA 석출의 초기단계에서 관찰되는 돌기상이 치밀한 구조로 석출이 되며 Ca/P 원자비 1.51을 보였지만 HT-H4 표면에서는 Mg가 크게 증가하며 Ca와 P는 검출되지 않았다.

HR FE-SEM images of specimens immersed in SBF for 3 days after cyclic precalcification treatment. (a, b) heat-treated at 100℃ (CP-H1), (c, d) heat-treated at 400 ℃ (CP-H4). (a) ×10k, (b) ×50k, (c) ×10k, (d) ×50k.
Figure 9는 90 ℃ 순환 석회화전처리 후 100 ℃에서 열처리한 시편(CP-H1)과 하이브리드 젤 시편(HG)에 ibandronate를 탑재처리한 다음 1 mL 증류수에 24시간 동안 침지하는 방식으로 7일 동안에 걸쳐서 방출량을 조사한 결과이다. CP-H1 그룹의 경우에는 적은 양이지만 6일 동안에 걸친 방출을 보인 반면 HG 그룹의 경우에는 2일간에 걸친 짧은 방출을 보였다.
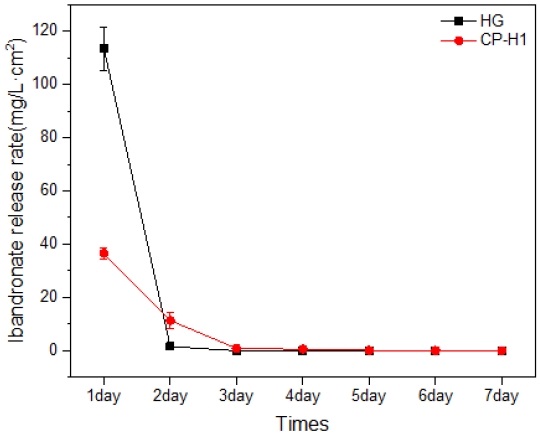
Changes in ibandronate release over 7 days of Mg specimens heat-treated at 100 ℃ after cycle calcification treatment (CP-H1) and hybrid gel specimens (HG).
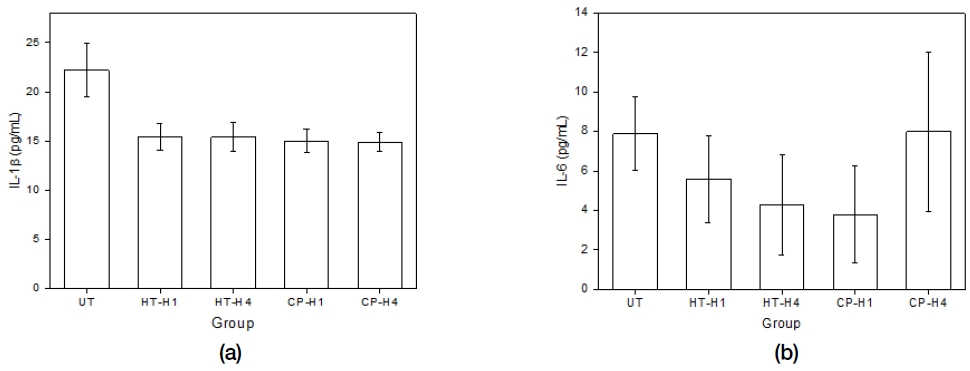
Figure 10은 무처리 그룹(UT), 90 ℃ 수열처리 후 100 ℃에서 열처리한 그룹(HT-H1과 400 ℃에서 열처리한 그룹(HT-H4) 그리고 90 ℃ 순환 석회화전처리 후 100 ℃에서 열처리한 그룹(CP-H1)과 400 ℃에서 열처리한 그룹(CP-H4)의 혈중 염증성 사이토카인 IL-1β (a)와 IL-6 (b)의 분석 결과이다. IL-1β(a)의 경우에는 UT 그룹을 제외한 나머지 모든 시험 그룹에서 유사한 정도로서 낮게 나왔으며, UT 그룹과의 사이에서 통계학적으로 유의한 차이를 보였다(P<0.05). 또한 IL-6 (b)의 경우에는 90 ℃ 순환 석회화전처리 후 400 ℃에서 열처리 그룹(CP-H4)에서 가장 높게 나왔고 90 ℃ 순환 석회화전처리 후 100 ℃에서 열처리(CP-H1)에서 가장 낮게 나왔으며, CP-H1 그룹과 HT-H4 그룹이 나머지 시험 그룹들과 통계학적으로 유의한 차이를 보였다(P<0.05).
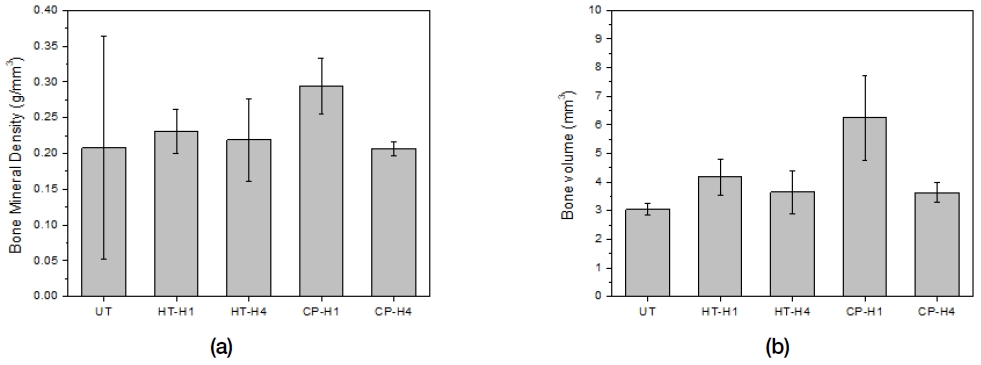
Figure 11은 시험쥐의 두부에 직경 8 mm critical defect를 형성한 다음 무처리 그룹(UT), 90 ℃ 수열처리 후 100 ℃에서 열처리한 그룹(HT-H1)과 400 ℃에서 열처리한 그룹(HT-H4) 그리고 90 ℃ 순환 석회화전처리 후 100 ℃에서 열처리한 그룹(CP-H1)과 400 ℃에서 열처리한 그룹(CP-H4) 그룹의 Mg 메쉬를 4주간 매식하고서 조사한 골밀도(a)와 골부피(b)를 도시한 것이다. 골밀도는 CP-H1 그룹에서 0.294±0.039 g/mm3에서 가장 높고 CP-H4 그룹에서 0.207±0.010 g/mm3으로 가장 낮게 나타났으며, CP-H1 그룹이 나머지 시험 그룹들과 통계학적으로 유의한 차이를 보였다(P<0.05). 신생골 부피의 경우에도 CP-H1 그룹에서 6.251±1.481 mm3으로 가장 높고 무처리 UT 그룹에서 3.048±0.212 mm3으로 가장 낮게 나타났으며, CP-H1 그룹이 나머지 시험 그룹들과 통계학적으로 유의한 차이를 보였다(P<0.05).
고 찰
생체재료로서 마그네슘에 대한 이전의 연구들은 순수 마그네슘과 그의 일부 합금에 대하여 많은 연구가 수행되었지만 생체의 높은 염화물 환경에서 일어나는 그의 빠른 분해가 임상적용의 주된 장애 요인으로 작용하였다. 마그네슘의 생분해 속도의 조절 및 골전도성의 개선을 위해서 합금 원소를 첨가하거나, 안정적인 보호 코팅층을 형성하거나, 생체 활성의 세라믹 코팅층을 형성하는 등의 방법들이 검토되어 왔다. 본 연구에서는 순수 Mg 포일을 사용하여 메쉬 시편을 시험제작하고 40 wt% HF 수용액에 침지하여 보호 코팅층을 형성한 다음 생체활성을 부여하기 위해 수열처리와 순환석회화처리에 의해 CaP 코팅층을 형성한 다음 생체활성도를 조사한 결과, 수열처리를 한 경우보다 순환 석회화전처리를 한 경우에 생체활성도가 더 크게 개선되는 결과를 보였다.
임플란트의 제작에 사용하는 금속 소재의 생체적합성은 생체환경조건에서의 내식성금속이온의 용출성, 금속산화물과 체액 사이의 반응성 등에 의해 결정된다. Ti는 표면에 자발적으로 생성되는 TiO2 산화피막층으로 인해 내식성이 우수하며 열악한 생체환경에서 임플란트가 생분해되는 것을 막아주는 장점도 있지만, 생체불활성의 특성을 보이므로 생체활성 재료에 비해 골유착이 일어나기까지 오랜 기간이 소요되는 단점도 있다(26-28). 이러한 Ti 임플란트 표면에 활성을 부여하여 골전도성을 개선하기 위해 여러 가지의 표면처리 방법이 시도되었으며(26, 29, 30), 그중 순환 석회화전처리법은 유용한 방법의 하나로 소개되고 있다(31-33). 순환 석회화전처리법은 인산염과 칼슘이온을 함유하는 수용액 중에 반복적으로 침지하여 인산칼슘의 석출을 유도하는 표면처리 방법이다. Kodama 등(31)은 순수 Ti를 NaH2PO4과 HF 혼합산 용액에서 양극산화처리를 하여 나노튜브 TiO2 층을 형성하고 실온의 0.02 M NH4H2PO4 수용액과 Ca(OH)2 포화 수용액에서 20회 순환처리를 하여 인산칼슘 wt% NH4F를 함유하는 글리세롤 용액에서 양극산화처리하여 나노튜브 TiO2 층을 하고 80 ℃ 0.05 M NaH2PO4 수용액과 90 ℃ Ca(OH)2 포화수용액에서 20회 순환처리를 했을 때 임플란트 표면의 생체활성도가 크게 개선되어 HA 석출이 빠르게 가속됨을 보고하였다. 본 연구에서는 순수 Mg로 시험용 메쉬를 제작한 다음 90 ℃ Ca(NO3)2·4H2O와 Na2HPO4 혼합 수용액에 30분 동안 침지하는 수열처리 및 90 ℃ 0.06 M NH4H2PO4 수용액과 0.011 M Ca(OH)2 수용액에서 20회 순환 석회화전처리를 시행하고 X-선 회절분석한 결과, 표면에서 인산칼슘계 물질이 석출되었고(Figure 5), 생체활성도를 조사하기 위해 SBF에 3일 동안 침지한 결과, 두 시험 그룹 모두 100 ℃에서 열처리한 경우에는 HA 석출의 초기단계에서 나타나는 돌기상이 생성되며 Ca와 P의 석출을 보였지만 400 ℃에서 열처리한 경우에는 표면에서 Mg 피크만 검출되었는데, 이는 400 ℃로 열처리하는 과정에서 일어난 Mg 압연 강판의 기계적 성질의 저하로 인해 SBF 침지 중 하부 기판에서 용해가 일어나 인산칼슘 석출층이 탈락되었기 때문이라고 생각된다(Figure 7-8, Table 1-2).
난용성의 약물은 용해와 전달이 용이하지 않기 때문에 친수성과 소수성을 겸비한 양친매성의 블록 공중합체를 이용하는 방법이 고려되고 있다. 가장 잘 알려진 양친매성 블록 공중합체로는 친수성의 PEO와 소수성의 PPO로 이루어진 PEO-PPO-PEO 삼중블록 공중합체 구조이다. Pluronic F-127은 그 중의 하나로서 생체적합성이 좋을 뿐만 아니라 상온에서는 졸 상태이지만 체온에서는 젤 형태를 유지하며, 주입형 젤(injectable gel) 시스템으로 활용할 경우 약물전달이나 조직공학을 포함하는 다양한 분야에서 생체응용이 고려되고 있다(18-20). 본 연구에서는 HEMA, methacrylic anhydride 및 Pluronic F-127을 사용하여 광경화형 하이브리드 젤 차폐막을 준비한 다음 시험 쥐의 두개골 결손부에 적용할 때 연조직의 침투를 차단할 목적으로 Mg 메쉬에 겹쳐서 적용하였다.
인간에게 있어서 bisphosphonate의 전신적인 투여는 식도염, 위궤양, 악골 골괴사(34) 등의 부작용이 있는 것으로 보고되었다. 그렇지만 악골 괴사는 암환자에게 투여하는 고용량의 bisphosphonate와 관련이 있고, 골다공증 환자에게 투여하는 적은 용량은 악골 괴사와 연관성이 있다고 보기는 어렵다(35, 36).
본 시험에서는 임플란트 식립 후 초기에 매식부 주위에서 일어나는 골흡수를 억제하는 것이 골재생에 보다 유리하게 작용한다는 점(37)에 근거하여 표면처리한 Mg 메쉬와 하이브리드 젤 차폐막에 ibandronate를 탑재처리하고 7일 동안에 걸쳐서 그의 방출능을 조사한 결과, 순환 석회화전처리한 Mg 메쉬 CP-H1 그룹에서는 6일 동안의 방출을 보였지만 하이브리드 젤 차폐막에서는 2일 동안에 그쳐서(Figure 9), 임플란트 식립부에서 파골세포에 의한 초기의 골흡수 억제에 이용하기 위해서는 좀 더 오랜 기간에 걸쳐서 방출을 유도하기 위한 추가적인 검토가 이루어져야 할 것이라고 생각된다.
Mg 메쉬의 매식 후 치유 과정에서 일어나는 여러 가지 반응들은 세포의 성장과 분화 및 치유에 영향을 주어서 혈중 염증성 사이토카인의 증가에 영향을 미칠 수 있다. 본 연구에서 IL-1β와 IL-6를 분석한 결과, 순환 석회화전처리 후 100 ℃에서 열처리한 그룹(CP-H1)에서 가장 낮고 무처리 대조 그룹(UT)과 순환 석회화전처리 후 400 ℃에서 열처리한 그룹(CP-H4)에서 유의하게 높게 나타났다(Figure 10). 무처리 대조 그룹에서 가장 높게 나타난 것은 Mg 메쉬의 빠른 용해속도 때문이라고 생각된다. 또한 CP-H4 그룹에서 IL-6가 높게 나타난 것은 열처리 과정에서 일어난 압연 메쉬의 기계적 성질의 저하로 인해 용해도가 증가된 것이 원인이라고 생각된다.
시험쥐의 두부에 결손부가 형성되면 손상된 부위에 혈병이 생성되며 혈관 신생과 골유도에 관여하는 인자들이 방출되어 신생골의 생성을 유도하게 된다. 본 연구에서 수열처리와 순환 석회화전처리한 Mg 메쉬를 시험쥐에 4주 동안 매식한 후 micro-CT를 이용하여 신생골의 부피와 밀도를 조사한 결과, 공히 순환 석회화전처리 후 100 ℃에서 열처리한 그룹(CP-H1)이 나머지 시험 그룹들에 비해서 유의하게 높은 결과를 보여서 순환 석회화전처리를 통한 인산칼슘의 석출이 생체활성도의 개선에 유용함을 확인할 수 있었다. 한편 순환 석회화전처리의 장점은 순환처리를 한 후 500 ℃ 열처리로 열처리하여 미세한 알갱이 구조의 HA를 석출함으로써 생체활성을 빠르게 가속할 수 있다는 것이다(32, 33). 하지만 본 시험에서 순환 석회화전처리 후 400 ℃에서 열처리한 그룹(HT-H4, CP-H4)의 경우에는 신생골의 부피가 감소하는 결과를 보였는데(Figure 11), 이는 열처리 과정에서 일어난 Mg 메쉬의 기계적 성질 저하로 인한 용해도의 증가가 원인이라고 생각되며, 이러한 문제점을 개선하기 위해서는 500 ℃에서 열처리하는 경우에도 기계적 성질이 영향을 받지 않는 융점이 높은 생체친화성 Mg 합금의 개발되어야 할 것으로 생각한다.
결 론
본 연구는 생체환경에서 Mg 메쉬의 용해 억제 및 생체활성도 개선을 위해 시행되었다. 생체환경에서 Mg 메쉬의 용해를 억제하기 위해 40 wt% HF 수용액에 2시간 동안 침지하여 보호 코팅층을 형성하였고, 생체활성을 부여하기 위해 수열처리와 순환 석회화전처리를 하여 인산칼슘 코팅층을 형성한 다음 SBF 침지시험을 통하여 용해도와 생체활성도를 조사하였다. 또한 시험쥐의 두개골에 골결손부를 형성하고서 이반드로네이트 탑재 표면처리 Mg 메쉬를 적용하고서 4주가 경과한 후 혈중 염증성 사이토카인의 변화 및 골재생에 미치는 영향에 대하여 조사하였다.
시험 결과, 수열처리한 표면에서는 침상의 인산칼슘이 석출되었지만 순환 석회화전처리한 표면에는 미세한 과립상의 인산칼슘이 클러스터 상으로 석출이 되었고, SBF 침지 후 HA 석출의 초기단계에서 관찰되는 돌기상이 석출되어 생체활성도가 개선되었으며, 그 효과는 수열처리한 경우보다 순환 석회화전처리한 경우에 더욱 우수하게 나타났다. 표면처리한 Mg 메쉬를 시험쥐의 두개골 결손부에 4주 동안 매식했을 때의 혈중 염증성 사이토카인의 증가 및 신생골의 생성은 순환 석회화전처리 후 100 ℃에서 열처리한 그룹에서 가장 우수하게 나타났다. 하지만 Mg 메쉬의 수열처리와 순환 석회화전처리 후 400 ℃에서 열처리한 경우에 불량한 결과를 보여 내열성이 우수한 Mg 합금 소재의 개발이 요구된다.
결론적으로, 생체환경에서 Mg 메쉬의 용해 억제 및 생체활성도의 개선을 위해서 불소 보호피막층을 형성하고 순환 석회화전처리를 하여 인산칼슘을 석출하는 것은 골재생 유도의 유용한 수단이 될 수 있을 것으로 생각된다.
Acknowledgments
본 연구는 2020년도 중소벤처기업부의 기술개발사업 지원에 의한 연구임 [S2872533]
References
-
Dearnley P. A brief review of test methodologies for surface-engineered biomedical implant alloys. Surf Coat Tech. 2005;198(1-3):483-90.
[https://doi.org/10.1016/j.surfcoat.2004.10.067]

-
Upadhyay D, Panchal MA, Dubey R, Srivastava V. Corrosion of alloys used in dentistry: A review. Mat Sci Eng A - Struct. 2006;432(1-2):1-11.
[https://doi.org/10.1016/j.msea.2006.05.003]

-
Cui W, Beniash E, Gawalt E, Xu Z, Sfeir C. Biomimetic coating of magnesium alloy for enhanced corrosion resistance and calcium phosphate deposition. Acta Biomater. 2013;9(10):8650-9.
[https://doi.org/10.1016/j.actbio.2013.06.031]

-
Staiger MP, Pietak AM, Huadmai J, Dias G. Magnesium and its alloys as orthopedic biomaterials: a review. Biomaterials. 2006;27(9):1728-34.
[https://doi.org/10.1016/j.biomaterials.2005.10.003]

-
Peuster M, Wohlsein P, Brügmann M, Ehlerding M, Seidler K, Fink C, et al. A novel approach to temporary stenting: degradable cardiovascular stents produced from corrodible metal—results 6–18 months after implantation into New Zealand white rabbits. Heart. 2001;86(5):563-9.
[https://doi.org/10.1136/heart.86.5.563]

-
Cui X-j, Lin X-z, Liu C-h, Yang R-s, Zheng X-w, Gong M. Fabrication and corrosion resistance of a hydrophobic micro-arc oxidation coating on AZ31 Mg alloy. Corros Sci. 2015;90:402-12.
[https://doi.org/10.1016/j.corsci.2014.10.041]

-
Duan H, Du K, Yan C, Wang F. Electrochemical corrosion behavior of composite coatings of sealed MAO film on magnesium alloy AZ91D. Electrochim Acta. 2006;51(14):2898-908.
[https://doi.org/10.1016/j.electacta.2005.08.026]

-
Tan A, Soutar A, Annergren I, Liu Y. Multilayer sol–gel coatings for corrosion protection of magnesium. Surf Coat Tech. 2005;198(1-3):478-82.
[https://doi.org/10.1016/j.surfcoat.2004.10.066]

-
Ishizaki T, Shigematsu I, Saito N. Anticorrosive magnesium phosphate coating on AZ31 magnesium alloy. Surf Coat Tech. 2009;203(16):2288-91.
[https://doi.org/10.1016/j.surfcoat.2009.02.026]

-
Van Phuong N, Gupta M, Sungmo M. Enhanced corrosion performance of magnesium phosphate conversion coating on AZ31 magnesium alloy. T Nonferr Metal Soc. 2017;27(5):1087-95.
[https://doi.org/10.1016/S1003-6326(17)60127-4]

-
Su Y, Guo Y, Huang Z, Zhang Z, Li G, Lian J, et al. Preparation and corrosion behaviors of calcium phosphate conversion coating on magnesium alloy. Surf Coat Tech. 2016;307:99-108.
[https://doi.org/10.1016/j.surfcoat.2016.08.065]

-
Su Y, Su Y, Lu Y, Lian J, Li G. Composite microstructure and formation mechanism of calcium phosphate conversion coating on magnesium alloy. J Electrochem Soc. 2016;163(9):G138.
[https://doi.org/10.1149/2.0801609jes]

-
Lim F, Sun AM. Microencapsulated islets as bioartificial endocrine pancreas. Science. 1980;210(4472):908-10.
[https://doi.org/10.1126/science.6776628]

-
Kim SJ, Shin SR, Shin DI, Kim IY, Kim SI. Synthesis and characteristics of semi‐interpenetrating polymer network hydrogels based on chitosan and poly (hydroxy ethyl methacrylate). J Appl Polym Sci. 2005;96(1):86-92.
[https://doi.org/10.1002/app.21407]

-
Tian W, Zhang C, Hou S, Yu X, Cui F, Xu Q, et al. Hyaluronic acid hydrogel as Nogo-66 receptor antibody delivery system for the repairing of injured rat brain: in vitro. J Control Release. 2005;102(1):13-22.
[https://doi.org/10.1016/j.jconrel.2004.09.025]

-
Peng K, Tomatsu I, Kros A. Light controlled protein release from a supramolecular hydrogel. Chem Commun. 2010;46(23):4094-6.
[https://doi.org/10.1039/c002565h]

-
Vercruysse KP, Marecak DM, Marecek JF, Prestwich GD. Synthesis and in vitro degradation of new polyvalent hydrazide cross-linked hydrogels of hyaluronic acid. Bioconjugate Chem. 1997;8(5):686-94.
[https://doi.org/10.1021/bc9701095]

-
Chiappetta DA, Sosnik A. Poly (ethylene oxide)–poly (propylene oxide) block copolymer micelles as drug delivery agents: improved hydrosolubility, stability and bioavailability of drugs. Eur J Pharm Biopharm. 2007;66(3):303-17.
[https://doi.org/10.1016/j.ejpb.2007.03.022]

-
Drury JL, Mooney DJ. Hydrogels for tissue engineering: scaffold design variables and applications. Biomaterials. 2003;24(24):4337-51.
[https://doi.org/10.1016/S0142-9612(03)00340-5]

-
Ahn J-H, Jeon Y-S, Chung D-J, Kim J-H. Preparation and swelling behavior of stimuli-responsive PHEMA hybrid gels. Polym. Korea. 2011;35(1):94-8.
[https://doi.org/10.7317/pk.2011.35.1.94]

-
Moreau M-F, Guillet C, Massin P, Chevalier S, Gascan H, Baslé M-F, et al. Comparative effects of five bisphosphonates on apoptosis of macrophage cells in vitro. Biochem Pharmacol. 2007;73(5):718-23.
[https://doi.org/10.1016/j.bcp.2006.09.031]

-
Weinreb M, Quartuccio H, Seedor J, Aufdemorte T, Brunsvold M, Chaves E, et al. Histomorphometrical analysis of the effects of the bisphosphonate alendronate on bone loss caused by experimental periodontitis in monkeys. J Periodont Res. 1994;29(1):35-40.
[https://doi.org/10.1111/j.1600-0765.1994.tb01088.x]

-
Reddy MS, Weatherford III TW, Smith CA, West BD, Jeffcoat MK, Jacks TM. Alendronate treatment of naturally‐occurring periodontitis in beagle dogs. J Periodont. 1995;66(3):211-7.
[https://doi.org/10.1902/jop.1995.66.3.211]

-
Meraw SJ, Reeve CM, Wollan PC. Use of alendronate in peri‐implant defect regeneration. J Periodont. 1999;70(2):151-8.
[https://doi.org/10.1902/jop.1999.70.2.151]

-
Meraw SJ, Reeve CM. Qualitative analysis of peripheral peri‐implant bone and influence of alendronate sodium on early bone regeneration. J Periodont. 1999;70(10):1228-33.
[https://doi.org/10.1902/jop.1999.70.10.1228]

-
Hanawa T, Ukai H, Murakami K, Asaoka K. Structure of surface-modified layers of calcium-ion-implanted Ti–6Al–4V and Ti–56Ni. Mater Trans JIM. 1995;36(3):438-44.
[https://doi.org/10.2320/matertrans1989.36.438]

- Ellingsen JE, Johansson CB, Wennerberg A, Holmén A. Improved retention and bone-to-implant contact with fluoride-modified titanium implants. Int J Oral Maxillofac Implants. 2004;19(5).
-
Ma Q, Li M, Hu Z, Chen Q, Hu W. Enhancement of the bioactivity of titanium oxide nanotubes by precalcification. Mater Lett. 2008;62(17-18):3035-8.
[https://doi.org/10.1016/j.matlet.2008.01.121]

- Chung H, Won D, Bae T, Lee M. Effect of potassium hydroxide treatment of titanium implant on the precipitation of calcium phosphate and tissue compatibility. J Korean Res Soc Dent Mater. 2001;28:223-33.
-
Kokubo T, Miyaji F, Kim HM, Nakamura T. Spontaneous formation of bonelike apatite layer on chemically treated titanium metals. J Am Ceram Soc. 1996;79(4):1127-9.
[https://doi.org/10.1111/j.1151-2916.1996.tb08561.x]

-
Kodama A, Bauer S, Komatsu A, Asoh H, Ono S, Schmuki P. Bioactivation of titanium surfaces using coatings of TiO2 nanotubes rapidly pre-loaded with synthetic hydroxyapatite. Acta Biomater. 2009;5(6):2322-30.
[https://doi.org/10.1016/j.actbio.2009.02.032]

-
Nguyen T-DT, Park I-S, Lee M-H, Bae T-S. Enhanced biocompatibility of a pre-calcified nanotubular TiO2 layer on Ti–6Al–7Nb alloy. Surf Coat Tech. 2013;236:127-34.
[https://doi.org/10.1016/j.surfcoat.2013.09.038]

-
Nguyen TDT, Moon SH, Oh TJ, Park IS, Lee MH, Bae TS. The effect of APH treatment on surface bonding and osseointegration of Ti‐6Al‐7Nb implants: An in vitro and in vivo study. J Biomed Mater Res Part B. 2015;103(3):641-8.
[https://doi.org/10.1002/jbm.b.33210]

-
Sharma D, Ivanovski S, Slevin M, Hamlet S, Pop TS, Brinzaniuc K, et al. Bisphosphonate-related osteonecrosis of jaw (BRONJ): diagnostic criteria and possible pathogenic mechanisms of an unexpected anti-angiogenic side effect. Vascular cell. 2013;5(1):1-8.
[https://doi.org/10.1186/2045-824X-5-1]

-
Khan AA, Sandor GK, Dore E, Morrison AD, Alsahli M, Amin F, et al. Bisphosphonate associated osteonecrosis of the jaw. J Rheumatol. 2009;36(3):478-90.
[https://doi.org/10.3899/jrheum.080759]

-
Lo JC, O'Ryan FS, Gordon NP, Yang J, Hui RL, Martin D, et al. Prevalence of osteonecrosis of the jaw in patients with oral bisphosphonate exposure. J Oral Maxillofac Surg. 2010;68(2):243-53.
[https://doi.org/10.1016/j.joms.2009.03.050]

-
Lee SJ, Oh TJ, Bae TS, Lee MH, Soh Y, Kim BI, et al. Effect of bisphosphonates on anodized and heat-treated titanium surfaces: an animal experimental study. J Periodont. 2011;82(7):1035-42.
[https://doi.org/10.1902/jop.2010.100608]