나트륨 뷰티레이트를 함유한 칼슘 설페이트 뼈이식재의 구강점막 및 골조직에 대한 영향
초록
본 연구에서는 나트륨 뷰티레이트(sodium butyrate, SB)를 함유한 칼슘 설페이트(calcium sulfate, CaS) 골이식재의 섬유아세포 및 구강점막과 뼈 조직에 대한 영향을 알아보고자 하였다. 모든 시험은 ISO 10993에 따라 수행하였다. 세포독성평가를 위하여 SB/CaS 혼합물을 24시간 경화시킨 후, 아가로 중층된 섬유아세포 위에 24시간 접촉시킨 결과, 혼합물 주변의 세포는 세포활성과 정상적인 세포형태를 유지하였다. 즉, 세포독성이 나타나지 않았다. SB/CaS 혼합물의 구강점막조직에 대한 영향 평가를 위해 햄스터 볼주머니를 이용하였으며, 염증소견을 나타내는 조직학적 반응은 보이지 않았다. 마지막으로 SB/CaS 혼합물이 이식된 토끼 대퇴골에서 염증세포는 발견되지 않았으며, 정상적인 조직학적 형태를 보였다. 따라서, SB/CaS 혼합물은 세포독성이 없으며, 구강점막과 뼈조직에 생물학적 자극을 초래하지 않았다.
Abstract
The purpose of this study was to investigate the effect of sodium butyrate (SB)-containing calcium sulfate (CaS) bone graft on fibroblasts, oral mucosa and bone tissue. All the tests were performed according to the standard method of ISO 10993. For the cytotoxicity assay, the SB/CaS mixture was set for 24 h, and was placed on the layer of fibroblasts covered with agar for 24 h. Most cells under and near the mixture were viable and showed the morphology of healthy cells, which indicated that there was no cytotoxicity. The effect of SB/CaS mixture on oral mucosa was evaluated using the hamster cheek pouch. There were no signs of tissue responses indicating inflammatory reactions to SB/CaS mixture. Finally, there was no appearance of inflammatory cells, and normal tissue histology was shown by the implantation of SB/CaS mixture to the femur of rabbits. Therefore, it was considered that the SB/CaS mixture was non-cytotoxic and non-irritant to oral mucosa and bone tissue.
Keywords:
Sodium butyrate, Calcium sulfate, Cytotoxicity, Oral mucosa irritation, Implantation키워드:
나트륨 뷰티레이트, 칼슘 설페이트, 세포독성, 구강점막자극, 이식서 론
뷰티레이트(butyrate)는 장내세균의 발효에 의해 발생하는 단쇄지방산(short chain fatty acid)로서 장벽의 상피조직을 보호하고 염증을 감소시키는 역할을 한다(1, 2). 나트륨 뷰티레이트(sodium butyrate, SB)는 또한 LPS에 의한 대식세포 활성화를 제어하여 조염증 싸이토카인의 생성을 억제하는 것으로 보고된 바 있다(3). 이러한 SB의 항염증 작용은 nuclear factor kappa-B (NF-κB) 신호전달의 차단에 의한 것으로 알려져 있다(4). 항염증 활성과 함께 뷰티레이트는 histone deacetylase (HDAC) inhibition 작용을 통하여 히스톤(histone)의 아세틸화 상태를 유지함으로써 유전자 발현을 조절하는 후생유전학적 유전자 조절기능을 하는 것으로 알려져 있다(5). 뷰티레이트의 후생유전학적 활성에 의해 다양한 유전자의 발현이 조절되는 것이 보고되어 왔으며(6-8), 암을 비롯한 질병치료 적용 가능성에 대하여 많은 연구가 진행되어왔다(9-11). HDAC inhibitor의 의학적 활용 가능성은 경조직 재생 분야에서도 주목을 받고 있으며, SB를 포함한 HDAC inhibitor의 골재생 촉진 활성이 보고 된 바 있다(12). 우선 2008년에 Katono 등은 SB가 조골세포의 bone sialoprotein과 osteopontin의 발현과 세포외기질의 광화(mineralization)를 촉진한다고 보고하였다(13). 또한 Xu 등은 중간엽 줄기세포를 이용한 연구에서 SB가 산소분압을 낮추는 작용이 있으며, SB의 뼈형성 촉진 활성에서 산소분압 감소의 중요성을 제시하였다(14). 조골세포 분화 촉진 효과와 함께 SB의 파골세포 분화 억제 활성 또한 다수 보고된 바 있다(15, 16). 따라서 골다공증과 같은 골형성부전의 치료에도 SB의 적용 가능성이 높을 것으로 기대된다.
치과 및 정형외과 등에서 뼈재생 활성화합물의 국소적 적용을 위해서는 활성화합물과 골이식재를 혼합하여 적용할 수 있으며, 골이식재는 일차적으로 뼈 결손 부위의 부피를 유지하고, 최종적으로는 흡수됨으로써 새롭게 재생되는 뼈에 의해 대체되는 역할을 한다. 이 과정에서 활성화합물은 뼈의 재생을 촉진하여, 신생뼈로의 대체 속도 증가를 목적으로 한다. 골이식재는 활성화합물의 방출에도 영향을 줄 수 있으므로, 뼈재생 활성화합물의 특성에 부합하는 골이식재의 선택은 매우 중요하다. 특히 SB의 경우, 고 농도에서 osteoblast 분화를 억제하는 것으로 보고된 바 있어(17), 이의 방출 속도를 고려한 골이식제의 선택이 중요할 것으로 판단된다. Jung 등은 SB의 국소 적용을 위해 칼슘설페이트(calcium sulfate, CaS)를 혼합 사용하였으며, rat calvarial 모델에서 SB의 뼈재생 촉진 효과를 확인하였다(18). SB를 함유한 CaS 이식재는 in vitro에서 MC3T3-E1 pre-osteoblast의 뼈형성 관련 유전자의 발현을 촉진하였으므로, CaS로부터 SB의 방출이 적절히 유지된 것으로 판단된다. 또한 SB/CaS 복합물은 토끼 두개골 결손의 vertical onlay graft 모델에서 이식 2주후에 신생골 생성을 촉진하였으며, 상악동거상 토끼 모델에서 뼈형성 촉진과 상악동에서 생성된 뼈의 부피유지가 개선됨을 보여주었다(19, 20). 이와 같이 일련의 동물실험을 통한 유효성 결과는 SB/CaS 복합물이 뼈재생에 효과적이고, 다양한 경조직 부위에 적용될 가능성을 제시하였다. 따라서 향후 SB/CaS 복합물의 임상 적용이 기대되는 바, 유효성과 함께 생물학적 안전성이 확보되어야 한다. 뷰티레이트는 인체의 장내세균에 의해 지속적으로 생성되어 인체에 유입되고 혈중에도 상시 존재하며, 평균 혈중농도는 단식 상태에서도 17.6 µmol/L로 보고된 바 있다(21). 그러므로 SB는 저농도에서 인체에 유해하지 않을 것으로 예상되지만, 고농도 뷰티레이트의 국소적 영향은 아직까지 보고된 바 없으며, CaS와의 복합물의 경우도 생물학적 안전성에 대한 검토가 이루어진 바 없다. 이에 본 연구에서는 세포독성시험과 함께 구강점막과 골조직에 대한 SB/CaS 복합물의 안전성을 평가하기 위하여, 햄스터와 토끼를 이용한 구강점막자극시험과 이식시험을 수행하였고, 국제표준인 ‘ISO 10993 의료기기의 생물학적 평가’에 준하여 시험을 실시하였다.
재료 및 방법
1. SB/CaS 복합물 제작
SB와 CaS는 Sigma-Aldrich (St. Louis, MO, USA)와 Whip Mix (Louisville, KY, USA)로부터 각각 구입하였다. 이하 본 연구에 사용되는 재료는 별도의 언급이 없는 경우 Sigma-Aldrich에서 구입하였다. SB는 멸균증류수에 100 µM의 농도로 용해시키고 여과멸균한 후, 사용 전까지 냉동보관 하였다. CaS 분말은 에틸렌옥사이드 가스로 멸균하고 가스제거 후 사용 전까지 상온 보관하였다. CaS 분말과 SB 용액을 사용직전에 혼합하여 SB/CaS 복합물 제작하였으며, 혼합 비율은 이전 연구(18)에 근거하여 분말 8.9 g과 용액 2 mL로 하였다.
2. 세포독성 측정
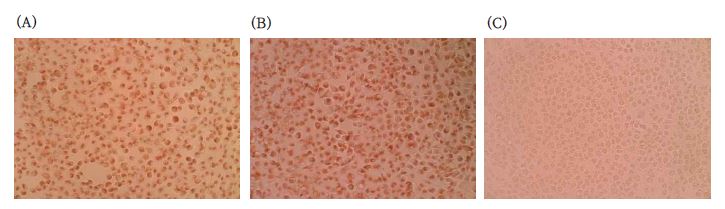
멸균 환경하에서 SB와 CaS 용액을 혼합하여 지름 5 mm, 두께 1 mm의 원판형으로 제작하고, 37 ℃ 가습환경에서 24시간 경과 후, 세포독성 평가에 사용하였다. 세포독성 평가는 ISO 10993-5:2009 (Part 5: Tests for in vitro cytotoxicity) (22)에 준하여 다음과 같이 실시하였다, NCTC Clone 929 섬유아세포 세포주(ATCC, Rockville, MD, USA)를 10% 소태아혈청FBS, Gibco-BRL, Grand Island, NY, USA)과 1% 페니실린-스크렙토마이신 용액(Gibco-BRL)을 포함한 Minimal essential medium (MEM, Gibco-BRL)으로 37 ℃의 CO2 배양기 (5% CO2, 95% air)내에서 전배양하고, 지름 5 cm의 petri dish에 분주한 후, 37 ℃에서 24시간 이상 배양하였다. 80% 정도의 세포단층 형성을 확인한 후, 배지를 제거하고, 2% 한천용액과 2X MEM 혼합물 5 mL을 중층하여, 시험물질을 한천배지 위에 위치한 상태에서 배양하였다. 24시간 후 0.02% 뉴트럴 레드(neutral red)로 염색하였으며, 광학현미경으로(IX70-S1F2, Olympus, Tokyo, Japan) 세포를 관찰하였다. High density polyethylene film (HDPE, Hatano Research Institute, Hatano, Japan)을 음성대조군으로, 0.1% zinc diethydithiocarbamate (ZDEC)를 포함한 폴리에틸렌 필름(polyethylene film) (Hatano Research Institute)을 양성대조군으로 사용하였다. 세포독성 평가는 ISO 10993-5 (2009)에 준하여, 시편주위 및 시편 아래에 염색되지 않은 세포구간이 관찰되지 않을 경우 세포독성이 없음(0 등급), 시편 아래에서 세포가 약간 변형되었거나 분해되었을 경우는 약한 세포독성(1 등급), 시편 아래에의 세포가 염색되지 않은 경우는 보통 세포독성(mild), 시편주위로 1 cm 이하의 염색되지 않은 세포구간이 관찰되면 중증의 세포독성(moderate), 시편주위로 1 cm 이상의 염색되지 않은 세포구간이 관찰되면 심한 세포독성(severe)로 등급을 규정하였다.
3. 구강점막자극시험
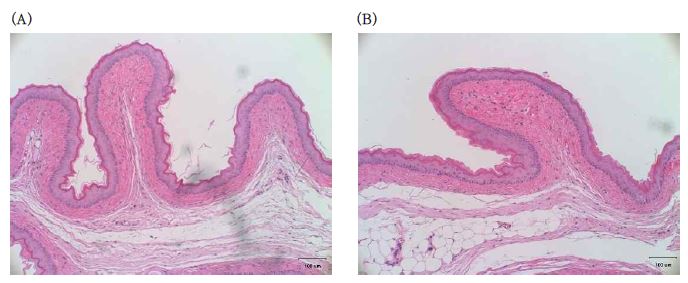
구강점막자극시험은 ISO 10993-10:2010 (Part 10: Tests for irritation and delayed-type hypersensitivity, B.3 Oral mucosa irritation test) (23)에 준하여 시험하였다. 시험동물로 6주령의 시리안 햄스터(Syrian Hamster) (Central Lab. Animal Inc., Seoul, Korea)를 사용하였으며, 서울대학교 동물시험윤리위원회의 승인하(SNU-121205-6-7)에서 동물시험을 진행하였다. 시험물질로서 SB와 CaS 용액을 혼합하여 지름 5 mm, 두께 1 mm의 원판형으로 제작하고, 37 ℃ 가습환경에서 24시간 경과 후, 햄스터의 볼주머니에 적용하였다. 시료를 적용하기에 앞서 햄스터의 볼주머니를 생리식염수로 세척하고 점막 조직의 이상 증상 여부를 확인하였다. 이후, 4시간 동안 매시간마다 1회에 5분씩 총 5회 시료를 볼주머니에 접촉시켰다. 시료를 적용한 부분의 반대쪽 볼주머니를 음성대조군으로 사용하였다. 시료적용이 완료된 시점에서 1, 2, 3, 4, 24 시간째에 볼주머니를 육안관찰하고 자극지수를 기록하였다. 육안관찰 후, 조직을 채취하여 탈수 및 4% 포름알데하이드로 고정하고, 파라핀으로 포매하여 조직절편을 제작하였다. 조직절편은 헤마톡실린 및 에오신 (H&E)으로 염색하여 현미경으로 조직병리학적 검사를 시행하였다. 육안관찰은 홍반과 가피형성 정도를 다음과 같은 등급으로 나누어 평가하였다; 1) 홍반없음(0 등급), 2) 아주 약간의 홍반(1 등급), 3) 잘 형성된 홍반(2 등급), 4) 중간 정도의 홍반(3 등급), 5) 가피가 형성됨(4 등급). 현미경하의 조직병리학적 반응 검사는 상피, 백혈구 침투, 혈관 울혈, 부종을 각각 5 등급(0-4 등급)으로 자극지수를 나누어 평가하였다. 조직반응의 자극지수는 시험군 3마리의 조직 반응 평균과 대조군 평균의 차이로 하였다.
4. 이식시험
SB/CaS 복합물의 이식시험은 ISO 10993-6:2007 (Part 6: Tests for local effects after implantation, Annex D. Test methods for implantation in bone) (24)에 준하여 서울대학교 동물시험윤리위원회의 승인하(SNU-130613-7-6)에서 시험하였다. 대조군으로 이식시험에서 자극성이 없는 것으로 확인된 바 있는 합성골이식재(mini MIG X3 GRAFT, Xenos, Suwon, Korea)를 사용하였다. 3.0 ~ 3.5 kg의 뉴질랜드 화이트 토끼(New Zealand White Rabbit) (DooYeal Bioteck, Seoul, Korea)를 졸레틸(Zoletil) 50 (Virbac, Carros, France)과 2% 럼푼(Rumpun) (Bayer, Leverkusen, Germany)으로 전신마취 후, 대퇴골의 피질 부분을 노출시키고, 수술 키트를 사용하여 양쪽 대퇴골에 총 6개의 이식부위를 형성하였다. 시험물질과 대조물질을 각각 3개의 이식부위에 이식하고, 12주 후 안락사하여 육안관찰을 시행한 후, 이식부위 조직을 채취하여 고정하고 10% 에틸렌다이아민테트라아세틱산 (ethylenediaminetetraactetic acid, EDTA)로 2주간 탈회하여 조직절편을 제작하였다. 조직은 H&E로 염색하여 세포반응 및 조직학적 평가를 시행하였다. 세포반응은 다형핵 세포 [polymorphonuclear cell (PMN)], 림프구, 형질세포(plasma cell), 대식세포의 발생에 대하여 다음과 같이 나누어 평가하였다; 1) 0개(0 등급), 2) 1 ~ 5개/400×filed (1 등급), 3) 5 ~ 10개/400×filed (2 등급), 4) 심한 침윤(3 등급), 5) 가득참(4 등급). 또한 조직의 괴사 정도를 세포 반응과 같이 5개의 등급으로 나누어 평가하였다. 조직학적 평가를 위해 신생혈관 형성, 섬유화, 지방침윤을 관찰하여 정도에 따라 5개의 등급으로 나누어 평가하였다. 즉, 신생혈관은 1) 생성없음(0 등급), 2) 1-3개 혈관돌기(1 등급), 3) 4-7개의 모세혈관과 혈관지지 섬유모세포 형성 (2 등급), 4) 모세혈과 띠 형성 (3 등급), 5) 광범위한 모세혈관 밴드 형성(4 등급)으로 나누고, 섬유화는 섬유화 없음을 0 등급으로 하고, 밴드의 두께에 따라 1-4 등급으로 나누어 평가하였다. 지방침윤은 1) 침윤없음(0 등급), 2) 섬유화와 연관된 소량의 지방 침윤(1 등급), 3) 여러층의 지방과 섬유화(2 등급), 4) 광범위한 지방 침윤 (3 등급), 5), 이식물질을 완전히 둘러싸는 과도한 지방 침윤(4 등급)으로 평가하였다. 시험군과 대조군 모두 10군데의 이식부위를 관찰하여, 평균 등급값을 구하고, 시험군과 대조군의 평균 등급 차이가 0.0 ~ 2.9는 자극이 없음, 3.0 ~ 8.9는 미약, 9.0 ~ 15.0은 중증, 15 이상은 심한 자극으로 평가하였다. 각 이식 부위의 평균등급 산출 시, 세포 반응과 괴사 등급은 가중치를 2배로하였다. 이식부위의 골 형성 정도를 평가하기 위하여, 형성된 골의 두께를 측정하였으며, 대조군과 시험군의 평균 골 두께의 차이에 대한 통계적 유의성 검토는 t-test로 검증하였다. P<0.05를 통계적으로 유의한 것으로 판단하였다.
결 과
1. 세포독성
SB/CaS 복합물의 세포독성을 측정한 결과, 시편주위 및 시편 아래에 염색되지 않은 세포구간이 나타나지 않았다(Figure 1). 세포의 모양 또한 변형되지 않았으며, 비대한 액포(vacuole) 등 세포내 기관의 이상이 발생하지 않았다. 음성대조군은 0 등급의 세포반응을 보였으며, 양성대조군은 시편주위에 약 7 mm 정도의 염색되지 않는 구간이 발생하여 3 등급의 세포독성을 보였다.
2. 구강점막자극
SB/CaS 복합물의 구강점막 자극 시험 결과, 우선 육안관찰에서는 SB/CaS 접촉면에서 홍반 및 가피가 전혀 발생하지 않았다. 따라서 육안관찰 등급수치는 0의 자극지수를 나타내었다.
조직 병리학적 관찰 결과, 대조군과 시험군 모두 상피가 손상되지 않았으며, 백혈구 침투와 부종이 발생하지 않았고, 약간의 혈관 울혈이 나타났다(Table 1, Figure 2). 따라서 SB/CaS 복합물의 조직 병리학적 자극 지수는 0이다.
3. 대퇴골 이식시험
SB/CaS 혼합물이 이식된 토끼는 시험기간(12주) 동안 임상적 이상 증상을 보이지 않았다. 12주 후 조직채취 시 육안관찰 결과, 혈종 및 부종, 피막형성이 보이지 않았으며, 시료는 대부분의 동물에서 이식부위에 그대로 남아 있었다. 조직병리학적 검사 결과, 다핵형 세포, 림프구 등 염증 반응을 나타내는 세포의 발생은 나타나지 않았으므로, 세포 및 괴사의 총 반응지수는 0이다. 조직학적 반응의 경우 신생혈관이 10개의 이식부위 중 3개에서 나타났으며, 섬유화는 2군데에서 발생하였다. 반응 정도는 모두 1 등급으로 매우 미약하게 발생하였다. 반면 대조군에서는 신생혈관, 섬유화 모두 전혀 발생하지 않았다(Table 2, Figure 3). 따라서, SB/CaS 혼합물의 총 자극지수는 5이고, 평균 자극지수는 0.5이며, 대조군 평균자극 지수 0과는 0.5의 차이를 보여, 자극이 없음으로 판단되었다.
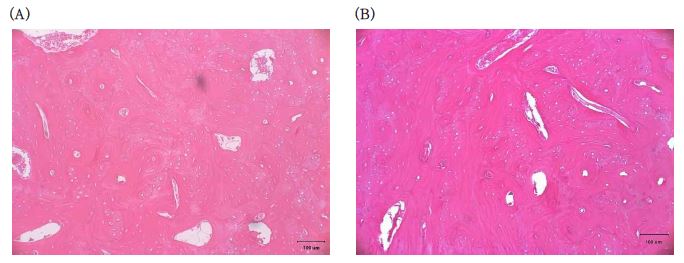
Tissue reaction of rabbit femur to SB/CaS mixture (A) Negative control, (B) SB/CaS implanted tissue. Scale bar=100 μm.
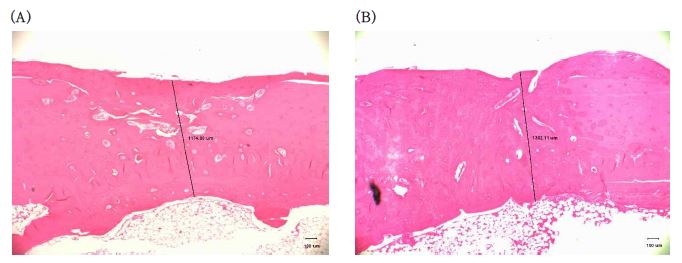
마지막으로 이식부위의 신생골 형성정도를 관찰을 위하여 이식부위의 골 두께를 구하였다(Figure 4). SB/CaS군의 골 두께는 (1.10±0.37) mm이고, 대조군은 (1.18±0.34)이며, 통계적으로 유의한 차이는 없었다(p=0.935).
고 찰
SB/CaS 혼합물은 Figure 1에서 보이는 바와 같이 세포독성을 나타내지 않았다. 이는 SB의 세포독성이 낮은 것이거나, SB가 CaS로부터 방출되지 않았기 때문으로 판단된다. 이전의 연구에서 유방암 세포주인 MCF-7에 대하여 SB의 MTT assay 결과, IC20가 2.45 mM이었다(25). 즉, 2.45 mM에서 20%의 세포활성이 감소되었다. 비록 세포의 종류는 다르지만 본 연구에서는 100 µM의 SB가 사용되므로 CaS로부터 방출되는 SB의 세포독성은 미약할 것으로 예측되었다. CaS의 경우, 이전의 연구에서 CaS 추출물이 100%의 농도에서 세포독성을 나타내었다(26). 경화가 되지 않은 CaS는 50%에서도 세포독성을 보였다. 따라서 본 연구의 시험 조건에서는 세포독성이 나타나지 않았으나, CaS는 세포독성의 가능성이 있는 생체재료이므로 염증 등 다른 생물학적 부작용에 대한 충분한 검증이 필요하다 할 수 있다. 이러한 맥락에서 본 연구에서는 구강점막자극시험과 이식시험이 수행되었으며, 시험 결과 점막과 뼈에 대하여 대체적으로 염증반응은 보이지 않았다. 구강점막자극시험의 경우, 조직 반응 분석에서 약간의 울혈이 나타났으나, 음성대조군에서도 유사한 정도의 울혈이 발생하였으므로, 이는 시험물질에 의한 것으로 판단되지 않는다. 이식시험에는 시험한 일부의 동물에서 약한 정도의 신생혈관 형성과 섬유화가 보였으나, 그 정도가 미미하고, 대부분의 동물은 정상적인 조직 반응을 보였으므로, 뼈 조직에 대한 SB/CaS의 생물학적 위해성은 없는 것으로 판단된다. 또한, 이식 수술에 의해 발생한 뼈 손상부위의 수복 정도가 대조군과 유사하므로 SB/CaS가 뼈재생을 저해하지 않은 것으로 판단된다. 다만, 본 연구의 실험 조건의 한계로 인해 뼈재생 촉진 활성은 확인할 수 없었다. 마지막으로 SB/CaS의 생물학적 안전성 확보를 위해 전임상 시험으로서 유전독성, 감작성, 급성독성 등에 대한 시험이 더 필요하며, 본 연구의 결과로서 SB/CaS로 인한 국소적 부작용이 발생할 가능성이 적다고 할 수 있다.
결 론
SB/CaS 혼합물의 생물학적 안전성을 평가하기 위하여 ISO-10993에 준하여 세포독성, 구강점막자극시험 및 이식시험을 수행하였다. 세포독성은 나타나지 않았으며, 구강점막자극시험에서는 일부 울혈이 발생하였으나, 음성대조군과 비교하여 자극성이 없다고 할 수 있다. 마지막으로 토끼 대퇴골에 대한 이식시험 결과, 일부의 동물에서 이식부위에 미약하게 신생혈관 형성과 섬유화가 발생하였으나, 음성대조군과의 비교에서 자극지수가 0.5로서 조직이상반응이 없음으로 나타났다. 또한 이식부위에 새로이 형성된 뼈의 두께는 대조군과 통계적으로 유의한 차이가 없었다. 따라서 SB/CaS 혼합물은 구강점막과 뼈에 대한 국소적 자극을 초래하지 않는다고 할 수 있다.
References
-
Vernero M, De Blasio F, Ribaldone DG, Bugianesi E, Pellicano R, Saracco GM, et al. The usefulness of microencapsulated sodium butyrate add-on therapy in maintaining remission in patients with ulcerative colitis: A prospective observational study. J Clin Med. 2020;9(12):3941.
[https://doi.org/10.3390/jcm9123941]

-
Leonel AJ, Alvarez-Leite JI. Butyrate: implications for intestinal function. Curr Opin Clin Nutr Metab Care. 2012;15(5):474-9.
[https://doi.org/10.1097/MCO.0b013e32835665fa]

-
Lee C, Lee JW, Seo JY, Hwang SW, Im JP, Kim JS. Lupeol inhibits LPS-induced NF-kappa B signaling in intestinal epithelial cells and macrophages, and attenuates acute and chronic murine colitis. Life Sci. 2016;146:100-8.
[https://doi.org/10.1016/j.lfs.2016.01.001]

-
Lee C, Kim BG, Kim JH, Chun J, Im JP, Kim JS. Sodium butyrate inhibits the NF-kappa B signaling pathway and histone deacetylation, and attenuates experimental colitis in an IL-10 independent manner. Int Immunopharmacol. 2017;51:47-56.
[https://doi.org/10.1016/j.intimp.2017.07.023]

-
Vidali G, Boffa LC, Bradbury EM, Allfrey VG. Butyrate suppression of histone deacetylation leads to accumulation of multiacetylated forms of histones H3 and H4 and increased DNase I sensitivity of the associated DNA sequences. Proc Natl Acad Sci U S A. 1978;75(5):2239-43.
[https://doi.org/10.1073/pnas.75.5.2239]

- Lea MA, Randolph VM. Induction of reporter gene expression by inhibitors of histone deacetylase. Anticancer Res. 1998;18(4A):2717-22.
-
Downes M, Ordentlich P, Kao HY, Alvarez JG, Evans RM. Identification of a nuclear domain with deacetylase activity. Proc Natl Acad Sci U S A. 2000;97(19):10330-5.
[https://doi.org/10.1073/pnas.97.19.10330]

-
Chen T, Sun H, Lu J, Zhao YM, Tao D, Li XX, et al. Histone acetylation is involved in hsp70 gene transcription regulation in Drosophila melanogaster. Arch Biochem Biophys. 2002;408(2):171-6.
[https://doi.org/10.1016/S0003-9861(02)00564-7]

-
Gridelli C, Rossi A, Maione P. The potential role of histone deacetylase inhibitors in the treatment of non-small-cell lung cancer. Crit Rev Oncol Hematol. 2008;68(1):29-36.
[https://doi.org/10.1016/j.critrevonc.2008.03.002]

-
Guidotti A, Auta J, Chen Y, Davis JM, Dong E, Gavin DP, et al. Epigenetic GABAergic targets in schizophrenia and bipolar disorder. Neuropharmacology. 2011;60(7-8):1007-16.
[https://doi.org/10.1016/j.neuropharm.2010.10.021]

-
Yip W, Hughes MR, Li Y, Cait A, Hirst M, Mohn WW, et al. Butyrate Shapes Immune Cell Fate and Function in Allergic Asthma. Front Immunol. 2021;12:628453.
[https://doi.org/10.3389/fimmu.2021.628453]

-
Huynh NC, Everts V, Ampornaramveth RS. Histone deacetylases and their roles in mineralized tissue regeneration. Bone Rep. 2017;7:33-40.
[https://doi.org/10.1016/j.bonr.2017.08.001]

-
Katono T, Kawato T, Tanabe N, Suzuki N, Iida T, Morozumi A, et al. Sodium butyrate stimulates mineralized nodule formation and osteoprotegerin expression by human osteoblasts. Arch Oral Biol. 2008;53(10):903-9.
[https://doi.org/10.1016/j.archoralbio.2008.02.016]

-
Xu Y, Hammerick KE, James AW, Carre AL, Leucht P, Giaccia AJ, et al. Inhibition of histone deacetylase activity in reduced oxygen environment enhances the osteogenesis of mouse adipose-derived stromal cells. Tissue Eng Part A. 2009;15(12):3697-707.
[https://doi.org/10.1089/ten.tea.2009.0213]

-
Rahman MM, Kukita A, Kukita T, Shobuike T, Nakamura T, Kohashi O. Two histone deacetylase inhibitors, trichostatin A and sodium butyrate, suppress differentiation into osteoclasts but not into macrophages. Blood. 2003;101(9):3451-9.
[https://doi.org/10.1182/blood-2002-08-2622]

-
Pham L, Kaiser B, Romsa A, Schwarz T, Gopalakrishnan R, Jensen ED, et al. HDAC3 and HDAC7 have opposite effects on osteoclast differentiation. J Biol Chem. 2011;286(14):12056-65.
[https://doi.org/10.1074/jbc.M110.216853]

-
Morozumi A. High concentration of sodium butyrate suppresses osteoblastic differentiation and mineralized nodule formation in ROS17/2.8 cells. J Oral Sci. 2011;53(4):509-16.
[https://doi.org/10.2334/josnusd.53.509]

-
Jung HM, Song GA, Lee YK, Baek JH, Ryoo HM, Kim GS, et al. Modulation of the resorption and osteoconductivity of alpha-calcium sulfate by histone deacetylase inhibitors. Biomaterials. 2010;31(1):29-37.
[https://doi.org/10.1016/j.biomaterials.2009.09.019]

-
Kim DH, Cha JK, Song YW, Woo KM, Jung UW. Bone augmentation using small molecules with biodegradable calcium sulfate particles in a vertical onlay graft model in the rabbit calvarium. J Biomed Mater Res B. 2020;108(4):1343-50.
[https://doi.org/10.1002/jbm.b.34483]

-
Cha JK, Lim HC, Lee JS, Choi SH, Woo KM, Jung UW. Sinus augmentation using a histone deacetylase inhibitor in a calcium sulfate carrier in rabbit: A pilot study. J Biomed Mater Res B. 2017;105(7):1916-23.
[https://doi.org/10.1002/jbm.b.33727]

-
Peters SG, Pomare EW, Fisher CA. Portal and peripheral blood short chain fatty acid concentrations after caecal lactulose instillation at surgery. Gut. 1992;33(9):1249-52.
[https://doi.org/10.1136/gut.33.9.1249]

- International Organization for Standardization. ISO 10993-5:2009. Biological evaluation of medical devices-Part 5: Tests for in vitro cytotoxicity. Geneva: ISO; 2009.
- International Organization for Standardization. ISO 10993-10:2010. Biological evaluation of medical devices-Part 10: Tests for irritation and delayed-type hypersensitivity, B.3 Oral mucosa irritation test. Geneva: ISO; 2010.
- International Organization for Standardization. ISO 10993-6:2007. Biological evaluation of medical devices-Part 6: Tests for local effects after implantation, Annex D. Test methods for implantation in bone. Geneva: ISO; 2007.
-
Louis M, Rosato RR, Brault L, Osbild S, Battaglia E, Yang XH, et al. The histone deacetylase inhibitor sodium butyrate induces breast cancer cell apoptosis through diverse cytotoxic actions including glutathione depletion and oxidative stress. Int J Oncol. 2004;25(6):1701-11.
[https://doi.org/10.3892/ijo.25.6.1701]

-
Teparat-Burana T, Onsiri N, Jantarat J. Cytotoxicity and migration of fibroblasts on two types of calcium sulfate dihydrate. J Investig Clin Dent. 2017;8:e12177.
[https://doi.org/10.1111/jicd.12177]