치과용 고분자계 손기구의 용출물 특성
초록
본 연구의 목적은 치과에서 사용되는 고분자 기구에서 용출될 수 있는 위해물질을 분석하기 위함이다. 연구에서는 치과용 고분자계 손기구 의료기기에 대하여 ISO 10993-12:2021의 방법에 따라 3차 증류수를 이용하여 과장조건(4 g/20 mL, 50 ℃, 72 h)에서 용출되었다. 용출물의 성상, pH, 과망간산칼륨환원성물질, 자외가시부흡수스펙트럼, 증발잔류량 그리고 납 함유량을 분석하였다. 또한 BPA (bisphenol A) 용출 가능성을 확인하기 위하여 기체크로마토그래피/질량분석기(7826A GC/5977E MS, Agilent Technologies, Santa Clara, CA, USA)를 이용하여 용출물 내 BPA 함량을 분석하였다. 연구결과 치과용 고분자계 손기구 10종의 용출물은 모두 무색 투명하였고, 이물질이 발견되지 않았다. 용출물의 pH는 0.9~1.7, 과망간산칼륨 소비량의 차는 0.1~0.5 mL, 흡광도(220~350 nm)는 0.05미만, 증발잔류량은 0.5~0.8 mg, 납(pb)은 4 ppm 이하였으며, BPA는 검출되지 않았다. 본 연구에서 사용된 10종의 고분자 물질은 국내 규제기관(식약처)에서 정한 위해물질의 규제양을 초과하지 않음을 확인할 수 있었으며, 이러한 결과는 본 연구에서 분석된 고분자계 손기구가 구강 내에서 안전하게 사용이 가능한 것으로 사료되었다.
Abstract
The purpose of this study is to analyze hazardous substances that can be eluted from polymer instruments used in dentistry in vitro. In the study, Dental polymer based hand instruments were eluted with exaggerated conditions (4 g/20 mL, 50 ℃, 72 h) in accordance with ISO 10993-12:2021. Appearance, pH, potassium permanganate-reducible substances, UV spectrum, residue on evaporation, and heavy metals. The additional test was performed by GC/MS for Bisphenol A. As a result, the extracts of 10 types of dental polymer based hand instruments showed colorless, transparent, and no foreign substances. pH was between 0.9 to 1.7. the difference in potassium permanganate consumption was 0.1 to 0.5 mL. The absorbance (220~350 nm) was less than 0.05, and the evaporation residue was 0.5 to 0.8 mg. Concentration of Pb was less than 4 ppm, and BPA was not detected in all extracts. It was confirmed that the 10 types of polymer materials used in this study did not exceed the regulated amount of hazardous substances set by the domestic regulatory body (Ministry of Food and Drug Safety (MFDS), Korea). These results suggest that these polymers could be safely used in the oral cavity as dental instruments.
Keywords:
Polymer, Dental instrument, Material, Extractable키워드:
고분자, 치과용 기구, 재료, 용출물서 론
치과용 고분자계 손기구는 제품을 시판하기 전에 의료기기 개발 업체가 식품의약품안전처 “의료기기 허가·신고·심사 등에 관한 규정”(식품의약품 안전처 고지 제 2015-114호)에 따라 허가를 받아야 한다. 다양한 의료기기가 존재하듯 사용되는 원재료 또한 다양하여 의료기기의 안전성 확보에 필요한 첨부자료로 ‘물리·화학적 특성에 관한 자료’가 있으며, 그 중 용출물 시험 항목에는 성상이나 pH, 과망간산칼륨환원성물질, 자외가시부흡수스펙트럼, 증발잔류물, 중금속에 대한 안전성 평가를 ‘물리·화학적 특성에 관한 자료 심사 지침’에 따라 수행해야 한다(1).
의료기기의 용출물 시험은 인체에 주입되는 혈액·체액·약물 등과 접촉하는 고분자를 포함하는 다빈도 의료기기의 경우에만 한정하여 적용하도록 되어있으며, 금속이나 세라믹 재질 등을 원재료 또는 완제품으로 사용하는 의료기기인 경우에는 해당 원재료의 재질 분석 자료를 제출하게 되면 용출물 시험을 추가로 제출할 필요가 없다(2). 특히 의료기기는 사용용도에 따라 시험 항목이 분류되어 있어 제품을 개발하여 허가 신청과정을 통해서 제품으로 생산되어진다. 다만, 고분자계 재료의 특성은 제품 개발과정에서 주변 환경의 영향에 따라 물리적 성질이 변화가 나타나기 때문에 물리·화학적 평가를 실시해보는 것도 큰 의미가 있다고 본다. 특히 고분자 기구는 단일성분으로 사용되지 않고 혼합하여 사용하거나 소재를 첨가하는 방법으로 제조하거나 중합과정이나 방법에 따라 폴리머의 특성이 변하기 때문에 구강내에서 사용되기 전에 물리·화학적 특성과 독성 평가를 실시해서 구강점막에 직접 접촉되는 기구의 안정성을 평가해볼 수 있다는 관점에서 본 연구가 의미가 있을 것으로 생각된다. 진료실에서 사용하는 치과용 기구는 금속이나 고분자 재료로 제작되어 있으며, 구강 점막에 직접 기구 표면이 접촉되거나 구강점막 안으로 삽입되어 사용되는 기구이다. 따라서 기구를 제작해서 시판되려면 엄격한 평가 기준에 통과되어야 한다(1). 본 연구는 앞서 수행한 진료실에서 사용되는 10종의 고분자 기구에 대한 세포독성 안전성 시험 평가에 이어(4), 고분자 기구의 용출물을 평가해 보고자 의료기기 용출물 시험 평가 가이드 지침에 따라 시험을 진행하였다(5).
재료 및 방법
1. 연구재료
본 연구에서 사용된 치과용 고분자계 손기구 10종은 현재 임상에서 사용되고 있는 제품을 선택하여 실험군으로 선정하였다. 제품에 대한 정보는 Table 1과 같다.
2. 시험방법
Table 1의 고분자계 치과용 기구들을 ISO 10993-12의 방법에 따라 3차 증류수를 이용하여 과장조건(4 g/20 mL, 50 ℃, 72 h)에서 용출하였으며, 3차 증류수를 같은 방법으로 조작하여 공시험액을 만들어 「의료기기 허가 ·신고·심사 등에 관한 규정」에서 요구하는 ‘물리·화학적 특성에 관한 자료’ 중 용출물 시험 항목인 성상, pH, 과망간산환원성물질, 자외가시부흡수스펙트럼, 증발잔류량 그리고 납 함유량을 대한약전(KP) 플라스틱제의약품용기 용출물 시험법에 따라 분석하였다(5). 또한 BPA 용출 가능성을 확인하기 위하여 기체크로마토그래피/질량분석기(7826A GC/5977E MS, Agilent Technologies, Santa Clara, CA, USA)를 이용하였다.
용출물로부터 나오는 가소제, 윤활제, 안정제, 색소 등을 확인하는 시험으로, 검액과 공시험액을 10 mL씩 유리병에 담은 후, 육안으로 하얀바탕의 종이 위에서 색 변화를 관찰하였다.
검액 및 공시험액 20 mL씩을 취하여 여기에 염화 칼륨(Samchun Chemicals, Pyeongtaek, Korea) 1.0 g을 물에 녹여 1,000 mL로 한 액 1.0 mL씩을 넣고 pH meter (A210, Thermo Fisher Scientific ORION, Waltham, MA, USA)를 사용하여 두 액의 pH를 3회 측정하고 그 차이를 산출하였다. 이를 총 3회씩 반복수행하여 결과를 확인하였다.
과망간산칼륨을 사용하여 유기물이나 무기물의 존재유무를 확인하는 시험으로, 검액 20 mL를 마개가 달린 삼각 플라스크에 취하여 0.002 mol/L 과망간산칼륨액(Samchun Chemicals, Pyeongtaek, Korea) 20 mL 및 묽은 황산(Duksan, Ansan, Korea) 1 mL를 넣고 마그네틱 교반기(PC-420D, Corning Inc., Corning, NY, USA) 를 이용하여 3분간 끓여 산화 반응을 시켜주었다. 충분히 식힌 다음 요오드화 칼륨(Samchun Chemicals, Pyeongtaek, Korea) 0.1 g을 넣고 마개를 한 다음 흔들어 섞고 10분간 방치한 후 0.01 mol/L 티오황산나트륨액(Deajung Chemicals & Metals, Siheung, Korea)으로 적정하였다. 따로 공시험액 20 mL를 써서 같은 방법으로 조작하였다. 검액 및 공시험액을 적정하는데 소비된 0.002 mol/L 과망간산칼륨액의 차이를 산출하였다.
검액을 가지고 공시험액을 대조로 하여 동물용의약품 공정서의 자외가시부흡광도측정법에 따라 분광광도계(Epoch, Biotek, Winooski, VT, USA)를 이용하여 파장 220~240 nm 및 241~350 nm에서 최대 흡광도를 기록하였다.
검액 20 mL를 취하여 항온수조에서 증발 건조하고 잔류물을 건조기(C-DOD, Chang Shin Science Co., Seoul, Korea)를 이용하여 105 ℃에서 1시간 건조한 후 전기식 지시저울(XS105, Mettler-toledo AG, Greifensee, Switzerland)을 이용해 질량을 측정하였다.
용출물 40 mL를 취하여 묽은 초산(Duksan, Ansan, Korea) 2 mL 및 물 8 mL를 넣어 총 50 mL를 검액으로 하였다. 납표준액(Deajung Chemicals&Metals, Siheung, Korea) 40 mL를 취하여 같은 방법으로 조작하였다. 검액과 비교액에 황화나트륨(Junsei Chemical Co., Tokyo, Japan) 시액 1방울을 각각 넣고 5분간 방치 후, 육안으로 백색 배경에서 검액이 비교액보다 진한지 확인하였다.
BPA 용출 확인을 위해 Table 1. 치과용 기구들을 각각 250 mL 용기에 샘플링 한 후, 4 g 당 20 mL의 물을 넣어 50 ℃에서 72시간 동안 용출하였다. 용출된 검액 중 2 mL를 동결 건조시켰다. 동결 건조된 시료에 2 mL의 메탄올(Samchun Chemicals, Pyeongtaek, Korea)을 넣어 교반 하였다. BPA 표준용액(Sigma-Aldrich Co., St. Louis, Mo, USA)을 농도별로 일정량 취하여 각각 분석하였다. 얻어진 크로마토그래프의 각 피크 면적과 내 표준물질의 면적의 비를 구하여 검량선을 작성하였다.
(1) 기기분석조건
GC/MS (7826A GC/5977E MS, Agilent Technologies, Santa Clara, CA, USA)를 사용하였으며 분석 컬럼은 HP-5MS Ultra Inert (30 m×250 µm, 0.25 µm) (Agilent Technologies, Santa Clara, CA, USA)를 사용하였다. 자세한 기기분석 조건은 Table 2에서 나타냈다.
(2) Target 분석물질
Target 분석물질 Bisphenol A에 대한 정보는 Table 3과 같다.
결 과
1. 치과용 고분자계 손기구의 성상 평가
치과용 고분자계 손기구의 용출물 시험 중 성상에 대한 평가 결과, 모든 검액이 무색, 투명하며 이물질이 없는 것이 확인됐다. 이를 통해 제품의 표면에 붙어있는 입자나 색소의 용출이 없이 없다고 판정하였다.
2. 치과용 고분자계 손기구의 거품 평가
치과용 고분자계 손기구의 용출물 시험 중 거품에 대한 평가 결과, B와 C가 15초로 가장 빠르게 없어졌고, F가 30초로 검액들 중 거품이 없어지기까지 가장 긴 시간이 걸렸다. 검액들의 거품이 없어지는데 걸리는 평균 시간은 (21.2±4.93)초를 나타내었다. 이를 통해 평가에 사용된 고분자계 손기구에서 거품이 발생하는 물질이 포함되지 않았다고 판정하였다.
3. 치과용 고분자계 손기구의 pH 평가
치과용 고분자계 손기구의 용출물 시험 중 pH에 대한 평가 결과, 3회 반복시험한 공시험액의 평균 pH는 (5.57±0.02)였으며 C와 E, J가 각각 (6.72±0.02), (6.73±0.01), (6.77± 0.04)의 결과를 보여 공시험액과 가장 큰 pH차인 1.2를 보였고 K가 평균(6.26±0.01)로 가장 작은 pH차인 0.7을 보였다. 이를 통해 평가에 사용된 고분자계 손기구에서 전위를 가지는 물질이 없는 것으로 판정하였다.
4. 치과용 고분자계 손기구의 과망간산칼륨환원성물질 평가
치과용 고분자계 손기구의 과망간산칼륨환원성물질 평가 결과, 공시험액의 평균 과망간산칼륨액 소비량은 19.5 mL이였으며 검액 중 A와 D, I가 20 mL로 공시험액과 가장 큰 차이를 보였고 B와 E가 19.6 mL로 가장 착은 차이를 보였다.
5. 치과용 고분자계 손기구의 자외가시부흡수스펙트럼 평가
치과용 고분자계 손기구의 자외가시부흡수스펙트럼 평가 결과, 220~240 nm의 영역대에서 흡광도 측정 결과 C가 0.046으로 공시험액과 가장 큰 차이를 보였고 D와 E가 0.011의 가장 작은 차이를 나타냈다. 241~350 nm의 영역대에서 흡광도 측정 결과는 A가 0.043으로 공시험액과 가장 큰 차이를 보였고 E가 0.010으로 가장 작은 차이를 나타냈다.
6. 치과용 고분자계 손기구의 증발잔류물 평가
치과용 고분자계 손기구의 증발잔류물 평가 결과, G와 H가 증발잔류량이 0.8 mg으로 가장 많았고, A와 C, E, I가 0.5 mg으로 가장 적은 양을 보였다. 평가에 사용된 검액들의 평균 증발잔류량은 (0.6±0.12) mg으로 미지의 물질이 용출되지 않았다고 판정하였다.
7. 치과용 고분자계 손기구의 중금속 평가
치과용 고분자계 손기구의 중금속 평가 결과, 평가에 사용된 검액 모두 공시험액에 비해 진하지 않았으며 이는 고분자계 손기구에서 중금속이 용출되지 않았다고 판정하였다.
8. 치과용 고분자계 손기구의 유기물 분해산물 분석
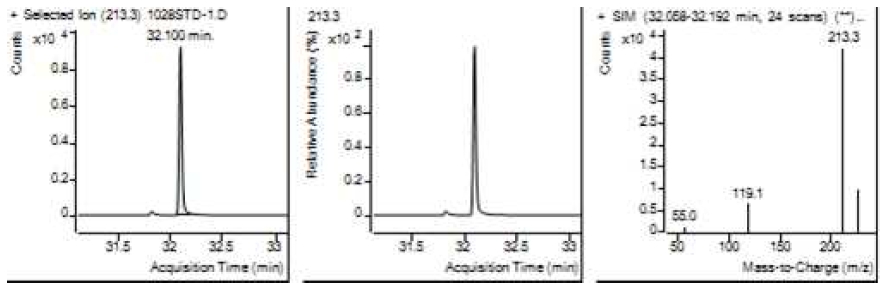
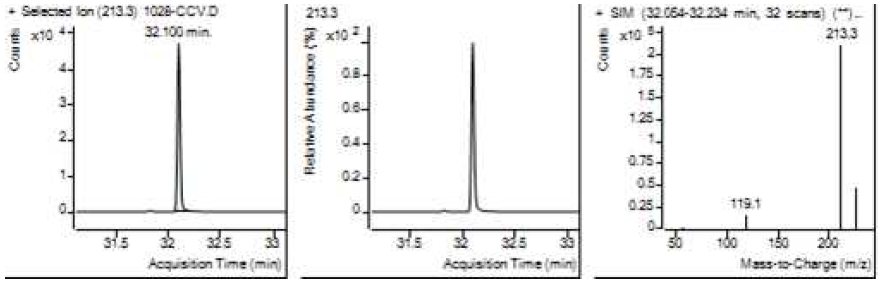
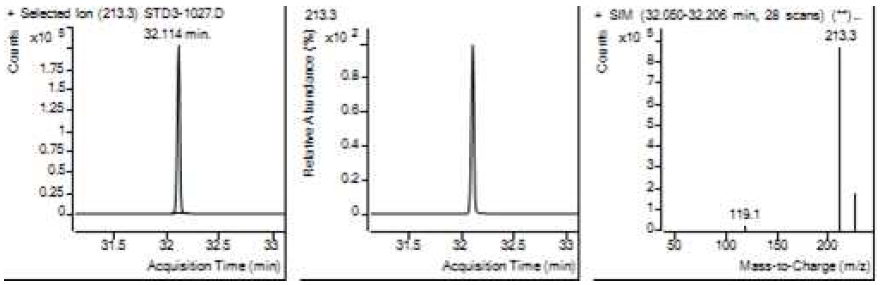
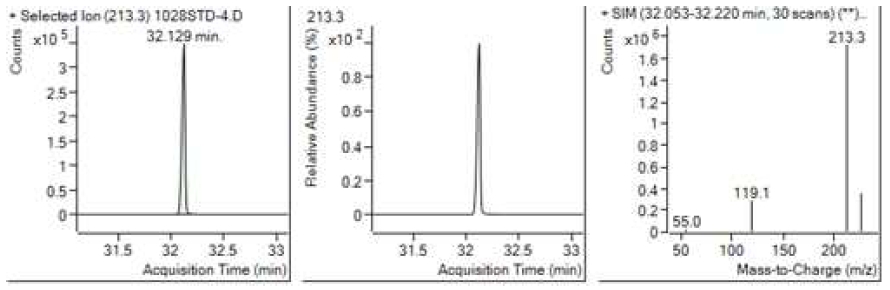
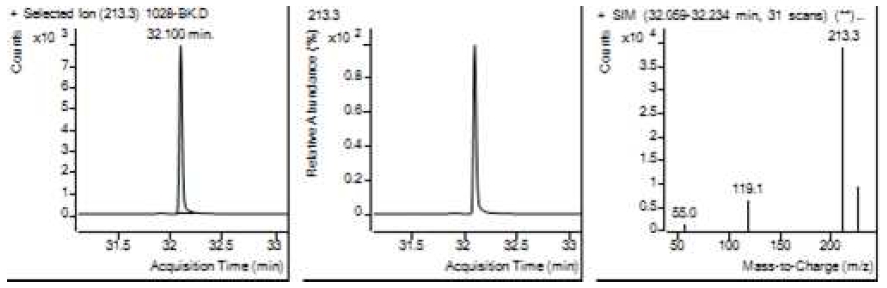
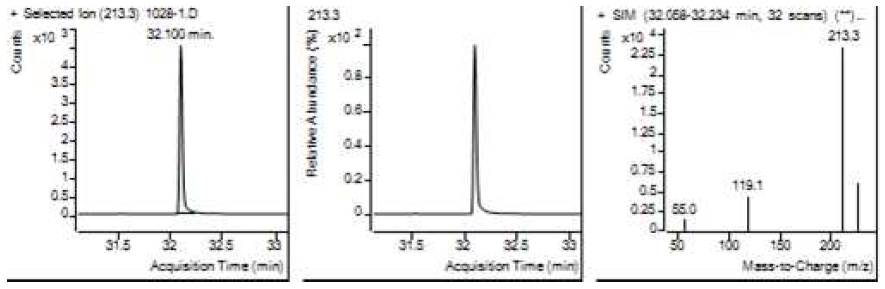
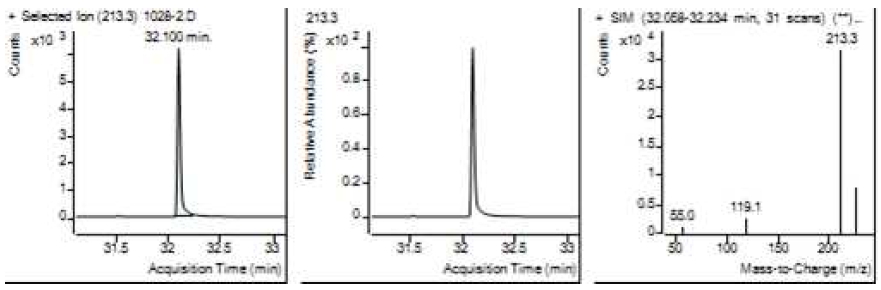
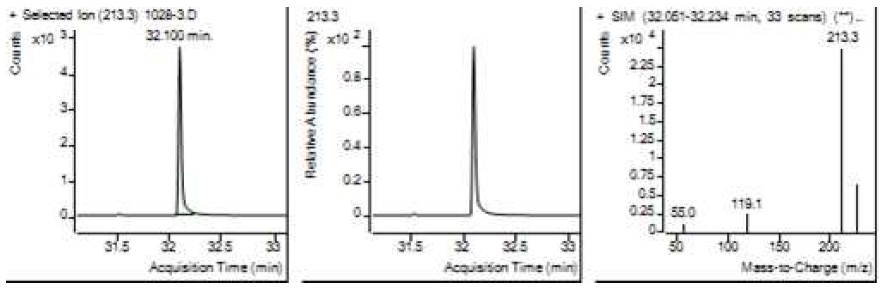
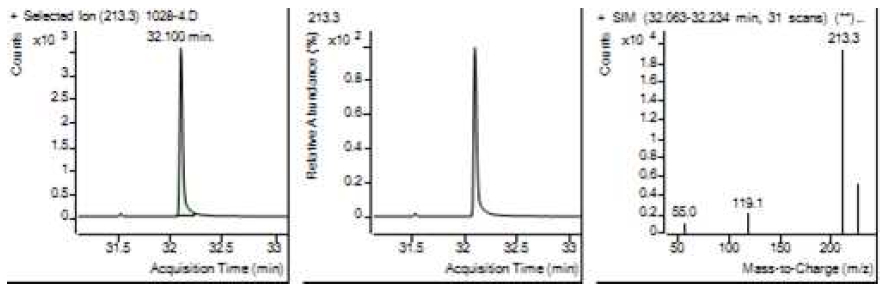
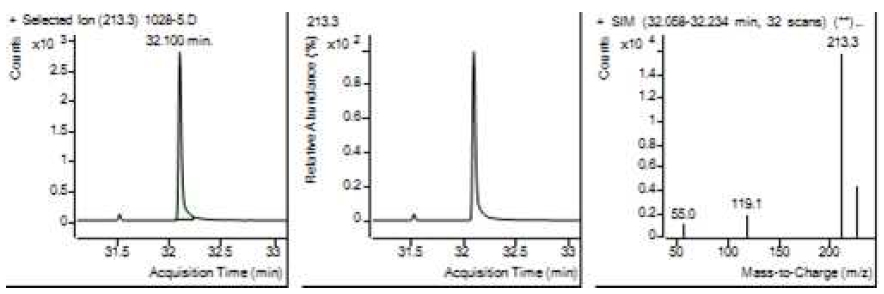
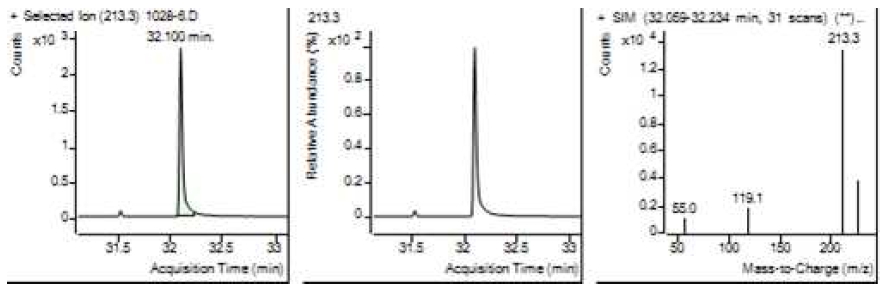
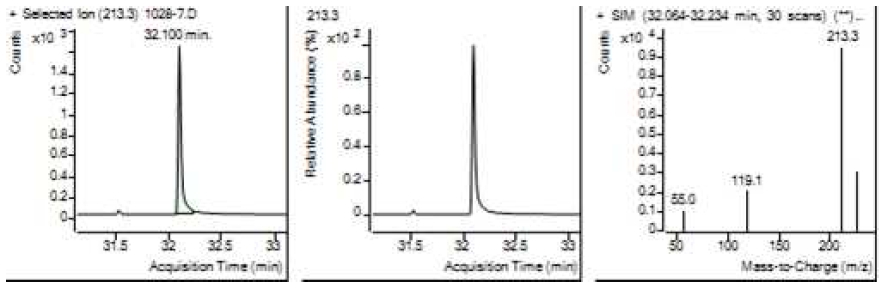
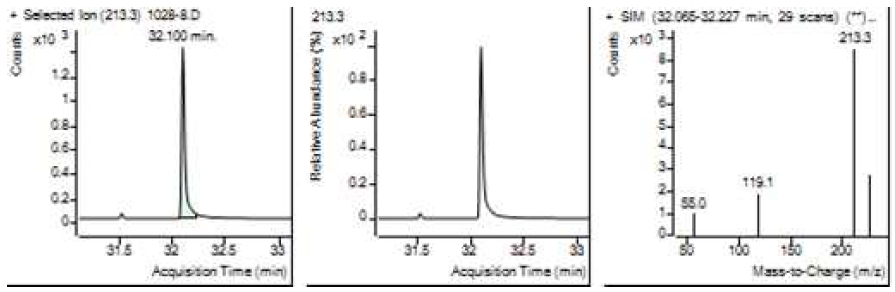
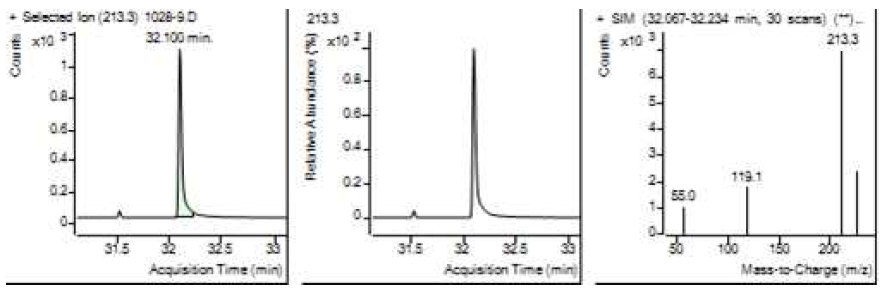
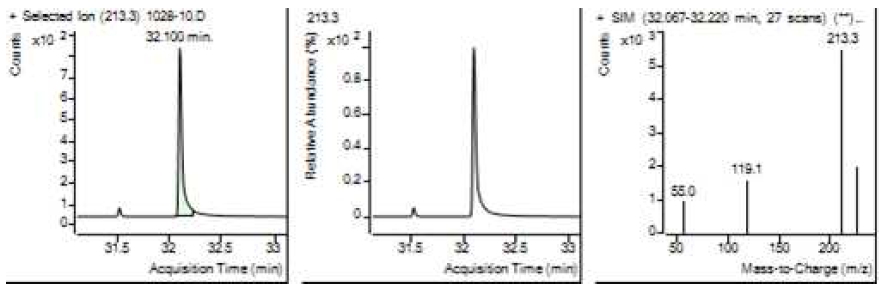
Table 5는 치과용 고분자계 손기구의 유기물 분해산물 분석 결과이고, Figure 1에서 Figure 4는 BPA 표준용액의 농도별 검출 결과이고 Figure 5는 공시험액, Figure 6에서 Figure 15는 검액의 검출 결과이다. GC/MS를 사용하여 BPA 표준용액의 검량선을 그리고 치과용 고분자계 손기구의 용출물에서 BPA 검출한 결과 용출물에서 BPA는 검출되지 않았다.
본 연구에서는 플라스틱 인상용 트레이, 3D 프린팅 레진, 일회용 인상용 트레이, 치실 홀더, 임플란트 스케일러, 외과용 개구기, 구강스캐너 팁, 플라스틱 치경, 워터 픽 등 10종의 치과용 고분자 기구를 선정하여 용출물 시험을 진행하였다. 결과는 성상시험 결과 모든 시료의 검액은 무색이며, 투명하여 이물질이 없었으며, 거품이 거의 없어질 때까지의 시간은 B와 J는 15초, C와 G는 18초, A는 20초, I는 21초, D, E 그리고 H는 25초, F는 30초였다. pH는 공시험액의 0.7~1.2로 나타났으며, 과망산칼륨환원성물질 0.1 ~ 0.5 mL, 자외선가시부흡수스펙트럼 222~240 nm 미만 흡광도는 0.011~0.041, 241~350 nm 미만 흡광도는 0.10~0.043으로 나타났다. 증발잔류량은 0.5~0.8 mg으로, 증금속은 비교액에 비해 진하지 않은 것으로 나타났으며, 용출물 내 BPA 함량은 검출되지 않았다.
GC/MS를 이용한 BPA 표준용액과 치과용 고분자 기구의 BPA 검량 및 검출 결과는 Table 5와 같으며 LOD, LOQ는 각각 0.23 µg/mL, 0.71 µg/mL의 결과를 얻었다.
고 찰
본 연구에서는 고분자 치과용 기구를 대상으로 「의료기기 허가·신고·심사 등에 관한규정」 산환원성물질, 자외가시부흡수스펙트럼, 증발잔류량 그리고 납 함유량을 대한 약전(KP) 플라스틱제의약품용기 용출물 시험법에 따라 분석하였다(6). 이후 얻어진 결과는 Table 4와 같으며 이는 대한 약전(KP) 플라스틱제의약품용기 용출물 시험법 및 중금속 시험법 및 플라스틱제 수성주사제용기 규격의 시험기준 범위 내에 적합하였다(7). 또한 구강내에서 사용되는 손기구의 안전성 및 성능 가이드라인(안)을 마련하여 치과 의료기기 개발 및 연구 기관에 평가 표준을 제시하고 고분자계 손기구의 용출물 분석으로 안전성을 평가하여 치과의료기기 산업의 선진화에 기여하고자 하였다.
하지만, 고분자 기구는 사용하는 환경에 따라 물리 화학적인 변화가 나타날 수 있기 때문에 발열이 되거나 소독, 멸균 또는 구강의 온도 및 습도 등 기구 사용 시 노출되는 주변 환경에 따라 고분자 제품의 기구가 일시적으로 또는 반복적으로 진료에 직접 사용할 수 있는 기구인지 평가하기 위해서는 구강내 사용시의 환경에 따른 기구의 사용 횟수 즉 반복 사용시 멸균 전 후로 평가하기 위해 추가적인 연구가 필요할 것으로 사료된다.
결 론
고분자 소재의 치과용 기구에 대한 용출물 및 유해물질 함유 여부는 치과진료를 통한 고분자 기구가 구강점막과 접촉 시 인체에 위해를 가할 수 있는 요소 중 하나이다. 본 연구에서 사용된 기구는 현재 시판중인 치과용 고분자계 손기구이며 주로 구강 내에서 직접 사용되기 때문에 기구의 손잡이를 제외하고 팁이나 구강 내로 삽입되는 손잡이의 끝 부분에서 접촉되어 고분자의 성분들이 구강 내로 용출될 수 있다고 판단하여 고분자 소재의 치과용 기구들이 식품의약품안전처에서 제시하는 유해물질의 함유 여부와 용출물 시험의 기준에 적합하는지 살펴보았다(8). 치과용 고분자계 10종류의 손기구의 모든 시료의 검액은 무색이며, 투명하고, 이물질이 없으며, 거품이나 pH는 물리화학적 특성의 변화가 없었으며, 과망간산환원성물질, 자외가시부흡수스펙트럼, 중금속과 BPA가 검출되지 않았다. 따라서 이와 같은 분석 결과를 바탕으로 고분자 소재 치과용 기구의 안전성을 평가할 수 있었다.
Acknowledgments
본 연구는 경동대학교와 정부(식품의약품안전처)의 재원으로 범부처전주기의료기기연구개발사업단의 지원을 받아 수행된 연구임(과제번호: RS-2020-KD000271)
References
- Ministry of Food and Drug Safety Medical Device Inspection Department. Guidelines for reviewing data on physicochemical properties of medical device. Chungbuk: 2014.
- Ministry of Food and Drug Safety, Ministry of Food and Drug Safety Evaluation, Medical Device Review Division. Medical Device Extraction Test Review Guidelines. Chungbuk: KATS; 2014.
- Ministry of Food and Drug Safety Medical Device Inspection Department. Study of development of evaluation guideline for extractable test of medical device. Chungbuk: 2016.
- Choi E-M. Cytotoxicity (MTT) evaluation of dental instruments made of polymers. Korean J Convergence Society. 2021;12(8):187-95.
- Study of developmental of evaluation guideline for extractable test of medical device. Food and Drug Safety Evaluation Institute. Chungbuk: KATS; 2016.
- Ministry of Food and Drug Safety, Ministry of Food and Drug Safety Evaluation, Medical Device Review Division. Guidelines for evaluation of extractables by item of medical devices using polymer materials (Guideline for Civil Petitioners). Chungbuk: KATS; 2020.
- Department of Cardiovascular Imaging Devices, Medical Device Review Department, Ministry of Food and Drug Safety, Food and Drug Safety Evaluation Institute. Guidelines for evaluation of extractables by item using medical devices using polymeric materials. Civil petitioner's guide. Chungbuk: KATS; 2020.
- Ministry of Food and Drug Safety, Ministry of Food and Drug Safety Evaluation, Medical Device Review Division. Article 26 Paragraph 1 Subparagraph 4 of the ‘Regulations on Medical Device Permission, Notification, Review, etc.’ of the Medical Device Review Division as a technical document. Chungbuk: KATS; 2014.
- International Organization fot Standardization. ISO 10993-12:2021 – Biological evaluation of medical devices. Geneva: ISO; 2011