양극산화와 순환 석회화전처리하여 개질한 티타늄 메쉬의 이반드로네이트 처리 효과
 ; Kyeong-Seon Kim2
; Kyeong-Seon Kim2 ; Jae-Woo Shin2
; Jae-Woo Shin2 ; Chung-Cha Oh2
; Chung-Cha Oh2 ; Tae-Hwan Kim2
; Tae-Hwan Kim2 ; Yong-Seok Jang2
; Yong-Seok Jang2 ; Min-Ho Lee2
; Min-Ho Lee2 ; Tae-Sung Bae3
; Tae-Sung Bae3 ; Seung-Geun Ahn3, *
; Seung-Geun Ahn3, *
초록
티타늄 메쉬는 결손된 치조제의 증강 및 임플란트 주위 골의 재생을 유도하기 위한 목적으로 사용되고 있으나, 티타늄의 생체 불활성을 개선해야 한다. 본 연구에서는 나노튜브 구조의 TiO2 층이 형성된 티타늄 메쉬에 인산칼슘 코팅층과 이반드로네이트를 탑재하여 생체활성도와 골재생 향상에 대한 효과를 평가하였다. 티타늄 메쉬를 다음의 네 그룹으로 나누어 표면 처리를 시행하였다: (1) 무처리, (2) 나노튜브 TiO2 층 형성, (3) 나노튜브 TiO2 층 형성 후 순환 석회화전처리 (인산칼슘 코팅층), (4) 나노튜브 TiO2 층 형성 후 인산칼슘 코팅 및 이반드로네이트 탑재. 이반드로네이트의 생체 외 방출량은 자외선-가시광선 분광광도계로 분석하였고, 생체활성도는 유사체액에 침지한 후 표면층의 변화를 X-선 회절기, 에너지 분산 분광계 및 고분해능 전계방출 주사전자현미경로 평가하였다. SBF에 침지된 (4) 그룹의 표면에는 수산화인회석이 균일하게 분포되어 있었으며, 시간이 지남에 따라 칼슘과 인의 함량도 증가하여 생체활성이 향상되었다는 것을 확인하였다. 10일 동안 지속적으로 방출된 이반드로네이트는 골과 티타늄 메쉬의 골융합이 강화되는 메커니즘을 실현하는 데 도움이 될 수 있다. 이러한 결과는 나노구조의 티타늄 메쉬 표면에 인산칼슘이 석출됨에 따라 생체활성이 향상되었음을 알 수 있었다. 또한, 결합된 이반드로네이트가 티타늄 메쉬의 안정성을 개선하며 골재생을 유도하는 유효한 수단이 될 수 있을 것으로 생각된다.
Abstract
Titanium mesh is commonly employed to reinforce missing alveolar ridges and promote bone regeneration around implants. However, the bioinertness of titanium mesh must be improved. This study evaluated the effect of improving bioactivity and bone regeneration by loading a calcium phosphate coating layer and ibandronate onto a titanium mesh with a nanotube-structured TiO2 layer. The surface treatment of titanium mesh was divided into four groups: (1) No treatment; (2) Formation of nanotube TiO2 layer; (3) Cyclic calcification pretreatment (calcium phosphate coating layer) after the formation of a nanotube TiO2 layer; (4) Calcium phosphate coating and ibandronate loading after the formation of a nanotube TiO2 layer. The release amount of ibandronate was analyzed using a UV spectrophotometer, and bioactivity was assessed through XRD, EDS, and HR FE-SEM to observe changes in the surface layer after immersion in simulated body fluid (SBF). Hydroxyapatite was uniformly distributed on the surface of the (4) group immersed in SBF, and calcium and phosphorus content also increased over time. This result supported that bioactivity was improved. The continuous release of ibandronate over 10 days may contribute to realizing a mechanism that improves osseointegration between bone and titanium mesh. These results showed that bioactivity was improved as calcium phosphate precipitated on the surface of the nanostructured titanium mesh. Additionally, it is believed that combined ibandronate can effectively increase the stability of titanium mesh and promote bone regeneration.
Keywords:
Ti mesh, Bioactivity, Ibandronate, Anodic oxidation, Cyclic pre-calcification키워드:
티타늄 메쉬, 생체활성, 이반드로네이트, 양극산화, 순환 석회화전처리서론
치조골이 국소적으로 결손된 환자의 임플란트 시술 시는 골량의 증대가 요구되며, 이러한 경우 골이식재와 차폐막을 병용한 골유도재생술이 적용되고 있다(1). 하지만 상기의 방법을 적용하는 경우 구조적인 완전성이 결여되어 있기 때문에 연조직이 압박을 받으면서 일어나는 골이식 재료의 변형이나 위치의 이동이 문제가 되고 있다(2, 3). 차폐막에 대한 초기의 연구에서는 결손된 치조골을 덮어서 연조직의 침투와 외형적인 변형을 막는 것에 주로 관심을 기울였지만(4), 근래에는 결손된 치조제의 증강 및 임플란트 주위골의 재생을 유도하기 위한 목적으로 사용된다(5).
차폐막은 생분해성의 여부에 따라서 비흡수성과 흡수성으로 분류한다. 비흡수성의 차폐막 재료로는 polytetrafluoroethylene (PTFE)계의 수지와 순 티타늄 박판이 널리 사용되고 있다. PTFE 차폐막은 골 결손 공간에서의 혈액 공급이 제한되거나 구강 내에서 노출이 되면 치태가 침착되어 감염을 일으키는 등의 문제점을 보였다. 하지만, 티타늄 메쉬는 혈류공급을 방해하지 않으므로 체액의 교환이 이루어질 수 있고, 소재의 특성상 생체적합성이 우수하므로 노출이 된 경우에도 염증반응이 적고, 세포외기질을 통해 완전한 골유착을 촉진한다. 또한, PTFE 차폐막에 비하여 견고하므로 치유기간 동안에 외형적인 변형을 막을 수 있다는 점에서 주목을 받고 있다(6, 7).
비반응성의 티타늄 표면에 생체활성을 부여하기 위한 초기의 시도에서는 골의 주성분인 하이드록시아파타이트(hydroxyapatite: HA)와 같은 생체활성 세라믹 재료를 코팅하는 방법이 고려되었다(8). 하지만 이 방법을 적용하는 경우 HA 피막층과 하부 티타늄 기판 사이에서 강한 결합을 얻기가 어렵고, 피막층이 상대적으로 두껍게 형성되어 기저로부터 박리가 일어나는 등의 문제점을 보였다(9, 10). 이러한 이유로 티타늄의 골전도성을 개선하기 위한 최근의 연구에서는 HA를 피복한 것과 유사한 효과를 보이면서도 피막층이 쉽게 손상되지 않는 표면처리 방법에 대하여 관심이 모아지고 있다. 그의 대안적인 방법의 하나로서 불소이온을 함유하는 전해질 용액 중에서 양극산화처리를 하여 나노튜브 구조의 TiO2 층을 형성한 후 생체활성 코팅층을 형성하는 순환 석회화전처리 방법에 관심이 집중되어 왔다(11-13). 여러 연구들에서도 나노튜브가 형성된 티타늄 임플란트에 인산칼슘계의 생체활성 물질을 탑재하여 골유착이 촉진되었다고 보고한 바 있다(13, 14).
티타늄 메쉬나 임플란트의 골재생을 향상시키기 위해서는 앞선 연구에서 설명한 나노튜브 TiO2에 인산칼슘과 생체활성 물질을 탑재하거나 약물을 로딩시킬 수 있는데, 비스포스포네이트계 이반드로네이트(Ibandronate: IB) 약물은 골재생을 개선할 수 있는 대표적인 물질이다. IB는 성숙한 파골세포의 흡수성 활성을 억제시키고, 조골세포의 증식, 분화 및 뼈 형성 활동을 직접적으로 향상시키는 것으로 나타났다(15). 특히, 비스포스포네이트와 함께 인산칼슘의 기능화에 대한 관심이 높아지고 있다. 인산칼슘과 비스포스포네이트의 강한 친화력으로 뼈에 대한 국소 투여에 이상적인 전달 시스템으로 작용하며, 이는 장기적인 약물 투여에 대한 부작용을 방지할 수 있다(16).
이에 본 연구에서는 생체활성을 증가시키고, 골재생을 유도하기 위하여 나노튜브 TiO2 층이 형성된 티타늄 메쉬의 표면에 생체활성 물질인 인산칼슘을 석출시키고, IB를 탑재하였다. 표면처리된 티타늄 메쉬의 생체활성도와 IB의 방출 특성에 대하여 조사하였다.
재료 및 방법
1. 시험 시편의 준비
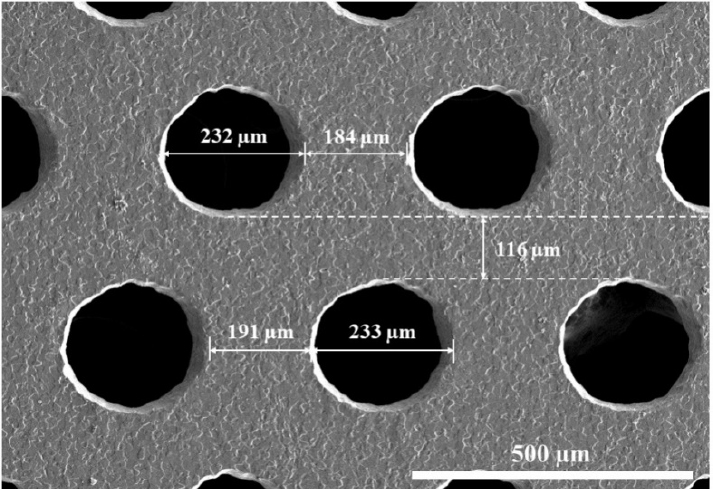
본 연구에서는 두께 100 ㎛ 티타늄 박판에 직경 0.23 ㎜ 홀이 0.19 ㎜ 간격으로 형성되어 있고, 홀들을 연결하는 줄 사이의 간격이 약 0.12 ㎜인 티타늄 메쉬 (TMN35508-S2, Neobiotech, Seoul, Korea)를 10 ㎜ × 10 ㎜ 크기로 절단하여 시험에 사용하였다(Figure 1).
2. 표면 처리
메쉬의 제조과정에서 형성된 표면층의 산화물을 제거하기 위해 HNO3 : HF : H2O를 12 : 7 : 81로 혼합한 용액에 준비한 시편을 10초 동안 침지하여 산세처리를 하였고, 이어서 3차 증류수에서 5분간 초음파 세척을 하고 50 ℃ 건조기에서 24시간 건조 후 양극산화처리에 사용하였다. 이후 나노튜브 TiO2 층을 형성하기 위하여 DC 정전원장치(Inverter Tech Co, Ltd, Gwangju, Korea)의 양극과 음극에 각각 준비한 시편과 백금판을 결선하고 두 전극을 약 20 ㎜ 떨어지도록 위치시킨 다음 1.5 wt% NH4F와 20 wt% H2O를 함유하는 글리세롤 수용액에서 전압 20 V, 전류밀도를 20 ㎃/㎠의 조건에서 1시간 동안 양극산화처리를 하여 나노튜브 TiO2 층을 형성하였다. 이후 시편들을 3차 증류수에서 1분간 초음파 세척한 다음 50 ℃ 건조기에서 24시간 건조하였다.
나노튜브를 형성한 시편을 0.5 vol% 실리카 수용액에 5분 동안 침지한 후 100 ℃에서 1시간 동안 건조하였다. 인산칼슘의 석출을 유도하기 위해 실온에서 0.05 M NH4H2PO4 수용액과 0.01 M Ca(OH)2 수용액을 준비한 후 온도를 90 ℃로 올리고서 침지시간 1분과 외부 유지시간 1분을 주기로 하여 20회 순환 침지처리를 하였다. 이어서 시편들을 전기로(Ajeon Industrial Co, Ltd, Namyang, Korea)에 넣고 승온속도 10 ℃/min으로 500 ℃까지 온도를 올려서 2시간 동안 유지하였다.
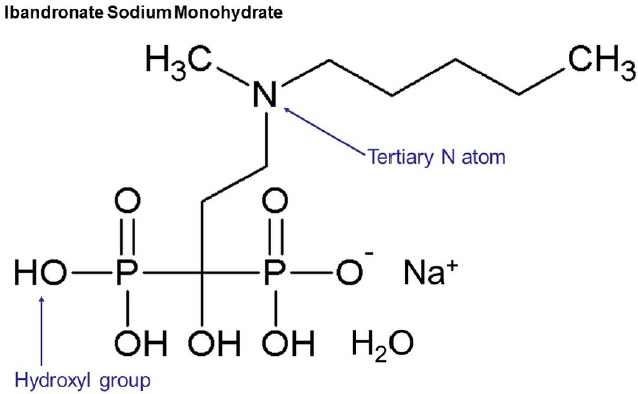
이반드로네이트는 피하주사용으로 제공되는 1 vial Unibone (Unimed Pharm, Seoul, Korea) 3 ㎖를 3등분하여 이반드론산나트륨일수화물(Figure 2)이 1.125 ㎎/㎖ 농도로 희석된 용액을 탑재처리에 사용하였다.
시편들을 각각 준비한 용액 1 ㎖에 10분 동안 침지하고 질소가스로 동결 건조하는 방식으로 3회 반복하였다. 시편을 용액에 침지하는 동안 -0.05 MPa의 음압을 가하였다.
표면 처리에 따른 네 가지 유형의 그룹을 Table 1에 요약하였다.
3. 생체 외 방출시험
IB로 처리한 시편들은 각각 증류수 1 ㎖에 24시간 침지하는 방식으로 10일 동안 반복하였으며, 용출물을 자외선-가시광선 분광광도계(ultraviolet-visible spectrophotometer; V-630, JASCO, Tokyo, Japan)로 wavelength accuracy ± 1 ㎚ 정밀도에서 방출량을 정량적으로 분석하였다.
4. 유사체액 침지시험
생체활성도를 조사하기 위해 pH와 무기이온 농도를 인간의 혈장과 유사하게 조절한 용액(simulated body fluid: SBF)에 준비한 시편들을 침지하고서 표면층의 변화를 조사하였다. SBF는 Hanks’ balanced salt 용액(HBSS; H2387, Sigma-Aldrich, St. Louis, MO, USA)에 calcium chloride dihydrate 0.185 g/L, magnesium sulfate 0.09767 g/L, sodium hydrogen carbonate 0.350 g/L를 첨가하여 제조하였으며, 1 N HCl 수용액을 사용하여 pH를 7.4로 조절하였다. 시편들을 침적한 용액은 3일 간격으로 교체하였다.
5. 표면 분석
표면 처리된 그룹들의 표면층과 SBF 침적 후 표면층의 원소를 X-선 회절기(Dmax Ⅲ-A type, Rigaku, Japan)로 분석하였다. SBF에 침지한 시편들과 비교하기 위하여 고분해능 전계방출 주사전자현미경(HR FE-SEM; SU8230, Hitachi, Japan)으로 표면의 형태학적 미세구조를 관찰하였고, 시편 표면에 부착된 원소의 농도 변화는 에너지 분산 분광계(EDS, Bruker, Germany)으로 분석하였다.
결과
1. 표면 특성
NT 그룹(Figure 3a, d)의 표면에서는, 나노튜브들이 큰 직경의 튜브들 사이에 작은 직경의 튜브들이 생성되는 형태로 치밀한 구조를 이루면서 자가 정렬되는 양상을 보였다. NTCP 그룹(Figure 3b, e)의 표면에서는, 미세한 알갱이 상의 인산칼슘 석출물들이 덩어리(cluster)를 이루며 치밀하게 석출이 되었으며, EDS 분석 결과에서도 Ca와 P가 크게 증가되었다(Table 2). NTCPI 그룹(Figure 3c, f)은 인산칼슘 석출물들이 NTCP 그룹에 비하여 소량 감소된 양상을 보였으나 표면에 고르게 분포하고 있었으며, EDS 분석 결과에서도 Ca와 P가 거의 유사하게 검출되었다(Table 2).
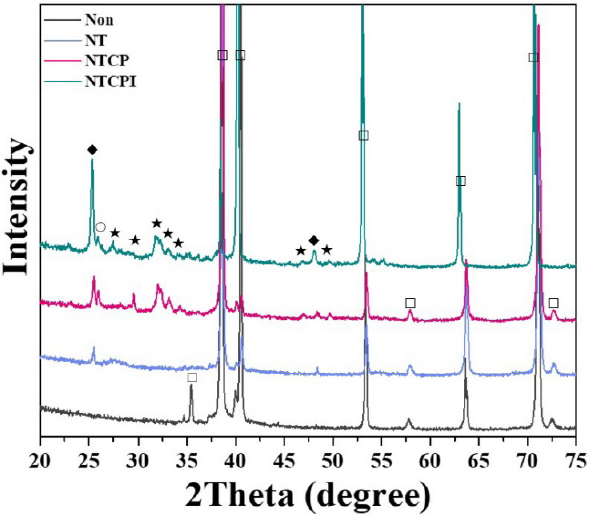
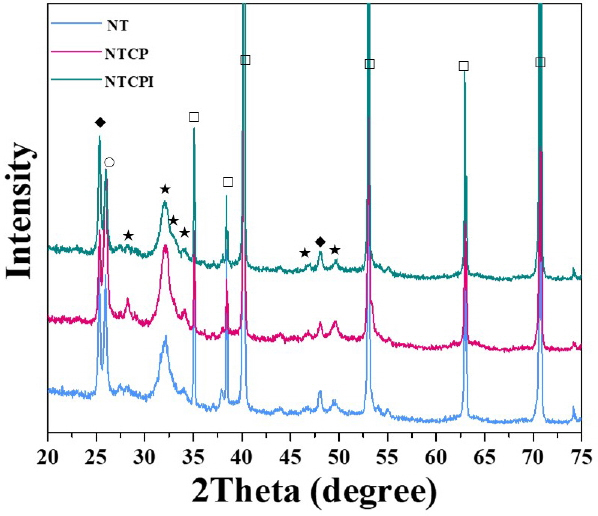
그룹들의 표면에서 검출된 원소들은 Non 그룹에서는 Ti 피크만이 관찰되었고, NT 그룹에서는 Ti 피크와 함께 TiO2 피크가 관찰되었다. NTCP와 NTCPI 그룹들에서는 이들 피크 이외에도 옥타칼슘포스페이트(OCP), HA의 주 피크가 함께 관찰되었다(Figure 4).
2. 생체 외 방출
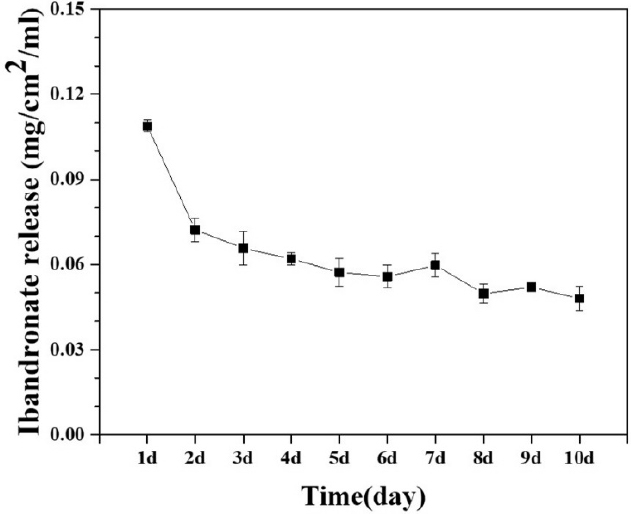
IB가 탑재된 NTCPI 그룹에서는 첫째날에 0.108 mg/cm2/mL가 방출되었고, 그 후 급격하게 감소하였지만 10일째까지 지속 방출되었다(Figure 5).
3. 유사체액 침지
SBF에 10일간 침적한 결과 NT (Figure 6a, d), NTCP (Figure 6b, e) 및 NTCPI 그룹(Figure 6c, f)에서 HA 석출 시 관찰되는 돌기상들이 치밀한 구조로 석출되었고, EDS 분석 결과 SBF 침적 전(Table 2)과 비교하여 Ca와 P의 함량이 증가하였다(Table 3). 특히, NTCP와 NTCPI 그룹에서는 돌기상들이 두께방향으로 중첩이 되며 성장하는 양상을 보였고(Figure 6), Ca/P의 함량이 크게 증가하였음을 확인하였다(Table 3).
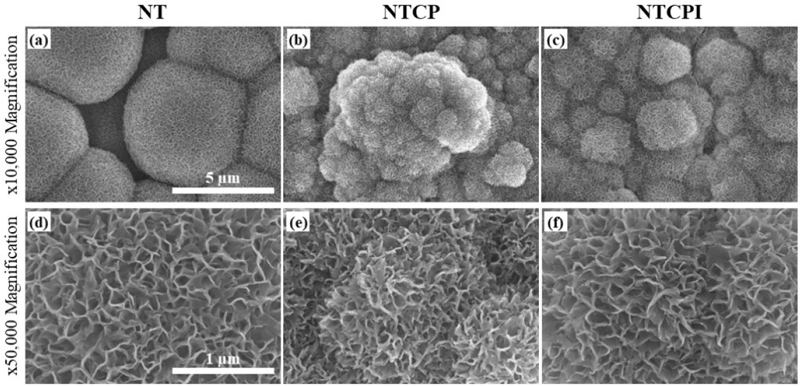
HR FE-SEM images of the NT (a, d), the NTCP (b, e), and the NTCPI groups (c, f) after immersion in SBF for 10 days.
Ti, TiO2 피크만 관찰되던 NT 그룹의 표면에서는 SBF에 침적한 후 HA와 octacalcium phosphate 피크가 관찰되었다. NTCP 및 NTCPI 그룹들에서는 SBF 침적 전과 비교하여 HA 상의 침전 증가가 관찰되었다(Figure 7).
고찰
임플란트 수술의 장기적인 성공을 위해서는 잠재적 임플란트 이식 부위에 충분한 양과 질의 치조골이 있어야 한다. 해결 방법으로 골이식재와 차폐막을 병용한 골유도재생술이 시행되고 있지만, 차폐막의 종류에 따라서 강성이 부족하여 붕괴되거나, 연조직의 성장을 차단하지 못하여 조기 흡수가 발생하는 경우가 있다(18).
다양한 연구에 따르면 티타늄 메쉬는 e-PTFE계 막이나 흡수성 막보다 신생 치조골의 공간을 예측 가능하게 유지하고, 붕괴에 저항력이 높다고 알려져 있다(19, 20). 또한, 뼈 재생에 티타늄 메쉬를 사용하면 상피 세포와 섬유아세포가 결함으로 이동하는 것을 방지하고, 이는 골조상(osteoprogenitor) 세포가 해당 부위에 도달하여 새로운 뼈를 재생성하도록 돕는다(21). 하지만, 티타늄은 생체 불활성 물질로 간주되어서 표면적을 증가시키는 나노기술을 적용하고, HA, 바이오글라스 및 글라스-세라믹과 같은 생체활성물질을 코팅하거나 골형성을 유도하는 약물 등을 담지해야 골전도성을 갖게 된다(22).
나노 튜브가 형성된 표면은 표면에너지의 증가, 생체 적합성 및 시험관 내 표면에 대한 조골 세포 접착력에 영향을 미친다(23). 본 연구에서는 티타늄 메쉬에 양극산화처리로 균일하게 자가 정렬된 나노튜브 TiO2 층을 형성하였고(Figure 3a, d), SBF에 침지하여 생체 활성을 평가하였다. 그 결과 표면에 HA 침전물이 형성되었고(Figure 6), 칼슘과 인산 이온이 검출되었다(Table 3). 이는 형성된 나노튜브 TiO2 층이 SBF와 상호작용하여 HA의 핵생성과 SBF에서 칼슘과 인산 이온을 흡수하여 자발적으로 HA의 형성이 발생한다는 문헌의 결과와 일치한다(24).
이온 주입, 알칼리처리, 플라즈마 스프레이 코팅 및 순환 석회화전처리와 같은 표면 개질 기술은 티타늄 표면의 화학적 조성, 거칠기 및 형태를 변화시킴으로써 티타늄의 생체 활성을 효과적으로 향상시킨다(25). 그 중 순환 석회화전처리는 칼슘과 인산염 이온이 함유된 수용액과 티타늄 표면의 TiO2 사이의 산-염기 반응을 유도하는 방법이다(26). NTCP와 NTCPI 그룹을 SBF에 침지하였을 때 단기간에 HA 돌기상이 치밀한 구조를 이루며 두께방향으로 성장하였고(Figure 6), X-선 회절분석 결과 이들은 HA와 OCP로 확인되어 생체활성도가 개선되었음을 알 수 있었다(Figure 7). 나노 구조 표면과 적절한 결정상 및 생체 활성 HA의 조합은 티타늄 메쉬의 생체 활성 및 생체 적합성을 향상시킬 수 있으며 이는 골유착을 향상시킬 수 있음을 시사합니다(27).
IB는 파골세포의 기능을 억제하는 비스포스포네이트계의 약물로서 파골세포 내 세포골격이 파괴되며 골 흡수의 기능을 상실시킨다. 또한, 인산칼슘과 결합된 IB의 지속 방출은 파골세포 전구체의 모집 및 분화 억제, 성숙한 파골세포에 의한 재흡수 억제, 성숙한 파골세포의 세포사멸을 촉진하여, 강력하게 골의 흡수를 억제한다(28). 본 연구에서는 나노튜브 TiO2 층이 형성된 티타늄 메쉬에 인산칼슘을 석출시킨 후 IB를 담지하였고, 골재생 유도를 위한 생체활성도를 조사하였다. 그 결과, 10일이 경과할 때까지 티타늄 메쉬에서 IB가 지속해서 방출되었고(Figure 5), 파골세포의 기능 억제와 조골세포의 증식, 분화 및 뼈 형성 활동에 기여할 수 있을 것으로 생각된다. IB의 분자는 2개의 공유결합 곁사슬로 R1과 R2 치환기를 갖고 있어서 R1 치환기의 -OH는 칼슘과 결합하고, R2 치환기의 질소는 HA의 하이드록실기와 결합하여 N-H-O 수소 결합을 형성한다(17)(Figure 2). 여러 연구들에서 티타늄 상에 인산칼슘을 코팅하고, 비스포스포네이트계 약물을 흡착하는 방법으로 골형성 효과에 대해서 뒷받침하고 있다. 문헌에 따르면 HA가 코팅된 티타늄 임플란트에 IB를 국소적으로 적용하여 초기 골 형성 비율을 증가시키는 것으로 알려졌다(29). Gao 등(30)은 HA로 코팅된 티타늄 임플란트에 IB 용액을 침지한 후 난소절제술을 받은 쥐의 경골에 삽입하였다. 3개월 후 처리된 임플란트 주위의 골밀도가 증가하였고, 신생골의 형성도 증가하였다는 연구 결과를 얻었다. 또한, Niu 등(31)은 비스포스포네이트-HA 복합 코팅된 임플란트에서 첫 주 동안 방출된 비스포스포네이트는 파골세포 활성을 억제하였고, 나머지는 11주 동안 점진적으로 방출되면서 임플란트 주위의 지속적인 저농도의 약물을 보장하고 임플란트 주위 골 형성에 도움을 주었다고 하였다.
양극산화처리를 하여 나노튜브 구조의 TiO2 층을 형성하고, 인산칼슘 코팅층과 결합한 골형성 유도 약물로(이반드로네이트) 처리된 티타늄 메쉬의 생체 활성이 증가하였음을 확인하였고, 앞선 연구들의 결과를 미루어 볼 때 임플란트 매식부의 골재생을 유도하는데 있어서 유용한 방법이 될 수 있을 것으로 생각된다. 그러나 본 연구에는 몇 가지 한계점이 있다. 첫째, 한 가지의 약물 탑재 조건에서만 실험하였으나, 후속 연구를 통해 탑재되는 약물의 양을 늘리고 방출을 조절하기 위한 추가적인 노력이 필요하다. 둘째, 약물의 원리와 효과를 입증할 수 있는 시험관 내 및 생체 내 분석이 필요하다.
결론
본 연구에서는 티타늄 메쉬의 생체 불활성을 개선하고자 나노튜브 구조의 TiO2 층을 형성하였고, 생체활성 물질인 인산칼슘을 코팅한 후 이반드로네이트를 탑재하여 결합하였다. 생체활성을 향상시켰다는 결과로 SBF 용액에 침지된 NTCPI 그룹의 표면에는 수산화인회석이 균일하게 분포되어 있었으며, 시간이 지남에 따라 칼슘과 인의 함량도 증가하였다. 10일 동안 지속해서 방출된 이반드로네이트는 생체적합성을 높이고, 골과 티타늄 메쉬의 골융합을 강화하는 메커니즘을 실현하는 데 도움이 될 수 있다. 또한, 연구에 사용된 인산칼슘 코팅 방법은 약물 전달 시스템 분야에 유용하게 이용될 수 있다.
References
-
Abu-Mostafa NA, Alotaibi YN, Alkahtani RN, Almutairi FK, Alfaifi AA, Alshahrani OD. The outcomes of vertical alveolar bone augmentation by guided bone regeneration with titanium mesh: a systematic review. J Contemp Dent Pract. 2023;23(12):1280-8.
[https://doi.org/10.5005/jp-journals-10024-3444]

-
Lee SH, Moon JH, Jeong CM, Bae EB, Park CE, Jeon GR, et al. The mechanical properties and biometrical effect of 3D preformed titanium membrane for guided bone regeneration on alveolar bone defect. Biomed Res Int. 2017;2017:1-12.
[https://doi.org/10.1155/2017/7102123]

-
Levin L, Clark Perry D. Use of a novel in situ hardening biphasic alloplastic bone grafting material for guided bone regeneration around dental implants: a prospective case series. Clin Adv Periodontics. 2022;12(1):12-6.
[https://doi.org/10.1002/cap.10141]

-
Tamburaci S, Tihminlioglu F. Development of Si doped nano hydroxyapatite reinforced bilayer chitosan nanocomposite barrier membranes for guided bone regeneration. Mater Sci Eng C-Mater Biol Appl. 2021;128:112298.
[https://doi.org/10.1016/j.msec.2021.112298]

-
Aprile P, Letourneur D, Simon Yarza T. Membranes for guided bone regeneration: a road from bench to bedside. Adv Healthc Mater. 2020;9(19):2000707.
[https://doi.org/10.1002/adhm.202000707]

-
Kim K, Su Y, Kucine AJ, Cheng K, Zhu D. Guided bone regeneration using barrier membrane in dental applications. ACS Biomater Sci Eng. 2023.
[https://doi.org/10.1021/acsbiomaterials.3c00690]

-
Li J, Jansen JA, Walboomers XF, van den Beucken JJ. Mechanical aspects of dental implants and osseointegration: A narrative review. J Mech Behav Biomed Mater. 2020;103:103574.
[https://doi.org/10.1016/j.jmbbm.2019.103574]

-
Fu C, Song B, Wan C, Savino K, Wang Y, Zhang X, et al. Electrochemical growth of composite hydroxyapatite coatings for controlled release. Surf Coat Technol. 2015;276:618-25.
[https://doi.org/10.1016/j.surfcoat.2015.06.007]

-
Mohseni E, Zalnezhad E, Bushroa AR. Comparative investigation on the adhesion of hydroxyapatite coating on Ti–6Al–4V implant: A review paper. Int J Adhes Adhes. 2014;48:238-57.
[https://doi.org/10.1016/j.ijadhadh.2013.09.030]

-
Sun L, Berndt CC, Gross KA, Kucuk A. Material fundamentals and clinical performance of plasma‐sprayed hydroxyapatite coatings: A review. J Biomed Mater Res. 2001;58(5):570-92.
[https://doi.org/10.1002/jbm.1056]

-
Minagar S, Berndt CC, Wang J, Ivanova E, Wen C. A review of the application of anodization for the fabrication of nanotubes on metal implant surfaces. Acta Biomater. 2012;8(8):2875-88.
[https://doi.org/10.1016/j.actbio.2012.04.005]

-
Barjaktarević DR, Cvijović-Alagić I, Dimić I, Đokić VR, Rakin MP. Anodization of Ti-based materials for biomedical applications: A review. Metall Mater Eng. 2016;22(3):129-43.
[https://doi.org/10.30544/209]

-
Kodama A, Bauer S, Komatsu A, Asoh H, Ono S, Schmuki P. Bioactivation of titanium surfaces using coatings of TiO2 nanotubes rapidly pre-loaded with synthetic hydroxyapatite. Acta Biomater. 2009;5(6):2322-30.
[https://doi.org/10.1016/j.actbio.2009.02.032]

-
Nguyen TDT, Moon SH, Oh TJ, Park IS, Lee MH, Bae TS. The effect of APH treatment on surface bonding and osseointegration of Ti‐6Al‐7Nb implants: An in vitro and in vivo study. J Biomed Mater Res Part B. 2015;103(3):641-8.
[https://doi.org/10.1002/jbm.b.33210]

-
Nepal M, Li L, Bae TS, Kim BI, Soh YJ. Evaluation of osseointegration around tibial implants in rats by ibandronate-treated nanotubular ti-32nb-5zr alloy. Biomol Ther. 2014;22(6):563.
[https://doi.org/10.4062/biomolther.2014.111]

-
Bigi A, Boanini E. Calcium phosphates as delivery systems for bisphosphonates. J Func Biomater. 2018;9(1):6.
[https://doi.org/10.3390/jfb9010006]

-
Russell R, Watts N, Ebetino F, Rogers M. Mechanisms of action of bisphosphonates: similarities and differences and their potential influence on clinical efficacy. Osteoporos Int. 2008;19:733-59.
[https://doi.org/10.1007/s00198-007-0540-8]

-
Louis PJ, Gutta R, Said-Al-Naief N, Bartolucci AA. Reconstruction of the maxilla and mandible with particulate bone graft and titanium mesh for implant placement. J Oral Maxillofac Surg. 2008;66(2):235-45.
[https://doi.org/10.1016/j.joms.2007.08.022]

-
Black BS, Gher ME, Sandifer JB, Fucini SE, Richardson AC. Comparative study of collagen and expanded polytetrafluoroethylene membranes in the treatment of human class II furcation defects. J Periodont. 1994;65(6):598-604.
[https://doi.org/10.1902/jop.1994.65.6.598]

-
Patel M, Langdon J. Titanium mesh (TiMesh) osteosynthesis: a fast and adaptable method of semi-rigid fixation. Br J Oral Maxillofac Surg. 1991;29(5):316-24.
[https://doi.org/10.1016/0266-4356(91)90118-O]

-
Briguglio F, Falcomatà D, Marconcini S, Fiorillo L, Briguglio R, Farronato D. The use of titanium mesh in guided bone regeneration: a systematic review. Int J Dent. 2019;2019.
[https://doi.org/10.1155/2019/9065423]

-
Fujibayashi S, Neo M, Kim HM, Kokubo T, Nakamura T. Osteoinduction of porous bioactive titanium metal. Biomaterials. 2004;25(3):443-50.
[https://doi.org/10.1016/S0142-9612(03)00551-9]

-
Liu Z, Liu X, Ramakrishna S. Surface engineering of biomaterials in orthopedic and dental implants: Strategies to improve osteointegration, bacteriostatic and bactericidal activities. Biotechnol J. 2021;16(7):1-23.
[https://doi.org/10.1002/biot.202000116]

-
Baino F, Yamaguchi S. The use of simulated body fluid (SBF) for assessing materials bioactivity in the context of tissue engineering: review and challenges. Biomimetics. 2020;5(4):57.
[https://doi.org/10.3390/biomimetics5040057]

-
Chen X, Zhu RF, Gao H, Xu WL, Xiao GY, Chen CZ, et al. A high bioactive alkali-treated titanium surface induced by induction heat treatment. Surf Coat Technol. 2020;385:125362.
[https://doi.org/10.1016/j.surfcoat.2020.125362]

-
Park JH, Hwang JY, Won EK, Kim YW, Yang KR, Jeon WY, et al. Effect of cyclic pre-calcification treatment on bioactivity of Ti-6Al-4V alloy orthodontic miniscrew. Korean J Dent Mater. 2021;48(4):245-54.
[https://doi.org/10.14815/kjdm.2021.48.4.245]

-
Jiang P, Zhang Y, Hu R, Wang X, Lai Y, Rui G, et al. Hydroxyapatite-modified micro/nanostructured titania surfaces with different crystalline phases for osteoblast regulation. Bioact Mater. 2021;6(4):1118-29.
[https://doi.org/10.1016/j.bioactmat.2020.10.006]

-
Byeon SM, Jeon J, Jang YS, Jeon WY, Lee MH, Jeon YM, et al. Evaluation of osseointegration of Ti-6Al-4V alloy orthodontic mini-screws with ibandronate-loaded TiO2 nanotube layer. Dent Mater J. 2023;42(4):610-6.
[https://doi.org/10.4012/dmj.2023-021]

-
Yoshinari M, Oda Y, Inoue T, Matsuzaka K, Shimono M. Bone response to calcium phosphate-coated and bisphosphonate-immobilized titanium implants. Biomaterials. 2002;23(14):2879-85.
[https://doi.org/10.1016/S0142-9612(01)00415-X]

-
Gao Y, Zou S, Liu X, Bao C, Hu J. The effect of surface immobilized bisphosphonates on the fixation of hydroxyapatite-coated titanium implants in ovariectomized rats. Biomaterials. 2009;30(9):1790-6.
[https://doi.org/10.1016/j.biomaterials.2008.12.025]

-
Niu S, Cao X, Zhang Y, Zhu Q, Zhu J. The inhibitory effect of alendronate-hydroxyapatite composite coating on wear debris-induced peri-implant high bone turnover. J Surg Res. 2013;179(1):e107-15.
[https://doi.org/10.1016/j.jss.2012.02.003]