광기능성 Ni-Ti-O 나노튜브의 항균성 평가
초록
Ni-Ti-O 나노튜브는 낮은 에너지 밴드갭으로 인해 가시광 매개 광흡수와 광촉매의 가능성을 가지고 있다. 그러나 가시광선 조사에 의한 광촉매 기반 항균 활성은 아직 불분명하다. 본 연구의 목적은 Ni-Ti-O 나노튜브의 광촉매 기반의 광 특성을 분석하고 항균 활성을 평가하는 것이다. Ni-Ti-O 나노튜브를 FE-SEM으로 관찰한 결과, 길이 600 ± 80 ㎚, 외경 52 ± 5 ㎚의 깨끗하고 균질한 나노튜브가 형성되었다. Ni-Ti-O 나노튜브의 확산반사 분석결과, 450 nm에 해당되는 광촉매 밴드갭을 나타내어 가시광선 범위에서의 광촉매 효과를 발현하는 것을 확인하였다. 그리고 Streptococcus sanguinis를 이용한 CFU 항균 실험 및 SOD 효소 활성 실험은 470 nm 가시광선 조사 하에서의 Ni-Ti-O 나노튜브 실험군이 다른 실험군들에 비하여 통계적으로 유의차 있게 항균능을 나타내었다(P<0.05). 따라서, Ni-Ti-O 나노튜브와 가시광 기반 광기능화의 결합은 치과분야에서 NiTi 임플란트 소재의 항균능을 향상시킬 것으로 기대된다.
Abstract
Ni-Ti-O nanotubes have the potential for visible light-mediated light absorption and photocatalysis due to their low energy band gap. However, their photocatalytic-based antibacterial activity under visible light irradiation is still unclear. This study aims to analyze the photocatalytic-based optical properties of Ni-Ti-O nanotubes and evaluate their antibacterial activity. From the FE-SEM observations of the Ni-Ti-O nanotubes, clean and homogeneous nanotubes with a length of 600 ± 80 ㎚ and an outer diameter of 52 ± 5 ㎚ were observed. The diffuse reflection analysis of the Ni-Ti-O nanotubes showed a photocatalytic bandgap, which is equivalent to the wavenumber of 450 nm, indicating that they exhibit photocatalytic effects in the visible light range. The CFU antibacterial test and SOD enzyme activity test using Streptococcus sanguinis showed that the Ni-Ti-O nanotube experimental group under 470 nm visible light irradiation exhibited statistically significant antibacterial activity compared to other experimental groups (P< 0.05). Therefore, the combination of Ni-Ti-O nanotubes and visible light-based photofunctionalization is expected to improve the antibacterial ability of NiTi implant materials in the dental field.
Keywords:
NiTi ally, Ni-Ti-O nanotubes, Visible light mediated antibacterial effect키워드:
NiTi 합금, Ni-Ti-O 나노튜브, 가시광 매개 항균효과서 론
NiTi 합금은 초탄성 및 형상 기억을 포함한 고유한 기계적 특성으로 인해 정형외과, 치과 교정용 와이어 등 의료 장치 개발에 사용된다(1, 2). 각각의 응용 분야에는 탄성과 같은 고유한 물질의 특성과 세포 접착의 강화 또는 감소를 담당하는 표면 특성이 필요하다. 특히 NiTi 합금은 낮은 탄성 계수로 인해 빠른 치유가 가능하고 주변 조직과의 외상을 최소화하므로 임플란트의 이상적인 재료이기도 하다(3, 4). 하지만 NiTi 임플란트는 마모되기 쉬운 환경에 장기간 접촉되어 있어 기계적 응력이나 결함은 산화물 층을 파괴하여 체액이나 조직과의 접촉으로 인해 재료의 전기화학적 부식을 유발한다. 이로 인해 임플란트의 기능 저하를 초래할 수 있으며, 부식 생성물은 장기간 노출 시 독성 및 알레르기 반응의 발생과 유기체의 염증 반응을 시작할 수 있으며, 이는 임플란트의 거부 및 재수술로 이어질 수 있는 이식 실패 가능성 증가로 인해 실제 적용이 제한된다(5-8).
현재까지 이러한 단점을 극복하기 위해 NiTi 합금의 효율적인 제조 방법 및 매개변수 제어 등 표면 개질 기술 같은 전략이 제안되고 있고(9-12), NiTi 합금의 표면 개질은 다양한 세포와 박테리아의 거동에 영향을 미칠 뿐만 아니라 내부식성을 증가시키고 니켈(Ni) 이온 방출을 감소시키는 산화물 층의 특성을 향상시킨다고 보고하였다(13-15). 임플란트 관련 감염으로 인한 박테리아의 집락화와 생존력의 영향은 여전히 해결해야 할 문제이다. 박테리아가 임플란트 표면에 결합하여 생물막을 형성하기 시작하면 임플란트가 주변 조직과 결합되는 것을 방해하고 많은 합병증을 초래할 수 있다(16).
NiTi 합금의 나노구조 표면 개질 방법 중 양극산화(anodization)는 티타늄(Ti)과 그 합금의 표면 산화물 층의 두께를 증가시키고, 최적의 조건에서 전기화학적 자기조직화가 일어나 원하는 정렬된 나노 구조를 생성할 수 있다(17). 양극산화방법을 통해 NiTi 합금 표면에 Ni-Ti-O 나노튜브 구조를 형성하는 것은 티타니아(TiO2)로 균질하고 균일하며 니켈 (Ni2+)방출에 대한 증가된 장벽 역할을 하여 생체 기능성을 향상시키는데 효과적인 것으로 알려졌고(18), 더욱이 양극산화는 전기화학적 공정이기 때문에 전기장의 도움을 받아 합금의 모든 원소는 산화될 수 있어 열 산화 후 NiTi 합금의 니켈(Ni)이 풍부한 층과 같은 산화되지 않은 하위 층을 제거할 수 있다고 보고하였다(19).
광촉매 효과(photocatalytic effect)는 빛 에너지를 받아 광화학 반응을 가속화시키는 물질을 말하며, 밴드갭(band gap) 에너지 이상의 빛을 받아 전자가 가전도대(valence band)에서 전도대(conduction band)로 올라 전기전도도가 증가할 수 있는 물질을 반도체라고 한다.
티타니아(TiO2)는 반도체 특성을 가지고 있는 재료 중의 하나로서 라디칼-티타늄 반응에 의해 미생물 세포의 활성 산소종(Reactive oxygen species, ROS)을 생성하고 활성 산소종(ROS)은 호흡 사슬 파괴로 인해 간접적으로 유도되거나 그 자체에 의해 직접적으로 유도된다(20, 21). 활성 산소종(ROS)의 과도한 증가는 심각한 산화 스트레스를 통해 모든 세포의 거대분자에 손상을 주어 지질과산화, 단백질 변형, 효소 억제, RNA 및 DNA 손상을 초래하고, 불균형된 활성 산소종(ROS)은 결국 세포 사멸을 일으키고 심각한 DNA 손상과 돌연변이를 유발한다(22, 23). Matejka와 Tokarsk (24)는 활성 산소종(ROS)의 생성이 가시광선이나 자외선(UV) 광에 의해 유도되는 경우 금속, 금속산화물 등의 항균활성을 광촉매 효과로 보고하였고, Maness (25) 등은 근자외선 광에서 티타니아(TiO2)는 지질 과산화를 유도하여 대장균 세포의 사망을 초래하는 것으로 보고하였다. 하지만, 니켈 티타늄 산화물(nickel titanate, NiTiO3)은 가시광선 영역에 감응할 수 있는 낮은 에너지 밴드갭(2.2 eV)을 가지고 있어 높은 광 활성 특성(26)과 NiTi 합금의 표면 개질 기술 등을 적용한 항균 활성 등 많은 연구를 통해 보고되었지만(27-29) 그럼에도 불구하고 여러 종류의 미생물 균이 아닌 한정된 미생물 균에 불과하였고 가시광선 기반의 항균활성은 아직도 불분명한 상태이다.
본 연구에서는 NiTi 합금 표면 위에 Ni-Ti-O 나노튜브를 제작하여 표면 분석 및 광학적 특성을 평가하고 가시광선 기반 광촉매 항균 활성 효과를 평가하고자 한다.
재료 및 방법
1. Ni-Ti-O 나노튜브의 시편 제작
NiTi 합금 판(Thickness; 0.127 mm, 5 x 5 cm2; Thermo Fisher Scientific, Ward Hill, MA, USA)을 이용하여 Ni-Ti-O 나노튜브 시편을 제조하였다. 표면의 이물질을 제거하기 위하여 600번, 1200번, 및 2000번의 Silicon carbide paper로 순차적으로 표면 연마를 수행하였다. 연마 후 0.2 wt% 불화 암모늄(NH4F, Sigma-Aldrich, St. Louis, MO, USA)및 1.0 vol% 물(H2O, J. T. Baker Chemical Inc, Phillipsburg, NJ, USA)이 포함된 에틸렌글리콜(Ethylene glycol, Sigma-Aldrich, St. Louis, MO, USA) 전해질 용액으로 양극산화(25 V, 1시간) 하였다. 양극산화 완료 후, 헵탄(Sigma-Aldrich, St. Louis, MO, USA)에 5분 담지 후 초음파 세척기(100 watt, 40 KHz, SD-D200H, Sungdong Ultrasonic Co., Seoul, Korea)를 이용하여 증류수에 초음파 세정을 시행하였다. 세척과정이 완료된 시편은 60 ℃ 오븐에서 24시간 건조시키고, 건조된 시편은 열처리 과정을 거쳐 최종 시편을 제작하였다(400 ℃, 3시간, 공기 중 열처리, 승온 및 냉각속도 = 1 K/min).
2. Ni-Ti-O 나노튜브의 특성분석
Ni-Ti-O 나노튜브의 미세구조 및 형태는 전계방사 주사전자현미경(Field emission scanning electron microscope: FE-SEM, JSM-6360, JEOL Ltd., Tokyo, Japan)으로 관찰하였다. 또한, Ni-Ti-O 나노튜브의 흡광도를 측정하기 위하여 확산 반사 자외선-가시광선-근적외선 분광광도계(Diffuse reflectance UV-Vis-NIR spectrophotometer: DRS, Soldspec-3700, Shimadzu Co., Tokyo, Japan)를 이용하였다.
3. 메틸렌블루(Methylene Blue: MB) 광분해 실험
470 nm의 가시광선 아래에서 Ni-Ti-O 나노튜브의 광촉매 활성을 평가하기 위해 MB 광분해 실험을 수행하였다. 시편(1 × 1 cm2)을 12 well plate에 넣고 1 ppm MB 용액 1 mL을 추가하였다. 실험실에서 제작된 470 nm LED 가시광선(Power density = 5.5 mW/cm2, 시편과 LED 사이의 거리 = 4 cm)을 15분 및 30분 동안 조사하였다. 광조사 시간 종료 후, 실험에 사용된 MB 용액은 자외선-가시광선 분광기(측정 범위 = 300-800 nm, UV mini-1240, Shimadzu Co., Kyoto, Japan)를 이용하여 MB 용액의 최대 흡광도 피크(Wavenumber = 665 nm)를 측정하였다. 실험에 사용된 MB 용액의 흡광도 값은 1 ppm MB 용액의 흡광도 값의 백분율로 평가되었다.
4. 집락형성단위수(Colony Forming Unit: CFU) 측정
Ni-Ti-O 나노튜브의 항균능을 평가하기 위해 집락형성단위수(colony forming unit)를 사용하였다(30, 31). Streptococcus sanguinis (ATCC 10556, ATCC Org., Manassas, VA, USA) 균주는 Trypticase soy broth (TSB, Difco, NJ, USA) 배지에 24시간 배양한 후, 부유 액의 세균 수를 측정하여 Optical density (600 nm) 값이 0.1로 세균 농도를 희석시킨 뒤, 시편 위에 50 ㎕를 떨어뜨리고 37 ℃ incubator에서 6시간 배양하였다. 배양 후, 950 ㎕ phosphate buffer saline (PBS; Gibco, Carlsbad, CA, USA)로 시편을 수세하였고, 470 nm 가시광선 LED 기기로 15분간 조사 후, Phosphate buffer saline (PBS)를 넣은 균 액 100 ㎕ 취하여 Trypticase soy agar (TSA) 배지에 도말 하였고 37 ℃ 배양기에서 24시간 배양 후, 생성된 세균의 군집 수(CFU)를 계산하였다.
5. 효소 활성도 측정
시편 위의 세균 배양물을 원심분리(5,000 rpm, 10분)하고 PBS로 수세 후 수집된 세포를 20초 동안 초음파(VCX-130, Sonics Co., Newtown, CT, USA) 처리하였다. 그 후 원심분리(12,000 rpm, 20분, 4 ℃)하여 상등액을 수집하였고 Superoxide dismutase (SOD) 및 Catalase (CAT) 효소활성도를 평가하였다. 효소 활성도는 SOD activity kit (EIASODC, Invitrogen Co., Carlsbad, CA, USA)와 CAT activity kit (MAK 381, Sigma-Aldrich, St. Louis, MO, USA)를 사용하여 지침서에 따라 평가하였고, 흡광도는 Microplate reader (Spectra Max 250, Molecular devices Co., Sunnyvale, CA, USA)를 이용하여 각각 470 nm, 405 nm에서 측정하여 표준 검량 곡선에 준하여 계산하였다. 단백질 농도는 Bradford reagent (Sigma-Aldrich, St. Louis, MO, USA)를 사용하여 단백질 1 mg 당 Unit 으로 설정한 후 계산하였다.
6. 통계분석
SPSS Ver. 23.0(SPSS Inc, Chicago, IL, USA)을 이용하여 일원 배치 분산 분석(One-way ANOVA)을 시행하였다. 사후검정으로 Duncan test를 시행하였으며, 유의 수준은 0.05로 설정하였다.
결 과
1. Ni-Ti-O 나노튜브의 표면 분석
Ni-Ti-O 나노튜브의 미세구조 및 형태를 FE-SEM으로 관찰한 결과, 길이 600 ± 80 ㎚, 외경 52 ± 5 ㎚를 나타내었고 나노튜브 구조의 파괴 없이 균질화된 나노튜브를 확인할 수 있었다(Figure 1).

FE-SEM images (x 100,000) of (A) NiTi alloy without polishing process, (b) NiTi alloy with polishing process, (C) Ni-Ti-O NTs (top view), (D) Ni-Ti-O NTs (oblique view).
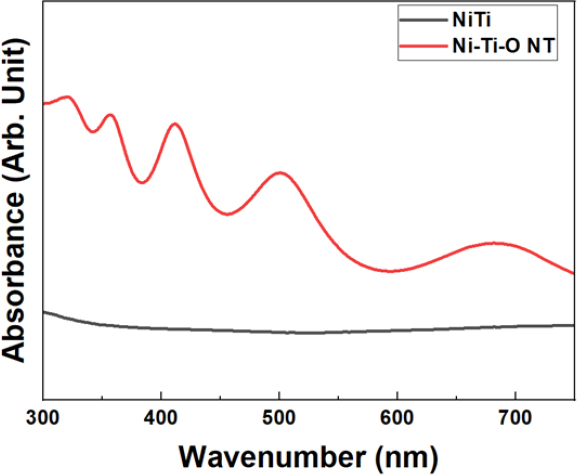
Ni-Ti-O 나노튜브의 DRS 분석 결과, NiTi 합금 시편의 광 흡수율은 가시광선 전 영역에서 관찰되지 않았고, Ni-Ti-O 나노튜브 실험군은 광흡수도가 350 nm 영역대부터 완만하게 감소하였고, 감소되는 곡선의 첫번째 접선을 그려 X축과의 접점을 확인한 결과, 대략 450 nm임을 확인하였다. 추가적인 분석을 수행 중이고, 현재까지 설명된 결과에 따라서 본 연구에서 사용하는 470 nm LED 광파장에 근접한 영역에서의 광흡수단을 가지는 것을 알 수 있다(Figure 2).
2. 메틸렌블루(Methylene blue:MB)의 광분해 특성
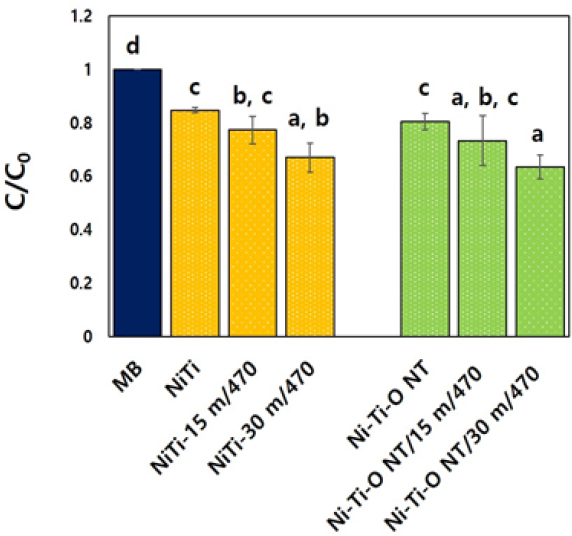
조사 시간에 따른 MB 용액과 Ni-Ti-O 나노튜브 실험군의 광분해 특성을 분광 광도계 를 이용하여 측정한 결과, 470 nm LED 조사시 대조군(NiTi)에 비해 15분 후 Ni-Ti-O 나노튜브 실험군에서 MB 용액의 흡수도가 감소하는 것을 관찰할 수 있었고(P>0.05), 470 nm LED 광 조사 30분 후, Ni-Ti-O 나노튜브 실험군에서 우수한 MB 광분해 활성을 나타내었다(P<0.05, Figure 3).
3. 항균능 평가
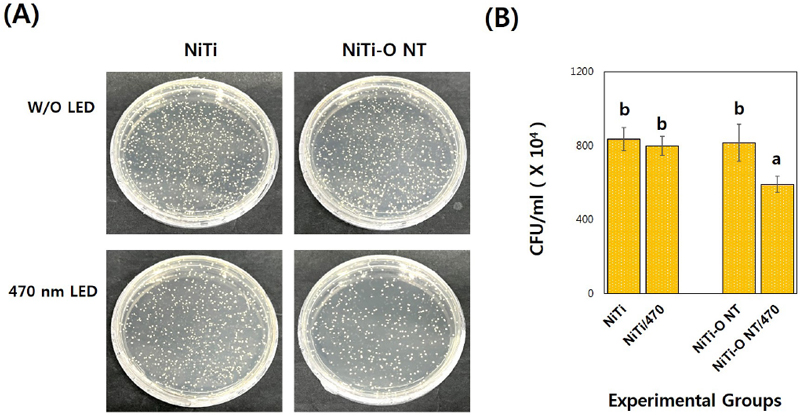
S. sanguinis (ATCC 10556) 배양 24시간 후, Ni-Ti-O 나노튜브의 집락형성단위수는 81.6×105 CFU/mL로 항균 활성 효과는 9.25 %가 나타났다(P>0.05). 470 nm LED 광조사 경우, 대조군인 NiTi는 79.9×105 CFU/mL로 27.16 %를 나타내었고(P>0.05), Ni-Ti-O 나노튜브 실험군은 59.0×105 CFU/mL로 43.16 %의 유의성 있는 항균 활성 효과가 나타났다(P<0.05, Figure 4).
4. SOD와 CAT 효소 활성도
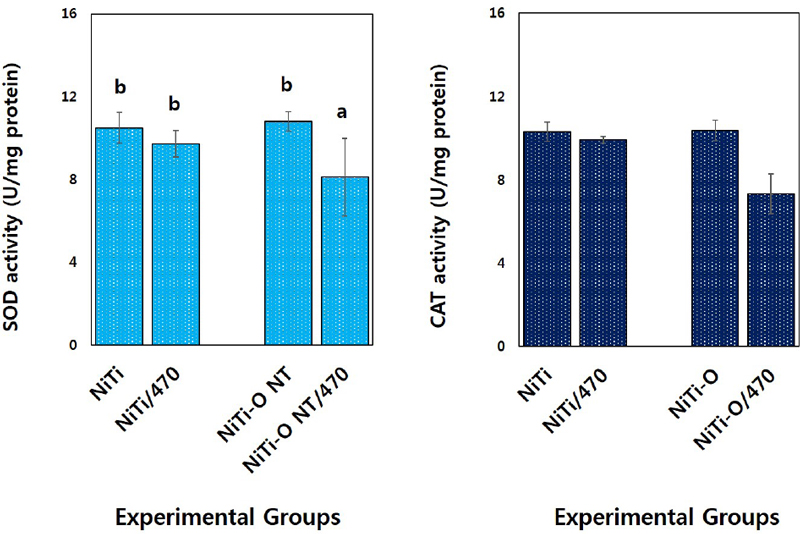
SOD, CAT 효소 활성을 측정한 결과, Ni-Ti-O 나노튜브 실험군은 대조군(NiTi)과 유사한 효소 활성을 나타냈다. 470 nm LED 광 조사시 대조군(NiTi)은 SOD와 CAT 효소 활성 모두 유의적인 차이가 없었고(P>0.05), Ni-Ti-O 나노튜브 실험군의 CAT 효소 활성은 대조군에 비해 낮은 효소 활성을 나타냈지만 통계적인 유의성은 없었고(P>0.05), SOD 효소 활성은 유의성 있게 낮은 효소 활성을 나타내었다(P<0.05, Figure 5).
고 찰
NiTi 합금은 형상 기억 효과, 초탄성 특성, 낮은 탄성 계수 등으로 임플란트 재료로 선호되지만 의료 및 바이오 응용 분야의 경우 내식성 및 생물학적 특성과 같은 표면 특성을 충족하기 위해서는 NiTi 합금의 표면 개질이 필요하다. 본 연구에서는 에틸렌글리콜을 전해질로 양극산화법을 이용하여 Ni-Ti-O 나노튜브를 제작하였다.
물질에 의한 빛의 흡수와 빛에 의해 유도된 전자와 정공의 이동이 물질의 전자 구조 특성과 관련된 광촉매 반응을 제어하는 핵심 요소라는 것은 잘 알려져 있다. 광 흡수 특성을 알아보기 위하여 확산반사 분광광도계로 분석한 결과, NiTi 합금 시편의 광흡수 피크는 관찰되지 않았고, Ni-Ti-O 나노튜브의 광 흡수율은 자외선 영역(~380 nm)에서 강하게 흡수할 뿐만 아니라 가시광선(400-700 nm) 영역까지 넓게(broad) 광 흡수 밴드를 관찰할 수 있었다. 니켈 티타늄 산화물인 NiTiO3는 가시광선 영역에 감응할 수 있는 낮은 에너지 밴드갭(2.2 eV)을 가지고 있어 높은 광 활성 특성이 보고되었고(26), Shu 등은(32) NiTiO3의 광 흡수 특성을 가시광선 범위에서는 450 nm와 510 nm 부근의 흡수 밴드가 관찰되었다고 보고하였는데 결정화된 NiTiO3가 광촉매 효과를 유도하기 위해서는 600 °C를 초과하는 열처리 과정이 반드시 수행되어야 한다. 그러나, 본 연구에서는 500 °C 이상에서 열처리할 경우 Ni-Ti-O 나노튜브 구조의 균열 및 붕괴현상이 발생하므로 400 °C에서 열처리를 수행하였다. 따라서, 열처리 온도의 차이로 인한 NiTiO3의 결정도 차이가 광촉매 기능에 어떠한 영향을 미치는지에 대한 추가적인 연구가 필요할 것으로 사료된다.
조사 시간에 따른 메틸렌 블루(methylene blue)의 광분해 특성을 분광 광도계(UV-Vis spectrophotometer)를 이용하여 측정한 결과, 470 nm LED 광 조사 30분 후, Ni-Ti-O 나노튜브 실험군에서 우수한 메틸렌 블루 광분해 활성을 나타내었다(P<0.05). 이와 같은 결과는, Shu 등(32)이 보고한 TiO2 결합 NiTiO3 나노입자가 가시광선 조사 하에서 메틸렌 블루 분해에 우수한 활성을 나타내었다는 결과와 유사하였고, Ni-Ti-O 나노튜브의 TiO2는 자외선 하에서 우수한 광촉매로 알려져 있기 때문에 TiO2와 결합된 NiTiO3는 자외선뿐만 아니라 가시광선에서도 효과적으로 활용하는데 있어 광촉매로 활용될 수 있음을 짐작할 수 있었다. 본 연구에서 항균능 평가를 위하여 사용된 균은 Streptococcus sanguinis로써 그람양성구균으로 통성 혐기성균이다(33). 구강에 자연적으로 존재하는 세균으로서 치태 생성에 관여하고, 법랑질 표면에 있는 펠리클(Pellicle)의 특정 수용체를 인식함으로써 집락(colonizing) 발달을 담당하는 미생물 중 하나이다(34). Streptococcus sanguinis에 대한 Ni-Ti-O 나노튜브의 CFU test를 한 결과, Ni-Ti-O 나노튜브의 항균 활성 효과는 9.25 %를 나타냈다. 나노구조의 길이는 변형된 NiTi 합금의 항균 활성에 대한 중요한 매개 변수 중 하나이다. Hang 등은 S. aureus에 대한 항균 활성 평가를 정렬된 나노구조의 길이(0.55 µm – 114 µm)에 따라 항균율이 증가한다고 보고하였고(35), Zhang 등은 길이가 0.95 µm(직경 60 - 75 nm)인 나노구조에서 세균 성장이 60 % 감소한 것으로 보고하였다(36). 또한 Sun 등은 길이가 약 5.3 µm(직경 90 nm)인 정렬된 나노구조의 길이를 사용하여 거의 100 % 항균 효과를 보고하였다(37). 따라서, 나노구조의 표면 형태와 크기, 구성 등 여러 매개변수에 따라 항균 활성은 달라질 수 있음을 짐작할 수 있었다. 나노구조를 갖는 항균 작용의 기작은 나노티타니아(TiO2)가 쉽게 표면에 존재하는 라디칼(radical)에 전자를 제공/제거함으로써 라디칼 형성/소실에 관여하게 된다. 이러한 라디칼의 형성은 곧 활성산소(Reactive Oxygen)의 생성을 의미하고, 나노튜브 표면에서의 미생물 균의 성장 억제에 대한 메커니즘은 티타늄(Ti)과 라디칼 반응에 의해 생성된 활성 산소의 항균 활성에 밀접한 관련이 있음을 유추할 수 있었다. 활성 산소종(ROS)의 과도한 증가는 심각한 산화 스트레스를 통해 모든 세포의 거대분자에 손상을 주어 지질과산화, 단백질 변형, 효소 억제, RNA 및 DNA 손상을 초래하고, 불균형의 활성 산소종(ROS)은 결국 세포 사멸을 일으키고 심각한 DNA 손상과 돌연변이를 유발한다(22, 23).
470 nm LED 광 조사에 따른 집락형성단위수(CFU)의 항균 활성 결과, NiTi 합금은 27.16%를 나타냈고(P>0.05), Ni-Ti-O 나노튜브는 43.16%의 유의성 있는 항균 활성 효과를 나타내었다(P<0.05). Matejka와 Tokarsk(24)는 활성 산소종(ROS)의 생성이 가시광선이나 자외선(UV) 광에 의해 유도되는 경우 금속, 금속산화물의 항균효과를 광촉매로 보고하여 이번 연구결과에서도 470 nm LED 광 조사에 의한 Ni-Ti-O 나노튜브가 가시광 매개 광촉매 효과로 항균 활성을 증가시킬 수 있음을 보여주었다.
활성 산소종(ROS)에 의한 산화 스트레스로부터 자신을 보호하기 위한 항산화 방어 기작은 Superoxide dismutase(SOD) 및 Catalase(CAT) 등과 같은 항산화 효소작용에 의해 이루어진다(38, 39). SOD는 과산화 라디칼(superoxide radical, O2-)로부터 과산화수소(H2O2)와 산소(O2)형성을 촉매 하는 효소로 산소(O2)수준을 감소시키고, CAT는 과산화수소(H2O2)를 사용하여 다른 물질을 산화함으로써 세포 내에서의 과산화수소(H2O2) 축적을 방지하도록 도와준다(38, 40). 이들 효소 활성이 억제되면 전체 효소 시스템의 작동이 크게 영향을 받고 효소 시스템의 보호 기능이 감소되거나 상실된다.
S. sanguinis에 대한 Ni-Ti-O 나노튜브의 SOD와 CAT의 효소 활성 평가 결과, 470 nm 광 조사시, Ni-Ti-O 나노튜브 실험군이 대조군에 비해 유의하게 낮은 SOD 효소 활성을 나타내었다(P<0.05). 이상의 결과로 보아 Ni-Ti-O 나노튜브 실험군은 가시광선 조사에 의한 효소 활동 능력을 억제시킴으로써 S. sanguinis 성장을 지연시키거나 사멸을 초래하는 것으로 판단되었다. 하지만 가시광선 조사에 의한 Ni-Ti-O 나노튜브와 효소 활성의 세부적인 메커니즘 연구는 더 필요할 것으로 사료된다.
결 론
본 연구에서는 NiTi 합금 표면 위에 Ni-Ti-O 나노튜브를 제조하여 표면 분석 및 광학적 특성을 평가하고 가시광선 기반 광촉매 항균 활성 효과를 평가하여 다음과 같은 결과를 얻었다.
- 1. Ni-Ti-O 나노튜브의 FE-SEM을 관찰한 결과, 길이 600 ± 80 ㎚, 외경 52 ± 5 ㎚를 나타내었고 나노튜브 구조의 파괴 없이 균질화된 나노튜브를 볼 수 있었다.
- 2. Ni-Ti-O 나노튜브의 집락형성단위(CFU)를 한 항균 활성 결과, 470 nm LED 광을 조사한 경우 43.16%의 유의성 있는 항균 활성 효과가 나타났다(P<0.05).
- 3. Ni-Ti-O 나노튜브의 항산화 효소 활성 평가 결과, 470 nm LED 광을 조사한 경우 SOD 효소 활성이 유의하게 낮은 효소 활성을 나타내었다(P<0.05).
따라서, 본 연구를 통하여 Ni-Ti-O 나노튜브는 가시광선 기반 광촉매 항균 활성을 나타내어 임플란트 소재로 치과에서 응용할 수 있는 많은 가능성이 있다고 사료된다.
Acknowledgments
이 논문은 2022학년도 원광대학교의 교비지원에 의해 수행됨
References
-
Shabalovskaya SA. On the nature of the biocompatibility and on medical applications of NiTi shape memory and superelastic alloys. Biomed Mater Eng. 1996;6:267-89.
[https://doi.org/10.3233/BME-1996-6405]

- Nasab MB, Hassan MR, Sahari BB. Metallic biomaterials of knee and hip - A review. Trends Biomater Artif Organs. 2010;24:69-82.
-
Wong M, Man H. Low-temperature fabrication of Ag-doped HA coating on NiTi. Mater Lett. 2018;229:229-31.
[https://doi.org/10.1016/j.matlet.2018.07.003]

-
Sun Y, Rong Y, Zhao Y, Yao X, Hang R. The influence of substrate electropolishing on anodization behavior, corrosion resistance, cytocompatibility and antibacterial ability of NiTi alloy. Mater Lett. 2020;268:127631.
[https://doi.org/10.1016/j.matlet.2020.127631]

-
Safavi MS, Bordbar-Khiabani A, Khalil-Allafi J, Mozafari M, Visai L. Additive manufacturing: An opportunity for the fabrication of near-net-shape NiTi implants. J Manuf Mater Process. 2022;6:65.
[https://doi.org/10.3390/jmmp6030065]

-
Weng ZM, Bai L, Liu YL, Zhao Y, Sun YH, Zhang XY, et al. Osteogenic activity, antibacterial ability, and Ni release of Mg-incorporated Ni-Ti-O nanopore coatings on NiTi alloy. Appl Surf Sci. 2019;486:441-51.
[https://doi.org/10.1016/j.apsusc.2019.04.259]

-
Jafar KA, Hamed D, Mir SS, Vida KB. A survey on crystallization kinetic behavior of direct current magnetron sputter deposited NiTi thin films. Phys B Condens Matter. 2021;615:413086.
[https://doi.org/10.1016/j.physb.2021.413086]

-
Asghari R, Safavi MS, Khalil-Allafi J. A facile and cost-effective practical approach to develop clinical applications of NiTi: Fenton oxidation process. Trans IMF. 2020;98(5):250-7.
[https://doi.org/10.1080/00202967.2020.1802104]

-
Su Y, Li D, Su Y, Lu C, Niu L, Lian J, et al. Improvement of the biodegradation property and biomineralization ability of magnesium–hydroxyapatite composites with dicalcium phosphate dihydrate and hydroxyapatite coatings. ACS Biomater Sci Eng. 2016;2:818-28.
[https://doi.org/10.1021/acsbiomaterials.6b00013]

-
Firstov GS, Vitchev RG, Kumar H, Blanpain B, Humbeeck JV. Surface oxidation of NiTi shape memory alloy. Biomater. 2002;23:4863-71.
[https://doi.org/10.1016/S0142-9612(02)00244-2]

-
Michiardi A, Aparicio C, Planell JA, Gil FJ. New oxidation treatment of NiTi shape memory alloys to obtain Ni-free surfaces and to improve biocompatibility. J Biomed Mater Res B Appl Biomater. 2006;77:249-56.
[https://doi.org/10.1002/jbm.b.30441]

-
Liu F, Xu J, Wang F, Zhao L, Shimizu T. Biomimetic deposition of apatite coatings on microarc oxidation treated biomedical NiTi alloy. Surf Coat Technol. 2010;204:3294-9.
[https://doi.org/10.1016/j.surfcoat.2010.03.044]

-
Markhoff J, Krogull M, Schulze C, Rotsch C, Hunger S, Bader R. Biocompatibility and inflammatory potential of titanium alloys cultivated with human osteoblasts, fibroblasts and macrophages. Materials. 2017;10(1):52.
[https://doi.org/10.3390/ma10010052]

-
Liu Y, Ren Z, Bai L, Zong M, Gao A, Hang R, et al. Relationship between Ni release and cytocompatibility of Ni-Ti-O nanotubes prepared on biomedical NiTi alloy. Corros Sci. 2017;123:209-16.
[https://doi.org/10.1016/j.corsci.2017.05.006]

-
Hang R, Liu Y, Liu S, Bai L, Gao A, Zhang X, et al. Size-dependent corrosion behavior and cytocompatibility of Ni–Ti–O nanotubes prepared by anodization of biomedical NiTi alloy. Corros Sci. 2016;103:173-80.
[https://doi.org/10.1016/j.corsci.2015.11.016]

-
Oliveira WF, Silva PMS, Silva RCS, Silva GMM, Machado G, Coelho L, et al. Staphylococcus aureus and Staphylococcus epidermidis infections on implants. J Hosp Infect. 2018;98(2):111-7.
[https://doi.org/10.1016/j.jhin.2017.11.008]

-
Gao A, Hang R, Bai L, Tang B, Chu PK. Electrochemical surface engineering of titanium based alloys for biomedical application. Electrochim Acta. 2018;271:699-718.
[https://doi.org/10.1016/j.electacta.2018.03.180]

-
Lee PP, Cerchiari A, Desai TA. Nitinol-based nanotubular coatings for the modulation of human vascular cell function. Nano Lett. 2014;14:5021-8.
[https://doi.org/10.1021/nl501523v]

-
Cheng FT, Shi P, Pang GKH, Wong MH, Man HC. Microstructural characterization of oxide film formed on NiTi by anodization in acetic acid. J Alloy Compd. 2007;438:238-42.
[https://doi.org/10.1016/j.jallcom.2006.08.020]

-
Pelgrift RY, Friedman AJ. Nanotechnology as a therapeutic tool to combat microbial resistance. Adv Drug Deliv Rev. 2013;65:1803-15.
[https://doi.org/10.1016/j.addr.2013.07.011]

-
Nathan C, Cunningham-Bussel A. Beyond oxidative stress: an immunologist’s guide to reactive oxygen species. Nat Rev Immunol. 2013;13(5):349-61.
[https://doi.org/10.1038/nri3423]

-
Pan X, Redding JE, Wiley PA, Wen L, McConnell JS, Zhang B. Mutagenicity evaluation of metal oxide nanoparticles by the bacterial reverse mutation assay. Chemosphere. 2010;79(1):113-6.
[https://doi.org/10.1016/j.chemosphere.2009.12.056]

-
Wang S, Lawson R, Ray PC, Yu H. Toxic effects of gold nanoparticles on Salmonella typhimurium bacteria. Toxicol Ind Health. 2011;27(6):547-54.
[https://doi.org/10.1177/0748233710393395]

-
Mateejka V, Tokarsk J. Photocatalytical nanocomposites. J Nanosci Nanotechnol. 2014;14(2)1597-616.
[https://doi.org/10.1166/jnn.2014.9081]

-
Maness PC, Smolinski S, Blake DM, Huang Z, Wolfrum EJ, Jacoby WA. Bactericidal activity of photocatalytic TiO2 reaction: toward an understanding of its killing mechanism. Appl Environ Microbiol. 1999;65(9)4094-8.
[https://doi.org/10.1128/AEM.65.9.4094-4098.1999]

-
Qu Y, Zhou W, Ren Z, Du S, Meng X, Tian G, et al. Facile preparation of porous NiTiO3 nanorods with enhanced visible-light-driven photocatalytic performance. J Am Chem. 2012;22(32):16471-6.
[https://doi.org/10.1039/c2jm32044d]

-
Hang R, Zhao F, Yao X, Tang B, Chu PK. Self-assembled anodization of NiTi alloys for biomedical applications. Appl Surf Sci. 2020;517:146118.
[https://doi.org/10.1016/j.apsusc.2020.146118]

-
Sun YH, Zhao Y, Zhao YY, Rong YJ, Yao RH, Yao XH, et al. Improving exposure of anodically ordered Ni–Ti–O and corrosion resistance and biological properties of NiTi alloys by substrate electropolishing. Rare Met. 2021;40(12):3575-87.
[https://doi.org/10.1007/s12598-021-01721-4]

-
Liu Y, Hang R, Zhao Y, Bai L, Sun Y, Yao X, et al. The effects of annealing temperature on corrosion behavior, Ni2+ release, cytocompatibility, and antibacterial ability of Ni-Ti-O nanopores on NiTi alloy. Surf Coat Technol. 2018:352:175-81.
[https://doi.org/10.1016/j.surfcoat.2018.08.016]

-
Akhavan O, Ghaderi E. Toxicity of graphene and graphene oxide nanowalls against bacteria. ACS Nano. 2010;4(10):5731-6.
[https://doi.org/10.1021/nn101390x]

-
Mondal T, Bhowmick AK, Krishnamoorti R. Chlorophenyl pendant decorated graphene sheet as a potential antimicrobial agent: synthesis and characterization. J Mater Chem. 2012;22(42):22481-7.
[https://doi.org/10.1039/c2jm33398h]

-
Shu X, He J, Chen D. Visible-light induced photocatalyst based on nickel titanate nanoparticles. Ind Eng Chem Res. 2008;47:4750-3.
[https://doi.org/10.1021/ie071619d]

-
Paik S, Senty L, Das S, Noe JC, Munro CL, Kitten T. Identification of virulence determinants for endocarditis in Streptococcus sanguinis by signature tagged mutagenesis. Infect Immun. 2005;73:6064-74.
[https://doi.org/10.1128/IAI.73.9.6064-6074.2005]

-
Kolenbrander PE, Palmer RJ, Rickard AH, Jakubovics NS, Chalmers NI, Diaz PI. Bacterial interactions and successions during plaque development. Periodontol 2000. 2006;42(1):47-79.
[https://doi.org/10.1111/j.1600-0757.2006.00187.x]

-
Hang R, Liu Y, Bai L, Zhang X, Huang X, Jia H, et al. Length-dependent corrosion behavior, Ni2+ release, cytocompatibility, and antibacterial ability of Ni-Ti-O nanopores anodically grown on biomedical NiTi alloy. Mater Sci Eng C. 2018;89:1-7.
[https://doi.org/10.1016/j.msec.2018.03.018]

-
Zhang JM, Sun YH, Zhao Y, Liu YL, Yao XH, Tang B, et al. Antibacterial ability and cytocompatibility of Cu-incorporated Ni–Ti–O nanopores on NiTi alloy. Rare Met. 2019;38(6):552-60.
[https://doi.org/10.1007/s12598-019-01225-2]

-
Sun Y, Rong Y, Zhao Y, Hang R, Yao X, Chu PK. Electrochemical stability, corrosion behavior, and biological properties of Ni–Ti–O nanoporous layers anodically on NiTi alloy. Corros Sci. 2021;179:109104.
[https://doi.org/10.1016/j.corsci.2020.109104]

-
Dayem AA, Hossain MK, Lee SB, Kim K, Saha SK, Yang GM, et al. The role of reactive oxygen species (ROS) in the biological activities of metallic nanoparticles. Int J Mol Sci. 2017;18:120.
[https://doi.org/10.3390/ijms18010120]

-
Choi Y, Kim HA, Kim KW, Lee BT. Comparative toxicity of silver nanoparticles and silver ions to Escherichia coli. J Environ Sci. 2018;66:50-60.
[https://doi.org/10.1016/j.jes.2017.04.028]

-
Imlay JA. Pathways of oxidative damage. Annu Rev Microbiol. 2003;57:395-418.
[https://doi.org/10.1146/annurev.micro.57.030502.090938]