약물 서방 방출형 다공성 수산화인회석
Abstract
Sustained drug release of hollow HA was investigated. HA slurry was prepared with amount of 30-70% HA(H groups) and sodium chloride up to 15%(N groups). Alginate beads were coated with HA slurry and burned out. In order to insert vancomycin-laden PLGA nanoparticles into hollow HA granules, vacuum pressure was applied. Drug release rates of vancomycin from HA/PLGA complex were monitored.
Size of HA spherical granules was controlled by injecting size or dropping speed into liquid nitrogen. Internal empty space that formed by burning out alginate beads during sintering was connected to external surface through pores in the shell. In H groups, increasing the ratio between HA and water, thickness of shell was increased, while the pore size and porosity was decreased because pores were formed as water frozen and subsequent sublimation of ice inside the shell. Addition of sodium chloride did not affect pore size and porosity in N groups. However, irregular-shaped pores were caused because sodium chloride that remains after the lyophilization burns out during the sintering. This played a role in delay the initial burst out of the drug.
In conclusion, tailoring the structure of pore channels between internal space and external surface was the key to control the sustained drug release rate.
Keywords:
Bone-graft, Bone regeneration, Drug delivery, Hydroxyapatite, PLGA, VancomycinⅠ. INTRODUCTION
과학기술 및 의료기술의 발전으로 인간의 수명이 연장되어 65세 이상 노인의 비율이 2005년에 9.1%가 되면서 고령화 사회로 접어든 이래, 2018년에는 14.3%가 되어 고령사회로, 2026년에는 20.8%로 초고령사회에 도달할 것으로 전망되면서 각종 산업 및 자연 재해로 인한 상해와 질병으로 인한 조직 결손이 증가하고, 국민 의식과 삶의 질이 높아짐에 따른 의료복지 서비스에 관한 욕구가 높아지면서 인체장기나 조직의 결손으로 인한 치료에 대한 수요와 관심이 높아지고 있다.
비교적 재생이 용이한 연조직과는 달리 경조직은 자발적으로 재생이 되지 못하는 경우에는 골이식을 통해 재생을 촉진시켜 왔다. 자가골 이식이 가장 이상적이나, 채취 부위의 2차 수술로 인한 비용과 환자의 고통이 수반되고, 채취량에 제한이 있으며, 2차 수술이 필요하다는 한계가 있다(Quintero와 Mellonig, 1982). 동종골은 사체 혹은 조직은행에 보관된 골조직을 이용하여 만드는 것으로, 부가적인 수술이 없는 것이 장점이지만, 면역학적 거부반응 및 일부 바이러스 질환에 이환된 경우 전염가능성을 완전히 배제할 수 없다는 것이 문제점으로 지적된다 (Mellonig, 1991). 이종 골이식은 골 성장 인자를 포함하고 있어서 골유도가 가능한 장점이 있어서 널리 사용되고 있으나, 주로 소뼈에서 채취한 후 화학처리하여 병원균 위험이 적지만, 광우병과 같은 동물의 질환에 전염될 위험성을 배제할 수 없다(Mellonig, 1991).
따라서, 경제적이고, 질병의 전염 가능성이 없을 뿐 아니라, 재료의 물성을 조절할 수 있는 인공적으로 합성한 골이식 재료에 관한 관심이 높아지고 있다. 생체친화성과 물리적 성질을 모두 만족하는 것으로 1926년 X선 회절 분석에 의해 인체의 뼈와 치아가 아파타이트 구조를 가지고 있다는 것이 밝혀짐으로써 칼슘 포스페이트 화합물이 주로 사용되어 왔다(de Bruijn 등, 1995; Dennis 등, 1992; Hench와 Wilson, 1984; Jarcho, 1981; Roy, 1974). 그 중에서도 가장 대표적인 수산화인회석[HA; Ca10(PO4)6(OH)2]에 관한 여러 논문에서 동물시험 결과, 면역 거부 반응이 없고, 장기간에도 우수한 생체적합성을 나타내며, 골전도성이 있어서 골조직과 결합한다고 보고되었다(Cerroni 등, 2002; Ducheyne 등, 1999; Klein 등, 1983). 하지만 합성 골이식재는 골전도성은 있으나 골유도성이 없어서, 주변 조직과 상호 작용할 수 있도록 하기 위한 연구가 많이 진행되어 왔다(Healy, 1999; Hubbell, 1999; Sakiyama와 Hubbell, 2001). 생체재료의 표면에 세포외기질(ECM) 단백질을 흡착시켜, 세포가 흡수된 ECM 단백질을 통해 생체재료 표면에 간접적으로 상호 작용할 수 있도록 하는 생체모사(biomimetic) 특성에 관한 연구들로, 크게 두 가지 방법이 보고되었다. 첫 번째는 재료에 성장인자나 플라스미드 DNA와 같은 용해성 생체활성 분자를 적용하여 생체 분자를 방출시켜 새로운 조직을 형성하는 방법이고(Babensee 등, 2000; Richardson 등, 2001; Whitaker 등, 2001), 두 번째는 재료를 세포-결합 인자(peptide)로 개질하여 재료가 특이적 단백질성효소에 의해 분해하여 세포간 반응을 유도하는 것이다(Suzuki 등, 2000; West 등, 1999).
최근의 연구 방향은 성장인자를 골이식재에 부착시키는 것이다. 성장인자는 수용체에 의해 합성되는 단백질을 upregulation하거나 down-regulation하여 세포의 부착, 증식, 이동이나 분화를 촉진하거나 억제하는 물질로, 인접세포와 결손부에 침윤된 세포의 분열을 자극하고, 특별한 경로를 통해 세포의 분화와 혈관생성과정을 촉진시키는 역할을 하는 신호전달 물질이다.
대표적인 것으로 TGF-β superfamily에 속하는 BMP(bone morphogenic protein) 및 FGF(fibroblast growth factor) 등이 있다(Nohe 등, 2004; Pittenger 등, 1999). BMP는 1988년 Wozney 등에 의해 클로닝하여 30여 가지의 물질이 확인된 이래, 지난 10여 년간 BMP를 재조합하여 상용화하는 많은 연구가 진행되어 왔다.
그럼에도 불구하고, BMP의 효능은 실제 임상에서 아직까지 명확하지 않으며, 골재생에 영향을 미치는 적정량의 BMP 농도에 관해 많은 연구 결과가 보고되었고, 최근에는 BMP-2를 고정화하여 서방형으로 방출하는 골이식재에 관하여 많은 연구가 다수 발표되고 있다(Boden, 1999; Schmitt 등, 1999; Winn 등, 1999).
따라서, 본 논문에서는 BMP와 같은 성장인자를 골이식재의 내부에 담지하고 원하는 속도로 방출시킬 수 있는 방법에 관한 기초 연구로, 성장인자를 대신하여 항생제로 반코마이신을 사용하였다. 골이식재로는 인체의 뼈와 화학적으로 가장 유사한 조성을 갖는 수산화인회석을 선택하여, 속이 비어 있고, 외부 표면과 내부는 껍질의 기공 채널을 통해 연결되어 있는 형태로 제조하고자 하였다.
속이 비어 있는 형태로 제조하기 위해서는 알지네이트를 비드 상태로 제조하여 템플레이트(template)로 사용하였다. 수산화인회석 나노 분말을 합성하여 증류수에 현탁액(slurry)을 만들어 알지네이트 비드를 코팅하여, 소결(sintering)하는 과정에서 알지네이트 비드를 태워서 제거하였다(burn out).
성장인자를 담지하기 위한 기초 연구로 항생제를 수산화인회석 내부에 담지시키기 위한 방법을 연구하였으며, 항생제를 poly(lactic-co-glycolic acid)[PLGA]에 넣어 나노스피어로 만들어, 이를 수산화인회석의 기공 채널을 통해 내부로 들어간 상태의 복합 골이식재로 제조한 후, 방출 거동을 연구하였다.
Ⅱ. MATERIALS AND METHODS
1. 실험재료
칼슘(Ca)과 인(P)의 전구체로 Ca(NO3)2·4H2O(Sigma-Aldrich, USA)와 (NH4)2HPO4(Sigma-Aldrich, USA)을 사용하여 공침법으로 수산화인회석 나노 분말을 합성한 후, 증류수에 분산하여 수산화인회석 현탁액을 제조하였다. 이때 결합제, 분산제, 건조제어제로 polyvinyl alcohol(Du Pont, USA), polyethylene glycol(Duksan Pure Chemical Co., Korea), methyl cellulose(Duksan Pure Chemical Co., Korea), dimethyl formamide(Aldrich, USA)를 사용하였다. Table 1에 나타낸대로, 수산화인회석 나노 분말은 증류수 100 mL당 30, 50, 70 g 첨가하여, 이를 H1, H2, H3군이라 칭하였고, H2군에 NaCl을 5, 10, 15 g 첨가한 것을 N1, N2, N3군이라 칭하였다.
수산화인회석 입자를 속이 빈 형태를 제조하기 위해 알지네이트 비드를 템플레이트로 사용하였다. Sodium alginic acid(Sigma-Aldrich, USA) 용액을 calcium chloride (Sigma-Aldrich, USA) 용액에 적하하여 직경 1~2 mm의 비드를 제조한 후, 수산화인회석 현탁액에 넣어 교반하면서 알지네이트 비드 표면에 수산화인회석을 코팅하고, 액체 질소에 적하한 후, 동결건조(freeze drying)하고 1300 ℃에서 소결하면서 알지네이트를 연소시켜 속이 빈 형태로 제조하였다.
Dichloromethane(Sigma-Aldrich, USA) 10 mL에 항생제인 반코마이신(Vancomycin HCl Injection, CJ, Korea) 100 mg을 넣어 10분간 혼합한 후, PLGA (RG504H, Boehringer Ingelheim, Germany) 500 mg을 혼합하여 반코마이신을 함유한 PLGA 용액을 제조하였다. 0.5 wt% PVA 수용액과 10,000 rpm의 속도로 강력 교반하여 PLGA/dichloromethane/반코마이신 용액이 PVA 용액에 구형으로 분산되어 있는 에멀젼(emulsion)을 제조한 후, rotary evaporator(NN Series, Eyela, Japan)를 이용하여 진공 하에서 dichloromethane을 증발시키고, ultracentrifuge(Beckman Coulter, USA)를 이용하여 10,000 rpm의 속도로 원심분리하여 PVA를 제거한 후, 동결건조하여 반코마이신이 함유된 PLGA 나노스피어를 제조하였다.
속이 빈 수산화인회석 입자와 PLGA 나노스피어를 증류수에 분산시킨 후, 진공 챔버(chamber)에 넣고 진공을 가하여 수산화인회석의 기공을 통해 PLGA 나노스피어가 수산화인회석 내부로 들어간 복합체를 제조하였다.
2. 실험방법
제조한 수산화인회석의 결정상은 X-ray diffractometer(XRD; Ultima IV, Rigaku, Japan)로 측정한 후, JCPDS software(PCPDFWIN1.30, JCPDS-ICDD)로 분석하였다. 수산화인회석과 PLGA의 형태는 투과전자현미경(TEM; JEM 4010, Jeol, Japan)과 주사전자현미경(SEM; JSM-6701F, Jeol, Japan)을 이용하여 관찰하였다. 수산화인회석의 기공율은 질소가스의 흡착량을 측정하여 BET(Brunauer-Emmett-Teller) 원리에 따라 계산하였다. 반코마이신의 용출량은 UV/vis spectrometer(UVD-3200, Labomed, USA)을 이용하여 파장 280 nm의 흡수피크 세기로 측정하였다(Dion 등, 2005).
3. 통계 처리
SPSS(SPSS Inc Co., PASW Statistics 18.0, Chicago, USA)를 사용하여 통계적 유의성을 one-way ANOVA로 통계처리 하였으며, Tukey test로 유의수준 95% 범위에서 사후 검증하였다.
Ⅲ. RESULTS
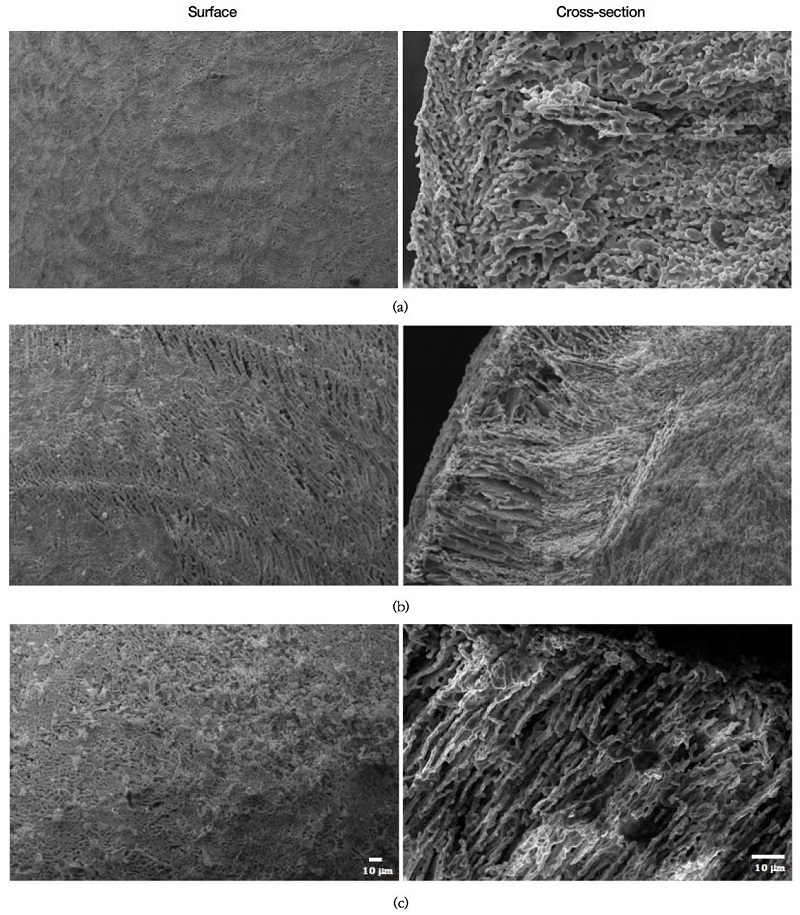
제조한 수산화인회석 입자의 주사전자현미경 사진을 Figure 1에 나타내었다. Figure 1(a)에서 보는 바와 같이 평균 직경이 1.5 mm인 구형체이었고, 직경은 템플레이트로 사용한 알지네이트 비드의 크기에 따라 조절 가능하였다. 알지네이트 비드를 사용하지 않았을 때는 Figure 1(b)와 같이 속이 꽉 차 있는 구형체로도 만들 수 있었고, 알지네이트를 사용하면 Figure 1(c)와 같이 속이 비어 있는 구형체로 제조할 수 있었다. 속이 비어 있는 수산화인회석 입자의 두께는 알지네이트 비드에 코팅된 수산화인회석 현탁액의 두께에 의존하게 되며, 수산화인회석의 함량이 증가하면 현탁액의 점도가 증가하여 최종적인 두께가 증가하는 경향을 나타내었다. 본 연구에서는 20~100 μm의 두께를 나타내었다.

SEM images of HA granules showing (a) outer appearance, (b) solid, and (d) hollow internal structures.
제조 조건에 따른 수산화인회석 입자의 표면과 두께 방향의 단면을 전자현미경으로 관찰하여 Figure 2와 Figure 3에 나타내었다. Figure 2에서 보면 두께 방향에 따라 비어 있는 내부로부터 바깥 표면쪽으로 가면서 기공 크기가 커지는 양상을 볼 수 있었다. 조성에 따라서는 수산화인회석 현탁액의 수산화인회석 함량이 감소함에 따라, 즉 증류수의 양이 증가함에 따라 기공 크기가 증가하는 경향을 나타내었다. Figure 3에 나타낸 NaCl를 첨가한 경우에는 NaCl의 첨가량이 증가함에 따라 기공 채널이 치밀해지는 경향을 나타내었다.
수산화인회석의 기공율을 Table 2에 나타내었다. 수산화인회석 현탁액의 증류수 양이 증가함에 따라 기공율이 증가하는 경향을 나타내었고, NaCl의 첨가량이 증가함에 따라 기공율이 감소하여 (0.454±0.020)~(0.902±0.035) mL/g의 값을 나타내었다.
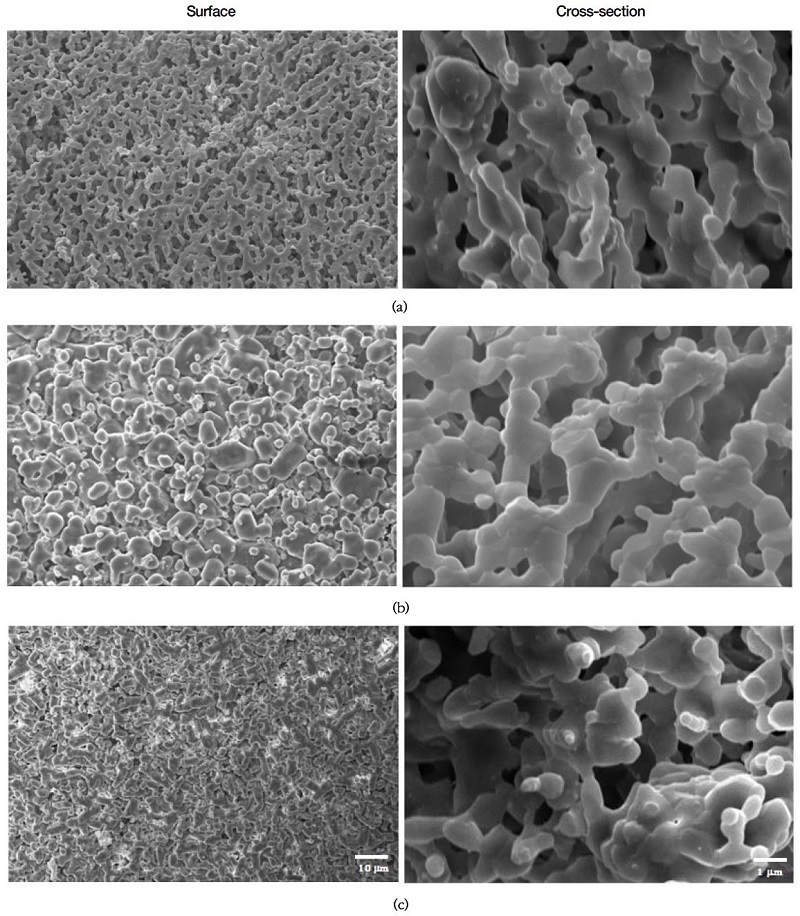
PLGA 나노스피어의 전자현미경 사진을 Figure 4에 나타내었다. 직경이 200~300 nm인 구형 입자임을 볼 수 있으며, 제조 조건에 따라 안이 꽉 찬 것부터 다공성인 것까지 다양하게 제조할 수 있었고, 모든 경우에 반코마이신을 함유하고 있었다.

SEM images of PLGA nanospheres showing (a) size distribution, (b) outer appearance, (c) solid, and (d) porous internal structures.
HA-PLGA 복합 골이식재의 전자현미경 사진을 Figure 5에 나타내었다. PLGA 나노스피어가 수산화인회석 입자의 내부와 기공 사이에 존재하고 있는 것을 볼 수 있다.
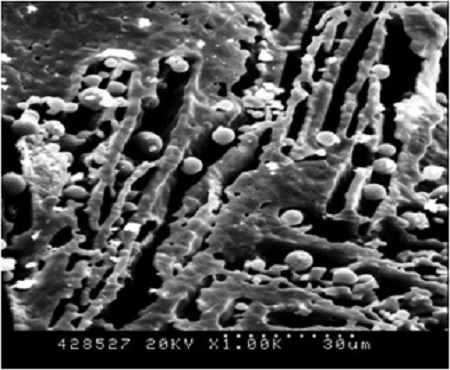
SEM images of HA-PLGA composites. Figure 6. Releasing behavior of vancomycin from HA-PLGA composites.
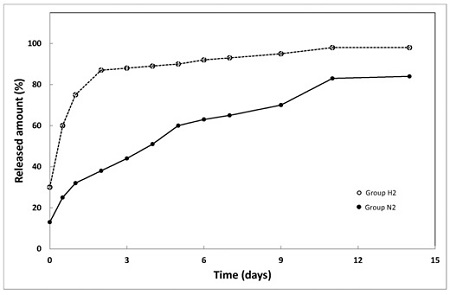
HA-PLGA 복합 골이식재로부터 반코마이신이 방출되는 경향을 Figure 6에 나타내었다. NaCl를 첨가하지 않은 H2는 초기에 급격하게 방출되어 2일에 거의 90%가 방출되는 경향을 나타낸 반면, NaCl를 첨가한 N2는 초기의 급격한 방출없이 시간에 따라 서서히 방출되는 경향을 나타내었다.
IV. DISCUSSION
골 재생력을 향상시키기 위한 골조직공학에서 성장인자와 생체재료에 관한 많은 연구가 진행되었으나, 성장인자와 생체재료의 종류가 매우 다양할 뿐 아니라, 성장인자를 생체재료에 부착하는 방법도 다양해서 방출 속도를 제어할 수 있는 방법에 관해서는 명확한 해답이 제시되지 못하고 있다. 성장인자를 함유하는 생체재료, 즉 캐리어(carrier)로는 주로 고분자 재료가 널리 이용되어 왔으며, 고분자의 종류와 크기, 형태 등에 따라 방출 속도가 달라지게 된다. 또한, 성장인자가 고분자 재료의 표면에 부착되면 고분자 재료의 표면 물성이 변화하여 생체친화성, 생체활성 등이 저하된다는 우려가 있다(Son 등, 2011)
따라서, 본 연구에서는 인체의 뼈 및 치아와 화학적 조성이 유사하여 고분자 재료에 비해 생체친화성과 생체활성이 우수할 뿐 아니라, 독성과 발암성이 없다고 보고된 수산화인회석(Alexander 등, 1983; Boonsongrit 등, 2008; Jose 등, 2009; Kim 등, 2012; Sharma 등, 1993; Son 등, 2011)을 기본 조성으로 선택하여 나노 분말을 합성한 후에 구형체로 제조하였다. 나노 분말은 마이크로 분말에 비해 비표면적이 커서 세포의 이동, 단백질 흡착 및 골모세포의 부착에 유리하다고 보고되었다(Christenson 등, 2007; Li 등, 2006; Webster 등, 2000; Webster 등, 2001). 구형체는 다른 형태에 비하여 신생골의 골전도에 유리하고(Parsons 등, 1988; Salthouse 등, 1980; Weinlander 등, 1992), 치조골과 같이 하중을 받는 부위의 사용에도 적합하다고 알려져 있다(Misiek 등, 1984).
성장인자를 내부에 넣기 위해 속이 비어 있는 구형체로 제조하였으며, 이를 위하여 알지네이트를 비드 형태로 만들어서 템플레이트로 사용하였다. 구체적으로는 알지네이트 비드에 수산화인회석 현탁액을 코팅하였는데 알지네이트의 카복실기와 수산화인회석의 카복실 기가 화학 결합하여 코팅력을 갖게 된다. 수산화인회석의 비어 있는 내부 공간은 성장인자 또는 항생제를 담지할 수 있을 뿐 아니라, 혈관 신생과 신생골의 성장, 세포 이동 및 영양분 공급에도 유리하게 작용할 수 있다. 세포가 이동하기 위해서는 약 100 μm, 혈관 신생과 영양분 공급을 위해서는 300~500 μm 크기의 기공이 필요하다고 보고되었다(Davies, 2000; Gittings 등, 2005; Karageorgiou와 Kaplan, 2005; Rezwan 등, 2006). 비어 있는 내부는 수산화인회석 껍질의 기공을 통하여 바깥 표면으로 연결되어 있는 구조로 설계하였다. 이 기공을 통하여 내부로부터 성장인자가 방출하게 되며, 다공성 구조로 인한 높은 비표면적으로 인해 세포와 재료 간에 반응성도 향상될 수 있다. 또한, 수산화인회석은 기공 구조와 기계적 물성을 위하여 소결 단계를 반드시 거쳐야 하므로(Chaim 등, 2008; German, 1996) 열에 약한 성장인자를 소결 전에 담지하는 것은 곤란하여 소결 후에 기공을 통하여 넣었다.
본 연구에서는 성장인자를 대신한 기초 연구로 항생제인 반코마이신을 사용하였으며, 미국식약처(FDA)의 허가를 받은 대표적 고분자 생체재료인 PLGA로 인캡슐레이션(encapsulation)하였다. 에멀젼-용매 증발법으로 PLGA 나노스피어를 제조하였으며, PLGA의 함량, 교반 시간, 계면활성제 함량, 용매의 증발 속도, 물과 유기상의 비율 등에 따라 Figure 4에 나타낸 바와 같이 다양한 구조로 제조할 수 있었다(Mainardes와 Evangelista, 2005).
Figure 2에 나타낸 H군의 전자현미경 사진에서 수산화인회석 입자의 비어 있는 내부로부터 바깥 표면 쪽으로 기공이 연결된 것을 볼 수 있으며, 증류수 양이 증가할수록 기공 크기가 커지는 것을 볼 수 있다. 이는 기공이 증류수에 의해 형성되는 것으로 설명할 수 있다. 수산화인회석 현탁액을 알지네이트 비드에 코팅한 후 동결건조하는 과정에서 증류수는 -50 ℃의 온도에서 동결하고, 압력을 낮추면 얼음이 승화되면서 기공이 발생하게 되는 것이다. 따라서, 기공 크기는 수산화인회석 현탁액의 증류수 함량에 의존하게 된다. 즉, 증류수의 양이 많을수록 기공이 커지게 된다. 증류수의 양이 많아지면, 상대적으로 현탁액 내의 수산화인회석 함량은 감소하게 되어, 현탁액의 점도가 낮아지기 때문에 알지네이트 비드에 코팅되는 두께가 감소하여 결과적으로 수산화인회석 구형체의 껍질이 얇아지게 된다. 본 연구에서 H3군은 강도가 너무 낮아 조작하기 어려웠고, H1군은 H2군에 비해 기공율이 낮아서 H2군을 최적 조성으로 보고, 이를 대상으로 NaCl을 첨가하였다.
Figure 3은 NaCl을 첨가한 N군의 전자현미경 사진이다. N1군은 H군과 유사한 기공을 나타내고 있지만, N2군과 N3군은 불규칙한 기공 형태를 나타내고 있다. NaCl은 구형이 아닌 육면체의 형태를 갖고 있어서 증류수가 동결했다가 승화되는 과정에서 중간 중간에 남아 있다가 소결 과정에서 기화되면서 기공의 구조를 불규칙하게 만들게 된다.
항생제인 반코마이신의 방출 거동을 2주간 관찰하여 Figure 6에 나타내었다. 수산화인회석 현탁액을 제조할 때, NaCl를 넣지 않았던 H2군은 초기에 급격하게 방출되어 2일만에 거의 90%가 방출되는 경향을 나타낸 반면, NaCl를 첨가한 N2군은 초기의 급격한 방출없이 시간에 따라 서서히 방출되는 경향을 나타내었다. 이것은 위에서 설명한 바와 같이, NaCl로 인해 기공이 불규칙한 형태를 갖게 되어 발생한 결과라고 생각되며, NaCl의 첨가가 항생제가 초기에 급격하게 방출되는 것을 억제하는데 효과적임을 알 수 있었다.
V. CONCLUSIONS
본 논문에서는 치조골 재생을 위한 약물 서방 방출형 다공성 수산화인회석에 관하여 연구하고자, 수산화인회석 나노 분말을 합성한 후, 증류수로 현탁액을 만들어 알지네이트 비드에 코팅하고, 소결하면서 알지네이트 비드를 제거하여 속이 비어 있는 구형체 입자로 제조하였다. 항생제인 반코마이신을 PLGA로 인캡슐레이션하여 수산화인회석 구형체 입자의 비어 있는 내부로 넣어 복합화하였다.
- 1. 평균 직경 1.5 mm의 속이 비어 있는 수산화인회석 구형체 입자를 제조할 수 있었으며, 껍질 두께는 20~100 μm이었다.
- 2. 수산화인회석 구형체 입자는 현탁액의 증류수로 인해 형성된 0.5~10 μm의 기공으로 비어 있는 내부와 표면이 연결되어 있는 다공성 구조를 갖고 있으며, 증류수 양이 증가할수록 기공율과 기공 크기가 증가하였다.
- 3. 수산화인회석 현탁액 제조시에 NaCl을 첨가하여 반코마이신이 초기에 급격하게 방출되는 것을 억제하여 시간에 따라 서서히 방출되게 할 수 있었으며, 이는 기공 구조가 불규칙해졌기 때문으로 생각된다.
Acknowledgments
본 논문은 2014년도 조선대학교 교내 연구비 지원을 받았음.
References
- Alexander, H., Parsons, JR., Ricci, JL., Bajpai, BK., Weiss, AB., (1987), In DF. Williams (ed.), CRC critical reviews, Boca Raton, FL, CRC Press, p43.
- Babensee, JE., McIntire, LV., Mikos, AG., (2000), Growth factor delivery for tissue engineering, Pharm Res, 11, p47-58.
-
Boden, SD., (1999), Bioactive factors for bone tissue engineering, Clin Orthop, 367, pS84-S94.
[https://doi.org/10.1097/00003086-199910001-00009]

-
Boonsongrit, Y., et al , (2008), Controlled release of bovine serum albumin from hydroxyapatite microspheres for protein delivery system, Mater Sci Eng B, 148, p162-165.
[https://doi.org/10.1016/j.mseb.2007.09.006]

-
Cerroni, L., et al , (2002), Growth of osteoblast like cells on porous hydroxyapatite ceramics: an in vitro study, Biomol Eng, 19, p119-124.
[https://doi.org/10.1016/S1389-0344(02)00027-8]

-
Chaim, R., et al , (2008), Sintering and densification of nanocrystalline ceramic oxide powders: a review, Adv Appl Ceram, 107, p159-169.
[https://doi.org/10.1179/174367508X297812]

-
Christenson, EM., et al , (2007), Nanobiomaterial applications in orthopedics, J Orthop Res, 25, p11-22.
[https://doi.org/10.1002/jor.20305]

- Davies, JE., (2000), Bone Engineering, EM Squared, Toronto.
-
de Bruijn, JD., van Blitterswijk, CA., Davies, JE., (1995), Initial bone matrix formation at the hydroxyapatite interface in vivo, J Biomed Mater Res, 29, p89-99.
[https://doi.org/10.1002/jbm.820290113]

- Dennis, JE., et al , (1992), Osteogenesis in marrow-derived mesenchymal cell porous ceramic composites transplanted subcutaneously: effect of fibronectin and laminin on cell retention and rate of osteogenic expression, Cell Transplant, 1, p23-32.
-
Dion, A., et al , (2005), Vancomycin release behaviour from amorphous calcium pyrophosphate matrices intended for osteomyelitis treatment, Biomaterials, 26, p7276-7285.
[https://doi.org/10.1016/j.biomaterials.2005.05.072]

-
Ducheyne, P., Qiu, Q., (1999), Bioactive ceramics: the effect of surface reactivity on bone formation and bone cell function, Biomaterials, 20, p2287-2303.
[https://doi.org/10.1016/S0142-9612(99)00181-7]

- German, RM., (1996), Sintering theory and practice, Wiley, New York.
-
Gittings, JP., Turner, IG., Miles, AW., (2005), Calcium phosphate open porous scaffold bioceramics, Bioceramics 17, 284-286, p349-352.
[https://doi.org/10.4028/www.scientific.net/KEM.284-286.349]

-
Healy, KE., (1999), Molecular engineering of materials for bioreactivity, Curr Opin Solid State Mat Sci, 4, p381-387.
[https://doi.org/10.1016/S1359-0286(99)00038-8]

-
Hench, LL., Wilson, J., (1984), Surface-active biomaterials, Science, 226, p630-636.
[https://doi.org/10.1126/science.6093253]

-
Hubbell, JA., (1999), Bioactive biomaterials, Curr Opin Biotechnol, 10, p123-129.
[https://doi.org/10.1016/S0958-1669(99)80021-4]

-
Jarcho, M., Calcium phosphate ceramics as hard tissue prosthetics, Clin Orthop Rel Res, (1981), 157, p259-278.
[https://doi.org/10.1097/00003086-198106000-00037]

-
Jose, MV., et al , (2009), Aligned PLGA/HA nanofibrous nanocomposite scaffolds for bone tissue engineering, Acta Biomater, 5, p305-315.
[https://doi.org/10.1016/j.actbio.2008.07.019]

-
Karageorgiou, V., Kaplan, D., (2005), Porosity of 3D biomaterial scaffolds and osteogenesis, Biomaterials, 26, p5474-5491.
[https://doi.org/10.1016/j.biomaterials.2005.02.002]

-
Kim, SM., et al , (2012), Gelatin-layered and multi-sized porous β-tricalcium phosphate for tissue engineering scaffold, Nanoscale Res Lett, 7, p1-5.
[https://doi.org/10.1186/1556-276x-7-78]

-
Klein, C., et al , (1983), Biodegradation behavior of various calcium-phosphate materials in bone tissue, J Biomed Mater Res, 17(5), p769-784.
[https://doi.org/10.1002/jbm.820170505]

-
Li, WJ., Jiang, YJ., Tuan, RS., (2006), Chondrocyte phenotype in engineered fibrous matrix is regulated by fiber size, Tissue Eng, 12, p1775-1785.
[https://doi.org/10.1089/ten.2006.12.1775]

-
Mainardes, RM., Evangelista, RC., (2005), PLGA nanoparticles containing praziquantel. effect of formulation variables on size distribution, Int J Pharm, 290, p137-144.
[https://doi.org/10.1016/j.ijpharm.2004.11.027]

- Mellonig, J., (1991), Freeze-dried bone allografts in periodontal reconstructive surgery, Dent Clin North Am, 35, p504-511.
-
Misiek, DJ., Kent, JN., Carr, RF., (1984), Soft tissue responses to hydroxylapatite particles of different shapes, J Oral Maxillofac Surg, 42, p150-160.
[https://doi.org/10.1016/S0278-2391(84)80025-7]

-
Nohe, A., et al , (2004), Signal transduction of bone morphogenetic protein receptors, Cell Signal, 16, p291-299.
[https://doi.org/10.1016/j.cellsig.2003.08.011]

- Parsons, JR., Ricci, JL., Alexander, H., Bajpai, PK., In P. Ducheyne, JE. Lemons (eds.), (1988), Bioceramics: material characteristics versus in vivo behavior, New York, The New York Academy of Sciences, p191.
-
Pittenger, MF., et al , (1999), Multilineage potential of adult human mesenchymal stem cells, Science, 284, p143-147.
[https://doi.org/10.1126/science.284.5411.143]

-
Quintero, G., Mellonig, JT., (1982), A six months clinical evaluation of decalcified freeze-dried bone allograft in periodontal osseous defects, J Periodontol, 53, p726-734.
[https://doi.org/10.1902/jop.1982.53.12.726]

-
Rezwan, K., et al , (2006), Biodegradable and bioactive porous polymer/inorganic composite scaffolds for bone tissue engineering, Biomaterials, 27, p3413-3431.
[https://doi.org/10.1016/j.biomaterials.2006.01.039]

-
Richardson, TP., Murphy, WL., Mooney, DJ., (2001), Polymeric delivery of proteins and plasmid DNA for tissue engineering and gene theraphy, Crit Rev Eukaryot Gene Expr, 11, p47-58.
[https://doi.org/10.1615/CritRevEukarGeneExpr.v11.i1-3.30]

-
Roy, DM., Linnenhan, SK., (1974), Hydroxyapatite formed from coral skeletal carbonate by hydrothermal exchange, Nature, 5438, p220-222.
[https://doi.org/10.1038/247220a0]

- Salthouse, TN., Matlaga, BF., (1980), Effects of implant surface on cellular activity and evaluation of histocompatibility, In: Winter, GD., Leray, JL., de Groot, K. editors, Evaluation of biomaterials, John Wiley and Sons, New York, p295-305.
-
Sakiyama Elbert, SE., Hubbell, JA., (2001), Functional biomaterials: design of noble biomaterials, Ann Rev Mater Res, 31, p183-201.
[https://doi.org/10.1146/annurev.matsci.31.1.183]

- Sharma, CP., et al , (1993), Synthesis of biocompatible hydroxyapatite powders and granules, Trends Biomater Artif Organs, 7, p8-11.
-
Schmitt, JM., et al , (1999), Bone morphogenetic proteins: An update on basic biology and clinical relevance, J Orthop Res, 17, p269-278.
[https://doi.org/10.1002/jor.1100170217]

-
Son, JS., et al , (2011), Porous hydroxyapatite scaffold with three-dimensional localized drug delivery system using biodegradable microspheres, J Control Release, 153, p133-140.
[https://doi.org/10.1016/j.jconrel.2011.03.010]

-
Suzuki, Y., et al , (2000), Alginate hydrogel linked with syntheic oligopeptide derived from BMP-2 allows ectopic osteoinduction in vivo, J Biomed Mater Res, 50, p405-409.
[https://doi.org/10.1002/(SICI)1097-4636(20000605)50:3<405::AID-JBM15>3.0.CO;2-Z]

-
Webster, TJ., et al , (2000), Enhanced functions of osteoblasts on nanophase ceramics, Biomaterials, 21, p1803-1810.
[https://doi.org/10.1016/S0142-9612(00)00075-2]

-
Webster, TJ., et al , (2001), Mechanisms of enhanced osteoblast adhesion on nanophase alumina involve vitronectin, Tissue Eng, 7, p291-301.
[https://doi.org/10.1089/10763270152044152]

- Weinlander, M., Plenk, H. Jr, Adar, F., Holmes, R., In Ravaglioli, A., Krajewski, A. (eds), (1992), Bioceramics and the human body, New York, Elsevier Science Publishers, p317.
-
West, JL., Hubbell, JA., (1999), Polymeric biomaterials with degradation sites for proteases involved in cell migration, Macromolecules, 32, p241-244.
[https://doi.org/10.1021/ma981296k]

-
Whitaker, MJ., et al , (2001), Growth factor release from tissue engineering scaffolds, J Pharm Pharmacol, 53, p1427-1437.
[https://doi.org/10.1211/0022357011777963]

-
Winn, SR., Uludag, H., Hollinger, JO., (1999), Carrier systems for bone morphogenetic proteins, Clin Orthop, 367, pS95-106.
[https://doi.org/10.1097/00003086-199910001-00010]