TiO2 나노튜브를 형성한 Ti-6Al-4V 합금의 석회화 순환처리가 생체활성도에 미치는 영향
Abstract
The purpose of this study was to evaluate the effect of calcium phosphate treatment on the bioactivity of Ti-6Al-4V alloy modified by anodic oxidation, pre-calcification treatment, and heat treatment. Anodic oxidation were performed to increase specific surface area and form nanotubular TiO2 layer (AH). After that, pre-calcification treatment was carried out in NaH2PO4 solution and Ca(OH)2 saturated solution for 10 cycles (APH 10) and 30 cycles (APH 30) to induce the precipitation of calcium phosphates on surface. Additionally, the specimens were heat treated for structural stability and elimination of remaining impurities. The nanotubes were shown densely on the AH group. APH 10 and 30 groups showed the precipitated calcium phosphate on the nanotubular TiO2 layer, but the APH 30 group showed more precipitation of calcium phosphate. Additionally, APH 10 and 30 groups showed the precipitation of HAp after immersion in SBF for 3 days. Compared to the untreated group, the surface treatment groups (AH, APH 10, and APH 30) showed a significant increase in surface roughness (p < 0.05), and the APH 30 group showed the highest surface roughness. Contact angle was decreased significantly in the surface treated groups compared to the untreated group (p < 0.05), and wettability was highest in APH 30 group. Consequently, we found out that APH 30 group greatly improved bioactivity by formation of nanotubular TiO2 layer and HAp precipitation.
Keywords:
Bioactivity, Nanotubular TiO2 layer, Pre-calcification (10, 30 cylces), Ti-6Al-4V alloy ImplantⅠ. INTRODUCTION
Ti-6Al-4V 합금은 α+β형의 합금으로, 안정한 부동태 산화층이 형성되므로 생체친화성과 부식저항성이 높은 우수한 재료이다. 생체친화성은 임플란트 재료의 표면에 생성되는 비반응성의 산화피막(TiO2)층에서 기인하며(Jang 등, 2008), 부동태 상태에서는 용해속도가 매우 느리고 용해산물은 화학적으로 불활성이기 때문에 골의 성장을 허용하여 골과의 계면에서 골유착 반응이 일어난다(Kim 등, 2007).
티타늄 합금 표면에 활성을 부여하는 표면처리방법은 치조골 내에서 염증의 유발 없이 빠른 골 유착이 일어나게 하기 때문에 치조골에 고정되는 치료기간을 줄일 수 있다(Lugscheider 등, 1991; Rompen 등, 2000; Albrektsson과 Wennerberg, 2004). 나노기술이 발전하면서 임플란트 소재분야에서는 Ti, Nb, Zr 등의 금속 표면에 나노구조의 산화물층을 형성하는 방법이 연구되어 왔으며(Macak 등, 2007; Allam 등, 2010), Ti 합금의 표면적을 증가시키기 위해 전해질 수용액에서 낮은 정전압과 정전류를 일정시간 동안 가하여 나노튜브 TiO2 층을 형성하는 양극산화처리법은 그의 유용한 수단의 하나로서 소개되고 있다(Sharma, 1992; Zhao 등, 2005; Lee 등, 2006). 얇고 두께가 균일한 나노튜브 TiO2 층은 골과 접촉하는 비표면적을 넓혀주므로 골유착에 유리하게 작용하게 된다(Park 등, 2007; Lavenus 등, 2012). 수산화인회석(Hydroxyapatite, HAp) 코팅법에 의한 골유착 반응은 티타늄 표면과 코팅층 사이에 강력한 결합이 어려워 두꺼운 피막층에서 박리가 쉽게 일어나는 문제점이 있었다(Fini 등, 1999). 이에 대한 대안적인 방법으로서, HAp 코팅법과 비슷한 효과를 갖고, 두께가 얇은 피막층을 형성하기 위해 석회화 순환처리법이 이용되고 있다(Kodama 등, 2009; Nguyen 등, 2013).
화학적 산처리, 미세입자를 이용한 분사처리(sandblasting), 양극산화처리(anodizing), 플라즈마 분사처리 등의 표면처리(Kurella와 Dahotre, 2005)에 의해 임플란트와 골의 경계면에서는 혈병(blood clot)의 형성을 안정화하며 섬유소가 형성되고, 골모세포(Osteoblat cell)의 분화를 촉진시키며, 술 후의 초기에 임플란트 주변의 골 치유를 향상시킨다(Park 등, 2009; Mustafa 등, 2001; Lai 등, 2011). 또한, 임플란트 표면의 접촉 면적이 증가하여 식립된 임플란트의 주위에 세포의 부착을 증가시키고, 세포가 분열하여 성장하면서 골유착을 증가시킨다(Han 등, 2006).
이에 본 연구에서는 임플란트의 표면조도를 증가시키기 위해 SLA처리된 Ti-6Al-4V 합금 시편에 대해 양극산화를 통해 나노튜브 TiO2층을 형성하였고, 또 석회화 순환처리를 통하여 Ca-P의 석출을 유도한 다음 유사체액 중에서의 생체활성도를 연구하였다. 또한, 이전 연구에서는 석회화 순환처리로 나노튜브 구조의 TiO2층이 형성된 표면에서 생체활성도가 크게 개선됨을 확인하여(Song, 2016), 이번 연구에서는 석회화 순환처리에 사용되는 NaH2PO4 수용액의 함량을 증가시키고, 순환처리 횟수를 변화시킴으로써 그 효과의 변화를 확인하고자 하였다.
Ⅱ. MATERIALS AND METHODS
1. 나노튜브 TiO2층 형성을 위한 양극산화 처리
시편은 가로 10 mm, 세로 20 mm, 두께 1.5 mm의 Ti-6Al-4V 합금판(Kobe Steel Ltd, Japan)을 사용하였다. SLA 처리를 위해 평균입경 300 ㎛와 100 ㎛ 입자를 50/50 wt% 비율로 혼합한 HAp 분말(MCD powder, Hi-Med, USA)을 4기압으로 분사처리한 다음 80℃의 HCl-H2SO4 수용액으로 산부식을 하였다. 시편 표면의 불순물을 제거하기 위해 HNO3(Sigma-Aldrich, USA)와 HF와 H2O의 혼합 용액 속에 10초간 침적하여 산세처리를 하였다. 건조 후, 양극산화장치(Inverter Tech Co, Ltd, Korea)를 사용하여 시편 표면에 나노튜브 TiO2층을 형성하기 위해, 글리세롤(SHOWA, Japan)과 3차 증류수를 80:20으로 혼합한 후 1 wt% NH4F(SHOWA, Japan)를 첨가한 전해질 용액 중에서 양극에 Ti-6Al-4V 시편을, 음극에 백금판을 연결하여 전원을 공급하였다. 두 전극간의 거리는 약 20 ㎜ 정도 이격시키고, 정전압 20 V와 정전류 20 mA를 1시간 동안 인가하였다. 이렇게 양극산화 처리를 하여 나노튜브 TiO2 층을 형성한 다음 3차 증류수로 1분간 초음파 세척을 하여 건조기(50℃)에서 24시간 이상 건조한 후 시험에 사용하였다.
2. 생체활성화를 위한 석회화 순환처리
생체활성을 부여하기 위해 80℃ 0.1 M NaH2PO4(SHOWA, Japan) 수용액과 100℃ Ca(OH)2(SHOWA, Japan) 포화수용액 속에서 각각 1분씩을 주기로 해서 10회와 30회 반복 침적하는 방식으로 석회화 순환처리를 시행하였으며, 시편의 구조적 안정화와 표면층에 형성된 불순물을 제거하기 위해 전기로(Ajeon Industrial Co, Ltd, Korea)에서 500℃ 에서 2시간을 유지시키는 열처리를 한 후 상온까지 서냉을 하였다.
3. 생체활성도 평가를 위한 SBF 침적시험
시험군은 SLA 처리만을 시행한 무처리의 UT군, 양극산화와 열처리를 거친 시편 AH군 (Anodizing + Heating), 양극산화처리를 하고 각각 10회와 30회의 석회화 순환처리를 한 다음 열처리를 거친 APH 10군, APH 30군으로 분류하였다. 모든 시편은 120℃에서 20분 동안 고압멸균 처리를 한 후 pH와 무기이온 농도를 인간의 혈장과 유사하게 조절한 유사체액(Simulated body fluid, SBF) 속에 3일 동안 침적하여 HAp 석출 양상을 조사였다. SBF는 Hanks 용액(H2387, Sigma Chemical Co, USA)에 염화칼슘 2수화물(calcium chloride dihydrate, SHOWA, Japan) 0.185 g/L, 황산마그네슘(magnesium sulfate, SHOWA, Japan) 0.09767 g/L, 탄산수소나트륨(sodium hydrogen carbonate, SHOWA, Japan) 0.350 g/L를 첨가하여 제조하였으며, 1M HCl(SHOWA, Japan) 수용액으로 pH를 7.4로 조절하였다.
양극산화를 통해 시편의 표면에 생성된 나노튜브 TiO2 층과 SBF 침적 후 생성된 HAp의 미세구조를 관찰하기 위해 전계방사주사전자현미경(Field emission scanning electron microscope: FE-SEM)(S800, Hitachi, Japan)을 사용하였으며, 표면에 형성된 원소의 농도를 조사하기 위해 X-선 스펙트럼 (Energy dispersive spectroscopy: EDS)(Bruker, Germany)으로 분석하였다. 또한, 피막층에 존재하는 원소의 결정구조를 조사하기 위해 X-선 회절기(X-ray diffraction spectroscopy: XRD)(Dmax Ⅲ-A type, Rigaku, Japn)로 scanning speed: 4°/min, range: 20-80°의 조건에서 분석을 하였다.
4. 표면 거칠기와 접촉각 측정
양극산화와 석회화 순환처리 후의 표면 거칠기를 알아보기 위해 표면 거칠기 측정기(SV-3000, Mitutoyo manufactured Ltd, Japan)의 다이아몬드 팁으로 4.8 mm의 범위를 0.2 mm/s의 속도로 7번 측정하여 평균 거칠기를 조사하였다. 또한 표면 거칠기가 젖음성에 미치는 영향을 평가하기 위해 접촉각 측정기(PHX-300 Touch, Surface Electro Optics Co, Korea)로 정적법(sessile drop method)을 이용하여 시편의 표면에 형성된 유사체액의 접촉각을 Sufaceware8 software (Surface Electro Optics, Korea)로 분석하였다.
Ⅲ. RESULTS
1. 양극산화처리에 의한 나노튜브 TiO2 층의 형성과 석회화 순환처리에 의한 인산칼슘 석출
AH군의 표면에서는 치밀한 형태로 배열된 나노튜브층이 관찰되었다(Figure 1a). 나노튜브 TiO2 층 형성 후 10회와 30회의 석회화 순환처리를 시행한 APH 10군과 APH 30군의 표면에서는 알갱이 형태와 클러스터 형태를 이루는 인산칼슘 석출물이 관찰되었으며, APH 10군에 비해 APH 30군에서 보다 더 조대한 형태를 이루며 증가된 인산칼슘 석출물들이 관찰되었다(Figure 1b, c).

SEM images (×2,000, ×50,000) of the nanotubular TiO2 layer on Ti-6Al-4V alloy specimens. (a) AH, (b) APH 10, (c) APH 30.
Table 1은 석회화 순환처리 후 표면에 석출된 Ca와 P를 X-선 스펙트럼 (EDS)으로 분석한 것으로, APH 10군에 비해 APH 30군에서 유의하게 높은 석출량을 보였다( P <0.05).
2. 표면 거칠기와 접촉각 측정
중심선 평균 거칠기의 값 Ra를 비교해 보면, UT군에서는 0.100 ± 0.008 ㎛ 이고, AH군에서는 0.153 ± 0.034 ㎛, APH 10군에서는 0.255 ± 0.039 ㎛, APH 30군에서는 0.464 ± 0.067 ㎛로 나타났으며, 각 군 상호간에 통계학적으로 유의한 차이를 보였다(P < 0.05, Figure 2).
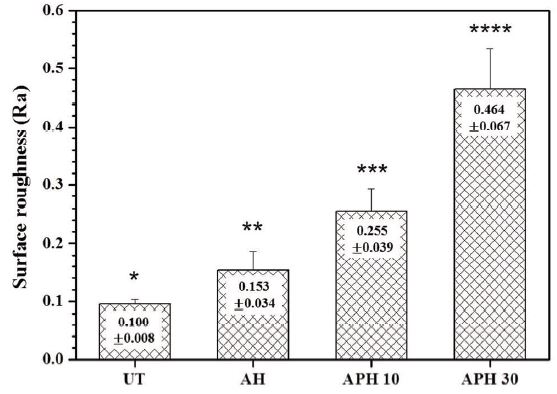
Results of surface roughness of UT, AH, APH 10, APH 30 specimens. The different symbols are significantly different (p < 0.05).
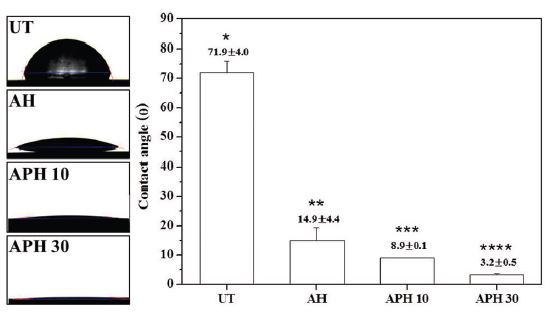
접촉각 측정 결과를 비교해 보면, UT군에서 71.9 ± 4.0°, AH군에서 14.9 ± 4.4°, APH 10군에서 8.9 ± 0.1°, APH 30군에서 3.2 ± 0.5°로서, 모든 군들이 상호간에 통계학적으로 유의한 차이를 보였다(P < 0.05, Figure 3).
3. SBF 침적에 의한 HAp 석출
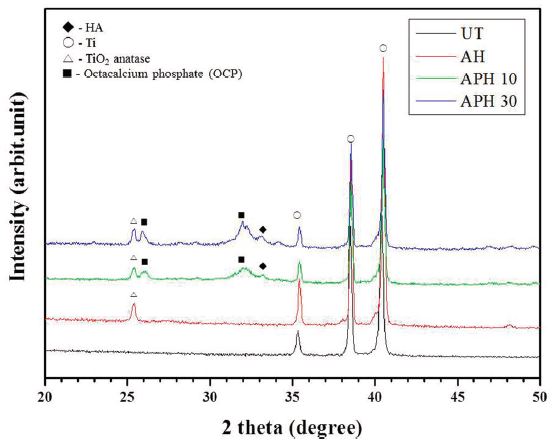
37℃의 SBF 용액에 3일 동안 침적하고서 관찰한 FE-SEM 사진을 비교해 보면, APH 10군과 APH 30군에서는 돌기상이 치밀하게 석출된 양상을 보였지만, APH 10군에 비해 APH 30군에서 보다 치밀하게 석출이 되는 양상을 보였다(Figure 4). 또한 SBF에 3일간 침적한 후 표면에 석출된 Ca와 P의 농도 및 X-선 회절분석기로 분석한 결과를 보면, APH 10군에 비해 APH 30군에서 유의하게 높은 석출량을 보였으며(Table 2, P < 0.05), UT군에서는 타이타늄의 피크만이 관찰되지만, AH군에서는 TiO2 anatase 피크(2θ = 25°)가 관찰이 되었다. 또한 APH 10군과 APH 30군에서는 TiO2 anatase 피크와 함께 octacalcium phosphate(OCP)상의 피크(2θ = 26°, 32°) 및 HAp의 피크(2θ = 33°)가 관찰되었다(Figure 5)(Nguyen 등, 2013).

FE-SEM images after immersion in SBF for 3 days. (a) APH 10 (×2,000), (b) APH 10 (×50,000), (c) APH 30 (×2,000), (d) APH 30 (×50,000)
Ⅳ. DISCUSSION
치과에서 임플란트는 치아가 결손된 부위에 소실된 자연치아를 대신하여 상, 하악골에 매식체를 식립하고 안정적으로 구강의 기능과 치아의 기능을 회복시키는 술식이다. 이러한 임플란트의 기능회복과 안정적 골유착에 영향을 주는 요소로는 임플란트 소재의 재질, 디자인, 표면특성, 골량과 골질, 외과적 술식, 하중조건과 환자의 구강환경 등을 거론하고 있다(Andersson 등, 1998; Testori 등, 2001; Kan 등, 2003). 본 연구에서는 SLA 처리한 Ti-6Al-4V 합금을 불소이온을 함유하는 글리세롤 용액에서 양극산화 처리하여 나노튜브 TiO2 층을 형성하고, NaH2PO4 수용액과 Ca(OH)2 포화수용액에 교대로 10, 30회 침적하여 석회화 순환처리를 한 결과, APH 10군에 비해 APH 30군에서 더 조대한 형태를 이루며 증가된 인산칼슘 석출물들이 관찰되었고(Figure 1b, c), Ca/P의 비율은 각 각 1.61, 1.96로 APH 30군에서 높게 나타났다(Table 1). 이는, 0.05M NaH2PO4 수용액으로 석회화 순환처리를 하였을 때 Ca/P의 비율이 1.94였던 결과에 비하여(Nguyen 등, 2013), 본 실험에서 사용된 조건인 0.1 M NaH2PO4 수용액으로 30회 석회화 순환처리를 시행하면 1.96로 더 높은 값을 얻을 수 있었다. 이러한 결과로 미루어 봤을 때, NaH2PO4 수용액의 농도와 산성도가 높을수록 석출된 Ca/P의 비율이 높아졌음을 알 수 있다. SBF 용액에 침적하고서 관찰한 결과도 APH 30군에서 돌기상이 치밀하게 석출된 양상을 보였다(Figure 4). 또한, SBF 용액에 침적한 후 표면에 석출된 Ca/P의 비율은 APH 10군에 비해 APH 30군에서 높게 나타났으며(각 각 1.73, 2.05; Table 2), OCP상의 피크 및 HAp의 피크가 더 높게 관찰되었다(Figure 5). 이러한 결과는, OCP상이 HAp의 석출을 증가시키는데 중요한 역할을 하며, SBF 용액에서 생체활성도를 향상 시킨다는 이전의 연구 결과들과 일치한다(Nguyen 등, 2013).
양극산화 처리에 의해서 타이타늄 합금의 표면에 나노튜브 TiO2 층을 형성하는 기전은 전기화학적인 작용으로 일어나는 산화 피막층의 성장과 불소이온에 의한 산화물의 분해가 연속적으로 진행되어 일어난 결과라고 언급되고 있다(Macak 등, 2007). 양극산화 처리법의 장점으로는 표면형상에 관계없이 균일한 두께의 산화피막층의 형성이 가능하고, 전해질 수용액의 조성, 전압 및 첨가제 등의 조절에 의해서 산화피막층 두께와 특성을 조절할 수 있을 뿐만 아니라 표면처리에 적은 비용이 소요되는 점 등을 들고 있다(Gong 등, 2001; Macak 등, 2005). 본 연구에서 Ti-6Al-4V 합금제 임플란트의 SLA 처리 후 1 wt% NH4F와 20 wt% H2O를 함유하는 글리세롤 용액에서 20 V의 DC 전압을 인가하여 양극산화 처리한 결과, 치밀한 구조의 완전한 자기정렬 형태를 갖춘 나노튜브 TiO2 층이 생성되었다.
표면의 거칠기가 골형성에 미치는 영향에 관해서는 아직도 논쟁이 이루어지고 있다. Deligiannii 등(2000), Huang 등(2004)은 티타늄 임플란트의 세포 부착성이나 증식성은 매끄러운 표면에 비해 거친 표면이 더 유리하다고 하였고, Orsini 등(2000)은 임플란트 매식부에서 골과 임플란트의 접촉 비율은 분사처리만 시행한 경우보다 분사처리와 산부식 처리를 병용한 경우에 더 높게 나타난다고 하였다. 본 연구의 결과를 살펴보면, 나노튜브 TiO2 층을 형성한 후 석회화 순환처리를 한 APH 30군에서 표면조도의 증가와 젖음성이 개선되어 친수성이 개선되었기 때문에 임플란트로서 매식되었을 때 골형성에 유리하게 작용할 것으로 생각된다.
생체불활성의 특성을 보이는 Ti-6Al-4V 합금의 표면에 활성을 부여하여 골전도성을 개선하기 위해 여러 가지 방법이 시도되었으며(Khor 등, 2004; Shi 등, 2009; Park 등, 2010), 이들 중 유효한 방법의 하나로서 석회화 순환처리법이 도입되었다(Sobieszczyk 와 Zieliński, 2008; Nguyen 등, 2013). 본 연구에서 SLA 처리한 Ti–6Al–4V 합금의 표면에 glycerol 용액에서 나노튜브 TiO2 층을 생성한 다음 80℃ 0.1 M NaH2PO4 수용액과 100℃ Ca(OH)2 포화수용액에 교대로 침적하는 방식으로 석회화 순환처리를 하여 인산칼슘의 석출을 유도하는 것은 생체활성도를 개선하는 유효한 수단이 될 수 있을 것으로 생각한다.
한편, 향후 본 연구에서 시행한 방법에 대한 in vitro 및 in vivo 실험이 추가적으로 필요하리라 사료된다.
Ⅴ. CONCLUSION
본 연구에서는 SLA 처리한 Ti-6Al-4V 합금의 생체적합성과 생체활성도를 개선하기 위해 불소이온을 함유하는 글리세롤 용액에서 나노튜브 TiO2 층을 생성한 다음 인산염과 칼슘 이온을 함유하는 용액에서 석회화 순환처리를 시행한 결과, 다음과 같은 결론을 얻었다.
- 1. 글리세롤 용액에서 양극산화 처리로 Ti-6Al-4V 합금의 표면에 자가정렬 형태를 갖춘 치밀한 구조의 나노튜브 TiO2 층이 생성되었다.
- 2. 30회 석회화 순환처리한 표면(APH 30군)에서는 알갱이 형태와 클러스터 형태를 이루는 치밀한 구조의 인산칼슘이 석출되었으며, 표면조도의 증가와 함께 접촉각의 감소가 확인되었다.
- 3. SBF에 3일 침적 시 APH 30군에서 HAp 석출이 빠르게 가속되어 생체활성도가 개선된 결과를 보였다.
Acknowledgments
이 논문은 2016년도 청암대학교 학술연구비 지원에 의해서 수행된 연구임.
References
- Albrektsson, T., Wennerberg, A., (2004), Oral implant surfaces: Part 1-review focusing on topographic and chemical properties of different surfaces and in vivo responses to them, Int J Prosthodont, 17, p536-543.
-
Allam, NK., Alamgir, F., El-Sayed, MA., (2010), Enhanced photoassisted water electrolysis using vertically oriented anodically fabricated Ti-Nb−Zr−O mixed oxide nanotube arrays, ACS nano, 4, p5819-5826.
[https://doi.org/10.1021/nn101678n]

- Andersson, B., Odman, P., Lindvall, AM., Branemark, PI., (1998), Cemented single crowns on osseointegrated implants after 5 years: Results from a prospective study on ceraone, Int J Prosthodont, 11, p212-218.
-
Deligianni, DD., Katsala, ND., Koutsoukos, PG., Missirlis, YF., (2000), Effect of surface roughness of hydroxyapatite on human bone marrow cell adhesion, proliferation, differentiation and detachment strength, Biomaterials, 22, p87-96.
[https://doi.org/10.1016/S0142-9612(00)00174-5]

-
Fini, M., Cigada, A., Rondelli, G., Chiesa, R., Giardino, R., Giavaresi, G., Aldini, NN., Torricelli, P., Vicentini, B., (1999), In vitro and in vivo behaviour of ca-and p-enriched anodized titanium, Biomaterials, 20, p1587-1594.
[https://doi.org/10.1016/S0142-9612(99)00060-5]

-
Gong, D., Grimes, CA., Varghese, OK., Hu, W., Singh, R., Chen, Z., Dickey, EC., (2001), Titanium oxide nanotube arrays prepared by anodic oxidation, J Mater Res, 16, p3331-3334.
[https://doi.org/10.1557/JMR.2001.0457]

- Han, YS., Kim, IK., Chang, KS., Park, TH., Jeon, W., (2006), Histomorphometric study of dental implants with double acid-etched and anodic oxidized surface in the rabbit tibia, J Korean Assoc Maxillofac Plast Reconstr Surg, 28, p434-444.
-
Huang, HH., Ho, CT., Lee, TH., Lee, TL., Liao, KK., Chen, FL., (2004), Effect of surface roughness of ground titanium on initial cell adhesion, Biomol Eng, 21, p93-97.
[https://doi.org/10.1016/j.bioeng.2004.05.001]

-
Jang, JM., Park, SJ., Choi, GS., Kwon, TY., Kim, KH., (2008), Chemical state and ultra-fine structure analysis of biocompatible TiO2 nanotube-type oxide film formed on titanium substrate, Met Mater Int, 14, p457-463.
[https://doi.org/10.3365/met.mat.2008.08.457]

- Kan, JY., Rungcharassaeng, K., Lozada, J., (2003), Immediate placement and provisionalization of maxillary anterior single implants: 1-year prospective study, Int J Oral Max Impl, 18, p31-39.
-
Khor, K., Gu, Y., Pan, D., Cheang, P., (2004), Microstructure and mechanical properties of plasma sprayed HA/YSZ/ Ti-6Al–4V composite coatings, Biomaterials, 25, p4009-4017.
[https://doi.org/10.1016/j.biomaterials.2003.10.089]

-
Kim, HS., Kee, KM., Lee, DJ., Park, SW., Lee, KK., (2007), Surface characteristics of oxide film prepared on cp Ti and Ti-10Ta-10Nb alloy by anodizing, Korean J Mater Res, 17, p6-10.
[https://doi.org/10.3740/MRSK.2007.17.1.006]

-
Kodama, A., Bauer, S., Komatsu, A., Asoh, H., Ono, S., Schmuki, P., (2009), Bioactivation of titanium surfaces using coatings of TiO2 nanotubes rapidly pre-loaded with synthetic hydroxyapatite, Acta Biomater, 5, p2322-2330.
[https://doi.org/10.1016/j.actbio.2009.02.032]

-
Kurella, A., Dahotre, NB., (2005), Surface modification for bioimplants: The role of laser surface engineering, J Biomater Appl, 20, p5-50.
[https://doi.org/10.1177/0885328205052974]

-
Lai, M., Cai, K., Zhao, L., Chen, X., Hou, Y., Yang, Z., (2001), Surface functionalization of TiO2 nanotubes with bone morphogenetic protein 2 and its synergistic effect on the differentiation of mesenchymal stem cells, Biomacromolecules, 12, p1097-1105.
[https://doi.org/10.1021/bm1014365]

-
Lavenus, S., Trichet, V., Chevalier, LS., Hoornaert, A., Louarn, G., Layrolle, P., (2012), Cell differentiation and osseointegration influenced by nanoscale anodized titanium surfaces, Nanomedicine, 7, p967-980.
[https://doi.org/10.2217/nnm.11.181]

-
Lee, WJ., Alhoshan, M., Smyrl, WH., (2006), Titanium dioxide nanotube arrays fabricated by anodizing processes electrochemical properties, J Electrochem Soc, 153, pB499-B505.
[https://doi.org/10.1149/1.2347098]

-
Lugscheider, E., Weber, T., Knepper, M., Vizethum, F., (1991), Production of biocompatible coatings by atmospheric plasma spraying, Mater Sci Eng A, 139, p45-48.
[https://doi.org/10.1016/0921-5093(91)90594-D]

-
Macak, J., Tsuchiya, H., Ghicov, A., Yasuda, K., Hahn, R., Bauer, S., Schmuki, P., (2007), TiO2 nanotubes: Self-organized electrochemical formation, properties and applications, Curr Opin Solid State Mat Sci, 11, p3-18.
[https://doi.org/10.1016/j.cossms.2007.08.004]

-
Macak, JM., Tsuchiya, H., Schmuki, P., (2005), High‐aspect‐ratio TiO2 nanotubes by anodization of titanium, Angew Chem Int Edit, 44, p2100-2102.
[https://doi.org/10.1002/anie.200462459]

-
Mustafa, K., Wroblewski, J., Lopez, BS., Wennerberg, A., Hultenby, K., Arvidson, K., (2001), Determining optimal surface roughness of TiO2 blasted titanium implant material for attachment, proliferation and differentiation of cells derived from human mandibular alveolar bone, Clin Oral Implant Res, 12, p515-525.
[https://doi.org/10.1034/j.1600-0501.2001.120513.x]

-
Nguyen, TDT., Park, IS., Lee, MH., Bae, TS., (2013), Enhanced biocompatibility of a pre-calcified nanotubular TiO2 layer on Ti–6Al–7Nb alloy, Surf Coat Tech, 236, p127-134.
[https://doi.org/10.1016/j.surfcoat.2013.09.038]

- Orsini, G., Assenza, B., Scarano, A., Piattelli, M., Piattelli, A., (2000), Surface analysis of machined versus sandblasted and acid-etched titanium implants, Int J Oral Max Impl, 15, p779-784.
-
Park, JW., Kim, HK., Kim, YJ., Jang, JH., Song, H., Hanawa, T., (2010), Osteoblast response and osseointegration of a Ti–6Al–4V alloy implant incorporating strontium, Acta Biomater, 6, p2843-2851.
[https://doi.org/10.1016/j.actbio.2010.01.017]

-
Park, J., Bauer, S., Schmuki, P., von der Mark, K., Narrow window in nanoscale dependent activation of endothelial cell growth and differentiation on TiO2 nanotube surfaces, (2009), Nano Lett, 9, p3157-3164.
[https://doi.org/10.1021/nl9013502]

-
Park, KH., Heo, SJ., Koak, JY., Kim, SK., Lee, JB., Kim, SH., Lim, YJ., (2007), Osseointegration of anodized titanium implants under different current voltages: A rabbit study, J Oral Rehabil, 34, p517-527.
[https://doi.org/10.1111/j.1365-2842.2006.01688.x]

- Rompen, E., DaSilva, D., Lundgren, AK., Gottlow, J., Sennerby, L., (2000), Stability measurements of a double-threaded titanium implant design with turned or oxidized surface, Appl Osseointegration Res, 1, p18-20.
-
Sharma, A., (1992), Anodizing titanium for space applications, Thin Solid Films, 208, p48-54.
[https://doi.org/10.1016/0040-6090(92)90946-9]

-
Shi, GS., Ren, LF., Wang, LZ., Lin, HS., Wang, SB., Tong, YQ., (2009), H2O2/HCl and heat-treated Ti-6Al-4V stimulates pre-osteoblast proliferation and differentiation, Or Surg Or Med Or Pa, 108, p368-375.
[https://doi.org/10.1016/j.tripleo.2009.05.033]

-
Sobieszczyk, S., Zieliński, A., (2008), Coatings in arthroplasty: Review paper, Adv Mater Sci, 8, p35-54.
[https://doi.org/10.2478/v10077-008-0049-7]

-
Song, JJ., (2016), Evaluation of Biological Activity and Corrosion Resistance on Ti-6Al-4V Alloy Implant by Anodic Oxidation and Cyclic Pre-calcification Treatments, Korean J Dent Mater, 43, p399-406.
[https://doi.org/10.14815/kjdm.2016.43.1.9]

- Testori, T., Wiseman, L., Woolfe, S., Porter, SS., (2001), A prospective multicenter clinical study of the osseotite implant: Four-year interim report, Int J Oral Max Impl, 16, p193-200.
-
Zhao, J., Wang, X., Chen, R., Li, L., (2005), Fabrication of titanium oxide nanotube arrays by anodic oxidation, Solid State Commun, 134, p705-710.
[https://doi.org/10.1016/j.ssc.2005.02.028]