양극산화 전해용액에 따른 치과용 임플란트의 전기화학적 평가
Abstract
The surface morphology and electrochemical evaluation of anodic films on dental implant Ti alloy in different electrolytes were investigated in this study. Titanium oxide films were prepared using an anodic oxidation method on the surface of the dental implant in three different electrolytes; phosphoric acid (EL1), sulfuric acid (EL2) and mixed calcium acetate solution (EL3) with different voltages for 5 min at room temperature. Anodic films consisted with porous structures were formed on Ti alloy for dental implant after anodization in all electrolytes. The corrosion resistance of EL1 and EL3 were higher than that of the non-coated Ti alloy for dental implant in 0.9% NaCl solution from the results of the potentiodynamic test, indicating better protective effect. From the results of A.C. impedance analysis in 0.9% NaCl solution, polarization resistance values of EL1 showed 2.37×107Ωcm2. EL1 were higher than those of non-treated Ti alloy for dental implant, EL2 and EL3.
Keywords:
Dental, Implant, Anodize, Electrolyte, ElectrochemicalⅠ. INTRODUCTION
생체 기관을 인공적으로 대체하기 위한 생체용 재료의 연구는 고분자, 세라믹, 금속 등의 거의 모든 재료 분야에서 다양하게 연구 개발되고 있으며, 특히 금속의 경우는 높은 하중이나 고강도가 요구되는 치아, 관절 및 wire, plate, screw와 같은 골절된 뼈의 접합재료 등으로 널리 사용되고 있다 (Niomi, 1998; Davies 등, 1990).
금속 재료는 1912년에 Sherman이 바나듐 합금강(vanadium steel)을 사용한 골고정판(bone plate)과 골나사(bone screw)를 소개하면서 활발하게 발전되었다(Sherman, 1912). 그러나 이 시기에 제작된 바나듐 골고정판과 골나사는 열악한 가공 기술 때문에 응력집중 현상에 의한 파단 현상이 발생되어 기계적인 취약성을 나타내는 경우도 있었다. 뿐만 아니라 바나듐 합금강은 인체 내에서 빠르게 부식되는 단점이 발견되었다. 이러한 문제점들이 지적되면서 금속 재료가 의료용으로 사용되려면 생체 내에서 적절하게 목표 기능을 수행할 수 있는 생체적합성의 개선에 대한 연구가 시작되었다. 스테인리스강은 비교적 초기에 발견된 합금으로서 가공이 용이하고, 내식성이 우수하기 때문에 각종 임플란트로 널리 사용하게 되었다. 이 외에도 코발트–크롬 합금과 타이타늄, 타이타늄 합금은 우수한 내식성과 탁월한 기계적 특성을 갖고 있어서 의료용으로 많은 관심을 갖게 되었다(Sotuw 등, 1981).
타이타늄(Titanium, Ti)은 산소가 포함된 분위기에 노출되었을 때 Ti 산화물(주로 TiO2)이 지속적으로 표면에 형성되어, 이 층에 의해 표면의 부식 반응이 억제되는 부동태 금속(valve metal; Al, Ta, Nb, V, W 등) 중 하나로 알려져 있다. 이때 생성된 자연 산화막은 보통 2~5 nm의 두께를 가지며 금속의 부식 저항 능력을 향상시킨다. 이러한 금속 부식 저항성은 생체 내에서 금속의 용출을 억제하여 생체적합성을 증가시킨다(Krupa 등, 2001). 하지만 자연적으로 생긴 Ti 산화막 층과 뼈와의 골융합(osseintegration) 정도가 약하여 임플란트 시술 후 지속적으로 파괴되어 정형외과용 임플란트 수명은 10~15년으로 알려져 있다(Liu 등, 2004; Moran 등, 2000). 이러한 이유로 골 조직 내에 임플란트의 접합을 개선하고자 하는 연구, 즉 골과의 결합을 높이기 위하여 Ti 표면 개질을 통하여 생체 활성도(bioactivity)를 증진시키고자 하는 연구가 활발히 진행되어 왔다. 최근 들어서는, Ti 임플란트 표면 조직의 개선을 통해 골조직에 생역학적인 방법으로 우수한 결합을 유도하기 위해 Ti 소결 코팅, Ti 플라즈마 스프레이 코팅법, 전기화학적 방법에 의한 양극산화처리, 칼슘-인산 코팅, 입자분사 후 양극산화처리 공법, 물리기상 증착법을 이용한 질화물 코팅과 칼슘인산 코팅법 등 다양한 기법으로 임플란트 표면을 개질하는 연구가 새롭게 이루어지고 있다. 이중 전기화학적 방법에 의해 생체재료용 Ti 임플란트 표면을 양극산화 처리 시 표면개질공법이 비교적 간단하고 표면처리 비용이 저렴하며, 다공성 산화피막 형성시 전해 공정 변수인 인가전압, 전류, 시간, 다양한 임플란트 디자인 형상에 적용성 등을 고려하여 표면의 다공성 조직을 제어하기가 용이하다. 뿐만 아니라 임플란트를 식립한 후 오랜 기간 동안 물리 및 화학적 안정성을 유지하기 위해 전해질 용액의 종류에 따라 피막의 특성 및 조직의 변화를 유도하여 생체친화성 산화막을 형성시킬 수 있다는 장점이 있다. 또한 미세기공의 비표면적이 넓을 경우 골과 임플란트의 접촉율이 증가하고, 다공성 산화피막의 임플란트에서 골조직과의 결합성이 우수한 것으로 알려져 있다.
따라서 본 연구에서는 현재 상용 판매되고 있는 치과용 임플란트 재료 표면을 다양한 전해용액 내에서 양극산화 처리한 후에 표면 분석 및 전기화학적 평가를 실시하여 내부식 특성 등을 관찰하고자 하였다.
Ⅱ. MATERIALS AND METHODS
1. 실험재료
본 연구에서는 상용 판매되고 있는 Ti-6Al-4V ELI 인 BN 5010®(KJ Meditech Co., Gwangju, Korea) 대구치용 임플란트(Fig. 1)를 양극산화용 시료로 사용하였다. 시료로 사용한 BN 5010® 임플란트를 구리선에 접합한 후, 증류수와 에틸 알콜 및 아세톤을 이용하여 초음파 세척을 실시하였다.
2. 실험방법
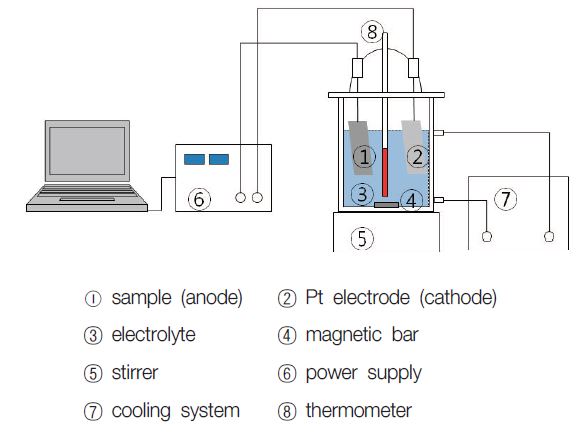
BN 5010® 임플란트 표면의 양극 산화에 사용한 전해용액을 Table 1에 나타내었다. 인산(EL1), 황산(EL2) 및 초산칼슘과 칼슘글리세로포스페이트의 혼합용액(EL3)의 3가지 용액을 전해용액으로 사용하였으며, 농도와 인가 전압은 참고문헌을 참조하였다(Cu 등, 2009). Fig. 2에 나타낸 것과 같이 온도를 조절하면서 용액을 교반할 수 있는 항온조 내에서 양극산화 처리하였다. 양극산화시 전해 전압은 180~280 V로 인가하고, 전류 밀도는 0.7 A/cm2로 정전류를 공급하여 일정 전압에 도달하면 정전압 방식으로 처리하였다.
전해 전압에 따른 다공성 산화피막 형성과 표면구조를 관찰하기 위해 FE-SEM(field emission scanning electron microscope, Hitaci, S-4800, Japan)을 이용하였으며, 산화막의 화학조성을 관찰하기 위해 FE-SEM에 부착된 EDS(energy dispersive spectrometer, Oxford, X-Man, U.K.)를 이용하였다.
① 동전위 시험(potentiodynamic test)
내부식성을 전기화학적으로 정량 평가하기 위하여 동전위 시험을 행하였다. 분극 거동을 확인하기 위하여 소프트웨어(Princetion Applied Research. U.S.A.)로 제어되는 potentiostat (EG&G, model 263, U.S.A.)을 이용하여 (36.5 ± 1)℃의 0.9% NaCl 전해액에서 100 mV/min의 주사 속도로 동전위 분극 시험을 실시하였다. 시편을 아세톤, 에탄올 및 증류수 순으로 초음파 세척하여 건조한 후 사용하였고, 시편을 작업 전극으로 하고, 보조 전극으로는 고밀도 탄소 전극을 사용했으며, 기준 전극으로는 포화감홍전극(SCE; saturated calomel electrode)을 사용하였다. -1500 mV의 음극 전위 하에서 10분간 인위적으로 환원시키면서 동시에 Ar 가스를 주입하면서 교반하여 시편 표면의 불순물, 산화물과 용존 산소를 제거하였다. 동전위 시험은 -1500 mV에서 +1500 mV에서 행하였다.
② AC 임피던스 측정(AC impedance test)
교류 임피던스 측정에 사용한 전해액과 전극은 동전위 시험과 동일하다. Table 2에 나타낸 바와 같이, 10 mHz~100 kHz의 주파수 영역에서 potentiostat (EG&G, model 263, U.S.A.)을 이용하여 측정한 후에 ZSimWin(Princeton applied Research, U.S.A.) 소프트웨어를 사용하여 용액저항(Rs) 및 분극저항(Rp)을 구하였다.
Ⅲ. RESULTS AND DISCUSSION
EL3 전해 용액을 이용한 양극산화 처리 전후의 표면을 FE-SEM으로 관찰하여 Fig. 3에 나타내었다. Fig. 3(a)와 (a-1)은 50배와 1000배로 관찰한 양극산화 전의 표면으로 가공면이 매끄럽게 형성되어 있는 것을 볼 수 있었다. Fig. 3(b)은 50배로 관찰한 양극산화 후의 표면으로 Fig. 3(a)와는 달리 표면 전체에 다공성 피막이 형성된 것을 볼 수 있었고, 1000배로 관찰한 Fig. 3(b-1)에서 보면 다공성 피막이 가장자리까지 형성된 것을 볼 수 있어서 양극산화 처리가 다른 코팅법과는 차별적으로 표면 전체에 균질한 다공성 피막을 형성하는 것을 관찰할 수 있었다.

The surface morphologies of (a) before and (b) after anodization in EL3. The magnification of (a), (b) and (a-1) (b-1) is 50 and 1000, respectively.
전해용액에 따른 양극산화 처리한 표면을 관찰하여 Fig. 4에 나타내었다. Fig. 4(a)에 나타낸 인산을 이용한 경우와 (b)에 나타낸 황산을 이용한 경우에는 산화층 피막에 0.5~0.85 μm 크기의 기공이 형성된 것을 볼 수 있으며, 황산을 사용한 경우에 인산을 사용한 경우에 비해 다소 거친 표면이 형성된 것을 볼 수 있었다. (c)에 나타낸 초산칼슘 혼합용액을 사용한 경우에는 0.8~1.0 μm 크기의 다소 큰 기공들이 관찰되었고, 기공 내부에 다른 기공들이 형성된 것으로 보아 산화층 피막이 두꺼운 것으로 보인다.
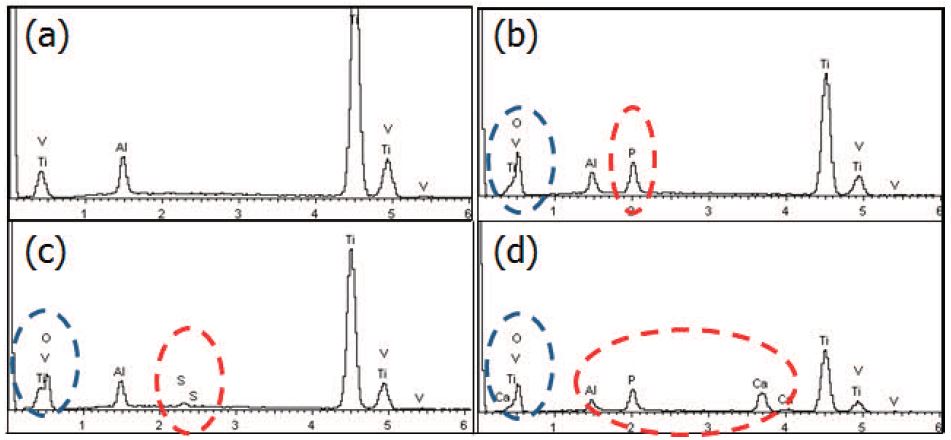
Fig. 5는 FE-SEM에 부착된 EDS를 이용하여 표면층의 화학적 조성을 분석한 결과를 나타낸 것이다. Fig. 5(a)는 양극산화 처리하기 전의 결과로 Ti-6Al-4V라는 것을 알 수 있었다. Fig. 5(b), (c), (d)은 양극산화 처리 후의 결과로 공통적으로 산소가 검출되어 산화막이라는 것을 알 수 있었고, 각각 사용한 전해용액에 따라 (b)에서는 인, (c)에서는 황, (d)에서는 칼슘과 인을 검출할 수 있었다.
내부식성을 평가하기 위한 방법인 동전위 분극시험은 금속 표면이 용액과 접촉하면 이온화 경향에 따라 금속 표면에 있는 이온이 부식되는 전위를 측정하는 것으로 미세한 전위에 의해 금속 표면에 부식이 생기면서 생성되는 부식 생성물에 의해 나타나는 전류 차단을 인지하여 금속이 용액으로 용출되어 전해액과 어떤 반응이 얼마나 일어나는지를 단시간 내에 정량적으로 나타낼 수 있다(Shukla 등, 2005).
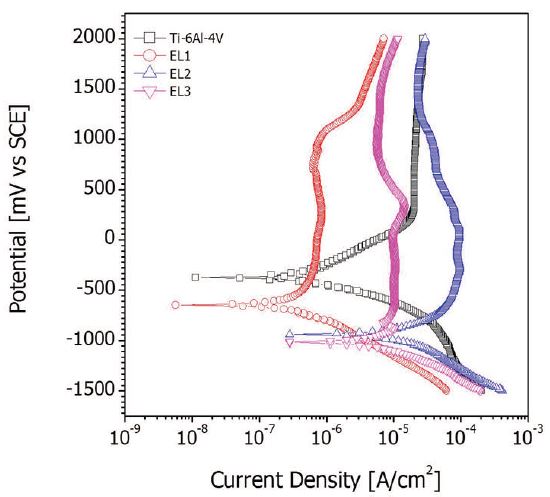
Fig. 6은 전해용액에 따른 시료표면의 전기화학적 특성을 관찰하기 위해 (36.5 ± 1)℃의 0.9% NaCl 용액에서 동전위 분극 곡선을 나타낸 것이다. 양극산화 처리 전의 시편은 -400 mV에서 부식 전위가 발생하고, +300~2000 mV에서는 급격한 부동태 파괴가 일어나지 않았다. 양극산화 처리하면 처리하기 전에 비해 전류밀도가 낮아지는 것으로 보아, 양극산화 처리에 의해 안정한 산화막이 형성되어 내부식성이 향상되었음을 알 수 있다. 생체전위인 +300 mV에서의 전류밀도를 보면 EL3는 양극산화 처리 전과 비슷하지만, EL1는 10배 정도 높아진 반면, EL2는 현저하게 낮아진 것을 알 수 있었다. EL1은 Ecorr에서도 매우 낮은 전류밀도를 나타내었다.
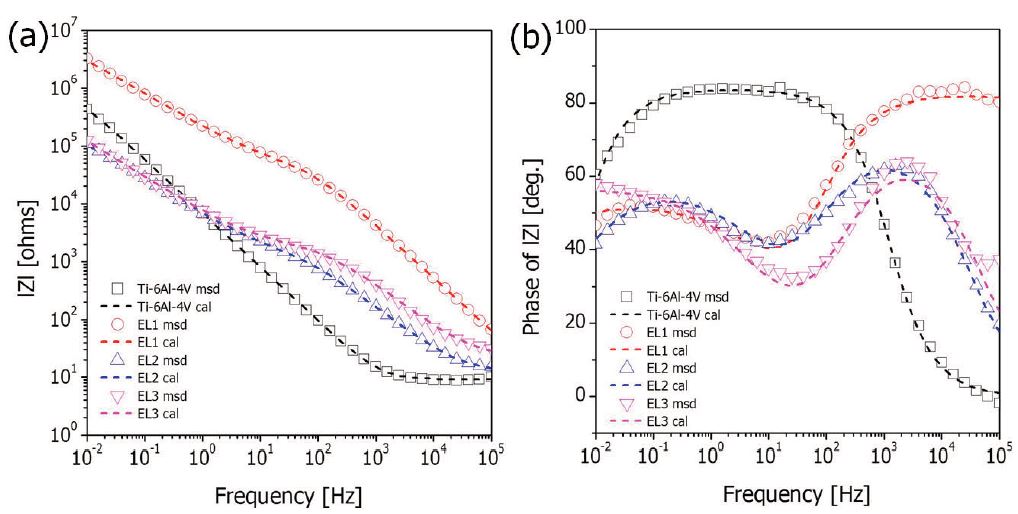
Fig. 7은 AC 임피던스 실험 후의 Bode plot과 Bode phase plot을 나타낸 것이다(Niomi, 1998). Fig. 7(a)에 나타낸 Bode plot에 보면, 모든 시편에서 2개 영역으로 특성화되는 공통적인 현상을 나타내었다. 고주파 영역의 Bode plot은 phase angle이 0에 가까워질수록 log(f)에 따른 log|Z|의 값이 일정하였는데, 이는 전해질 용액의 저항(Rs)에 의한 것으로 생각된다. 중·저주파 영역에서는 log(f)에 따른 log|Z|의 값이 대략 -1에 가까운 기울기를 갖는 것을 확인하였는데, 이것은 순수 캐패서티한 지역에서 양극산화 처리하기 전 시편의 조밀한 부동태 피막의 캐패시턴트(Cp)를 나타낸다. 양극산화 처리하면 전해질의 저항이 증가하였으나, 분극저항(RP)은 EL1이 2.37×107 Ω㎠로 가장 높은 값을 나타내었다.
Fig. 7(b)에 나타낸 Bode phase plot에서 보면, 양극산화 처리 전 시편은 고주파 영역에서 저주파 영역으로 갈수록 캐피시터 반응을 나타내었다. 고주파 영역의 임피던스는 용액의 저항을 나타낸다(Gonzalez 등, 1999). 양극산화 처리한 시편은 고주파 영역에서 중주파 영역으로 가면서 감소하다가, 저주파 영역으로 가면서 다시 증가하는 경향을 나타내었는데, 이는 양극산화층에 형성된 미세기공에 의한 영향으로 생각된다.
EL2와 EL3에서 양극산화 처리한 시편은 초기의 고주파 영역에서 20° 정도의 낮은 phase를 나타낸 반면, EL1에서 양극산화 처리한 시편은 초기의 고주파 영역부터 90° 에 가까운 phase를 나타내어 표면에 캐피시터 반응을 나타내고 있으며, 이런 현상은 시편의 표면에 양극산화 피막이 형성이 되어서 부동태 피막과 같은 경향이 보이는 것이다(Pan 등, 1996).
Table 3는 동전위 분극시험과 AC 임피던스 측정 후에 ZSimpWin V 3.20 프로그램을 이용하여 계산한 값을 나타낸 것이다. EL2을 제외하고, EL1과 EL3에서 양극산화 처리하면 내부식성이 유사하거나 증가하는 것을 알 수 있으며, 특히 EL1이 Ecorr값을 제외한 나머지 값에서는 가장 높은 값을 나타내었다. 따라서, 전해용액의 종류에 따라 내부식성이 달라지는 것을 알 수 있었으며, 생체에 식립 후에 골융합에 영향을 미칠 것으로 생각된다.
Ⅳ. CONCLUSION
치과용 임플란트 표면에 다양한 전해용액으로 양극 산화막을 형성한 후 표면을 관찰하고, 전기화학적 평가를 통하여 내부식성을 관찰한 결과 다음과 같은 결론을 얻었다.
- 1. 치과용 임플란트 표면에 양극산화처리를 실시한 후 미세구조를 관찰한 결과, 임플란트 전체 표면에 일정한 크기를 갖는 다공성 피막이 형성되었고, 특히 가장자리 부근에도 일정한 다공이 형성되었다.
- 2. 인산, 황산 및 초산칼슘과 칼슘글리세로포스페이트 혼합용액을 전해용액으로 사용하여 산화피막을 형성한 결과, 인산과 황산을 전해용액으로 사용했을 때는 인가 전압 180 V에서 0.5~0.8 μm의 미세 기공을 갖는 피막이 형성되었으며, 초산칼슘과 칼슘글리세로포스페이트 혼합용액을 사용했을 때는 인가 전압 280 V에서 0.8~1.0 μm의 다공성 피막이 형성되었다.
- 3. 동전위 분극시험과 AC 임피던스를 측정한 결과, 황산을 제외한 전해용액을 사용했을 때에 양극산화 처리 후에 내부식성이 향상되었으며, 특히 인산을 사용했을 때가 가장 우수한 내부식성을 나타내었다.
결론적으로 치과용 임플란트에 양극산화 처리했을 때 전해용액의 종류에 따라 내부식성이 달라지는 것을 알 수 있었으며, 인산을 사용하여 양극산화 처리했을 때에 가장 우수한 내부식성을 나타내었다.
Acknowledgments
이 논문은 2013년도 정부(미래창조과학부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(No.2008-0062283)
References
-
Cu, X., Kim, HM., Kawashita, M., Wang, L., Xiong, T., Kokubo, T., Nakamura, T., Preparation of bioactive titania films on titanium metal via anodic oxidation, Dent Mater, (2009), 25, p80-86.
[https://doi.org/10.1016/j.dental.2008.04.012]

-
Davies, JE., Lowenberg, B., Shinga, A., The bone-titanium interface in vitro, J Biomed Mat Res, (1990), 24, p1289-1306.
[https://doi.org/10.1002/jbm.820241003]

-
Gonzalez, JEG., Mirza-Rosca, JC., Study of the corrosion behavior of titanium and some of its alloys for biomedical and dental implant applications, J Electroanal Chem, (1999), 471, p109.
[https://doi.org/10.1016/S0022-0728(99)00260-0]

-
Krupa, D., Baszkiewicz, J., Kozibowski, JA., Barcz, A., Sobzak, JW., Biliniski, A., Lewandowska-Szumiel, MD., Rajchel, B., Effect of calcium-ion implantation on the corrosion resistance and biocompatibility of titanium, Biomaterials, (2001), 22, p2139-2151.
[https://doi.org/10.1016/S0142-9612(00)00405-1]

-
Liu, XY., Paul, KC., Ding, CX., Surface modification of titanium, titanium alloys and related materials for biomedical applications, Mater Sci Eng R, (2004), 47, p49-121.
[https://doi.org/10.1016/j.mser.2004.11.001]

-
Moran, CG., Horton, TC., Total knee replacement: the Joint of the decade, Brit Med J, (2000), 320, p820.
[https://doi.org/10.1136/bmj.320.7238.820]

-
Niiomi, M., Mechanical properties of biomedical titanium alloys, Mater Sci Eng A, (1998), 243, p231-236.
[https://doi.org/10.1016/S0921-5093(97)00806-X]

-
Pan, J., Thierry, D., Leygraf, C., Electrochemical impedance spectroschopy study of the passive oxide film on titanium for implant application, Electrochim Acta, (1996), 41, p1147.
[https://doi.org/10.1016/0013-4686(95)00465-3]

- Sherman, WD., Vanadium steel plates and screw, Surg Gynecol Obster, (1912), 14, p629-634.
-
Shukla, AK., Balasubramaniam, R., Bharagava, S., Effect of replacement of V by Fe and Nb on passive film behavior of Ti-6Al-4V in simulated body fluid conditions, J Alloy Compd, (2005), 400, p144-152.
[https://doi.org/10.1016/j.jallcom.2004.08.005]

- Sotuw, EJ., Pollack, SR., The biocompatibility of certain stainless steels. Biocompatibility of Clinical Impant Materials. I, CRC Press, (1981), p46.