인공 체액에서 탄탈럼과 티타늄의 부동태 특성 비교
Abstract
The passivation characteristics of tantalum and titanium were studied in various simulated body fluid conditions by means of several electrochemical techniques; open circuit potential vs. time measurement, potentiodynamic polarization, potentiostatic current vs. time measurement, and electrochemical impedance spectroscopy. The polarization resistance was calculated by fitting the impedance data to the equivalent circuit model. The strong passivation was observed for tantalum and titanium at open circuit potential and anodic oxidation potential. The passive currents less than a few tens of μA/cm2 were recorded over a wide range of anodic oxidation potential. The impedance data was fitted to the equivalent circuit model R(Q(RW)) and high polarization resistance values were obtained. Although the passivation rate of tantalum was initially lower than titanium, the passive layer became stable as it grew. The passivation rates of tantalum and titanium both increased in the fluid with pH adjusted to 4.5. The passivation rate of tantalum decreased in the fluid containing bovine serum albumin and the passive layer became unstable at anodic oxidation potential, while the passivation rate of titanium increased.
Keywords:
Albumin, Impedance, Passivation, Tantalum, TitaniumⅠ. INTRODUCTION
탄탈럼과 티타늄은 임플란트 재료로서 여러 면에서 유사성을 가진다. 즉 크롬 성분의 부동태 성질에 의존하여 부식 저항성을 나타내는 스테인리스강, 코발트-크롬, 니켈-크롬 등 다른 비귀금속계 합금 생체 재료들과 달리 주 금속의 강한 부동태 성질에 의해서 부식 저항성을 유지한다. 따라서 이들 두 금속은 합금이 아닌 단일 금속으로 그대로 사용되기도 한다. 두 금속은 부식 저항성 외에도 생체 적합성, MRI 안정성, 방사선 불투과성, 그리고 우수한 기계적 특성을 나타내며 이미 20세기 중반부터 중요한 생체 재료로서 다양한 임플란트 제품에 적용되어 왔다(Freese 등, 2001 ; Matsuno 등, 2001 ; Niinomi 등, 2012 ; William, 2001).
탄탈럼은 티타늄에 비해서 밀도와 탄성계수가 높다. 따라서 골 조직 대체용 임플란트의 경우에는 경량화와 동시에 탄성계수를 자연 골 조직과 유사하게 조절하고 내부로의 골 성장을 유도하기 위한 다공성 재료(Trabecular Metal, Zimmer, USA)가 개발되어 효과적으로 사용되기도 했다(Abdel과 Hanssen, 2012 ; Moor와 Austin, 2012). 이 재료는 전체를 탄탈럼으로 구성하기보다는 다공성 유리질 탄소 상에 화학 증착법으로 탄탈럼을 코팅하는 방식으로 제조되었다. 그 밖에도 코팅용 생체 재료로서 탄탈럼에 대한 연구가 다양하게 수행되어 왔다. 즉 일반적인 티타늄 합금 다공성 스캐폴드에 탄탈럼을 코팅하여 골 성장 특성을 개선하거나(Li 등, 2013) NiTi 합금 표면에 탄탈럼을 코팅하여 부식 저항성을 향상시키는 동시에 생체 적합성을 증가시키고(Li 등, 2008 ; Maho 등, 2013 ; Zhou 등, 2013) 코발트-크롬 합금으로 제작 조립된 인공 고관절 임플란트의 목 부위에 탄탈럼을 코팅하여 부식 저항성을 향상시키려는(Dorn 등, 2014) 등의 시도가 계속되어 왔다.
본 연구는 생체와 유사한 조건에서 탄탈럼과 티타늄의 부동태 특성을 조사함으로써 임플란트 식립 후 형성되는 산화 환경에서 두 재료의 부식 거동을 비교하는 것을 목적으로 하였다. 이를 위해서 다양한 인공 체액 조건에서 기본적인 전기화학적인 방법을 사용하여 실험을 수행하였다. 즉 용출 실험 또는 장기 노출 실험보다는 전기화학적 방법의 의해서 넓은 산화 범위에서의 부동태 특성을 정량화하고자 하였다. 인공 체액은 기본 조성 외에도 산을 첨가하여 약산성으로 조절하거나 또는 혈액이나 세포외 기질 등에 존재하는 단백질 중 대표적인 성분인 알부민을 첨가하여 그 영향을 조사하였다. 이는 각각 임플란트 식립 후 국부적으로 체액의 일시적 pH 변화 가능성, 그리고 기본적으로 체액을 구성하는 무기물 외에 단백질 성분 등이 미치는 영향을 고려하기 위한 것이다.
Ⅱ. MATERIALS AND METHODS
전극은 순수 탄탈럼(262854, Sigma-Aldrich, USA, 순도 99.9%)과 순수 티타늄(347132, Sigma-Aldrich, USA, 순도 99.99%)을 각각 한 면만 노출한 상태로 포매하여 제작하였고 실험 직전에 Grit 600 Emery Paper까지 습식으로 연마하고 세척하여 사용하였다. 용액은 인공 체액으로 Hank 용액(Hank’s balanced salt solution, HBSS, H8264, Sigma-Aldrich, USA)을 37℃에서 사용하였고 필요에 따라서는 염산 또는 수산화나트륨으로 pH를 조절하거나 알부민(bovine serum albumin, BSA, A4503, Sigma-Aldrich, USA)을 첨가하였다. pH는 실제 생체 조건에서 변화 가능한 중성 및 약산성 범위로 하였고 알부민은 2.0 g/l 이하의 농도로 첨가하여 그 영향을 조사하였다.
Potentiostat(273A 및 2263, EG & G PAR, USA)을 사용하여 시간에 따른 개방 회로 전위 변화 측정, 동전위 및 정전위 분극 실험, 전기화학적 임피던스 분석 등 다양한 전기화학적 실험을 복합적으로 실시하였다. 기준 전극으로는 포화 칼로멜 전극(SCE)(K0077, EG & G PAR, USA), 대응 전극으로는 고밀도의 흑연봉(G0091, EG & G PAR, USA)을 사용하였다. 동전위 분극 실험은 초당 5 mV의 스캔 속도로 전위를 상승시킨 후 다시 하강시키는 순환 분극을 실시하였고 정전위 분극 실험은 산화 전위를 일정하게 유지한 상태에서 시간에 따른 부동태 전류의 변화를 측정하였다. 전기화학적 임피던스 분석은 개방 회로 전위에서 AC 10 mV 폭으로 실시하였고 주파수 범위는 10-2에서 105Hz 사이로 하였다. 한편 시간에 따른 전극의 특성 변화를 파악하기 위해서 연마 직후의 전극 뿐 아니라 일정한 시간 동안 실험 용액 내에서 미리 안정화시켜 부동태를 진행시킨 후의 전극도 사용하였다.
Ⅲ. RESULTS
1. 시간에 따른 개방 회로 전위 변화 측정
표면 연마 직후에 시작한 개방 회로 전위 측정에서 탄탈럼과 티타늄 모두 Figure 1과 같이 지속적인 상승 경향을 보였다. 표면이 산화되면서 초기에는 급하게 그리고 시간이 지나면서 점차 완만하게 상승하였다. 동일한 용액 조건에서 두 금속의 결과를 비교하면 탄탈럼은 티타늄에 비해서 초기부터 완만한 상승 속도를 보였고 1시간이 지난 후에도 상대적으로 낮은 개방 회로 전위를 유지하였다.
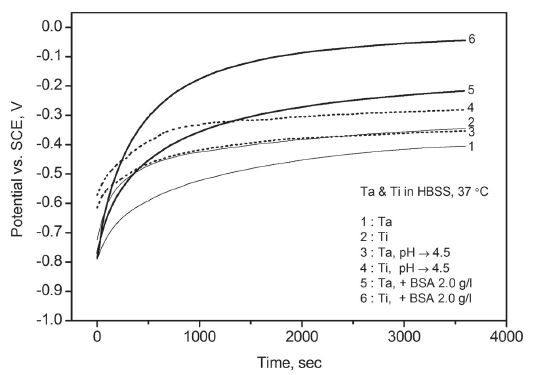
Variation of open circuit potential with time for Ta and Ti in Hank’s balanced salt solution - effect of pH and bovine serum albumin.
개방 회로 전위의 상승 경향은 단순 인공 체액 뿐 아니라 변형된 인공 체액에서도 유사하게 나타났다. 단 단순 인공 체액에 비해서 산을 첨가하여 약산성으로 조절한 인공 체액에서 개방 회로 전위가 상대적으로 높게 나타났다. 알부민을 첨가한 인공 체액에서는 개방 회로 전위가 초기부터 급격히 상승하여 약산성 인공 체액보다도 높게 유지되며 알부민의 흡착에 따른 표면 상태의 변화를 반영하였다. 산에 의한 개방 회로 전위의 증가는 기존 티타늄에 대한 연구(Lee와 Choi, 2004 ; Heo 등, 2010)에서도 보고된 바 있다.
2. 동전위 분극 실험
동전위 분극 실험 결과 Figure 2 및 3과 같이 탄탈럼과 티타늄 모두 정방향 스캔 초기부터 수십 ㎂/㎠ 이하의 약한 부동태 전류만을 기록하며 강한 부동태화 경향을 나타냈다. 또한 1.7 V에서 방향을 바꾼 역방향 스캔에서는 저 전류 방향으로 뚜렷한 이력 현상을 보이며 정방향 스캔에서 생성되었던 산화층의 성질을 반영하였다.
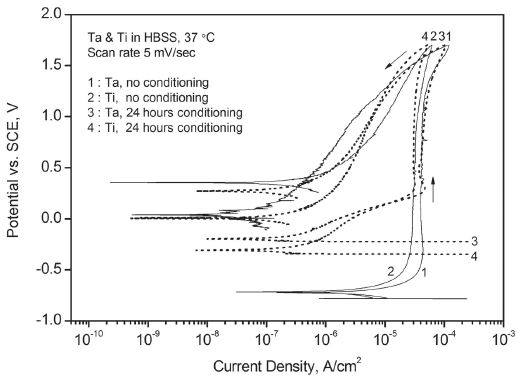
Potentiodynamic polarization curves for Ta and Ti in Hank’s balanced salt solution – effect of conditioning.
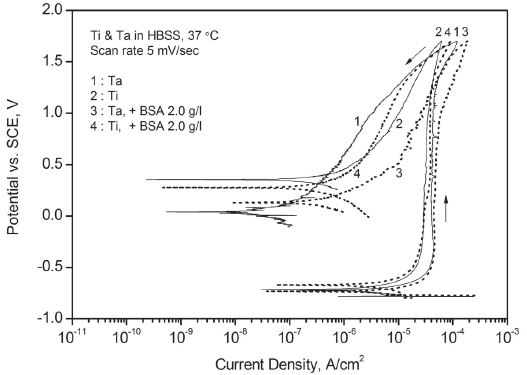
Potentiodynamic polarization curves for Ta and Ti in Hank’s balanced salt solution – effect of bovine serum albumin.
동일한 용액 조건에서 두 금속의 결과를 비교하면 탄탈럼은 티타늄에 비해서 높은 부동태 전류를 기록하였으며 정방향 스캔 후반부에 전류가 급하게 상승하는 경향을 보였다. 또한 티타늄과 달리 실험 전에 일정한 시간 동안 용액 속에 침지시켜 자연 산화시킨 경우에도 부동태 전류는 거의 감소하지 않았다. 다양한 인공 체액 조건에서 모두 유사한 결과가 얻어졌다. 단 알부민을 첨가한 용액에서 탄탈럼은 티타늄과 달리 정방향 스캔 후반부로 갈수록 부동태 전류가 급하고 불안정하게 상승하는 경향을 보였다. 또한 역방향 스캔에서는 이력 현상의 폭이 뚜렷이 축소되며 약화된 부동태의 특징을 나타냈다.
3. 정전위 분극 실험
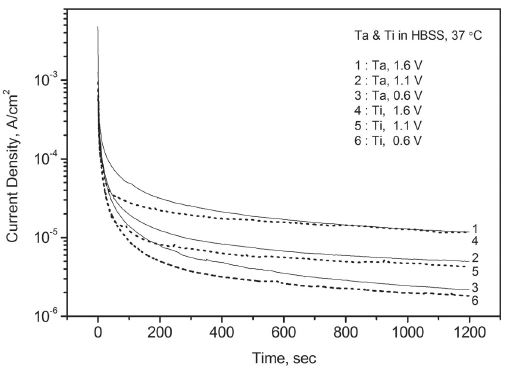
정전위 분극 실험은 동전위 분극 실험에서 확인되지 않는 시간에 따른 부동태의 변화를 분석하기 위해서 실시되었다. 실험 결과 Figure 4, 5, 6과 같이 탄탈럼과 티타늄 모두 일정한 산화 전위에서 전류가 지속적으로 하락하는 전형적인 부동태화 경향을 보였다. 초기에는 급하게 그리고 시간이 지나면서 다소 완만하게 하락했으며 가해진 산화 전위가 높을수록 상대적으로 높은 부동태 전류를 유지하였다.
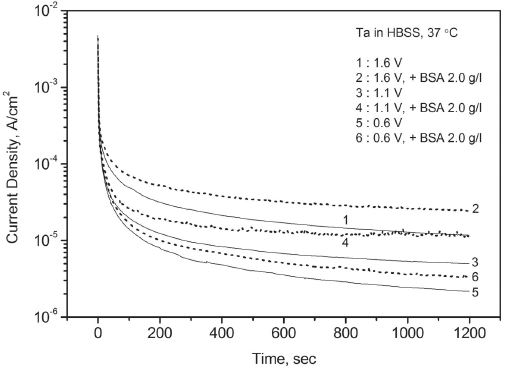
Variation of potentiostatic current with time for Ta in Hank’s balanced salt solution – effect of bovine serum albumin.
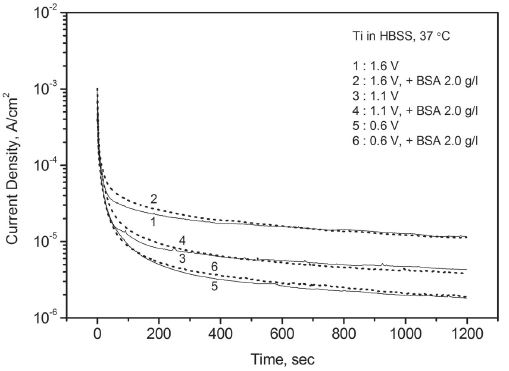
Variation of potentiostatic current with time for Ti in Hank’s balanced salt solution – effect of bovine serum albumin.
동일한 용액 조건에서 두 금속의 결과를 비교하면 탄탈럼은 티타늄에 비해서 초기에 느린 전류의 하락 속도를 보였으나 시간이 지나면서 티타늄과 유사한 부동태 전류에 도달하였다. 다양한 인공 체액 조건에서 대체로 유사한 결과가 얻어졌다. 그러나 알부민을 첨가한 인공 체액에서 탄탈럼은 전류의 하락 경향이 둔화되며 단순 인공 체액에서보다 높은 부동태 전류를 유지하였다. 반면에 티타늄은 전류의 꾸준한 하락으로 20분 만에 단순 인공 체액에서보다 낮은 부동태 전류에 도달하기도 하였다. Table 1에는 금속별로 알부민의 첨가 유무에 따른 20분 후의 부동태 전류값을 열거하였다.
4. 전기화학적 임피던스 분석
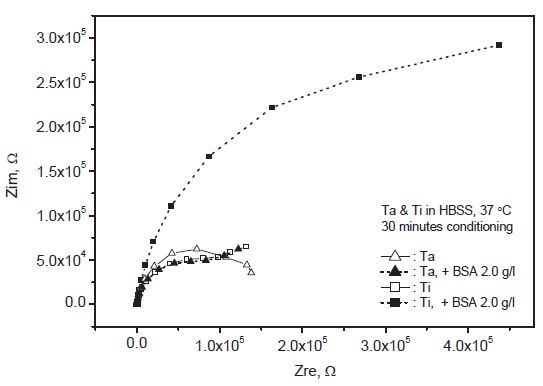
다양한 인공 체액 조건에서 실시한 전기화학적 임피던스 측정에서 탄탈럼과 티타늄 모두 Nyquist Plot과 Bode Plot 상에 전형적인 부동태 특성을 나타냈다. 분석에는 Randles 회로 모델의 일종으로 Warburg 요소가 포함된 R(Q(RW)) 모델이 적용되었다. 실험 조건에 따라서는 약간의 오차가 관찰되었으며 이는 시간이 지나도 개방 회로 전위가 안정화되지 않고 지속적으로 상승하는 등 두 금속의 산화층 상태가 가변적인 것도 한 원인으로 보인다. 따라서 측정 전에 실시하는 안정화 시간이 너무 짧은 경우에는 시간적으로 지연되는 후반부의 저주파 영역으로 갈수록 오차가 커질 수밖에 없었다. 또한 측정 전에 용액 내에서 24시간 이상 안정화시킨 경우에도 변형된 산화층 상태에 따라서 오차가 커지는 경향을 보였다. Table 2에는 세 가지 용액 조건에서 20분간 안정화시킨 후에 측정한 결과를 R(Q(RW)) 모델에 적용하여 산출한 주요 변수값을 열거하였다. Rs는 용액의 저항, Q는 이상적인 커패시터에 비해서 실제 이중층에 가까운 회로 모델 구성 요소인 CPE(consant phase element), Rp는 분극 저항, 그리고 W는 Warburg 요소를 나타낸다. Q와 W는 어드미턴스의 단위로 표시하였다.
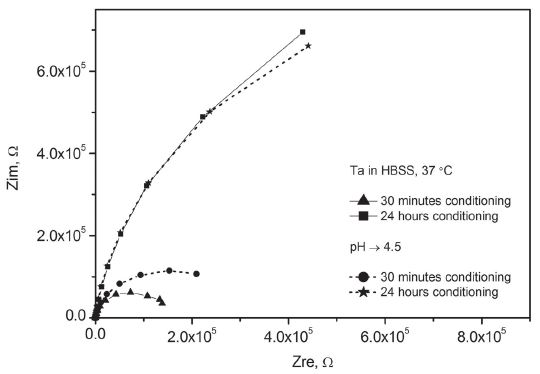
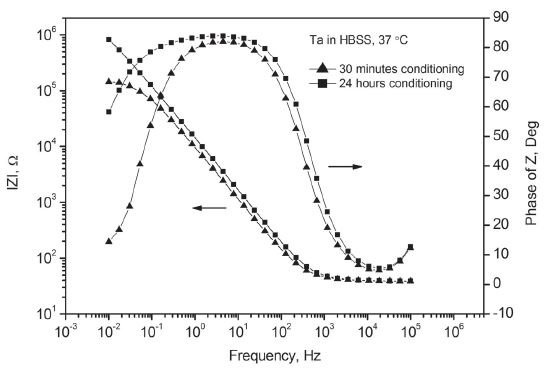
탄탈럼은 대부분의 용액 조건에서 Figure 7과 같이 Nyquist Plot 상에 반원에 가까운 곡선 형태를 나타냈다. 측정 전에 용액 내에서 24시간 동안 안정화시켜 미리 산화를 유도한 경우에는 예상대로 그 반경, 즉 분극 저항이 크게 증가하는 경향을 보였으나 측정 주파수 범위를 벗어나는 전체적인 형태를 예측하기는 어려웠다. Figure 8의 Bode Plot 상에서도 24시간 동안 안정화 이후 분극 저항의 증가, 곡선 형태의 변화 등 Nyquist Plot과 일치하는 경향이 확인되었다.
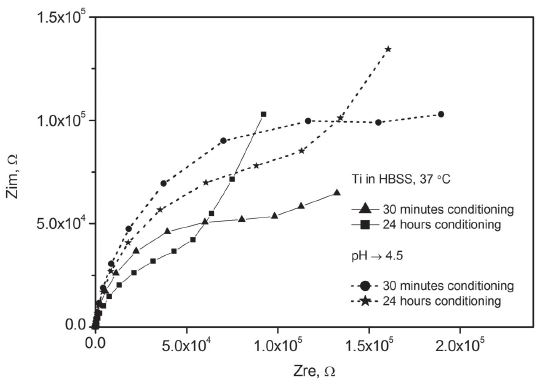
한편 티타늄은 Figure 9와 같이 Nyquist Plot 상에 단순한 반원보다는 후반부의 저주파 영역에서 Warburg 요소의 영향으로 곡선 형태가 바뀌어 상승하는 모습을 보였다. 이는 전하 전달 외에 확산 같은 물질 전달에 의해서 복합적인 지배를 받는 경우에 나타나는 특징이다. 측정 전에 용액 내에서 24시간 동안 안정화시킨 경우에는 산화층이 성장하여 일찍 이 같은 특징을 나타내기 시작했다.
Figure 7 및 9와 같이 산을 첨가하여 약산성으로 조절한 인공 체액에서는 탄탈럼과 티타늄 모두 단순 인공 체액에 비해서 높은 분극 저항이 얻어졌다. 그러나 Figure 10과 같이 알부민을 첨가한 인공 체액에서는 두 금속 간에 뚜렷한 차이를 보였다. 즉 탄탈럼은 단순 인공 체액에서와 달리 Warburg 요소의 영향이 커지면서 물질 전달에 의한 복합적 지배 특성을 나타내기 시작한 반면에 티타늄은 단순 인공 체액에서보다 훨씬 증가한 분극 저항을 기록하였다.
Ⅳ. DISCUSSION
다양한 전기화학적 실험 결과 탄탈럼과 티타늄 모두 전형적인 부동태화 특성을 나타냈다. 즉 시간에 따른 개방 회로 전위 변화 측정에서 전위가 지속적으로 상승하며 안정적인 산화 경향을 보였다. 동전위 분극 실험에서는 정방향 스캔에서 넓은 산화 전위 범위에 걸쳐서 극히 낮은 부동태 전류를 유지하였고 방향을 바꾼 역방향 스캔에서는 저전류 방향으로 특유의 이력 현상을 나타내며 정방향 스캔에서 생성되었던 안정된 부동태 층의 존재를 확인시켰다. 정전위 분극 실험에서는 부동태 전류가 시간에 따라서 급격히 감소하며 부동태 층의 신속한 성장 경향을 반영하였다. 전기화학적 임피던스 분석에서는 분극 저항이 증가하고 물질 전달에 의한 복합적 지배가 강화되는 등 부동태 층의 안정화에 따른 특징을 나타냈다.
1. 탄탈럼과 티타늄의 비교
탄탈럼과 티타늄 모두 강한 부동태화 특성을 보였지만 구체적인 경향에는 다소 차이가 있었다. Figure 1과 같이 동일한 용액 조건에서 탄탈럼이 티타늄에 비해서 낮은 개방 회로 전위 상승 속도를 보인 것은 상대적으로 느린 산화 속도 때문으로 해석된다. 이는 Figure 2의 동전위 분극 실험에서 탄탈럼이 티타늄에 비해서 높은 부동태 전위를 기록한 결과와도 일치하는데 실험 전에 개방 회로 상태에서 24시간 이상을 안정화시키며 산화를 유도한 경우, 그리고 용액에 산이나 알부민을 첨가한 경우에도 두 금속 간의 차이는 그대로 유지되었다. 즉 탄탈럼은 상대적으로 느린 부동태층의 생성 속도 때문에 초기부터 다소 약한 부동태 특성을 나타냈다. 그러나 Figure 4에서와 같이 정전위 분극 실험에서 탄탈럼을 강제로 산화시킨 경우에 시간이 지나면서 티타늄과 유사한 부동태 전류에 도달한 점을 감안할 때 개방 회로 상태보다 강한 산화 조건에서 탄탈럼의 부동태 층이 충분히 성장하게 되면 느린 부동태화의 단점이 어느 정도 보완될 수 있을 것으로 판단된다. Figure 7 및 9의 전기화학적 임피던스 분석에서 탄탈럼이 티타늄과 달리 물질 전달에 의한 복합적 지배 특징을 강하게 나타내지 않은 것 역시 상대적으로 느린 산화 속도 및 그에 따른 산화층의 구조적 차이에서 기인한 것으로 보인다.
2. 인공 체액 조성의 영향
본 연구에서는 단순 인공 체액, 즉 제품 상태 그대로의 Hank 용액 외에도 산을 첨가하여 약산성으로 조절하거나 알부민 등을 첨가한 용액을 사용하였다. Figure 1과 같이 단순 인공 체액에 비해서 약산성 인공 체액에서 탄탈럼과 티타늄 모두의 개방 회로 전위가 높게 나타난 것은 표면에서의 산화 경향이 높기 때문으로 보인다. 이는 Figure 7 및 9의 전기화학적 임피던스 분석에서 약산성 인공 체액에서 두 금속의 분극 저항이 높게 나타난 결과와도 일치하며 약산성 조건에서 두 금속의 부동태가 강화될 수 있음을 의미한다. 단 동전위 분극 실험과 정전위 분극 실험에서와 같이 강제로 산화를 진행시킨 경우에는 산 첨가 여부에 따라서 부동태 전류의 차이가 거의 없었는데 이는 강제적인 산화에 의해서 부동태 전류가 이미 최저값 부근에 도달했기 때문으로 보인다.
한편 알부민을 첨가한 인공 체액에서는 탄탈럼과 티타늄의 개방 회로 전위가 가장 높게 나타났다. 금속과 알부민의 구체적인 반응은 전기화학적 실험 결과만으로는 설명할 수 없으나 표면에 흡착되어 산화 반응에 영향을 미치는 것으로 보인다. 탄탈럼의 경우에 Figure 3의 동전위 분극 실험에서 나타난 정방향 스캔에서의 불안정한 부동태 전류 증가와 역방향 스캔에서의 이력 현상 축소, Figure 5의 정전위 분극 실험에서 기록된 상대적으로 높은 부동태 전류, 그리고 Figure 10의 Nyquist Plot에서의 분극 저항 감소 등을 고려할 때 알부민의 존재가 부동태의 안정성에 도움을 주지 않는 것으로 판단된다. 반면에 티타늄의 경우에는 여러 실험 결과를 고려할 때 알부민의 첨가가 부동태의 강화에 크게 기여하는 것으로 보인다. 티타늄에 대한 이 같은 알부민의 영향은 기존의 다른 연구(Ide 등, 2003 ; Takemoto 등, 2005)에서도 보고된 바 있다.
Ⅴ. CONCLUSION
탄탈럼과 티타늄에 대해서 인공 체액 조건에서 시간에 따른 개방 회로 전위 변화 측정, 동전위 및 정전위 분극 실험, 전기화학적 임피던스 분석 등의 전기화학적 실험을 실시한 결과 다음과 같은 결론을 도출하였다.
- 1. 탄탈럼과 티타늄 모두 인공 체액에서 부동태 층이 빠르게 성장하며 부동태화가 진행된다. 탄탈럼은 티타늄에 비해서 부동태화의 진행 속도가 느리며 이는 부동태 층의 구조 및 반응 특성에 영향을 미친다. 단 탄탈럼의 부동태 층이 산화 환경에서 충분히 성장하는 경우에는 티타늄과 유사한 정도의 부동태에 도달할 수 있을 것으로 판단된다.
- 2. 탄탈럼과 티타늄은 다양한 인공 체액 조건에서 안정된 부동태를 유지한다. 산을 첨가하여 약산성으로 조절한 인공 체액에서는 두 금속 모두 부동태가 강화되는 경향을 나타낸다. 그러나 알부민을 포함한 인공 체액에서는 흡착된 알부민 성분이 두 금속에 상이한 영향을 미친다. 즉 탄탈럼의 경우에 알부민은 부동태의 안정성에 부정적인 영향을 미치는 반면에 티타늄의 경우에는 알부민이 부동태를 크게 강화시키는 역할을 한다.
References
-
Abdel, M., Hanssen, A., (2012), MD reconstruction of complex distal femur and proximal tibia defects using tantalum cones, Oper Tech Orthop, 22, p222-227.
[https://doi.org/10.1053/j.oto.2012.10.001]

-
Dorn, U., Neumann, D., Frank, M., (2014), Corrosion behavior of tantalum-coated cobalt-chromium modular necks to titanium modular necks in a simulator test, J Arthroplasty, 29, p831-835.
[https://doi.org/10.1016/j.arth.2013.08.022]

- Freese, H., Volas, M., Wood, J., (2001), Metallurgy and technological properties of titanium and titanium alloys, Brunette, DM., Tengvall, P., Textor, M., Thomsen, P. (Ed), Titanium in medicine, Springer, p25-51.
- Heo, KB., Choi, KY., Lee, JB., (2010), Electrochemical study of oxide layers on titanium alloy for dental implants, J Korean Res Soc Dent Mater, 37, p355-366.
-
Ide, K., Hattori, M., Yoshinari, M., Kawada, E., Oda, Y., (2003), The influence of albumin on corrosion resistance of titanium in fluoride solution, Dent Mater J, 22, p359-370.
[https://doi.org/10.4012/dmj.22.359]

- Lee, JB., Choi, KY., (2004), Corrosion behavior of titanium for implant in simulated body fluids, J Kor Inst Surf Eng, 37, p110-118.
-
Li, Y., Wei, S., Cheng, X., Zhang, T., Cheng, G., (2008), Corrosion behavior and surface characterization of tantalum implanted TiNi alloy, Surf Coat Tech, 202, p3017-3022.
[https://doi.org/10.1016/j.surfcoat.2007.11.003]

-
Li, X., Wang, L., Yu, X., Feng, Y., Wang, C., Yang, K., Su, D., (2013), Tantalum coating on porous Ti6Al4V scaffold using chemical vapor deposition and preliminary biological evaluation, Mat Sci Eng C, 33, p2987-2994.
[https://doi.org/10.1016/j.msec.2013.03.027]

-
Maho, A., Delhalle, J., Mekhalif, Z., (2013), Study of the formation process and the characteristics of tantalum layers electrodeposited on Nitinol plates in the 1-butyl-1-methylpyrrolidinium bis(trifluoromethylsulfonyl) imide ionic liquid, Electrochim Acta, 89, p346-358.
[https://doi.org/10.1016/j.electacta.2012.11.026]

-
Matsuno, H., Yokoyama, A., Watari, F., Uo, M., Kawasaki, T., (2001), Biocompatibility and steogenesis of refractory metal implants, titanium, hafnium, niobium, tantalum and rhenium, Biomaterials, 22, p1253-1262.
[https://doi.org/10.1016/S0142-9612(00)00275-1]

-
Moore, R., Austin, M., (2012), Use of porous tantalum cones in revision total knee arthroplasty, Oper Tech Orthop, 22, p209-221.
[https://doi.org/10.1053/j.oto.2012.12.002]

-
Niinomi, M., Nakai, M., Hieda, J., (2012), Development of new metallic alloys for biomedical applications, Acta Biomater, 8, p3888-3903.
[https://doi.org/10.1016/j.actbio.2012.06.037]

-
Takemoto, S., Hattori, M., Yoshinari, M., Kawada, E., Oda, Y., (2005), Corrosion behavior and surface characterization of titanium in solution containing fluoride and albumin, Biomaterials, 26, p829-837.
[https://doi.org/10.1016/j.biomaterials.2004.03.025]

- Williams, D., (2001), Titanium for medical applications, Brunette, DM., Tengvall, P., Textor, M., Thomsen, P. (Ed), Titanium in medicine, Springer, p13-24.
-
Zhou, Y., Li, M., Cheng, Y., Zheng, YF., Xi, TF., Wei, SC., (2013), Tantalum coated NiTi alloy by PIID for biomedical application, Surf Coat Tech, 228, pS2-S6.
[https://doi.org/10.1016/j.surfcoat.2012.11.002]