Dicalcium phosphate dihydrate가 포함된 mineral trioxide aggregates의 세포독성 및 조직염증반응
 ; Hee Chul Park
; Hee Chul Park ; Gitae Son
; Gitae Son ; Yongjoon Kim
; Yongjoon Kim ; Lele Wu
; Lele Wu ; Sang Hoon Choi
; Sang Hoon Choi ; Hyeong-Cheol Yang*
; Hyeong-Cheol Yang*
초록
본 연구에서는 Mineral Trioxide Aggregate(MTA)의 생체적합성에 대한 dicalcium phosphate dihydrate (DCPD)의 영향을 평가하고자 하였다. MTA 경화 시 발생하는 pH 상승을 억제하고자 DCPD를 OrthoMTA에 첨가하여 세포독성과 피하염증반응의 변화를 관찰하였다. 인산완충생리식염수에 침지한 OrthoMTA와 DCPD-OrthoMTA의 pH를 측정한 결과, OrthoMTA와 DCPD-OrthoMTA는 측정 1일째에 각각 12.5와 12.0의 pH를 보였다. 마지막 측정시점인 19일에 OrthoMTA는 평균 11.6을 보인 반면, DCPD-OrthoMTA는 8.8을 나타내었다. NIH 3T3 섬유아세포에 대한 세포독성은 높은 농도의 용출액(50% 이상)에서 DCPD가 OrthoMTA의 세포독성을 억제하는 효과를 보였다(p<0.05). 마우스 피하이식시험에서는 ProRoot MTA, OrthoMTA, DCPD-OrthoMTA 간의 염증반응의 차이는 발생하지 않았다. 따라서 DCPD의 MTA 세포독성을 낮추는 효과와 본 실험 조건에서의 피하염증발생에 대한 영향은 서로 유의한 상관관계를 보이지 않는 것으로 사료된다.
Abstract
The purpose of this study was to evaluate the effect of dicalcium phosphate dihydrate (DCPD) on the biocompatibility of mineral trioxide aggregate (MTA). DCPD was added to MTA (OrthoMTA) to suppress the increase in pH of MTA during hardening, and the change of pH, cytotoxicity, and subcutaneous inflammation reactions in mouse model were observed. The pH of OrthoMTA and DCPD-OrthoMTA at 1st day in phosphate-buffered saline was 12.5 and 12.8, respectively. At 19th day, the pH was 11.6 (OrthoMTA) and 8.8 (DCPD-OrthoMTA). Cytotoxicity of DCPD-OrthoMTA extract was lesser than that of OrthoMTA at high concentration (above 50%) (p<0.05). No significant differences appeared in subcutaneous inflammatory reactions among ProRoot MTA, OrthoMTA and DCPD-OrthoMTA. Therefore, it is likely that there is no apparent relationship between the cytotoxicity and subcutaneous inflammation in our experimental conditions.
Keywords:
Mineral trioxide aggregates, Dicalcium phosphate dihydrate, Cytotoxicity, Subcutaneous inflammation키워드:
세포독성, 피하염증서 론
Mineral Trioxide Aggregate (MTA)는 1993년에 Tora-binejad 등에 의해 치근 천공 치료 재료로서 처음 소개되었고(1), 1998년에는 미국 FDA로부터 치과 임상 적용이 승인된 바 있다. 이후 MTA의 우수한 물리적 성질과 생체적합성에 대한 다수의 연구 결과 보고와 함께 다양한 MTA 기반 제품이 각국에서 출시되고 있다. MTA의 초기 연구에서는 아말감 보다 유의하게 효과적으로, 그리고 강화형 산화아연 유지놀 시멘트(Super-EBA)와 유사한 정도로, MTA가 치근단 미세누출을 억제하였음이 보고되었다(2). 즉, 치근단 치주조직의 재생에 필수적인 우수한 치근단 밀폐효과를 보여주었다. 이후에도 다양한 조건에서 MTA의 밀폐 우수성을 확인한 연구 결과들이 최근까지 보고되었다(3-7). MTA는 치근단 폐쇄뿐 아니라, 치수 복조술에도 유용한 재료임이 증명되었으며, 현재 임상에서 치수 복조재로서도 빈번히 사용되고 있다. Ford 등은 MTA가 적용된 원숭이 치수에서 염증 발현 없이 상아질교(dentin bridge)가 형성됨을 보여주었고(8), 사람치아에서도 치수복조재로서 사용된 MTA는 calcium hydroxide(Ca(OH)2)계 치수복조재보다 적은 염증과 두꺼운 상아질교 형성을 유도하는 것으로 보고된 바 있다(9). MTA의 상아질교 형성 유도 기전은 아직 완전히 밝혀져 있지는 않으나, 적은 세포독성과 염증반응이 상아질교 형성에 기여하는 것으로 여겨지고 있다.
MTA의 세포독성과 염증반응은 이전의 많은 연구자들에 의해 관찰되어 왔다. 대부분의 경우, 경화된 MTA를 세포배양배지로 용출하여, 용출액의 세포독성을 측정하였으나(10-12), 트랜스웰(transwell)을 사용하여 보다 직접적으로 세포에 대한 영향을 관찰하거나(13), MTA powder를 배지에 넣고 세포독성을 평가하기도 하였다(14). 일부 연구자들의 보고를 제외하고는, 선행연구들의 결과에서 MTA가 대체적으로 낮은 세포독성을 보인다고 하였으며, 다른 근관충전재와의 비교에서도 MTA의 세포독성이 상대적으로 낮다고 보고하였으며, 이를 근거로 MTA의 우수한 생체적합성을 강조하였다. 그러나, Ko 등의 연구에서 충분히 경화되지 않은 MTA에서 세포독성이 관찰되었으며, 경화시간이 증가할수록 세포독성은 감소하는 것으로 보고되었다(15, 16). 임상에서 MTA의 경화는 구강내에서 이루어지므로, MTA는 경화되기 전까지 세포독성이 주변조직에 영향을 줄 가능성을 배제할 수 없다. 비록, MTA가 현재 성공적으로 임상에 사용되고 있으나, 경화 전에 발생하는 세포독성이 MTA의 생체적합성에 어떠한 영향을 주는지 아직 충분히 연구된 바 없다. 또한 MTA 세포독성의 원인에 대해서도 아직 완전히 밝혀지지 않았으나, 경화 초기에 pH의 급격한 상승이 세포활성 저해의 원인이 될 수 있다. 물과 혼합된 MTA는 경화 시, calcium hydroxide가 부산물로 생성되고, 칼슘 calcium hydroxide는 칼슘 이온과 수산화 이온(hydroxyl ion)으로 이온화되면서, 주변의 pH를 상승시킨다. pH 9 이상의 알칼리 환경은 28일 이상 지속되는 것으로 보고되었다(17). 세균의 막 단백질은 pH 9 이상에서 불활성화 될 수 있고(18), 수산화 이온은 세포막의 지질과산화 및 DNA 손상을 유도할 수 있다(19). 따라서, MTA의 높은 pH가 항균활성에 중요한 역할을 하는 것으로 인식되고 있다. 그러나, 위에서 기술한 수산화 이온에 의한 항균활성 기전은 세균 특이적이라 할 수 없으며, 동물세포에도 동일한 기전으로 영향을 줄 수 있으며, 결과적으로 세포독성을 초래할 수 있다. 따라서 MTA에 의한 pH 상승과 세포독성과의 관계 및 조직에 대한 영향이 연구되어야 할 필요성이 있다.
Dicalcium phosphate dehydrate (DCPD)는 tricalcium phosphate와 함께 calcium phosphate계 bone cement의 주요 구성 성분이다. 이전의 연구에서 Vitti 등이 MTA에 DCPD를 첨가한 결과, DCPD는 MTA의 칼슘 이온 방출과 pH 상승을 억제하였다(20). 동 반응에서의 pH 상승 억제는 DCPD가 MTA 경화 중 발생한 Ca(OH)2와 반응하여 수산화 이온의 배출을 억제하였을 것으로 추측된다(21). MTA 경화 시, pH의 상승이 세포독성을 야기할 가능성이 있으므로, DCPD의 첨가로 인한 pH 상승 억제는 MTA 세포독성을 줄일 수 있을 것으로 기대된다. 이에 본 연구에서는 MTA의 생체적합성 향상을 목적으로, MTA의 세포독성과 염증반응에 대한 DCPD의 영향을 조사하였다.
재료 및 방법
1. MTA 디스크 제조 및 용출
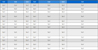
본 연구에 사용된 MTA 재료는 OrthoMTA (BioMTA, Seoul, Korea)를 사용하였으며, DCPD가 첨가된 Ortho MTA (DCPD-OrthoMTA)(제품명: OrthoMTAIII-1)는 BioMTA사로부터 제공받았다. 각 MTA의 조성은 Table 1에 보이는 바와 같다. MTA 분말은 사용 전 ethylene oxide 가스로 멸균하였다. MTA 분말과 멸균증류수를 2:1(무게/부피)의 비율로 혼합하고, 테프론 몰드를 이용하여 디스크 형태로(직경 5 mm, 두께 1 mm) 형성 후, 다습한 조건에서 경화시켰다. 세포독성 측정을 위해 MTA 디스크를 6시간 동안 경화시키고, ISO 10993-12에 준하여(22) 용출액을 조제하였다. 용출은 MTA 디스크 1 g 당 5 mL 세포배양배지에서 3일 동안 상온 조건[(25±1) ℃]으로 시행하였다. 용출 완료 후, 농도 별 세포 독성 측정을 위해 용출액을 배지로 2배 연속 희석하여 100, 50, 25, 12.5, 6.25%의 용출 희석액을 조제하였다.
2. MTA 용출액 pH 측정
MTA 용출액의 pH 변화를 측정하기 위해, 6시간 동안 경화시킨 MTA 디스크를 Dulbecco’s Phosphate-Buffered Saline (DPBS, Gibco BRL, Grand Island, NY, USA) (pH 7.2-7.4)에 0.2 g/2.25 mL이 비율로 넣고, pH meter (730P, Istek, Seoul, Korea)로 19일간 pH의 변화를 측정하였다. pH meter의 calibration은 시료 측정 전에 매번 시행하였다. 처음 3일 동안은 24시간 마다 측정하였으며, 이후에는 2일 간격으로 측정하였다. DPBS는 pH 측정 후 매회 새로운 DPBS로 교체하였다.
3. 세포독성 측정
MTA의 세포독성 측정은 ISO 10993-5에 준하여 실시하였다(23). 간략히 설명하면, NIH 3T3 섬유아세포(ATCC, Rockville, MD, USA)를 이용하였으며, 세포는 10% 우태혈청(fetal bovine serum; FBS) (Gibco BRL)과 항생제(penicillin-streptomycin) (Sigma Aldrich, St. Louis, MO, USA)를 포함한 Dolbecco’s Modified Eagle’s Media (DMEM) 배지(Gibco BRL)에서 배양하였다. 1×104개의 세포를 96-well plate의 각 well에 접종하고 24시간 배양 후, 배지를 MTA 용출 희석액으로 교환하고, 추가로 24시간 배양하였다. 용출액으로 24시간 동안 처리된 세포는 WST법으로(EZ-Cytox Cell Viability Assay Kit, DoGenBio, Suwon, Korea) 세포활성을 측정하여, MTA 용출물의 세포독성을 평가하였다. 세포활성 측정을 위해 EZ-Cytox 용액을 세포가 있는 각 well에 10 µL 첨가하고 37 ℃에서 1시간 반응시킨 후, 450 nm에서 plate reader (Sunrize, TECAN, Salzburg, Austria)를 사용하여 흡광도를 측정하였다. 음성대조군으로는 배지만으로 처리한 세포를 이용하였다.
4. 피하이식시험
MTA에 의한 염증발현 정도를 평가하기 위하여 ISO 10993-6에 준하여 마우스를 이용한 피하이식시험을 수행하였다(24). OrthoMTA, DCPD-OrthoMTA, ProRoot MTA (Dentsply, Tulsa, OK, USA)를 제조사의 지침에 따라 적당량의 멸균수와 혼합하여 Polytetrafluoroethylene (PTFE) tube(직경 2 mm, 길이 5 mm)에 넣고, 케타민으로 마취한 마우스의 등 부위 피하조직에 이식하였다. 대조군으로는 내부가 막혀 있는 PTFE rod를 사용하였으며, 사용된 동물의 수는 각 군당 6마리이다. 동물실험은 서울대학교 동물실험윤리위원회의 승인하에 실시하였다(SNU-160718-8-3).
이식 2주 후, 마우스를 안락사 시키고, PTFE tube와 주변조직을 제거하여 상온에서 4% 파라포름알데하이드(paraformaldehyde)로 15분간 고정하였다. 고정한 시편을 파라핀으로 포매하고, 조직 절편을 제작 후, 헤마톡실린과 에오신(hematoxylin & eosin)으로 염색하였다. 광학현미경(DM 5000B, Leica, Berlin, Germany)으로 염색된 시편을 관찰하여 조직학적 평가를 수행하였다. 염증발현 정도는 일정 면적 당 다핵형 세포, 림프구, 형질세포 등의 세포를 계수하고, 신생혈관 형성, 섬유화, 지방 침윤의 정도를 정량하여 평가하였다(Table 2).
5. 통계분석
pH와 세포독성 측정결과에서 OrthoMTA와 DCPD-OrthoMTA간의 비교에 대한 통계분석은 t-test로 수행하였으며, p-value가 0.05 미만인 경우에 유의성이 있는 것으로 판단하였다.
결 과
1. MTA 용출액의 pH 변화
OrthoMTA와 DCPD-OrthoMTA 용출액의 pH를 용출 1일부터 19일까지 측정하였다. 용출 1일차에는 OrthoMTA와 DCPD-OrthoMTA의 평균 pH가 각각 12.5±0.1와 12.0±0.1 이었으며 통계적으로 유의한 차이를 보였다(p<0.05) (Figure 1). 용출 시간이 길어질수록 두 그룹의 pH 차이가 커졌으며, 용출 19일차에는 OrthoMTA와 DCPD-Ortho MTA의 pH가 각각 11.6±0.4과 8.8±0.6로서 2.8의 차이를 나타냈다. 즉, DCPD-OrthoMTA의 pH가 더 빨리 저하되었다.
2. 세포독성
OrthoMTA와 DCPD-OrthoMTA의 세포독성 평가를 위해 MTA 용출액을 다양한 농도로 희석하여 섬유아세포를 처리한 후 세포활성을 측정하였다. OrthoMTA는 희석하지 않은 용출액(100%)과 2배 희석액(50%)이 강한 세포독성을 보였으며, 두 농도 모두에서 95% 이상의 세포활성 손실이 초래되었다. 25% 이하의 낮은 농도에서는 세포활성의 손실이 5%이하로서 세포독성이 거의 나타나지 않았다(Figure 2). DCPD-OrthoMTA의 경우 희석하지 않은 100% 용출액으로 처리한 세포는 음성대조군과 비교하여 약 23.5%의 세포활성을 보였으며, 50% 용출액은 80.1%의 세포활성을 유도하였다. 25% 이하의 낮은 농도에서는 세포독성이 나타내지 않았다. 따라서, DCPD-OrthoMTA 용출액은 100%와 50% 농도에서 OrthoMTA 용출액 보다 낮은 세포독성을 유도한 것으로 나타났다.

Cytotoxicity of MTA. NIH 3T3 cells were exposed to serially diluted MTA eluates for 24 h, and cell viability was measured. Cell viability was expressed as % of untreated negative control cell viability. Each value is an average of three independent experiments.* indicate a statistically significant differences at P<0.05.
3. 피하조직 반응
염증반응평가의 음성대조물질로 사용된 PTFE를 이식한 군에서는 림프구, 대식세포 등의 염증세포가 거의 나타나지 않았으나, 시료 주변으로 약간의 섬유화가 발생하였다. ProRoot MTA는 macrophage와 giant cell의 증가가 보였으며, 신생혈관 생성이 약하게 나타났다. 염증반응 판독기준에 따른 평가 결과, ProRoot MTA는 약한 정도의 염증(slight irritant)을 나타내었으며, 이는 이전의 연구에서와 유사한 결과로 판단된다(25). OrthoMTA는 ProRoot MTA와 유사한 정도의 염증반응을 보였다. 즉, macrophage와 giant cell의 발생과 신생혈관의 생성이 보였으며, 정량 결과 ‘slight irritant’한 염증을 보였다. 마지막으로 DCPD-OrthoMTA 이식군에서는 대식세포와 함께, 신생혈관 및 섬유화가 약하게 나타났다. 염증의 정도는 ProRoot MTA 및 OrthoMTA와 유사한 정도로 ‘slight irritant’를 보였다. Figure 3는 MTA 주변 조직의 헤마톡실린/에오신 염색 사진이며, Table 3은 Table 2의 염증반응 판독기준에 따른 판독결과이다.

Representative images of H&E stained tissue sections. Ma, macrophage; MGC, multinucleated giant cell; BV, blood vessel.
고 찰
MTA는 항균성 및 밀폐성과 같은 근관충전용 재료로서의 장점으로 인해 임상적용이 확대될 것으로 기대되고 있다. 최근에는 임상적용을 더욱 용이하게 하기 위해 경화시간이 단축된 MTA 혹은 실러 형태의 MTA 제품들이 출시되고 있다. 실러 형태의 MTA는 기존의 MTA 파우더와는 달리 근관에 직접 적용이 가능하여, 적용 시간이 단축되고 편리성이 증대되었을 뿐 아니라, 사용자 간에 발생하는 물과의 혼합 비율의 차이가 없어졌다. 이와 같이 MTA 성분 변화를 통해 기존 MTA의 단점을 보완하여 임상 적용성을 확대할 수 있을 것으로 기대된다.
MTA의 생물학적 성질 중 경화와 함께 발생하는 높은 pH는 항균작용을 하는 것으로 알려져 있으며, 포유동물세포의 활성도 억제할 가능성이 높다. MTA 용출물이 높은 pH를 보이며, 세포성장을 저해하는 하는 것을 in vitro 실험을 통하여 쉽게 관찰된다(16). 본 연구에서도 OrthoMTA는 초기 pH가 12.5를 보였으며, 희석하지 않은 용출물은 강한 세포독성을 보였다(Fig. 1 and Fig. 2). 이 두 실험은 높은 pH가 세포독성의 원인이 될 수 있음을 시사한다. DCPD-OrthoMTA 또한 MTA의 pH와 세포독성의 상관성을 간접적으로 보여준다. 즉, DCPD-OrthoMTA 용출물의 pH는 OrthoMTA 보다 낮으며, 세포독성 또한 일부 희석구간에서 적게 나타났다. 상기 두 연구의 결과로 pH와 세포독성의 상관성이 입증되었다고 할 수는 없으나, DCPD가 세포독성의 측면에서 OrthoMTA의 세포활성 저해 작용을 일부 감소시킨 것은 명백하다.
세포독성이 강한 생체재료는 생체내에서 세포의 사멸은 물론 조직의 괴사까지도 유발할 수 있다. 약한 세포독성일 경우에도, 적용되는 부위에 따라 조직이나 기관의 기능에 중대한 영향을 초래할 수 있다. 희석하지 않은 OrthoMTA의 용출액에 노출되는 세포는 대부분 세포 활성을 잃으므로 세포독성이 강한 것으로 분류될 수 있다. 그럼에도 불구하고 치과에서 꾸준히 사용되고 있으며, 임상적으로 세포독성으로 인한 문제점은 보고된 바 없다. 그러나 이는 세포독성이 생체에 미치는 영향이 전혀 없음을 시사하는 것은 아니며, 또한 세포독성을 줄임으로써 얻을 수 있는 이점이 없음을 제시하는 것도 아니다. 본 연구에서는 세포독성이 경감된 MTA에 대한 피하 조직 염증 반응을 관찰함으로써, MTA의 세포독성과 염증반응 간의 관계를 보고자 하였다. 그 결과 세포독성이 줄어든 DCPD-OrthoMTA의 염증지수는 OrthoMTA보다 적지 않았으며, 이는 세포독성과 염증반응 간의 연관성이 본 연구조건에서는 없음을 보여준 것이라 할 수 있다. 그 이유로서 DCPD-OrthoMTA의 세포독성이 염증반응을 일으킬 정도가 아니기 때문이거나, DCPD-OrthoMTA와 OrthoMTA 간 세포독성의 차이가 염증반응의 차이를 야기할 정도로 크지 않기 때문일 수 있다. 혹은 피하조직에 대한 염증반응이 세포독성 유래의 조직독성을 판단하기에 적절한 평가방법이 아닐 수 있다. 따라서, 향후 치수조직 반응 등 다양한 조직의 염증반응을 관찰할 필요성이 있으며, 세포독성이 더욱 낮추어진 MTA로 조직 반응을 평가하여 세포독성과 염증반응과의 상관성을 조사할 필요가 있다. 본 연구에서는 OrthoMTA와 함께 ProRoot MTA의 피내이식 반응도 관찰 비교하였다. ProRoot MTA는 가장 많이 연구가 이루어진 MTA 중 하나로서, ProRoot MTA 결과와의 비교를 통하여, 새로운 MTA의 임상에서의 생체적합성을 예측할 수 있다. 본 연구에서는 ProRoot MTA를 포함하여 각 MTA 간의 염증반응이 크게 차이를 보이지 않았으므로, 임상에서도 유사한 생체적합성이 예측된다.
결 론
DCPD는 OrthoMTA 경화시 발생하는 pH의 상승을 억제하였으며, 세포독성을 측정한 결과 DCPD는 OrthoMTA의 세포독성을 경감시키는 효과를 보였다. 따라서 MTA의 높은 pH가 세포독성에 일부 기여하는 것으로 판단된다. 그러나 동물실험에서 DCPD는 피하염증반응에 영향을 미치지 않은 것으로 나타났다. 즉, 본 연구의 조건에서는 MTA의 세포독성과 염증반응 간의 상관 관계가 보이지 않았다. 이는 DCPD에 의한 세포독성의 감소가 in vivo에서 염증반응을 억제할 정도로 강하지 않거나, MTA의 세포독성이 생체 내 염증반응에 크게 기여하지 않을 수 있음을 시사하는 결과라 할 수 있다.
Acknowledgments
본 연구는 보건복지부의 재원으로 한국보건산업진흥원의 보건의료기술연구개발사업 지원에 의하여 이루어진 것임(과제고유번호: HI15C1535).
References
-
Lee SJ, Monsef M, Torabinejad M. Sealing ability of a mineral trioxide aggregate for repair of lateral root perforations. J Endod. 1993;19(11):541-4.
[https://doi.org/10.1016/S0099-2399(06)81282-3]

-
Bates CF, Carnes DL, del Rio CE. Longitudinal sealing ability of mineral trioxide aggregate as a root-end filling material. J Endod. 1996;22(11):575-8.
[https://doi.org/10.1016/S0099-2399(96)80023-9]

-
Andelin WE, Browning DF, Hsu GH, Roland DD, Torabinejad M. Microleakage of resected MTA. J Endod. 2002;28(8):573-4.
[https://doi.org/10.1097/00004770-200208000-00002]

-
Al-Kahtani A, Shostad S, Schifferle R, Bhambhani S. In-vitro evaluation of microleakage of an orthograde apical plug of mineral trioxide aggregate in permanent teeth with simulated immature apices. J Endod. 2005;31(2):117-9.
[https://doi.org/10.1097/01.don.0000136204.14140.81]

-
Rahimi S, Shahi S, Lotfi M, Yavari HR, Charehjoo ME. Comparison of microleakage with three different thicknesses of mineral trioxide aggregate as root-end filling material. J Oral Sci. 2008;50(3):273-7.
[https://doi.org/10.2334/josnusd.50.273]

-
Shahi S, Yavari HR, Rahimi S, Eskandarinezhad M, Shakouei S, Unchi M. Comparison of the sealing ability of mineral trioxide aggregate and Portland cement used as root-end filling materials. J Oral Sci. 2011;53(4):517-22.
[https://doi.org/10.2334/josnusd.53.517]

-
Agrafioti A, Tzimpoulas N, Chatzitheodoridis E, Kontakiotis EG. Comparative evaluation of sealing ability and microstructure of MTA and Biodentine after exposure to different environments. Clin Oral Investig. 2016;20(7):1535-40.
[https://doi.org/10.1007/s00784-015-1638-6]

-
Ford TR, Torabinejad M, Abedi HR, Bakland LK, Kariyawasam SP. Using mineral trioxide aggregate as a pulp-capping material. J Am Dent Assoc. 1996;127(10):1491-4.
[https://doi.org/10.14219/jada.archive.1996.0058]

-
Aeinehchi M, Eslami B, Ghanbariha M, Saffar AS. Mineral trioxide aggregate (MTA) and calcium hydroxide as pulp-capping agents in human teeth: a preliminary report. Int Endod J. 2003;36(3):225-31.
[https://doi.org/10.1046/j.1365-2591.2003.00652.x]

-
Keiser K, Johnson CC, Tipton DA. Cytotoxicity of mineral trioxide aggregate using human periodontal ligament fibroblasts. J Endod. 2000;26(5):288-91.
[https://doi.org/10.1097/00004770-200005000-00010]

-
Souza NJ, Justo GZ, Oliveira CR, Haun M, Bincoletto C. Cytotoxicity of materials used in perforation repair tested using the V79 fibroblast cell line and the granulocyte-macrophage progenitor cells. Int Endod J. 2006;39(1):40-7.
[https://doi.org/10.1111/j.1365-2591.2005.01045.x]

-
Gorduysus M, Avcu N, Gorduysus O, Pekel A, Baran Y, Avcu F, et al. Cytotoxic effects of four different endodontic materials in human periodontal ligament fibroblasts. J Endod. 2007;33(12):1450-4.
[https://doi.org/10.1016/j.joen.2007.08.017]

-
Koulaouzidou EA, Economides N, Beltes P, Geromichalos G, Papazisis K. In vitro evaluation of the cytotoxicity of ProRoot MTA and MTA Angelus. J Oral Sci. 2008;50(4):397-402.
[https://doi.org/10.2334/josnusd.50.397]

-
Ribeiro DA, Sugui MM, Matsumoto MA, Duarte MA, Marques ME, Salvadori DM. Genotoxicity and cytotoxicity of mineral trioxide aggregate and regular and white Portland cements on Chinese hamster ovary (CHO) cells in vitro. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006;101(2):258-61.
[https://doi.org/10.1016/j.tripleo.2005.02.080]

-
Ko H, Yang W, Park K, Kim M. Cytotoxicity of mineral trioxide aggregate (MTA) and bone morphogenetic protein 2 (BMP-2) and response of rat pulp to MTA and BMP-2. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2010;109(6):e103-8.
[https://doi.org/10.1016/j.tripleo.2010.01.030]

-
Torshabi M, Amid R, Kadkhodazadeh M, Shahrbabaki SE, Tabatabaei FS. Cytotoxicity of two available mineral trioxide aggregate cements and a new formulation on human gingival fibroblasts. J Conserv Dent. 2016;19(6):522-6.
[https://doi.org/10.4103/0972-0707.194033]

- Amini Ghazvini S, Abdo Tabrizi M, Kobarfard F, Akbarzadeh Baghban A, Asgary S. Ion release and pH of a new endodontic cement, MTA and Portland cement. Iran Endod J. 2009;4(2):74-8.
- Estrela C, Sydney GB, Bammann LL, Felippe Junior O. Mechanism of action of calcium and hydroxyl ions of calcium hydroxide on tissue and bacteria. Braz Dent J. 1995;6(2):85-90.
-
Siqueira JF Jr., Lopes HP. Mechanisms of antimicrobial activity of calcium hydroxide: a critical review. Int Endod J. 1999;32(5):361-9.
[https://doi.org/10.1046/j.1365-2591.1999.00275.x]

-
Vitti RP, Prati C, Sinhoreti MA, Zanchi CH, Souza ESMG, Ogliari FA, et al. Chemical-physical properties of experimental root canal sealers based on butyl ethylene glycol disalicylate and MTA. Dent Mater. 2013;29(12):1287-94.
[https://doi.org/10.1016/j.dental.2013.10.002]

-
El Briak-Benabdeslam H, Ginebra MP, Vert M, Boudeville P. Wet or dry mechanochemical synthesis of calcium phosphates? Influence of the water content on DCPD-CaO reaction kinetics. Acta Biomater. 2008;4(2):378-86.
[https://doi.org/10.1016/j.actbio.2007.07.003]

- ISO 10993-12:2021 Biological evaluation of medical devices – Part 12: Sample preparation and reference materials.
- ISO 10993-5:2009 Biological evaluation of medical devices – Part 5: Tests for in vitro cytotoxicity.
- ISO 10993-6:Biological evaluation of medical devices – Part 6: Tests for local effects after implantation.
-
Zhang W, Peng B. Tissue reactions after subcutaneous and intraosseous implantation of iRoot SP, MTA and AH Plus. Dent Mater J. 2015;34(6):774-80.
[https://doi.org/10.4012/dmj.2014-271]