세 가지 의치상레진의 잔존 단량체의 용출에 관한 연구
초록
이 연구는 서로 다른 중합방식을 가진 세가지 의치상레진의 중합 후 잔존 단량체 방출과 세포독성을 평가하고자 하였다. 열중합의치상레진(Group H), 자가중합의치상레진 (Group S)과 3차원 프린팅에 의한 프린팅의치상레진(Group L)을 이용하여 제조사의 지시에 따라 중합시켜 실험시편을 제작하였다. 제작된 각 그룹의 시편들은 각각 하루, 1주, 2주, 3주, 4주, 6주, 8주 동안 37 ℃의 증류수에 보관하였다. 세그룹의 각 저장시점마다 흡광도를 측정하였고, MTT 테스트를 이용하여 각 시편들의 보관기간에 따른 세포독성을 측정하였다. 통계는 SPSS를 이용하였다. Group H가 Group S와 Group L에 비해 유의하게 낮은 흡광도를 나타냈다. Group S와 Group L의 흡광도는 첫날을 제외하고는 8주 동안 통계학적으로 유의한 차이가 나타나지 않았다. Group H와 Group S는 세포독성을 나타내지 않았으나, Group L은 상당한 세포독성을 나타냈다. 이 실험에 의하면 3차원 프린터로 프린팅된 의치상레진은 상당한 세포독성을 나타내는 것으로 사료된다. 프린팅의치상레진을 임상에 적용하기 위해서 잔존 단량체를 줄일 수 있는 방법개발이 필요할 것으로 사료된다.
Abstract
This study evaluated release of the residual monomer and cytotoxicity after polymerization of three denture base resins (heat curing resin, self-curing resin, light curing resin by 3D printer). Three types of resin specimen according to the manufacturer’s guideline were fabricated: heat curing resin (Group H), self-curing resin (Group S), 3D Printed resin (Group L). Each group of specimen were stored in distilled water at 37 ℃ for 1 day, 1 week, 2 weeks, 3 weeks, 4 weeks, 6 weeks, and 8 weeks in order to measure the release of the residual monomer. Absorbance was measured at each storage time in the three groups. Cytotoxicity is measured by MTT test at each storage time in the three groups. For statistical analysis, one-way ANOVA with post-hoc tests of Dunnett T3 test and Scheffe test were carried out, where p values of less than 0.05 were considered as significant.
Group H showed the lower absorbance than Group S and Group L. There was no statistically significant difference in the absorbance of Group S and Group L for 8 weeks, except for the one day. Group H and Group S showed no cytotoxicity, but Group L resulted in cytotoxicity. To conclude, light curing resin used in 3D printer revealed high cytotoxicity in this study. In order to apply the 3D printed denture base resin to clinical situation, it is necessary to develop a method to reduce the release of residual monomers.
Keywords:
Self curing, Heat curing, 3D printed resin, Denture, Monomer release, Cytotoxicity키워드:
자가중합, 열 중합, 3차원 프린팅 레진, 의치, 단량체 용출, 세포독성서 론
아크릴릭 레진(PMMA; polymethylmethacrylate)는 치과에서 매우 널리 사용되고 있는 재료이다(1-4). 재료의 특성으로 인해 의치상, 의치이장 및 수리, 가철성 교정장치와 임시치관제작 등 다양한 형태로 사용되고 있다(5-8). 이러한 용도때문에, 아크릴릭 레진은 적절한 물리적, 화학적 그리고 생물학적 특성을 가져야한다(2, 3, 9-11).
아크릴릭레진이 최적의 물리적 및 생물학적 특성을 형성하기위해서 단량체를 폴리머로 전화시켜주는 중합과정이 매우 중요하다(12). 중합이 불완전하면 의치상에 formaldehyde, methacrylic acid, benzoic acid, dibutylphthalate, phenyl benzoate, phenyl salicylate와 methyl methacrylate (MMA) 등과 같은 잔존 단량체와 화학적으로 독성이 있는 부산물들이 발생한다(2, 3, 9, 10, 12-15). 또한, 레진이 제조사의 지시에 따라 중합이 이루어졌다고 하여도 구강 내와 같이 수분이 있는 환경에서는 이러한 단량체들이 용출되어 존재하게 된다고 보고되고 있다(10, 13-15).
의치상레진에 의한 알러지반응과 세포독성효과들이 여러 문헌들을 통해 다양하게 보고되고 있다(16-20). 의치상레진에 알러지반응을 가진 환자들이 호소하는 가장 흔한 증상은 구내 통증과 작열감이 있다. 작열감은 주로 구개, 혀, 구강점막과 구인두에 나타난다고 보고되고 있다(21, 22). 의치상레진의 세포독성효과는 의치상에서 용출된 미반응 잔존 단량체들에 의해 발생하는데, 이 용출된 잔존 단량체가 타액으로 침출되어 구강조직으로 전달되고 이로 인해 세포독성과 바람직하지 않은 알러지 반응이 발생된다고 하였다(7, 23, 24).
이러한 바람직하지 않은 반응을 유발하는 의치상레진에서 용출된 단량체에 관한 다양한 연구가 보고되었다. 중합의 조건과 방법에 따른 의치상레진의 세포독성에 관해 연구하였던 Ivkovic 등에 의하면, 세포독성은 의치상레진의 분말과 액의 혼합비, 중합 후 수조 보관시간 및 중합방법과 관계가 있다고 보고하였다(25). Chaves 등은 다양한 문헌고찰을 통해 열중합레진이 자가중합레진과 광중합레진이나 이중중합이장레진보다 더욱 낮은 독성 효과를 나타낸다고 하였다(13). 또한, Sheridan 등은 치은섬유모세포에 대한 마이크로파 중합레진, 자가중합레진 및 열중합레진의 독성에 대해 보고하였는데, 자가중합레진이 가장 높은 세포독성을 나타내었다고 하였다(26).
이러한 용출된 단량체의 세포독성을 최소화하기 위해 Bural 등은 그들의 실험결과에 근거하여 통상적인 중합과정 이후 30분간 끓여 추가 중합을 유도하고, 완성된 의치를 구강내 시적하기 전 1~2일 동안 수조에 보관할 것을 임상적으로 추천하였다(12).
치의학에 디지털 기술이 접목되기 시작하면서 최근 몇 년간 다양한 3차원 프린팅을 위한 의치상레진이 개발되었다(27-29). 하지만 3차원 프린팅 된 의치상레진의 단량체 용출과 세포독성에 대한 보고는 거의 없다. 따라서, 본 연구에서는 3차원 프린팅 의치상레진을 포함한 서로 다른 세 가지의 의치상레진을 증류수에 침적 후 시간에 따른 잔류 단량체의 용출과 세포독성에 대해 알아보고자 하였다.
재료 및 방법
1. 실험 재료
이 실험에 사용된 의치상 재료는 Vertex Rapid Simplified (Vertex, Zeist, Netherlands), Vertex Castavaria (Vertex, Zeist, Netherlands), Dionavi-Denture (Dio, Busan, Korea)이었으며, 각기 Group H, Group S, Group L로 분류하였다(Table 1). 제작된 시편의 사이즈는 64 mm × 10 mm × 4 mm였으며, 그룹 별로 각기 90개의 시편을 제조사의 지시대로 제작하였다. Group L의 시편은 디지털광학처리(DLP, digital light processing)방식의 3차원 프린터(Slash 2, Uniz Technology LLC, San Diego, CA, USA)를 이용하여 제작하였으며, 제조사의 지시에 따라 시편을 출력하였다. 출력된 시편들은 이소프로필알콜(95%)로 5분간 교반세척하고, 자외선가시광선 중합기(Cure M, Graphy Inc, Busan, Korea)를 이용하여 5분간 후중합을 시행하였다. 제작된 모든 시편들의 한 면을 실리콘 버와 연마제를 이용하여 연마하였다.
2. 잔류 단량체 용출 평가
제작된 240개의 시편들을 각기 그룹별로 분리하여 하나씩 10 mL의 멸균증류수가 담긴 원심관튜브(conical tube)에 넣었다. 시편을 담은 원심관튜브는 36.5 ℃의 온도와 50 rpm의 교반속도로 설정된 항온진탕배양기(JEIO Tech, SI-600R®, Daejeon, Korea)에 보관하였다. 진탕배양기에 보관한 후 24시간이 되는 시점과 1주, 2주, 3주, 4주, 6주 그리고 8주까지 모두 7개의 저장시점에서 원심관튜브의 잔류단량체 측정을 총 7회 시행하였다. 각각의 저장시점에서 잔류 단량체 측정 시 측정된 시편의 개수는 각 그룹마다 10개씩이었다. 원심관튜브에 용출된 잔류단량체 측정은 자외선-가시광선 분광기(GENESYS 10S UV-Vis, Thermo Fisher Scientific, Massachusetts, USA)를 사용하였으며, 멸균증류수에 용출된 단량체의 methylmethacrylate에 가장 뚜렷한 흡수반응을 보인 250 nm의 파장을 이용하여 흡광도(Abs; absorbance) 값을 측정하였다. 멸균증류수의 흡광도 값을 0으로 설정하여 기준값(blank)으로 하였다.
3. 세포 독성 및 세포 성장억제 평가
세포 독성과 세포 성장억제에 대한 평가는 위에 잔류단량체 잔류 평가에서 각 그룹의 원심관튜브의 멸균증류수에 용출되어 있는 잔류단량체의 농도를 자외선-가시광선 분광기로 측정한 후, 0.2 µm의 주사기 필터(Sterile Millex, Merck KGaA, Darmstadt, Germany)로 소독한 후 세포를 적용하기 전에 4 ℃에서 보관하였다.
Human gingival fibroblast (HGF-1, CRL-2014) 세포(ATCC, Manassas, VA, USA)는 96 well plate에서 분주하였으며, 37 ℃의 온도와 5% CO2의 조건에서 배양하였다. 세포 독성 평가를 위하여 HGF-1 세포수는 2 ×104 cells/well사용하였고, 성장억제 실험에 사용한 세포수는 1×104 cells/well였다. 세포독성실험과 세포 성장억제를 위한 배지는 각각 Dulbecco’s Modified Eagle’s Medium (DMEM)(-) 배지와 DMEM(+) 배지를 사용하였다. 4 ℃에서 보관 중인 단량체가 용출된 용액을 DMEM(-) 배지 또는 DMEM(+) 배지로 각기 2배씩 희석한 다음, HGF-1 세포에 처리하였다. 이렇게 처리된 배지에서 세포 배양이 1일과 2일 동안 시행되었다. 이 실험에서 각 그룹마다 잔류단량체 용출 양상이 뚜렷하였던 각기 1일, 2주, 4주, 8주의 용액을 추출하여 세포에 대한 생활성과 세포 성장억제를 평가하였다. 세포 독성과 성장억제는 MTT 방법으로 평가되었다.
4. 의치상레진 표면의 주사전자현미경 관찰
단량체가 용출된 후의 각 그룹의 의치상 레진표면의 변화를 관찰하기 위해 주사전자현미경(Scanning Electron Microscope, SEM; Sero:AIS2000C, Seoul, Korea)을 이용하였다. 각 그룹마다 원심관튜브에 담기지 않은 중합직후의 시편과 3주, 8주가 지난 후 시편들에서 관찰되는 표면의 변화를 주사전자 현미경을 이용하였다. 관찰 배율은 ×100였다.
5. 통계분석
모든 통계는 IBM SPSS 25 (SPSS for windows version 25, SPSS INC, Chicago, IL USA) 프로그램을 사용하여 처리하였으며, 통계적 유의성 판정을 위한 유의수준은 5%로 설정하여 처리하였다. 각 그룹내 기간별 단량체 용출과 그룹 간의 모노모 용출결과에 대한 통계분석으로 one-way ANOVA를 이용하였으며, 사후 검증으로 Dunnett T3 test, Scheffe test를 이용하였다.
결 과
1. 잔류단량체 분석
세 그룹에 대한 각기 7회의 측정시점에서 용출된 잔류모노머는 평균흡광도로 측정하였으며, 아래 표와 같이 정리하여 표시하였다(Table 2, Figure 1). 세 그룹 모두 8주후의 평균 흡광도 값은 첫날의 수치에 비해 통계학적으로 유의하게 증가하였다(P<0.05). 세 그룹 모두 첫 날 이후 3~4주 까지는 현저하게 흡광도가 증가하다가 이후부터는 유의미한 증가량을 보이지 않았다.

Mean value of absorbance in each period of three groups. The different capital letter shows statistically significant difference between the three groups in each period (One-way ANOVA, p<0.05).
Group H는 첫 날부터 8주 차까지 Group S와 Group L에 비해 통계학적으로 유의하게 적은 평균 흡광도 값을 보여주었다(P<0.05). Group S는 첫날 평균 흡광도가 Group H보다는 통계학적으로 유의미하게 높았지만, Group L 보다는 유의미한 수준으로 낮은 수치를 나타내었다(P<0.05). 단량체 용출 실험 1주차 이후부터 8주차까지 Group S와 Group L의 평균흡광도가 거의 비슷하였으며, 유의성도 존재하지 않았다(p<0.05).
8 주차에서 측정된 세 그룹의 평균 흡광도 값은 각기 0.5332±0.1949, 1.0214±0.0723, 0.9892±0.0927으로 Group H가 나머지 두 그룹에 비해 통계학적으로 유의하게 적은 값을 나타내었다(p<0.05).
2. 세포 독성
세 그룹의 각 기간별 용출된 단량체에 대한 세포독성을 평가한 결과, Group H와 Group S에서는 HGF-1 세포의 생활성이 1일차와 2일차 배양에서 단량체 용출 기간에 관계없이 적절하게 유지됨을 관찰할 수 있었다(Figure 2). Group L은 배양 첫날 하루 동안 용출된 단량체 배지에서는 Group H, Group S와 비슷한 정도의 세포 생활력을 보였다(Figure 2). 하지만, 그것을 제외한 나머지 2주, 4주, 6주의 배지와 2일 동안 배양 된 모든 배지에서 Group L은 Group H와 Group S에 비해 유의미하게 세포의 생활성이 억제됨을 관찰할 수 있었으며(p<0.05), 1일차보다는 2일차에서 더욱 세포의 생활성이 감소함을 관찰할 수 있었다(p<0.05).
3. 세포성장억제
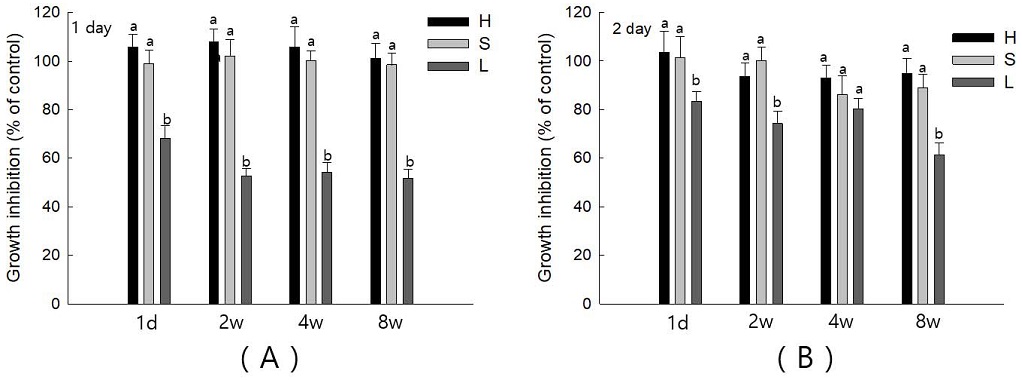
세 그룹의 각 기간별 용출된 단량체에 대한 세포성장억제를 평가한 결과, Group H와 Group S에서는 1일차와 2일차 배양에서 단량체 용출기간에 관계없이 성장억제가 유의미하게 변화가 없었다(Figure 3). 그러나, Group L은 2일동안 배양한 4주차 배지를 제외하고는 Group H와 Group S에 비해 세포 성장이 유의미하게 억제됨을 관찰할 수 있었다(Figure 3, p<0.05).
4. 시편의 표면변화 관찰
각 그룹의 레진 시편들의 표면의 변화를 주사전자현미경(SEM)을 이용하여 관찰하여 다음과 같은 소견을 관찰할 수 있었다(Figure 4).

Scanning electron microscope image (×100) of each group; (a) after curing, (b) 3 weeks storage, (c) 8 weeks storage.
중합직후의 시편들을 주사전자현미경을 이용하여 ×1000으로 관찰시 세 그룹 모두 거친 표면을 보였으나, ×100로 관찰 시 Group H와 Group S의 표면은 Group L에 비해 다소 매끄럽게 관찰되었다. Group L의 표면에는 중합이 완전치 않은 폴리머들이 표면에 부착된 것이 관찰되었다.
3주의 저장기간후 주자전자현미경사진 소견에서는 세 그룹 시편 모두에서 정도의 차이는 있으나 표면에 홈(pit) 같은 것들이 조금씩 관찰되기 시작하였으며, 이로인해 표면이 거칠게 관찰되었다. 패인 홈의 크기는 Group S에서 가장 크고 뚜렷하게 관찰되었다. Group L의 경우에는 수조에 보관하면서 표면의 불완전하게 중합된 폴리머들이 떨어져 나가면서 오히려 더 매끈해져 보였으나 조금씩 홈을 보이기 시작했다.
8주차의 주자전자현 사진에서는 더욱 많은 홈들이 표면에서 관찰되었으며, 이로인해 표면이 더욱 거칠게 관찰되었다. Group L은 표면의 불완전하게 중합된 폴리머들이 거의 떨어져 나갔으나, 패인 홈들이 점차 증가하기 시작했다.
고 찰
세 그룹의 8주 후 흡광도를 측정하였더니 Group H가 나머지 두 그룹에 비해 통계학적으로 유의미하게 낮은 수치를 나타내었다. 이는 열중합의치상레진에서 용출된 단량체의 양이 자가중합의치상 레진과 3차원 프린터로 중합된 의치상레진에 비해 유의미한 수준으로 낮았음을 의미한다. 열중합의치상레진이 자가중합의치상레진에 비해 더 낮은 양의 잔존 methyl methacrylate를 용출한다는 것은 여러 문헌들에서 보고되었다(2, 26, 30). Vallittu 등은 열중합레진이 자가중합레진에 비해 낮은 잔존단량체를 방출한다고 하였으며, 이러한 현상은 열중합레진에 가해지는 높은 온도에 기인한다 하였다. 높은 온도 상승이 고분자사슬을 움직이는 효과를 가져옴으로서 단량체가 중합체로 더욱 쉽게 전환되게하여 미반응 단량체가 줄어든다 하였다(30). 그들은 자가중합의치상 레진의 중합 후 단량체 용출을 줄이기 위해서는 추가적인 열처리를 추천하였다. 3차원 프린터로 중합된 레진과 열중합레진 및 자가중합레진의 단량체 용출에 대한 비교한 문헌 보고는 거의 없었다. De Andrade Lima Chaves 등은 의치상레진의 세포독성에 관한 문헌고찰을 통해 열중합레진이 자가중합레진과 광중합형레진에 비해 통계학적으로 낮은 세포독성을 보여준다 하였다(13). 비록, 동일한 방식은 아니지만 광중합형레진이 열중합형레진에 비해 더 많은 양의 잔존단량체를 방출하고 높은 세포독성의 결과를 나타냈다는 보고를 참고할 때, 이 실험에서 3차원 프린터로 제작된 의치상레진의 단량체 방출량이 열중합레진에 비해 높다는 것은 추정 가능한 결과로 사료된다.
세 그룹의 단량체 방출량은 저장기간 동안 모두 통계학적으로 유의미하게 증가하였다(p<0.05). 8주 후 평균흡광도는 Group S와 Group L 가 Group H의 두 배 수치를 기록할 만큼 유의하게 차이가 났으나, 모든 그룹이 첫 날 시점보다 모두 유의하게 높은 흡광도를 나타내었다. 이는 세 그룹의 레진이 중합 후에도 지속적으로 단량체를 방출하였음을 의미한다고 할 수 있다. 이러한 경향은 12개월에서 최장 36개월 동안의 단량체 방출을 실험하였던 Zissis의 보고와 유사하였다(31). Zissis 등은 실험기간동안 열중합레진과 자가중합레진이 지속적으로 단량체를 방출하였으며, 모든 열중합레진이 자가중합레진보다 모든 기간 동안 유의하게 낮은 단량체를 방출되었다고 하였다. 또한, 자가중합레진은 첫 12개월 저장까지 지속적으로 유의한 단량체 방출을 보여주었다고 보고하였다(31).
본 실험에서 세 그룹의 흡광도 그래프는 지속적인 상승을 보이기 보다는 세 그룹 모두가 3~4주 시점에서 완만히 꺾이는 변곡점을 보였으며, 각 그룹의 8주 시점의 약 90% 흡광도에 도달하였다. 이것은 단량체 용출이 3~4주까지가 가장 크게 증가하고 이후부터는 완만하게 이뤄진다는 것을 의미한다. Bural 등은 열중합레진의치상의 잔존단량체를 줄이기 위해 74 ℃에서 장시간의 중합과 끊는점에서 장시간의 추가적인 중합을 시행할 것과 의치 시적 전에 최소 1~2일 동안 수조에 보관할 것을 추천하였다(12). Bayraktar 등은 중합 후 잔존단량체 용출을 줄이기 위해 열중합레진은 장시간 끓는점에서 중합 시행과 최소 1일 동안 수조 보관을 추천하였으며, 자가중합레진의 경우에는 60 ℃에서 추가적인 중합 시행과 최소 1 주일 동안 수조 보관을 제시하였다(6). 본 실험에서도 Group H는 하루 시점과 1주 시점에 뚜렷한 흡광도 증가를 보여주었고, Group S도 하루 시점과 1주 시점에 현저하게 흡광도 증가를 나타내었다. 이는 기존의 선학의 실험결과와 유사한 결과를 나타내어준다. 하지만, Group H와 Group S 모두 1주 시점 이후에도 3~4주에 이르기까지 통계학적으로 유의한 흡광도 증가를 나타내었다. Group L 또한 하루 시점에서 가장 높은 흡광도를 나타내었으며 4주 시점까지 지속적인 흡광도 증가를 나타내었다. 본 실험의 결과가 열중합레진, 자가중합레진, 프린팅레진 모두 제조사의 지시에 따라 시편을 제작한 후 측정되었던 점을 고려하면, 세 그룹 모두 잔존 단량체 용출을 줄이기 위해서는 중합 후 3~4주 정도까지 의치를 수조에 보관하거나 추가적으로 단량체 용출을 줄일 수 있는 공정이 필요하다 할 수 있다.
세 그룹의 의치상레진이 중합반응 후 저장 기간에 따라 용출된 단량체를 이용하여, 세포독성을 실험하였다. 세포독성평가는 세포호흡활동을 평가하는 MTT 테스트를 이용하여 평가하였다(2, 13, 14, 32). 4개의 저장 시점(하루, 2주, 4주, 8주)에서 채취된 시료를 이용하여 24시간과 48시간 동안 세포의 증식을 관찰하였다. 24시간과 48시간 동안 배양 후, Group H와 Group S는 4개 저장 시점의 모든 배지에서 75%의 세포증식을 나타냈다. 이것은 Bural 등의 세포독성 분류에 따르면 세포독성이 없다 할 수 있다(12). 24시간과 48시간 배양 시에도 두 그룹의 각 저장 시점에 따른 세포증식은 유의한 차이를 나타내지 않았다. 하지만, Group L은 24시간 배양 시 하루 저장 시점의 배지들에서는 75% 이상의 세포증식을 보여주었으나, 2주, 4주, 8주 저장 시점의 배지들에서는 60%에 못 미치는 세포증식을 보여 약간의 세포독성이 있음을 나타내었다. 또한, Group L의 48시간 배양에서는 모든 저장 시점의 배지들에서 40%에 못 미치는 세포증식을 보여줌으로써 상당한 세포독성을 보여주었다. Group L의 세포 독성은 24시간에 비해 48시간 동안 배양된 모든 저장 시점의 배지들에서 더욱 뚜렷하게 나타났다. 본 실험에서는 Group H와 Group S 사이에 세포독성의 차이를 보이지는 않았다. 이는 열중합의치상레진이 자가중합레진에 비해 독성이 덜하다는 문헌(2, 6, 13, 31)의 보고와 일치하지 않는다. 이것은 기존의 문헌보고에서 자가중합레진의 시편제작이 실온에서 제작되었던 것에 반해 이번 실험에서는 자가중합레진의 시편제작이 제작사의 지시대로 55 ℃의 수조와 2.5기압에서 30분간 중합조건에서 이루어졌기 때문으로 추정된다. 본 실험에서 열중합레진 뿐만 아니라 자가중합레진도 수조에 담겨 중합이 이뤄졌기 때문에 두 그룹사이에 세포독성의 차이가 나지 않았을 것으로 사료된다. 이는 자가 중합레진의 세포독성을 줄이기 위해 60 ℃ 수조에 담아 중합하는 과정을 추가하고 37 ℃ 물에 최소 1일 정도 보관을 주장한 Bayracktar의 보고와 맥락을 같이 한다고 할 수 있다(6).
본 시험에서 주사전자현미경을 이용하여 세 그룹의 표면변화를 관찰하였더니, 세그룹 모두에서 증류수에 보관기간이 길어질수록 표면의 잔사는 줄어들면서 미세한 홈(pit) 같은 것이 증가함을 보였다. 이는 물분자들이 중합된 폴리머사이를 비교적 쉽게 통과하여 폴리머 사이에 존재하던 미반응된 단량체나 첨가제등이 빠져나오게 하는 역할을 하였기 때문으로 사료된다(33). Group L이 Group H와 Group S에 비해 표면의 홈들이 덜 관찰되었는데 이에 대한 추가적인 고찰이 필요할 것 같다.
최근 몇 년 동안 디지털 치의학의 발전과 더불어 다양하고 새로운 재료들이 개발되고 있다. 특히, 3차원 프린팅에 의해 제작되는 재료의 발전이 현저하지만, 이 방식으로 생체적합성을 지니면서 적절한 기계적 특성을 지닌 생체재료를 제작하는 것은 어려움이 있으며, 이견들이 많이 존재한다(34-36). 더불어, 대부분의 제조사들이 프린팅의치상 레진의 단량체 구성성분에 대한 정보를 상세하게 제시하지 않아서 연구결과의 해석을 어렵게 하고 있다. 본 실험에서 Group L은 8주 동안 Group S와 비슷한 평균 흡광도를 나타내었다. 하지만, 세포독성에서는 Group L이 Group H와 Group S에 비해 유의하게 높은 독성을 나타냈다. 제조사의 지시대로 제작하였음에도 Group L이 보여준 세포독성은 상당하였으며, 이는 액상프린팅레진의 미반응 단량체와 그외 첨가물의 작용으로 추정된다.
이 실험은 단량체의 성분 중에서 methylmethacrylate 성분에 반응하는 260 nm의 파장을 이용하여 흡광도를 측정하였다. 향후 3차원 프린팅 재료를 포함한 여러가지 레진의 단량체 성분들에 대한 추가적인 실험과 고찰이 필요할 것으로 사료된다.
결 론
본 연구는 현재 사용되고 있는 열중합 의치상레진, 자가중합 의치상레진과 3차원 프린트에 의해 적층방식으로 제작된 의치상레진의 단량체 방출과 세포독성에 대해 알아보고자 하였다. 본 실험의 결과내에서 열중합레진과 자가중합레진은 세포독성을 고려해볼 때 임상적으로 받아들일 만하였다. 하지만. 3차원 프린팅으로 제작된 의치상레진은 상당한 세포독성을 나타내어 임상적으로 사용하기 위해서는 잔존 단량체를 감소시킬 수 있는 방법 등의 개발이 필요할 것으로 사료된다.
Acknowledgments
이 논문은 2019년도 조선대학교 치과병원 학술연구비의 지원을 받아 연구되었음.
References
-
Acosta-Torres LS, Mendieta I, Nuñez-Anita RE, Cajero-Juárez M, Castaño VM. Cytocompatible antifungal acrylic resin containing silver nanoparticles for dentures. Int J Nanomedicine. 2012;7:4777–86.
[https://doi.org/10.2147/IJN.S32391]

-
Ata SO, Yavuzyilmaz H. In vitro comparison of the cytotoxicity of acetal resin, heat-polymerized resin, and autopolymerized resin as denture base materials. J Biomed Mater Res B Appl Biomater. 2009;91(2):905-90.
[https://doi.org/10.1002/jbm.b.31473]

-
Kojima N, Yamada M, Paranjpe A, Tsukimura N, Kubo K, Jewett A, Ogawa T: Restored viability and function of dental pulp cells on poly-methylmethacrylate (PMMA)-based dental resin supplemented with N-acetyl cysteine (NAC). Dent Mater. 2008;24(12):1686-93.
[https://doi.org/10.1016/j.dental.2008.04.008]

-
Hattori N, Suzuki T, Jinno H, Okeya A, Ishikawa A, Kondo C, Hayashi T, Ito M, Kanamori T, Kawai T, Noguchi T. Methyl methacrylate activates the Gsta1 Promoter. J Dent Res. 2008;87(12):1117-21.
[https://doi.org/10.1177/154405910808701214]

- León BL, Del Bel Cury AA, Rodrigues Garcia RC. Loss of residual monomer from resilient lining materials processed by different methods. Rev Odontol Ciênc. 2008;23(3):215-9.
-
Bayraktar G, Guvener B, Bural C, Uresin Y. Influence of polymerization method, curing process, and length of time of storage in water on the residual methyl methacrylate content in dental acrylic resins. J Biomed Mater Res B Appl Biomater. 2006;76(2):340-5.
[https://doi.org/10.1002/jbm.b.30377]

-
Urban VM, Machado AL, Vergani CE, Giampaolo ET, Pavarina AC, de Almeida FG, Cass QB. Effect of water-bath post-polymerization on the mechanical properties, degree of conversion, and leaching of residual compounds of hard chairside reline resins. Dent Mater. 2009;25(5):662-71.
[https://doi.org/10.1016/j.dental.2008.10.017]

- Nironen P. Some possible uses for acrylic resins in dentistry. Odontol Tidskr. 1950;58(2):118-25.
-
Tay LY, Herrera DR, Quishida CC, Carlos IZ, Jorge JH. Effect of water storage and heat treatment on the cytotoxicity of soft liners. Gerodontology. 2012;29(2):275–80.
[https://doi.org/10.1111/j.1741-2358.2011.00463.x]

-
Att W, Yamada M, Kojima N, Ogawa T. N-Acetyl cysteine prevents suppression of oral fibroblast function on poly(methylmethacrylate) resin. Acta Biomater. 2009;5(1):391–8.
[https://doi.org/10.1016/j.actbio.2008.07.021]

-
Yamada M, Kojima N, Att W, Hori N, Suzuki T, Ogawa T. N-Acetyl cysteine restores viability and function of rat odontoblast-like cells impaired by polymethylmethacrylate dental resin extract. Redox Rep. 2009;14(1):13–22.
[https://doi.org/10.1179/135100009X392430]

-
Bural C, Aktaş E, Deniz G, Ünlüçerçi Y, Bayraktar G. Effect of leaching residual methyl methacrylate concentrations on in vitro cytotoxicity of heat polymerized denture base acrylic resin processed with different polymerization cycles. J Appl Oral Sci. 2011;19(4):306–12.
[https://doi.org/10.1590/S1678-77572011005000002]

-
Chaves CA, Machado AL, Vergani CE, de Souza RF, Giampaolo ET. Cytotoxicity of denture base and hard chairside reline materials: a systematic review. J Prosthet Dent. 2012;107(2):114–27.
[https://doi.org/10.1016/S0022-3913(12)60037-7]

- Ebrahimi Saravi M, Vojdani M, Bahrani F. Evaluation of cellular toxicity of three denture base acrylic resins. J Dent (Tehran). 2012;9(4):180–8.
-
Bural C, Aktaş E, Deniz G, Ünlüçerçi Y, Kızılcan N, Bayraktar G. Effect of post-polymerization heat-treatments on degree of conversion, leaching residual MMA and in vitro cytotoxicity of autopoly- merizing acrylic repair resin. Dent Mater. 2011;27(11):1135–43.
[https://doi.org/10.1016/j.dental.2011.08.007]

-
Giunta JL, Grauer I, Zablotsky N. Allergic contact stomatitis caused by acrylic resin. J Prosthet Dent. 1979;42(2):188-90.
[https://doi.org/10.1016/0022-3913(79)90173-2]

-
Weaver RE, Goebel WM. Reactions to acrylic resin dental prostheses. J Prosthet Dent. 1980;43(2):138-42.
[https://doi.org/10.1016/0022-3913(80)90176-6]

-
Ali A, Bates JF, Reynolds AJ, Walker DM. The burning mouth sensation related to the wearing of acrylic dentures: An investigation. Br Dent J. 1986;161(12):444-7.
[https://doi.org/10.1038/sj.bdj.4806008]

-
Koutis D, Freeman S. Allergic contact stomatitis caused by acrylic monomer in a denture. Australas J Dermatol. 2001;42(3):203-6.
[https://doi.org/10.1046/j.1440-0960.2001.00517.x]

-
Gonçalves TS, Morganti MA, Campos LC, Rizzatto SM, Menezes LM. Allergy to auto-polymerized acrylic resin in an orthodontic patient. Am J Orthod Dentofacial Orthop. 2006;129(3):431-5.
[https://doi.org/10.1016/j.ajodo.2005.10.017]

-
Cibirka RM, Nelson SK, Lefebvre CA. Burning mouth syndrome: A review of etiologies. J Prosthet Dent. 1997;78(1):93-7.
[https://doi.org/10.1016/S0022-3913(97)70089-1]

-
Van Joost T, van Ulsen J, van Loon LA. Contact allergy to denture materials in the burning mouth syndrome. Contact Dermatitis. 1988;18(2):97-9.
[https://doi.org/10.1111/j.1600-0536.1988.tb02748.x]

-
Gautam R, Singh RD, Sharma VP, Siddhartha R, Chand P, Kumar R. Biocompatibility of polymethylmethacrylate resins used in dentistry. J Biomed Mater Res B Appl Biomater. 2012;100(5):1444-50.
[https://doi.org/10.1002/jbm.b.32673]

-
Kopperud HM, Kleven IS, Wellendorf H. Identification and quantification of leachable substances from polymer-based orthodontic base-plate materials. Eur J Orthod. 2011;33(1):26-31.
[https://doi.org/10.1093/ejo/cjq020]

-
Ivkovic N, Bozovic D, Ristic S, Mirjanic V, Jankovic O. The residual monomer in dental acrylic resin and its adverse effects. Contemporary Materials. 2013;4(1):84-91.
[https://doi.org/10.7251/COMEN1301084I]

- PJ Sheridan, S Koka, NO Ewoldsen, CA Lefebvre, MT Lavin. Cytotoxicity of denture base resins. Int J Prosthodont. 1997;10(1):73-7.
-
Tahayeri A, Morgan M, Fugolin AP, Bompolaki D, Athirasala A, Pfeifer CS, Ferracane JL, Bertassoni LE. 3D printed versus conventionally cured provisional crown and bridge dental materials. Dent Mater. 2018;34(2):192–200.
[https://doi.org/10.1016/j.dental.2017.10.003]

-
Lavorgna L, Cervino G, Fiorillo L, Di Leo G, Troiano G, Ortensi M, Galantucci L, Cicciù M. Reliability of a virtual prosthodontic project realized through a 2d and 3d photographic acquisition: An experimental study on the accuracy of different digital systems. Int J Environ Res Public Health. 2019;16(24):5139.
[https://doi.org/10.3390/ijerph16245139]

-
Wang Y, Xu Z, Wu D, Bai J. Current Status and Prospects of Polymer Powder 3D Printing Technologies. Materials. 2020;13(10):2406.
[https://doi.org/10.3390/ma13102406]

-
Vallittu PK, Ruyter IE, Buykuilmaz S. Effect of polymerization temperature and time on the residual monomer content of denture base polymers. Eur J Oral Sci. 1998;106(1):588-93.
[https://doi.org/10.1046/j.0909-8836.1998.eos106109.x]

- Zissis A, Yannikakis S, Polyzois G, Harrison A. A long term study on residual monomer release from denture materials. Eur J Prosthodont Restor Dent. 2008;16(2):81–4.
-
Tay LY, Herrera DR, Quishida CC, Carlos IZ, Jorge JH. Effect of water storage and heat treatment on the cytotoxicity of soft liners. Gerodontology. 2012;29(2):275–80.
[https://doi.org/10.1111/j.1741-2358.2011.00463.x]

-
Kawahara T, Nomura Y, Tanaka N, Teshima W, Okazaki M, Shintani H. Leachability of plasticizer and residual monomer from commercial temporary restorative resins. J Dent. 2004;32(4):277-83.
[https://doi.org/10.1016/j.jdent.2003.12.004]

-
Barui S, Panda AK, Naskar S, Kuppuraj R, Basu S, Basu B. 3D inkjet printing of biomaterials with strength reliability and cytocompatibility: Quantitative process strategy for Ti-6Al-4V. Biomaterials. 2019;213:119212.
[https://doi.org/10.1016/j.biomaterials.2019.05.023]

-
Herzberger J, Sirrine JM, Williams CB, Long TE. Polymer design for 3D printing elastomers : Recent advances in structure, properties, and printing. Prog Polym Sci. 2019;97:191144.
[https://doi.org/10.1016/j.progpolymsci.2019.101144]

-
Di Giacomo GDA, Cury PR, da Silva AM, da Silva JV, Ajzen SA. A selective laser sintering prototype guide used to fabricate immediate interim fixed complete arch prostheses in flapless dental implant surgery: Technique description and clinical results. J Prosthet Dent. 2016;116(6):874–9.
[https://doi.org/10.1016/j.prosdent.2016.04.018]