칼슘실리케이트 계열 치근단 역충전 재료의 체적 변화에 대한 micro-CT 분석
초록
본 연구의 목적은 칼슘실리케이트 계열 재료로 치근단 역충전 시 재료의 혈액 접촉과 치아 동요도가 재료의 체적 변화에 미치는 영향을 micro-CT를 이용하여 분석하는 것이다. 3종의 칼슘실리케이트 계열 재료(ProRoot MTA, Biodentine, RetroMTA)를 치근단 역충전에 사용하였다. 발치된 사람의 상하악 소구치 72개를 근관 충전하고 치근단 3 mm를 절제한 후 3 mm 깊이의 치근단 와동형성을 시행하였다. 3종의 칼슘실리케이트 계열 재료로 치근단 역충전을 시행하고 각 시편을 37 ℃ 배양기에서 5일 동안 생리식염수 또는 혈액에 침적시켰다(n=8). 동요도 재현을 위해 치아 시편을 저작 재현기에 고정하고 30 N으로 20,000회 교합을 시킨 후 생리식염수에 침적시켰다(n=8). Micro-CT 스캔은 치근단 역충전을 시행한 직후 시행하고, 저장매체 노출 및 동요도 재현 이후에 다시 한번 시행하였다. 첫 번째 스캔과 두 번째 스캔 시 산출한 체적의 차이를 계산하여 치근단 역충전 재료의 total volume loss (%)를 구하였다. 동요도 재현 실험군의 경우 치근단에서 1 mm 떨어진 부위 까지의 volume loss (%; apical volume loss)를 계산하였다. 치근단 역충전 재료를 생리식염수 또는 혈액에 노출 시 total volume loss는 두 경우 모두에서 Biodentine이 다른 재료에 비해 컸다(p<0.05). ProRoot MTA는 혈액과 접촉한 경우에 생리식염수와 접촉한 경우보다 total volume loss가 더 작았다(p<0.05). 치아 동요도를 재현했을 때 apical volume loss는 Biodentine이 RetroMTA에 비하여 유의하게 컸다(p<0.05). 결론적으로 칼슘실리케이트 계열 재료로 치근단 역충전 시행 시, 혈액과 직접 접촉 또는 치아의 동요도가 발생할 가능성이 있는 의도적 치아 재식술 상황에서는 ProRoot MTA 또는 RetroMTA의 사용을 추천할 만하다.
Abstract
The purpose of this study was to investigate the effect of blood contact and tooth mobility on volumetric changes of calcium silicate-based root-end filling materials using a micro-CT. Three calcium silicate-based materials (ProRoot MTA, Biodentine, and RetroMTA) were used in this study. Seventy-two extracted human single-rooted premolars were obturated with gutta percha. Root-end resection and root-end preparation were performed. After root-end filling with tested materials, the tooth specimens were immersed in saline or blood for 5 days in a 37 ℃ incubator (n=8). The tooth specimens were mounted in a chewing simulator to simulate tooth mobility with a force of 30 N and 20,000 cycles. Micro-CT scans were performed immediately after root-end filling and after exposure to storage media or simulation of tooth mobility. The volume loss (%) was obtained from difference in the percentage of defects of materials between first and second micro-CT scans. Apical volume loss (%; volume loss from resected surface to 1 mm from the surface) was calculated for tooth mobility simulating groups. Biodentine showed larger total volume loss than ProRoot MTA and RetroMTA in saline and blood. ProRoot MTA had smaller total volume loss in blood than in saline. Under the condition simulating tooth mobility, total volume loss was similar among materials, and apical volume loss of Biodentine was larger than that of RetroMTA. In conclusion, ProRoot MTA or Retro MTA is recommended in clinical situation of intentional replantation where tooth mobility or direct contact with blood may occur.
Keywords:
Calcium silicate-based material, Volume loss, Micro-CT, Blood, Tooth mobility키워드:
칼슘실리케이트 계열 재료, 체적 감소, 마이크로 컴퓨터 단층 촬영, 혈액, 치아 동요도서 론
칼슘실리케이트 계열 재료(calcium silicate-based materials)는 생체친화성, 항균성, 우수한 밀폐성으로 말미암아 비외과적 및 외과적 근관치료, 생활치수치료 영역에서 폭넓게 사용되어 왔다(1, 2).
MTA (mineral trioxide aggregate)는 규산삼칼슘(tricalcium silicate), 규산이칼슘(dicalcium silicate), 알루민산삼칼슘(tricalcium aluminate), 기타 산화 광물(mineral oxide)로 구성되어 있으며, 특히 수분이 존재하는 환경에서 잘 경화되며 낮은 미세누출을 보인다(3, 4). 하지만 방사선 불투과성을 나타내도록 하기 위해 포함된 산화물(bismuth oxide)로 인한 변색, 조작의 어려움, 긴 경화시간 등의 단점도 있다(5-7). 특히, 긴 경화시간으로 인해 치근단 역충전 시 혈액이나 조직액에 의한 오염으로 재료의 물성이 저하될 가능성이 있으며, 이러한 가능성을 확인하기 위한 다양한 연구들이 진행된 바 있다. 혈액에 의한 오염이 MTA의 누출에 유의할 만한 영향을 끼치지 않았다는 연구 결과가 있으나(8), 다른 연구들에서는 혈액이나 조직액이 MTA의 경화를 방해하여 결합강도를 감소시키고 압축강도나 미세경도 등의 물성에 부정적인 영향을 끼친다는 보고도 있다(9-12). 이에 따라 MTA의 긴 경화시간을 단축함으로써 혈액 등으로 인한 오염이 물성에 미치는 영향을 최소화하기 위해 최근 새로운 칼슘실리케이트 계열 재료들이 개발되었는데, 대표적인 제품으로 Biodentine (Septodent, Saint-Maur-des-Faussés, France), RetroMTA (BioMTA, Seoul, Korea) 등이 있다. Biodentine은 2010년에 dentine substitute로 소개되며 등장한 bioactive calcium silicate-based cement로서 초기 경화시간은 6분, 최종 경화시간은 10.1분이다(13, 14). RetroMTA는 contrast media로 calcium zirconia complex를 포함하는 ZrO2-containing calcium aluminate cement로서 초기 경화시간은 3분이고 최종 경화시간은 360분이다(15).
혈액 오염이 치근단 역충전 재료의 물성에 미치는 영향과 함께 추가로 생각해 볼 수 있는 것은 치아의 동요도에 의한 영향이다. 의도적 치아 재식술 후 치아에 가해진 동요도에 의한 pumping 작용에 의해 치근단에 역충전된 재료가 씻겨 나갈 가능성이 있다(16). 그러나 실제로 치아 동요도가 역충전 재료에 미치는 영향에 대한 연구는 아직 보고된 바 없다.
비침습적으로 치아내부를 평가하는 방법으로 micro-CT 분석이 있으며 작은 시편의 3차원적 영상을 고해상도로 얻을 수 있는 장점이 있다. Micro-CT를 활용하여 재료의 체적 변화를 영상과 측정값으로 획득하여 용해도를 알 수 있으며(17, 18), 변연의 gap 및 내부 pore도 평가할 수 있다(19-24). 조직액이나 혈액 등과 접촉하는 다양한 환경 하에서 여러 치근단 역충전 재료의 체적 변화를 micro-CT로 비교한 연구는 드물고, 특히 RetroMTA의 용해도에 관한 연구는 매우 부족하다.
본 연구의 목적은 기존 MTA와 비교하여 빠른 경화시간을 나타내는 칼슘실리케이트 계열 재료로 치근단 역충전 시 재료의 혈액 접촉과 치아 동요도가 재료의 체적 변화에 미치는 영향을 micro-CT를 이용하여 분석하는 것이다. 귀무가설은 “첫째, 칼슘실리케이트 계열 치근단 역충전 재료의 경화 시 혈액 노출 유무에 따라 재료의 체적 변화의 차이가 없을 것이다. 둘째, 치아 동요도 재현 시 칼슘실리케이트 계열 치근단 역충전 재료의 체적 변화의 차이가 없을 것이다”로 설정하였다.
재료 및 방법
본 연구는 서울대학교 서울대학교치과병원 연구윤리심의위원회의 승인(IRB No.: CRI22003)을 받아 시행하였다.
1. 재료
본 연구에서는 3종의 칼슘실리케이트 계열 재료를 치근단 역충전에 사용하였다. 각 재료의 구성 성분 및 세부사항을 Table 1에 제시하였다. 본 연구에 사용된 사람의 혈액은 서울대학교치과병원 인체유래물은행에서 제공받았다.
2. 시편 준비
본 연구에서는 서울대학교치과병원 인체유래물은행에서 제공받은 발치된 사람의 상하악 소구치 72개를 이용하였다. 단일 치근이며 근첨이 완전히 발달된 치아를 선택하였으며, 치근에 균열, 우식, 흡수성 결함, 파절, 충전물이 있는 치아는 배제하였다. 치아는 4% Chloramine-T solution (Sigma-Aldrich, St. Louis, MO, USA)에 침적된 상태로 실험 전까지 4 ℃ 냉장 보관하였다.
근관와동형성 후 #15 K-file (MANI INC., Tochigi, Japan)로 apical patency를 확인하고 근관장을 설정하였다. 회전식 전동 니켈-티타늄(Ni-Ti) 근관성형기구(Profile; Dentsply Maillefer, Ballaigues, Switzerland)를 이용하여 근관 성형을 시행하고 각 단계마다 2 ml의 2.5% NaOCl 용액(Duksan Pure Chemicals Co. Ltd., Ansan, Korea)으로 근관 세척을 시행하였다. 근관 성형은 #40, 0.06 taper 기구로 마무리하였다. 근관을 건조시킨 후 gutta-percha cone (DiaDent, Cheongju, Korea)과 Ceraseal sealer (MetaBiomed, Cheongju, Korea)를 이용하여 근관 충전하였다. 와동 입구는 광중합형 복합레진(FiltekTM Z250; 3M ESPE, St. Paul, MN, USA)을 이용하여 충전하였다. 시편은 37 ℃, 100% 습도에서 1주일간 보관하였다.
주수 하에 diamond bur (ISO 198/018 MANI INC., Tochigi, Japan)를 이용하여 치아 장축에 수직 방향으로 치근단 3 mm를 절제한 후, tapered diamond bur (ISO 170/014 MANI INC., Tochigi, Japan)를 이용하여 3 mm 깊이의 치근단 와동을 형성하였다. 치근단 와동의 깊이를 균일하게 유지하기 위하여 bur가 와동 내부로 3 mm 삽입되도록 하였고, 치주낭 측정 기구 (Hu-Friedy, Chicago, IL, USA)를 이용하여 와동의 깊이를 확인하였다.
48개의 치아를 치근단 역충전 재료의 종류에 따라 무작위로 3개의 실험군으로 분류하고(Group 1: ProRoot MTA, Group 2: Biodentine, Group 3: RetroMTA) 제조사의 지시에 따라 각 재료를 혼합하여 치근단 와동에 역충전을 시행하였다.
각 실험군은 저장매체(생리식염수 또는 혈액)에 따라 8개씩 2개의 세부 실험군으로 분류하였다. 저장매체가 담긴 Eppendorf tube에 치아를 넣고 치근단 부위의 역충전 재료가 생리식염수 또는 혈액에 3 mm 깊이로 잠기도록 설정한 후 뚜껑을 닫고 37 ℃ incubator에서 5일 동안 보관하였다.
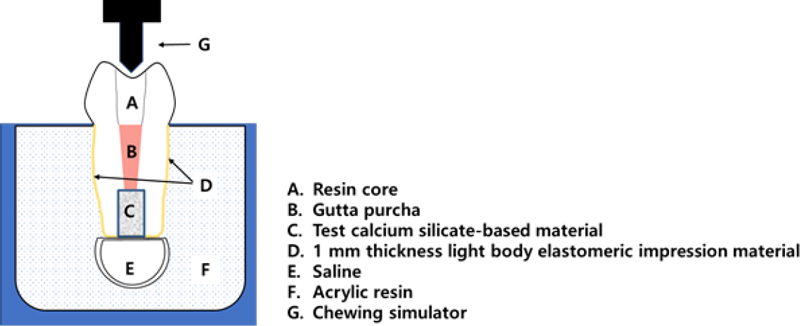
24개의 치아를 치근단 역충전 재료의 종류에 따라 무작위로 3개의 실험군으로 분류하였다(Group 1: ProRoot MTA, Group 2: Biodentine, Group 3: RetroMTA). 동요도 재현 실험 디자인은 치주인대를 모사한 Nawafleh의 연구를 일부 참고하였다(25). 치주인대의 공간을 재현하기 위하여 모델링 왁스(Crystal wax; Daedong Industry, Daegu, Korea)를 1 mm 두께로 치근 외면에 둘러싸고, 치근단 주위 공간을 재현하기 위하여 직경 1.2 cm의 구형 유틸리티 왁스(Utility wax; Daedong Industry, Daegu, Korea) 덩어리를 치근단에 부착하였다. 아크릴 레진(Ortho-Jet; Lang Dental, IL, USA)을 이용하여 백악법랑경계 하방 치근단 부위를 매몰하였고, 아크릴 레진 몰드가 완전히 경화된 후 치아를 몰드에서 탈거하고 치근 외면의 모델링 왁스를 제거하였다. Light-body 실리콘 인상재(Honigum Mono; DMG, Hamburg, Germany)를 아크릴 레진 몰드 내부에 형성된 치근 형태의 와동에 주입하고 치아를 즉시 재위치시켰다. 치근 외면의 모델링 왁스가 위치했던 부위는 light body 실리콘 인상재(periodontal ligament simulating material)로 대체되며, 이 실리콘 층이 아크릴 레진 몰드 내에서 치아의 움직임을 허용한다. 아크릴 레진 바닥면에 작은 홈을 형성하여 치근단의 유틸리티 왁스 덩어리를 제거하고 아크릴 레진을 소량 혼합하여 작은 홈의 겉표면을 보수하였다. 치아를 잠시 탈거하여 제조사의 지시에 따라 각 재료를 혼합하여 치근단 역충전을 시행하였다. 유틸리티 왁스를 제거한 빈 공간에 생리식염수를 채운 뒤 치근 형태의 와동에 치아를 다시 재위치시켰다(Figure 1). 매몰된 치아 시편을 저작 재현기(CS-4.8; SD Mechatronik, Feldkirchen-Westerham, Germany) 홀더에 고정한 후 수직으로 7 mm, 수평으로 2 mm의 운동 경로로 30 N의 수직적 힘을 가하였으며 10 mm/s의 속도로 20,000회의 교합을 시켰다. 동요도 재현이 끝난 시편은 생리식염수가 담긴 Eppendorf tube에 넣고 37 ℃ incubator에서 4일 동안 보관하였다.
3. Micro-CT 분석
치근단 역충전 재료의 체적 변화를 분석하기 위하여 micro-CT scanner (Skyscan 1272; Bruker, Kontich, Belgium)를 이용하였다. 각 시편에 대하여 치근단 역충전을 시행한 직후 첫 번째 스캔을 시행하였다. 치관 부위를 putty 인상재(Exafine putty; GC, Tokyo, Japan)로 잘 고정하고 위치 식별 표시를 하여 두 번째 스캔 시 방향의 변화가 일어나지 않도록 jig로 활용하였다. 촬영 조건은 80 kV, 125 µA, 1 mm thick Al filter, rotation step 0.6°, pixel size 12 µm로 설정하였다. NRecon software (NRecon V.1.7.4.2; Bruker, Kontich, Belgium)를 이용하여 이미지를 재구성하였고 CTAn software (CTAn V. 1.18.8.0+; Bruker, Kontich, Belgium)로 체적을 분석하였다. 영상 이진화 과정(binarization with thresholding)을 통해 역충전 재료와 전체 기포의 영역을 구분 지어 체적을 계산하였다. CTvol software (CTvol V. 2.3.2.0; Bruker, Kontich, Belgium)를 이용하여 시편의 삼차원적 이미지를 구현하였다(Figure 2).

Representative micro-CT images of Biodentine (a) before and (b) after exposure to blood. (c) Representative 3D reconstructions of root-end filling material evaluated after exposure to blood. The gray cylinder shapes represent the filling materials, and the orange dots represent the overall defects of the root-end fillings.
각 시편에 대하여 저장매체 노출 및 동요도 재현 이후 micro-CT 스캔을 다시 한번 시행하였다. 첫 번째 스캔 시 산출한 체적과 두 번째 스캔 시 산출한 체적의 차이를 계산하여 치근단 역충전 재료의 total volume loss (%)를 구하였다. 동요도 재현 실험에서는 재료의 total volume loss (%)와 함께 치근단으로부터 1 mm 떨어진 부위 까지의 volume loss (%; apical volume loss)도 추가로 계산하였다(Figure 2a and 2b).
4. 통계 분석
치근단 역충전 재료 간의 total volume loss 차이를 분석하기 위하여 Kruskal-Wallis test를 시행하였으며 저장 매체 간의 total volume loss 차이를 분석하기 위하여 Mann-Whitnet U test를 시행하였다. 통계분석은 SPSS software version 26.0 (IBM, Armonk, NY, USA)를 이용하였으며, 검정을 위한 유의수준은 5%로 설정하였다.
결 과
1. 저장 매체의 차이에 따른 치근단 역충전 재료의 volume loss 변화
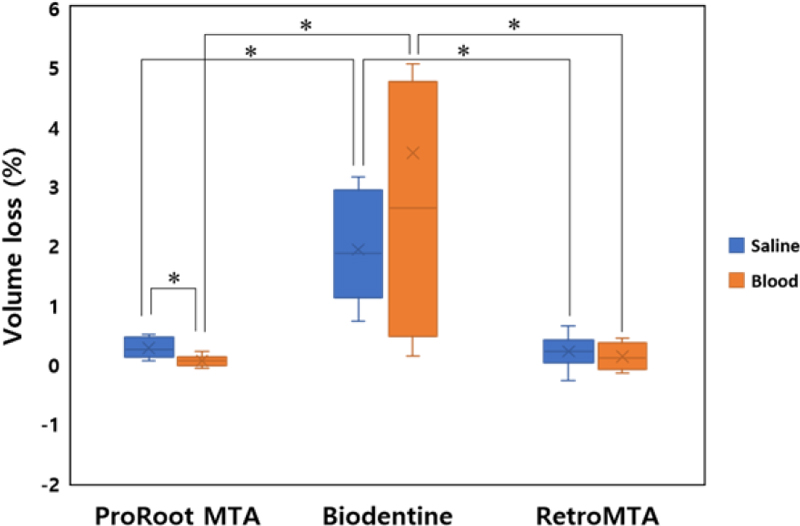
치근단 역충전 재료를 생리식염수 또는 혈액에 노출 시 total volume loss는 두 경우 모두에서 Biodentine이 가장 컸다(p<0.05; Table 2, Figure 3). ProRoot MTA는 혈액에 노출 시 생리식염수에 노출 시보다 유의하게 낮은 volume loss를 보였다(p<0.05; Table 2, Figure 3). Biodentine과 RetroMTA는 저장매체에 따른 total volume loss의 유의한 차이가 관찰되지 않았다(p>0.05; Table 2, Figure 3).
Total volume loss (%) of calcium silicate-based materials with different environments (saline or blood)
2. 동요도 재현에 따른 치근단 역충전 재료의 volume loss 변화
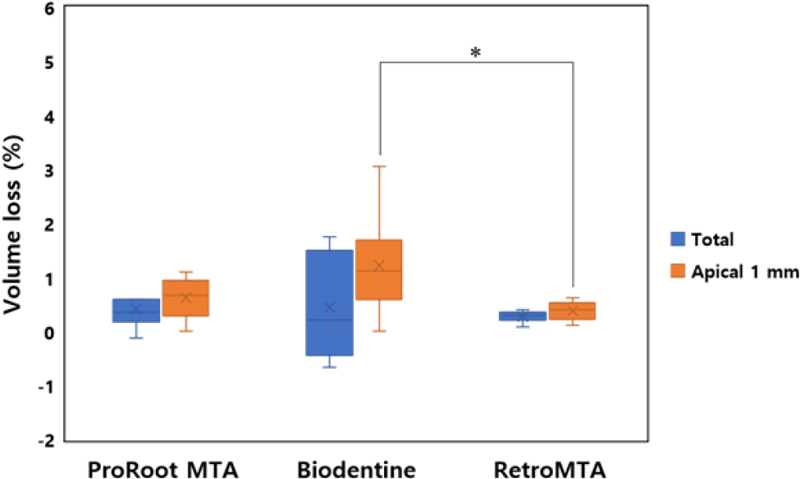
동요도가 재현된 조건 하에서 total volume loss는 재료 간에 유의한 차이를 보이지 않았다(p>0.05; Table 3, Figure 4). 치근단으로부터 1 mm 떨어진 부위까지의 volume loss (apical volume loss)는 Biodentine, ProRoot MTA, RetroMTA 순서로 감소하였고, 통계적으로 유의한 차이는 Biodentine과 RetroMTA 사이에서만 관찰되었다(p<0.05; Table 3, Figure 4).

Total and apical (1 mm from resected root surface) volume loss (%) under the condition simulating tooth mobility
고 찰
외과적 근관치료에서 치근단 역충전 재료의 변연봉쇄능은 세균의 성장을 막기 위한 중요한 요소이다. 근관벽과 치근단 역충전 재료 사이에 gap이 형성되고, 역충전재료의 체적 안정성이 낮으며, 재료 자체가 유실된다면 세균에 의한 재감염이 발생할 수 있다(26). 따라서 본 연구에서는 칼슘실리케이트 계열 치근단 역충전 재료의 물리적 특성 중 체적의 변화를 비교 분석하였다.
용해도는 재료의 적합성을 검증하기 위한 중요한 요소이다. 용해도와 기포는 서로 연관이 있으며(27), 기포가 많은 것은 반응이 활발하고 활성이온을 유리하는 능력이 우수한 것을 의미하지만 누출이 가능한 공간과 통로를 생성하여 재료의 밀폐능과 변연적합성에는 좋지 않은 결과를 초래한다(28). 재료의 용해도를 측정하는 방법으로 International Organization for Standardization (ISO) 6876:2001에 의한 방법이 있으나(29), 본 연구에서는 micro-CT로 스캔한 3차원적 영상에서 체적을 분석하는 방법을 이용하였다. 이 방법은 물의 함량을 제외하고 방사선 불투과성의 재료만을 평가한다는 점이 큰 장점이며(30), 치근단 역충전 재료와 근관벽 사이의 공간, 재료 내부의 기포, 재료의 체적 등을 gray scale 값에 근거하여 3차원적으로 평가할 수 있으며, 비침습적이고 반복 재현이 가능하다(21).
Biodentine의 용해도에 관한 연구 결과는 논쟁의 여지가 있다. Gandolfi 등(31)은 Biodentine의 용해도가 ProRoot MTA, MTA Angelus 그리고 MTA Plus보다 낮았다고 보고한 반면, 다른 연구들에서는 Biodentine의 용해도가 ProRoot MTA보다 높다는 결과를 보여주었다(27, 32, 33). 본 연구에서 Biodentine은 ProRoot MTA와 RetroMTA에 비해 높은 total volume loss값을 보였다. Micro-CT 영상에 의하면 Biodentine의 경우 저장매체와 접촉했던 치근단 부위에서 재료의 탈락과 새로운 기포의 형성이 두드러지게 관찰되었다.
ProRoot MTA의 경우 생리식염수에 노출시킨 군보다 혈액에 노출시킨 군에서 total volume loss (%)가 유의하게 더 작았다. MTA가 인산(phosphate)과 반응하면 MTA 표면에 결정이 생성된다(34). Sarkar 등은 MTA가 PBS (phosphate bufferd saline) 용액에 노출되었을 때 생성되는 구형 침전물이 hydroxyapatite와 유사하며, 이 침전물은 MTA와 상아질 벽 사이의 공간을 채워 mechanical sealing 뿐 아니라 chemical bonding까지 형성한다고 하였다(35). MTA의 경화 과정 동안 형성된 apatite 결정은 재료와 상아질 계면의 콜라겐 섬유를 따라 침착되어 mechanical bonding에 기여하는 tag-like structure를 형성한다(36). Gandolfi 등은 ProRoot MTA로 제작한 disk를 PBS용액에 침적하였을 때, 침전물의 형성이 비교적 빠르게 나타나 apatite 결정의 응집이 5시간 정도에도 관찰되었고, 점점 균일해지면서 7일 째에는 그 두께가 더 증가했다고 하였다(37). 본 연구에서는 사람의 혈액에 역충전 재료를 노출시켰으며, 혈액의 인산 농도(1 mM) (38)는 PBS의 인산 농도(9-10 mM) (36)보다 낮지만, 혈액에 포함되어 있는 인산이 ProRoot MTA와 반응하면서 apatite 결정이 형성되어 total volume loss가 작게 나타났을 가능성이 있다.
반면, Biodentine과 RetroMTA에서 생리식염수에 노출 시와 혈액에 노출 시 total volume loss에 유의한 차이를 보이지 않은 것은 두 재료의 빠른 경화시간 때문일 것이다. 혈액에 재료가 노출 시 재료 표면의 손실은 혈액에 의해 칼슘실리케이트 시멘트의 수화반응 및 결정 구조의 형성이 억제되어 재료가 경화되지 못하기 때문이며(10), 혈액의 단백질이 결정 응집 부분에 부착되어 수화를 방해할 수 있다(39). 따라서 ProRoot MTA에 비해 빠른 경화시간을 보이는 Biodentine과 RetroMTA의 경우 빠른 수화반응이 표면의 응결을 초래하여 혈액에 노출 시 수화 반응이 방해되는 부위가 감소하여 결과적으로 volume loss에 유의한 차이가 발생하지 않았을 것이다.
의도적 치아 재식술은 비외과적 근관 치료와 치근단 수술이 실패했을 때 고려해볼 수 있는 치료 술식으로서 치아를 의도적으로 발치하여 치근단 부위를 절제 후 역충전하고 재식하는 술식이다(40). 의도적 치아 재식술 시 역충전 재료는 혈액에 의한 오염 및 초기 동요도에 의해 영향을 받을 수 있다. 경화시간이 긴 gray MTA를 이용하여 역충전한 후 병소가 재발하여 실패한 증례가 보고된 바 있으며, 치아의 동요도가 불가피한 의도적 치아 재식술에서는 경화가 빠른 MTA를 사용하는 것이 술 후 MTA의 손실을 방지하는 데 유리할 수 있다(16).
저작력의 생리적인 범위는 10 N에서 120 N 사이이며(41, 42), 이전 연구에서 50,000회(43), 250,000회(44), 800,000회(45) 등의 저작 횟수를 1년 평균으로 가정하였다. 이러한 문헌들을 참고하여 본 연구에서는 구강 내 저작 환경을 재현하기 위하여 치아 시편에 30 N의 수직적 힘을 가하였으며, 1개월 동안의 평균 저작 횟수를 고려하여 20,000회의 반복 하중을 가하였다. 의도적 치아 재식술 이후 치주인대의 회복은 조직학적 또는 동요도 시험으로 검증해 보았을 때, 2-4주 후에는 거의 완성된다고 하였다(46). 따라서 치아의 동요도는 2-4주 간 지속될 수 있으며, 치주인대의 회복기간 동안 재식 치아에 가급적 저작력이 가해지지 않도록 주의를 기울인다 하더라도 해당 치아에 가해지는 하중을 모두 피하기는 어렵다. 따라서 30 N으로 20,000회의 반복하중을 가한 것은 의도적 치아 재식술 이후 일정기간 동안 발생할 수 있는 치아의 동요도를 재현하기에 적합한 실험 조건이라고 할 수 있다.
In vitro 연구에서 치주인대를 모방하기 위하여 다양한 방법과 재료들이 사용되어 왔는데 그 중에서도 가장 흔히 사용되는 방법은 본 연구에 사용된 ‘Transitional wax technique’으로 치근 주위를 감쌌던 일정 두께의 왁스(transitional isolating material)를 light-body 실리콘 인상재(periodontal ligament simulating material)로 대체하는 방식이다(25, 47). 본 연구에서는 치아의 생리적인 동요도가 아닌 의도적 치아 재식술 이후의 불규칙적인 동요도를 재현하고자 하였기 때문에 왁스의 두께를 1 mm로 임의 설정하였으며, 치근 주변 인공 치주인대의 두께의 균일함과 정밀함이 필수적으로 요구되지는 않는다. 그러나 치근단 병소에 해당하는 공간을 부여해야 하는 부가적인 조건이 요구되므로 향후 치근단 부위에 역충전을 시행한 치아에 발생하는 동요도를 재현하기 위한 더욱 정형화된 모델 고안이 필요할 것이다.
동요도에 의한 치근단 역충전 재료의 체적 변화에 대한 연구 결과는 전무하다. 경화 시간이 긴 ProRoot MTA의 경우 경화가 불완전한 시기에 가해진 동요도에 의해 재료의 용해나 탈락이 있을 것으로 예상하였지만 세 종류의 재료 사이에 동요도에 의한 total volume loss는 유의한 차이를 보이지 않았다. 전체 깊이의 재료 중에서도 특히 치근단 부위의 재료가 씻겨 나갈 가능성이 있으므로 치근단으로부터 1 mm 떨어진 부위 까지의 volume loss (apical volume loss)를 별도로 계산하였고 그 결과, RetroMTA가 Biodentine에 비하여 apical volume loss가 유의하게 작았다. 이를 통해, 교합면에 저작력을 가하여 모사한 치아의 동요도는 치근단 부위의 역충전 재료 체적 변화에 영향을 줄 수 있음을 유추해볼 수 있으며, 재료간 차이도 유발할 가능성에 대한 고려도 필요하다.
이로써, 본 연구의 첫 번째 귀무가설인 “칼슘실리케이트 계열 치근단 역충전 재료의 경화 시 혈액 노출 유무에 따라 재료의 체적 변화의 차이가 없을 것이다”와 두 번째 귀무가설인 “치아 동요도 재현 시 칼슘실리케이트 계열 치근단 역충전 재료의 체적 변화의 차이가 없을 것이다”는 기각되었다.
본 연구에서는 상아질과 치근단 역충전 재료 간의 상호 영향을 고려하여 발치된 사람치아에서 진행하였다(48). 그러나, 발치된 치아의 해부학적인 형태 차이로 인해 치근단 와동의 모양과 크기에 있어 차이가 발생할 수밖에 없으므로 재료 충전 과정에서의 오차 및 재료와 와동벽 사이의 접촉 면적에 차이에 의한 오차가 발생했을 가능성이 있다. 또한, micro-CT 분석 시 threshold를 설정하는 과정에서도 오차가 발생할 수 있다. 따라서 micro-CT 분석 시 적절한 방사선 불투과도를 가지면서 치근단 와동의 모양 및 크기를 일정하게 재현할 수 있는 치아 모사 시편을 개발하여 치근단 역충전 재료에 대하여 혈액과 접촉 시 영향 및 치아 동요도에 대한 영향에 대한 후속 연구를 진행할 필요가 있다. 본 연구는 치근단 역충전 재료의 경화 시 체적 변화에 대해 치아 동요도를 재현하는 실험적 모델의 첫 시도로서 향후 치아에 가해지는 동요도를 보다 임상 상황과 유사하게 모사하기 위한 추가적인 고찰도 필요할 것으로 사료된다.
결 론
In vitro 연구의 한계 내에서 칼슘실리케이트 계열 재료로 치근단 역충전 시행 시 Biodentine보다 ProRoot MTA와 RetroMTA가 경화 전후의 체적 변화가 더 작았다. 특히, ProRoot MTA는 혈액과 접촉한 경우에 더욱 우수한 체적안정성을 보였다. 혈액과 직접 접촉하며 치아의 동요도에 가해지는 의도적 치아 재식술 상황에서는 ProRoot MTA 또는 RetroMTA의 사용을 추천할 만하다.
Acknowledgments
이 논문은 서울대학교치과병원 원내연구과제 연구비 지원에 의해 이루어진 것임(과제번호 08-2021-0015).
본 연구에 사용된 인체자원과 데이터는 한국인체자원은행 네트워크의 일원인 서울대학교치과병원 인체유래물은행에서 제공받았음.
References
-
Torabinejad M, Parirokh M. Mineral trioxide aggregate: a comprehensive literature review--part II: leakage and biocompatibility investigations. J Endod. 2010;36(2):190-202.
[https://doi.org/10.1016/j.joen.2009.09.010]

-
Camilleri JP. Evaluation of the Effect of Intrinsic Material Properties and Ambient Conditions on the Dimensional Stability of White Mineral Trioxide Aggregate and Portland Cement. J Endod. 2011;37(2):239-45.
[https://doi.org/10.1016/j.joen.2010.11.012]

-
Torabinejad M, Hong CU, McDonald F, Pitt Ford TR. Physical and chemical properties of a new root-end filling material. J Endod. 1995;21(7):349-53.
[https://doi.org/10.1016/S0099-2399(06)80967-2]

-
Torabinejad M, Watson TF, Pitt Ford TR. Sealing ability of a mineral trioxide aggregate when used as a root end filling material. J Endod. 1993;19(12):591-5.
[https://doi.org/10.1016/S0099-2399(06)80271-2]

-
Parirokh M, Torabinejad M. Mineral Trioxide Aggregate: A Comprehensive Literature Review—Part III: Clinical Applications, Drawbacks, and Mechanism of Action. J Endod. 2010;36(3):400-13.
[https://doi.org/10.1016/j.joen.2009.09.009]

-
Islam I, Kheng Chng H, Jin Yap AU. Comparison of the Physical and Mechanical Properties of MTA and Portland Cement. J Endod. 2006;32(3):193-7.
[https://doi.org/10.1016/j.joen.2005.10.043]

-
Marciano MA, Costa RM, Camilleri J, Mondelli RFL, Guimarães BM, Duarte MAH. Assessment of Color Stability of White Mineral Trioxide Aggregate Angelus and Bismuth Oxide in Contact with Tooth Structure. J Endod. 2014;40(8):1235-40.
[https://doi.org/10.1016/j.joen.2014.01.044]

-
Torabinejad M, Higa RK, McKendry DJ, Pitt Ford TR. Dye leakage of four root end filling materials: effects of blood contamination. J Endod. 1994;20(4):159-63.
[https://doi.org/10.1016/S0099-2399(06)80326-2]

-
Kim Y, Kim S, Shin YS, Jung IY, Lee SJ. Failure of setting of mineral trioxide aggregate in the presence of fetal bovine serum and its prevention. J Endod. 2012;38(4):536-40.
[https://doi.org/10.1016/j.joen.2011.12.005]

-
Nekoofar MH, Stone DF, Dummer PMH. The effect of blood contamination on the compressive strength and surface microstructure of mineral trioxide aggregate: Effect of blood on MTA. Int Endod J. 2010;43(9):782-91.
[https://doi.org/10.1111/j.1365-2591.2010.01745.x]

-
Song M, Yue W, Kim S, Kim W, Kim Y, Kim J-W, et al. The effect of human blood on the setting and surface micro-hardness of calcium silicate cements. Clin Oral Investig. 2016;20(8):1997-2005.
[https://doi.org/10.1007/s00784-015-1693-z]

-
VanderWeele RA, Schwartz SA, Beeson TJ. Effect of Blood Contamination on Retention Characteristics of MTA When Mixed With Different Liquids. J Endod. 2006;32(5):421-4.
[https://doi.org/10.1016/j.joen.2005.09.007]

- Septodont. Biodentine active biosilicate technology: scientific file. Saint-Maur-Des-Fosses Cedex, France: R&D Department, Septodont. 2010.
-
Malkondu O, Kazandag MK, Kazazoglu E. A Review on Biodentine, a Contemporary Dentine Replacement and Repair Material. Biomed Res Int. 2014;2014:160951.
[https://doi.org/10.1155/2014/160951]

- RetroMTA Assessment service: Available from URL: http://www.biomta.com/shop/eng/product_5.php, (Accessed on May 26, 2023).
-
Cho S-Y, Lee Y, Shin S-J, Kim E, Jung I-Y, Friedman S, et al. Retention and Healing Outcomes after Intentional Replantation. J Endod. 2016;42(6):909-15.
[https://doi.org/10.1016/j.joen.2016.03.006]

-
Akinci L, Simsek N, Aydinbelge HA. Physical properties of MTA, BioAggregate and Biodentine in simulated conditions: A micro-CT analysis. Dent Mater J. 2020;39(4):601-7.
[https://doi.org/10.4012/dmj.2018-429]

-
Kwon SY, Seo M-S. Comparative evaluation of volumetric changes of three different retrograde calcium silicate materials placed under different pH condititions. BMC Oral Health. 2020;20(1):330.
[https://doi.org/10.1186/s12903-020-01325-x]

-
Dinçer AN, Güneşer MB, Sisli SN. Micro‐CT analysis of the marginal adaptation and porosity associated with ultrasonic activation of coronally placed tricalcium silicate‐based cements. Aust Endod J. 2020;46(3):323-9.
[https://doi.org/10.1111/aej.12422]

-
Jardine AP, Rosa KFV, Matoso FB, Quintana RM, Grazziotin-Soares R, Kopper PMP. Marginal gaps and internal voids after root-end filling using three calcium silicate-based materials: A Micro-CT analysis. Braz Dent J. 2021;32(4):1-7.
[https://doi.org/10.1590/0103-6440202104096]

-
Kim SY, Kim HC, Shin SJ, Kim E. Comparison of Gap Volume after Retrofilling Using 4 Different Filling Materials: Evaluation by Micro-computed Tomography. J Endod. 2018;44(4):635-8.
[https://doi.org/10.1016/j.joen.2017.11.009]

-
Tanomaru-Filho M, Espir CG, Nogueira KCT, Torres FFE, Guerreiro-Tanomaru JM. Micro-CT analysis of filling ability and porosity of root-end filling materials. Rev odontol UNESP. 2017;46(6):362-7.
[https://doi.org/10.1590/1807-2577.06517]

-
Torres FFE, Jacobs R, EzEldeen M, Guerreiro-Tanomaru JM, dos Santos BC, Lucas-Oliveira É, et al. Micro-computed tomography high resolution evaluation of dimensional and morphological changes of 3 root-end filling materials in simulated physiological conditions. J Mater Sci Mater Med. 2020;31(2):14.
[https://doi.org/10.1007/s10856-019-6355-2]

-
Vergaças JHN, Lima CO, Barbosa AFA, Vieira VTL, Santos Antunes H, Silva EJNL. Marginal gaps and voids of three root‐end filling materials: A microcomputed tomographic study. Microsc Res Tech. 2022;85(2):617-22.
[https://doi.org/10.1002/jemt.23935]

-
Nawafleh N, Bibars AR, Elshiyab S, Janzeer Y. In vitro Simulation of Periodontal Ligament in Fatigue Testing of Dental Crowns. Eur J Dent. 2020;14(3):380-5.
[https://doi.org/10.1055/s-0040-1713953]

-
Torabinejad M, Rastegar AF, Kettering JD, Pitt Ford TR. Bacterial leakage of mineral trioxide aggregate as a root-end flling material. J Endod. 1995;21(3):109–12.
[https://doi.org/10.1016/S0099-2399(06)80433-4]

-
Torres FFE, Guerreiro-Tanomaru JM, Bosso-Martelo R, Chavez-Andrade GM, Tanomaru Filho M. Solubility, porosity and fluid uptake of calcium silicate-based cements. J Appl Oral Sci. 2018;26:e20170465.
[https://doi.org/10.1590/1678-7757-2017-0465]

-
Prati C, Gandolfi MG. Calcium silicate bioactive cements: Biological perspectives and clinical applications. Dent Mater. 2015;31(4):351-70.
[https://doi.org/10.1016/j.dental.2015.01.004]

- International Organization for Standardization. Specification for dental root canal sealing materials: ISO 6876:2001. Geneva: International Organization for Standardization; 2001.
-
Canali LCF, Morais CAHd, Cavenago BC, Vivan RR, Duarte MAH. Influence of contact with blood and saline on solubility, pH and chemical composition of MTA. Dent Press Endod. 2016;6(3):41-5.
[https://doi.org/10.14436/2358-2545.6.3.041-045.oar]

-
Gandolfi MG, Siboni F, Botero T, Bossù M, Riccitiello F, Prati C. Calcium Silicate and Calcium Hydroxide Materials for Pulp Capping: Biointeractivity, Porosity, Solubility and Bioactivity of Current Formulations. J Appl Biomater Funct Mater. 2015;13(1):43-60.
[https://doi.org/10.5301/jabfm.5000201]

-
Dawood AE, Manton DJ, Parashos P, Wong R, Palamara J, Stanton DP, et al. The physical properties and ion release of CPP-ACP-modified calcium silicate-based cements. Aust Dent J. 2015;60(4):434-44.
[https://doi.org/10.1111/adj.12255]

-
Singh S, Podar R, Dadu S, Kulkarni G, Purba R. Solubility of a new calcium silicate-based root-end filling material. J Conserv Dent. 2015;18(2):149-53.
[https://doi.org/10.4103/0972-0707.153053]

-
Camilleri J, Montesin FE, Brady K, Sweeney R, Curtis RV, Ford TRP. The constitution of mineral trioxide aggregate. Dent Mater. 2005;21(4):297-303.
[https://doi.org/10.1016/j.dental.2004.05.010]

-
Sarkar NK, Caicedo R, Ritwik P, Moiseyeva R, Kawashima I. Physicochemical Basis of the Biologic Properties of Mineral Trioxide Aggregate. J Endod. 2005;31(2):97-100.
[https://doi.org/10.1097/01.DON.0000133155.04468.41]

-
Reyes-Carmona JF, Felippe MS, Felippe WT. Biomineralization Ability and Interaction of Mineral Trioxide Aggregate and White Portland Cement With Dentin in a Phosphate-containing Fluid. J Endod. 2009;35(5):731-6.
[https://doi.org/10.1016/j.joen.2009.02.011]

-
Gandolfi MG, Taddei P, Tinti A, Prati C. Apatite-forming ability (bioactivity) of ProRoot MTA. Int Endod J. 2010;43(10):917-29.
[https://doi.org/10.1111/j.1365-2591.2010.01768.x]

-
Kokubo T, Takadama H. How useful is SBF in predicting in vivo bone bioactivity? Biomaterials. 2006;27(15):2907-15.
[https://doi.org/10.1016/j.biomaterials.2006.01.017]

-
Gandolfi MG, Iacono F, Agee K, Siboni F, Tay F, Pashley DH, et al. Setting time and expansion in different soaking media of experimental accelerated calcium-silicate cements and ProRoot MTA. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009;108(6):e39-e45.
[https://doi.org/10.1016/j.tripleo.2009.07.039]

-
Bender IB, Rossman LE. Intentional replantation of endodontically treated teeth. Oral Surg Oral Med Oral Pathol. 1993;76(5):623-30.
[https://doi.org/10.1016/0030-4220(93)90073-D]

-
Kohyama K, Hatakeyama E, Sasaki T, Dan H, Azuma T, Karita K. Effects of sample hardness on human chewing force: a model study using silicone rubber. Arch Oral Biol. 2004;49(10):805-16.
[https://doi.org/10.1016/j.archoralbio.2004.04.006]

-
Schindler HJ, Stengel E, Spiess WEL. Feedback control during mastication of solid food textures—a clinical-experimental study. J Prosthet Dent. 1998;80(3):330-6.
[https://doi.org/10.1016/S0022-3913(98)70134-9]

-
Hakimeh S, Vaidyanathan J, Houpt ML, Vaidyanathan TK, Von Hagen S. Microleakage of compomer Class V restorations: Effect of load cycling, thermal cycling, and cavity shape differences. J Prosthet Dent. 2000;83(2):194-203.
[https://doi.org/10.1016/S0022-3913(00)80012-8]

-
Outhwaite WC, Twiggs SW, Fairhurst CW, King GE. Slots vs. Pins: A Comparison of Retention Under Simulated Chewing Stresses. J Dent Res. 1982;61(2):400-2.
[https://doi.org/10.1177/00220345820610020701]

-
Winkler S, Ring K, Ring JD, Boberick KG. Implant screw mechanics and the settling effect: overview. J Oral Implantol. 2003;29(5):242-5.
[https://doi.org/10.1563/1548-1336(2003)029<0242:ISMATS>2.3.CO;2]

- Andreasen JO. A time-related study of periodontal healing and root resorption activity after replantation of mature permanent incisors in monkeys. Swed Dent J. 1980;4(3):101-10.
- AlZahrani F, Richards L. Micro-CT evaluation of a novel periodontal ligament simulation technique for dental experimental models. Arch Orofac Sci. 2018;13(2):93-103.
- Camps J, Pashley DH. Buffering action of human dentin in vitro. J Adhes Dent. 2000;2(1):39-50.