사람구강점막모델 이용 안전성 평가를 위한 치과재료의 용출액 분석
Abstract
Various methods of the extraction test is currently available for the biological safety evaluation of dental materials. Hence, setting of the appropriate extraction conditions such as extraction media appropriate to the materials, extraction temperature, and extraction time would be required. In this study, analysis of the dental materials that is used while in contact with oral mucosa was carried out in term of their selections, sample preparations, extraction, in order to provide the foundation for the biological safety evaluation of medical devices that is alternative to the animal studies. Dental materials of restorative composite resin, chemical cured denture base resin, and polyvinyl siloxane impression materials were selected and the SPU-ZDEC (Zinc diethyldithiocarbamate) was used as the positive control. They were all extracted according to the ISO 10993-12. Visual inspection, pH meter, Ultimate 3000 UHPLC, UltraflexⅢ TOF/TOF, and UPLC were used as the method of extracted solution analysis. As the results, there was no foreign materials nor impurities in all of test samples during visual inspection of the appearance. The pH was near the neutral value of 7, except for the restorative composite resin and the blank test solution. Finally, the detailed analysis of extracted solution showed evidence of main components of materials such as bisphenol A glycerolate dimethacrylate, diurethane dimethacrylate, triethylene glycol dimethacrylate, and zinc diethyldithiocarbamate. The result of this study will provide useful information on safety evaluation of tested materials including the sample preparation method for the alternative test method to animal study such as mucosa irritation test.
Keywords:
Dental materials, Extraction, Human oral mucosa model, Medical devices1. 서 론
의료기기는 한국 식품의약품안전처의 ‘의료기기 품목 및 품목별 등급에 관한 규정’에 따라 기구·기계, 의료용품, 치과 재료 그리고 체외진단용 시약으로 분류된다(식품의약품안전처, 2014). 이 중 일부 치과재료는 구강 내에서 장기적으로 구강점막과 직접 접촉하여 사용되기 때문에 생물학적 안전성 평가 연구에 있어서 신중을 기해야 한다.
구강점막과 접촉하는 의료기기의 자극성 및 감작성 평가를 수행하기 위해서는 국제적으로 공인된 ISO 10993-10 (2010)의 Biological evaluation of medical devices – Part 10: Tests for irritation and skin sensitization 중 부록 B.3 Oral mucosa irritation test의 햄스터를 이용한 구강점막자극시험을 실시한다. 이 방법은 햄스터의 볼 주머니에 재료를 적용한 후, 구강 점막에 나타나는 홍반이나 부종과 같은 이상반응을 관찰하고 실험동물을 희생하여 조직학적 평가를 시행함으로써 재료의 자극성 및 감작성을 평가한다. 그러나 실험을 당하는 햄스터에게는 극심한 고통과 스트레스를 수반하는 윤리적인 한계점을 갖고 있다(ISO 10993-10, 2010).
최근에는 위와 같은 실험동물에 대한 윤리적인 한계점을 개선하고자 실험동물 수의 감소(Reduction), 동물의 고통 경감(Refinement), 실험동물 대체(Replacement)와 같은 3R원칙이 제안되었고, 유럽 및 미국을 포함한 선진국을 중심으로 동물복지 향상에 대한 인식 증가와 동물실험대체시험법 연구가 활발히 진행되었다(Russell과 Burch, 1959). 특히 유럽에서는 화장품을 중심으로 피부자극시험(OECD Test Guidelines 439, 2013), 안점막 자극시험 및 광독성 시험 등에 대한 동물실험 대체 연구가 진행되어 현재 국제적으로도 공인되는 다양한 시험법들이 제안되고 있는 추세이다(Hagino 등, 2008). 이러한 움직임은 화장품 산업을 넘어 의료기기 및 의약품 분야까지 확장되었고, 이 중 의료기기에 대한 대체시험법 필요성이 점차 두각 되고 있다.
현재 구강점막자극시험의 동물대체시험법으로 민달팽이 점막을 이용하는 방법이 연구되고 있으나 아직까지 실험실 차원의 접근에 불과한 실정이다(Lenoir 등, 2011). 이에 국외에서는 인공구강점막모델을 개발하여 의료기기의 자극성 시험을 진행한 사례가 있으나 이 또한 개발 단계로서 의료기기에 대한 검증된 구체적인 시험법은 전무한 실정이다(Nathalie 등, 2010). 따라서 향후 동물대체시험법을 이용한 의료기기 안전성 평가 연구의 요구 및 의료기기 동물대체시험법에 대한 필요성 증가에 대비하여 인체구강점막모델을 이용한 안전성 평가 연구의 기초 자료를 마련해야 한다.
인체구강점막모델은 구강점막세포를 이용한 3차원 배양조직의 인공구강점막조직으로서 생체 외 실험으로 구강점막 독성시험이 가능한 방법으로 소개되고 있다. 이 제품을 이용하여 치약, 구강 양치액, 치아 미백제 등에 관한 독성시험을 진행한 결과 재현성이 높은 결과를 나타낸 보고도 있었다(Mitchell 등, 2007).
이와 같은 모델에 치과재료를 적용할 수 있는 방법으로는 ISO 10993-10 (2010)과 같이 시편을 제작하여 모델에 직접적으로 접촉시키는 방법과 ISO 10993-12 (2012)와 같이 특정 용매에 용출시켜 용출액을 모델에 간접적으로 접촉시키는 방법이 있다. 이때 간접적으로 적용하는 용출액 중 일부 치과재료의 용출액에는 독성성분이 용출되어 안전성에 영향을 줄 수 있다는 선행보고에(Polydorou 등, 2007) 의거하여 용출액 분석은 독성평가를 연구하는데 있어서 중요한 요소가 될 수 있다.
따라서 본 연구의 목적은 의료기기 중 구강 점막에 지속적 혹은 다 빈도로 닿을 수 있는 대표적인 치과재료 3종, 심미수복용 복합레진, 화학중합형 의치상용레진, 폴리비닐실록산 인상재를 선택하여 증류수에 일정 시간 동안 침적시키고, 이때 용출된 용출액의 성상, 용출 전·후의 pH변화, 용출액 내의 성분을 분석함으로써 실제로 관심 물질이 용출되었는지 확인하여, 치과재료의 안전성 평가를 위한 구강점막자극 동물대체시험법 기반 마련을 위한 기초자료를 제공하는데 있다.
Ⅱ. 재료 및 방법
1. 실험재료
실험재료는 치과재료 중 구강점막에 지속적 혹은 다 빈도로 닿을 수 있는 대표적인 치과재료 3종 심미수복용 복합레진, 화학중합형 의치상용레진, 폴리비닐실록산 인상재를 실험 대상으로 선정하였고, 부가적으로 의료기기의 생물학적 안전성 평가시 음성대조물질로 사용되는 Polye- thylene film과 양성대조물질로 사용되는 SPU-ZDEC(Zinc diethyldithiocarbamate)도 함께 실험 대상으로 선택하였다(Table 1).
2. 실험방법
3종의 치과재료(심미수복용 복합레진, 화학중합형 의치상용레진, 폴리비닐실록산 인상재) 시편을 제작하기 위해 테프론 소재의 내경 7 ㎜, 높이 1 ㎜의 몰드를 준비하였다.
심미수복용 복합레진의 경우 slide glass에 polyester film을 놓고 그 위에 몰드를 올린 뒤 재료를 몰드 안에 약간 넘치게 채운 후, polyester film과 slide glass를 덮고 clamp를 이용하여 조여 주었다. 제조사의 지시사항에 따라 앞·뒤면 모두 광조사기(Eliper™ S10, 3M ESPE, Seefeld, Germany)를 이용하여 광조사를 시행하는데, 이 때 광조사는 부위 당 20초씩 앞·뒤면 10부위를 중첩하여 시행하였다. 중합된 시편은 몰드로부터 분리하여 지름 7 ㎜, 높이 1 ㎜의 시편을 얻었다.
화학중합형 의치상용레진의 경우 제조사가 제시한 비율(1.7 g powder / 1 ㎖ liquid)을 바탕으로 시편제작에 필요한 분말과 액을 각각 개량하여 준비하였다. 개량된 liquid와 powder를 플라스틱 스파튤라를 이용하여 20초 동안 혼합하였다. 그리고 slide glass에 polyester film을 놓고 그 위에 몰드를 올린 뒤 혼합된 재료를 몰드 안에 약간 넘치게 채운 후, polyester film과 slide glass를 덮고 clamp를 이용하여 조여 주었다. 제조사의 지시사항에 따라 항온수조를 이용하여 (50±5) ℃에서 10분 동안 재료를 중합시켰다. 중합된 시편은 몰드로부터 분리하여 지름 7 ㎜, 높이 1 ㎜의 시편을 얻었다.
폴리비닐실록산 인상재의 경우 slide glass에 polyester film을 놓고 그 위에 몰드를 올린 뒤 재료를 몰드 안에 약간 넘치게 채운 후, polyester film과 slide glass를 덮고 clamp를 이용하여 조여 주었다. 제조사의 지시사항에 따라 2분 30초 동안 중합시켰다. 중합된 시편은 몰드로부터 분리하여 지름 7 ㎜, 높이 1 ㎜의 시편을 얻었다.
그리고 SPU-ZDEC film(두께 0.5 ㎜ 이하)과 Polye- thylene film(두께 0.5 ㎜ 이하)은 가로 1 ㎝, 세로 1 ㎝ 정사각형 크기로 잘라 시편을 제작하였다.
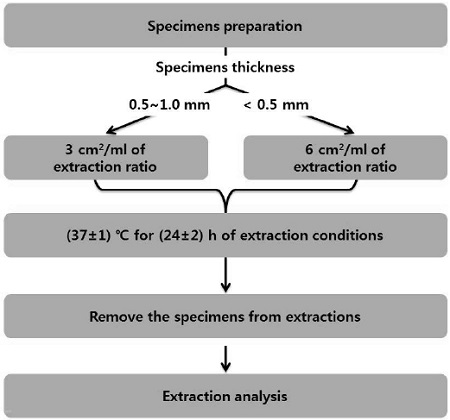
제작된 시편을 용출하기 위하여 용매로는 분석 장비가 측정할 수 있는 용매 특성을 고려하여 극성용매 중 가장 널리 사용되며 polarity가 높은 증류수(UltraPure™ Distilled water, Invitrogen, NY, USA)를 사용하였다. 용출방법은 ISO 10993-12 (2012)에 명시되어 있는 조건 중 (37±1) ℃에서 24시간 용출 하는 조건을 채택하였고, 심미수복용 복합레진, 화학중합형 의치상용레진, 폴리비닐실록산 인상재 시편의 경우 3 ㎠/㎖ 의 비율로, SPU-ZDEC film과 Polyethylene film의 경우 6 ㎠/㎖ 의 비율로 (37±1) ℃에서 24시간 동안 증류수에 용출하여 용출액을 얻었다. 동시에 공시험액도 시험검체와 동일한 조건과 방법으로 용출하였다. 용출액 분석을 위해 5번 반복 시행하여 결과물을 얻었다. 이에 대한 용출 시행 모식도는 그림 1과 같다.
각 시편으로부터 용출된 용출액을 평가하기 위하여 육안으로 이물질 및 분순물의 여부를 관찰하고, Digital pH-meter (Orion 4 star, Thermo Fisher Scientific Inc., Singapore)를 이용하여 용출 전·후의 pH 변화를 확인한 후 고성능 액체크로마토그래피(Ultimate 3000 UHPLC, Thermo Scientific, Bremen, Germany), 레이져보조탈착이온화질량분석기(Ultraflex Ⅲ, Bruker Daltonik, Bremen, Germany), 액체 크로마토그래피(Alliance 2795, Waters, Watford, UK)를 이용하여 용출액 내의 성분을 확인하였다.
고성능 액체크로마토그래피의 분리능을 향상하기 위하여 2.1 × 100 ㎜ (Aquity UPLC BEH C18; 1.8 ㎛, Waters) 컬럼에 측정시료 5 ㎕를 주입한 후 0.3 ㎖/min의 속도로 용리하였다. Solvent는 0.1% Formic acid in DW 와 0.1% Formic acid in Acetonitrile을 사용하였다.
레이져보조탈착이온화질량 분석시 사용되는 시료 매트릭스 혼합용액을 제조하기 위해서 매트릭스는 증류수에 2,5-dihydroxybenzoic acid (Sigma-Aldrich, USA)를 10 ㎎/㎖의 농도가 되도록 희석하여 사용하였고, 용매는 0.1% Trifluoro acetic acid (Sigma-Aldrich, USA)를 Acetonitrile (JT Baker, USA)과 1:1비율로 희석하여 사용하였다. 그리고 2 ㎕의 측정시료와 2 ㎕의 매트릭스 혼합용액을 혼합하여 MALDI-TOF target에 로딩하였다. 측정시 가속전압은 25.0 kV이었고, 총 300회의 레이저 주사를 통해 스펙트럼을 얻었다. MALDI-TOF MS 분석시 m/z 20~ 4,000의 범위에서 분자량을 확인하였다.
액체 크로마토그래피의 분리능을 향상하기 위하여 2.1 × 100 ㎜ (Aquity BEH C18; 1.7 ㎛, Waters) 컬럼에 측정시료 1 ㎕ 또는 10 ㎕를 주입한 후 0.3 ㎖/min의 속도로 용리하였다. Solvent는 0.1% Formic acid in DW와 0.1% Formic acid in Acetonitrile을 사용하였다.
용출액 분석을 위한 표준물질로는 심미수복용 복합레진은 Bisphenol A glycerolate dimethacrylate (Sigma-Aldrich, Steinheim, Germany), Bisphenol A (Sigma-Aldrich, Steinheim, Germany), Diurethane dimethacrylate (Sigma-Aldrich, Steinheim, Germany), Triethylene glycol dime- thacrylate (Sigma-Aldrich, Steinheim, Germany)이었고, 화학중합형 의치상용레진은 Methyl methacrylate (Sigma-Aldrich, Steinheim, Germany)이었으며, 폴리비닐실록산 인상재는 Vinyl terminated poly(dimethylsiloxane) (Sigma-Aldrich, Steinheim, Germany), Polyethylene film은 Polye- thylene (Sigma-Aldrich, Steinheim, Germany) 그리고 SPU- ZDEC은 Zinc diethyldithiocarbamate (Sigma-Aldrich, Stei- nheim, Germany)을 사용하였다.
모든 실험은 5번 반복 시행하여 결과를 얻었다.
Ⅲ. 결 과
1. 육안을 통한 성상 관찰
육안관찰을 통하여 용출액의 성상을 확인한 결과 모든 실험군에서 이물질과 불순물 등이 관찰되지 않았고 용출 전과 마찬가지로 투명하였다.
2. 용출 전·후의 pH 변화
모든 실험군의 용매로 사용되는 증류수의 용출전 pH는 5.32±0.02 로서 약산성의 pH를 나타내었다. 그리고 모든 실험군을 실험조건에 맞추어 용출한 결과 심미수복용 복합레진 용출액의 pH는 8.29±0.42, 화학중합형 의치상용레진 용출액의 pH는 7.45±0.09, 폴리비닐실록산 인상재 용출액의 pH는 7.48±0.02, SPU-ZDEC 용출액의 pH는 7.25±0.07, Polyethylene film 용출액의 pH는 7.77±0.03 그리고 공시험액의 pH는 5.45±0.05 로서, 약염기성을 나타낸 심미수복용 복합레진과 약산성의 pH를 나타내는 공시험액을 제외한 모든 실험군들의 용출액 pH는 7에 가까운 중성을 나타내었다 (표 2).
3. 용출액 내의 성분분석
3종류의 장비를 이용하여 심미수복용 복합레진, 화학중합형 의치상용레진, 폴리비닐실록산 인상재, SPU-ZDEC, Polyethylene film 용출액을 분석한 결과 표 3와 같은 결과를 얻을 수 있었다.
심미수복용 복합레진 시편을 증류수에 (37±1) ℃에서 24시간 동안 용출시킨 후 용출액 내의 성분을 분석한 결과, 고성능 액체크로마토그래피 장비를 이용하였을 때, Bisphenol A glycerolate dimethacrylate는 0.97±0.01 ppm, Diurethane dimethacrylate은 2.36±0.02 ppm으로 검출되었으나 이는 Standard range 5~20 ppm을 고려하였을 때 검출되지 않았다고 볼 수 있다. 그리고 Triethylene glycol dimethacrylate와 Bisphenol A는 검출되지 않았다. 레이져보조탈착이온화질량분석 장비를 이용하여 정성분석을 시행하였을 때, Diurethane dimethacrylate이 검출되었다. 반면 Bisphenol A glycerolate dimethacrylate, Bisphenol A, Triethylene glycol dimethacrylate는 검출되지 않았다. 그리고 액체 크로마토그래피 장비를 이용하여 정성분석을 시행하였을 때, Diurethane dime- thacrylate, Triethylene glycol dimethacrylate이 검출되었다. 반면 Bisphenol A glycerolate dimethacrylate, Bisphenol A는 검출되지 않았다. 위의 결과를 바탕으로 보았을 때, 3종류의 장비를 이용하여 심미수복용 복합레진 용출액을 측정한 결과 모두 공통적으로 Diurethane dimethacrylate이 검출되었고, Bisphenol A는 검출되지 않았다.
화학중합형 의치상용레진 시편을 증류수에 (37±1) ℃에서 24시간 동안 용출시킨 후 용출액 내의 성분을 분석한 결과, 고성능 액체크로마토그래피 장비를 이용하였을 때 Methyl methacrylate의 표준물질을 측정할 수 없었다. 반면, 레이져보조탈착이온화질량분석 장비를 이용하여 정성분석을 시행하였을 때 Methyl methacrylate의 표준물질은 측정할 수 있었으나, 용출액 내에 있는 Methyl methacrylate는 검출되지 않았다. 이는 증류수에 Methyl methacrylate가 용출되지 않음을 확인할 수 있다. 그리고 액체 크로마토그래피 장비를 이용하여 정성분석을 시행하였을 때, Methyl methacrylate의 표준물질을 측정할 수 없었다. 위의 결과를 바탕으로 보았을 때, 3종류의 장비를 이용하여 화학중합형 의치상용레진 용출액을 측정한 결과 Methyl methacrylate의 표준물질을 측정할 수 없거나 측정할 수 있어도 증류수 내에 용출되지 않았다.
폴리비닐실록산 인상재 시편을 증류수에 (37±1) ℃에서 24시간 동안 용출시킨 후 용출액 내의 성분을 분석한 결과, 고성능 액체크로마토그래피 장비를 이용하였을 때 Vinyl terminated poly(dimethylsiloxane)의 표준물질을 측정할 수 없었다. 반면, 레이져보조탈착이온화질량분석 장비를 이용하여 정성분석을 시행하였을 때 Vinyl termi- nated poly(dimethylsiloxane)의 표준물질은 측정할 수 있었으나, 용출액 내에 있는 Vinyl terminated poly (dimethylsiloxane)는 검출되지 않았다. 이는 증류수에 Vinyl terminated poly(dimethylsiloxane)가 용출되지 않음을 확인할 수 있다. 그리고 액체 크로마토그래피 장비를 이용하여 정성분석을 시행하였을 때, Vinyl terminated poly (dimethylsiloxane)의 표준물질을 측정할 수 없었다. 위의 결과를 바탕으로 보았을 때, 3종류의 장비를 이용하여 폴리비닐실록산 인상재 용출액을 측정한 결과 Vinyl terminated poly(dimethylsiloxane)의 표준물질을 측정할 수 없거나 측정할 수 있어도 증류수 내에 용출되지 않았다.
Polyethylene film 시편을 증류수에 (37±1) ℃에서 24시간 동안 용출시킨 후 용출액 내의 성분을 분석하기 위하여 고성능 액체크로마토그래피 장비, 레이져보조탈착이온화질량분석 장비, 액체 크로마토그래피 장비를 이용하여 시도하였으나 측정 불가능 하였다.
SPU-ZDEC 시편을 증류수에 (37±1) ℃에서 24시간 동안 용출시킨 후 용출액 내의 성분을 분석한 결과, 고성능 액체크로마토그래피 장비를 이용하였을 때 Zinc diethyldithiocarbamate의 표준물질을 측정할 수 없었다. SPU-ZDEC 시편을 증류수에 (37±1) ℃에서 24시간 동안 용출시킨 후 용출액 내의 성분을 분석한 결과, 고성능 액체크로마토그래피 장비를 이용하였을 때 Zinc diethyldithiocarbamate의 표준물질을 측정할 수 없었다.
Ⅳ. 고 찰
구강 내에 직접 노출되는 치과재료의 구강 점막 자극성 평가를 시행하기 위해서는 ISO 10993-10 (2010)에 따라 재료를 햄스터의 구강 점막에 적용한 후 이때 나타나는 증상을 거시적 평가와 조직학적 평가를 거쳐 결과를 얻는다. 이는 긴 시험기간이 걸리고 많은 동물을 필요로 하며 햄스터에게 극심한 고통을 야기할 수 있다는 단점을 갖고 있다(Baert 등, 1996). 따라서 동물실험을 대체할만한 국제적으로 공인된 대체시험법이 필요하다(Russell과 Burch, 1959). 최근에는 시험방법이 간단하고 짧은 시간에 결과를 얻으며 동물을 사용하지 않는 인체구강점막모델을 이용한 구강점막자극시험의 대체시험법연구가 진행되고 있다. 국내 및 국외에서는 인체구강점막모델을 이용하여 시험방법을 확립하고 의료기기의 안전성 평가에 동물대체시험법을 활용할 수 있는 방안을 마련하고자 다양한 시도를 수행하고 있으며, 이를 치과재료의 적용과 접목시키기 위하여 재료의 특성에 맞는 구강점막자극시험법을 확립시키는 연구가 필요하다.
본 연구에서는 인체구강점막모델을 이용한 치과재료의 안전성 평가를 위하여 구강 점막에 다 빈도 혹은 지속적으로 닿는 치과재료인 심미수복용 복합레진, 화학중합형 의치상용레진, 폴리비닐실록산 인상재 3종과 세포독성 평가시 양성대조군으로 사용되는 SPU-ZDEC, 음성대조군으로 사용되는 Polyethylene film을 선정하여 이 재료들의 용출액을 인체구강점막모델에 적용하는 방법을 고려하였다. 그리고 이때 인체구강점막모델에 접촉되는 용출액의 분석을 통하여 본 결과를 추후 인체구강점막모델을 이용한 자극성 및 독성 평가시 기반이 될 수 있는 기초자료로 제공하고자 연구를 수행하였다.
모든 실험군의 용출액에서는 이물질과 불순물 등이 관찰되지 않았다. 또한 pH 결과값은 중성에 가까운 결과를 보였고, 이는 ISO 10993-10 (2010)에서 제시하는 시험제외 조건인 재료의 pH가 2.0 이하 또는 11.5이상은 시험을 하지 않도록 하고 있는 권고사항에 부합하다. 따라서 본 연구의 실험재료 결과로부터 얻은 pH는 시험 가능한 조건이므로 안전성 평가를 하는데 적합한 근거자료가 될 것으로 사료된다.
심미수복용 복합레진의 안전성에 관한 우려는 물질 고유의 화학적인 독성과 구강 내 액으로 인한 재료의 용출로 인한 영향을 고려할 수 있다. 심미수복용 복합레진의 주요 성분은 Bisphenol A glycerolate dimethacrylate (Bis-GMA), Triethylene glycol dimethacrylate (TEGDMA), Urethane dimethacrylate (UDMA), and Bisphenol A ethoxylated dimethacrylate (Bis-EMA)로 구성되어 있고, 선행연구에 의하면 Bis-GMA, TEGDMA, UDMA는 유전독성 뿐만 아니라 세포독성에도 영향을 미친다는 보고가 있었다(Kleinsasser NH 등, 2006). 특히나 TEGDMA는 apoptotic cell death를 유도하고 Bis-GMA와 UDMA는 necrotic cell death를 유도한다(Schwengberg S 등, 2005). 또한 Bis-GMA와 TEGDMA는 쥐의 생식력, 몸무게, 임신율을 감소시킨다(Al-Hiyasat와 Darmani, 2006; Darmani와 Al-Hiyasat, 2006; Al-Hiyasat 등, 2004). 그리고 레진의 성분 중 일부인 Bis-GMA의 전구체인 Bisphenol A는 내분비계를 교란하여 생식성 기형을 초래한다는 연구결과도 있었다(Noda 등, 1999). 이와 같은 선행연구 결과를 미루어보았을 때 심미수복용 복합레진의 용출액 성분 분석은 추후 재료의 안전성 평가의 기초자료로 활용될 수 있다. 본 연구에서는 3 종류의 장비로 성분분석을 시행한 결과 Diurethane dimethacrylate는 공통적으로 검출되었고, Bisphenol A는 공통적으로 검출되지 않았다. 이는 증류수에 용출된 심미수복용 복합레진의 용출액 중 Bisphenol A가 인체에 영향을 미치는 요인은 배제할 수 있을 것으로 사료되고, 고성능 액체크로마토그래피 장비를 이용한 Diurethane dimethacrylate의 정성 및 정량 분석 결과 증류수 내에 용출된 양이 2.36±0.02 ppm으로 용출액 측정 전 시행한 Standard range 측정 범위가 5~50 ppm인 것을 고려하였을 때 본 결과는 미량의 Diurethane dimethacrylate가 검출되었다고 볼 수 있다.
화학중합형 의치상용레진의 경우 환자의 타액과 항상 접촉하거나 사용하지 않을 때에는 물에 담가 보관한다. 이 때 화학중합형 의치상용레진의 주성분인 Methyl met- hacrylate와 그 외 성분들이 구강 내 타액이나 보관하는 물에 용출될 수 있다는 보고가 있다. 의치의 잔류 단량체는 자극제로서 가장 많이 거론되는 성분이기는 하나 적절하게 중합된 의치의 잔류 단량체 양은 미미하다고 알려져 있고(Mikai 등, 2006), 임상연구에 의하면 구강 내에 용출된 Methyl methacrylate는 알레르기 반응을 거의 일으키지 않았다고 보고하였다(Kenneth J, 2003). 본 연구에서는 3 종류의 장비로 측정한 용출액 모두 Methyl methacrylate의 표준물질을 측정할 수 없거나 측정할 수 있어도 증류수 내에 용출되지 않았다. 측정할 수 없는 경우는 Methyl methacrylate의 분자량이 측정하기 너무 작거나 또는 휘발되어 측정할 수 없었던 것으로 사료된다. 그러나 Methyl methacrylate를 레이져보조탈착이온화질량분석 장비를 이용하여 측정한 결과 표준물질은 측정 가능 하였으나 용출액에서는 검출되지 않았으므로 증류수에 용출된 화학중합형 의치상용레진의 용출액 중 Methyl methacrylate가 인체에 영향을 미치는 요인은 배제할 수 있다.
폴리비닐실록산 인상재의 경우 선행연구에 따르면 생체적합성 평가시 세포생존률 부분에서 낮은 결과값을 보여주는 연구가 있었다. 이는 비닐폴리실록산에 첨가되는 친수성을 부여하기 위한 비이온성 계면활성제의 용출이 원인이라고 기술하였다(Kwon 등, 2014). 주성분인 Vinyl terminated poly(dimethylsiloxane)는 레이져보조탈착이온화질량분석 장비로 측정한 결과 검출되지 않았다. 선행논문에서 거론되는 폴리비닐실록산 인상재의 세포독성평가시 낮은 세포 생존률에 영향을 미치는 비이온성 계면활성제는 임상적인 관점으로 보았을 때, 재료가 구강 내에서 적용되는 시간이 10분 미만으로 구강점막에 자극을 줄 수 있는 가능성은 무시할 만하므로 Vinyl terminated poly(dimethylsiloxane)와 비이온성 계면활성제가 인체에 영향을 미치는 요인은 배제할 수 있다.
추가적으로 ISO 10993-12 (2012)의 Annex A에서 제시하고 있는 양성대조물질 SPU-ZDEC와 음성대조물질 Polyethylene의 용출물을 분석한 결과 레이져보조탈착이온화질량분석 장비와 액체크로마토그래피 장비를 이용하여 정성 분석하였을 때 용출액 내에서 Zinc diethyldithio- carbamate이 검출되었음을 확인하였고, Polyethylene은 3종류의 장비 모두 표준물질 측정이 불가 하였다. 이는 Polyethylene이 non-polar polymer로서 위의 장비로는 측정에 한계가 있다.
본 연구는 장기간 및 단기간 동안 구강 점막에 닿는 치과재료를 대표소재로 선정하고 세포독성평가시 사용되는 양성대조군과 음성대조군을 선정하여 ISO 10993-12 (2012)에 따라 증류수에 용출하여 용출액을 얻어 성상과 pH 그리고 성분을 분석하였다. 이때 용출액 분석시 사용되는 고성능 액체크로마토그래피, 레이져보조탈착이온화질량 분석기, 액체크로마토그래피 장비 특성상 용매를 증류수로 한정하여 측정하였기 때문에, 이를 바탕으로 용출액의 정성 및 정량을 확대해석하여 결론내리는 것은 다소 한계가 있음을 고려해야 한다(Hsu 등, 2012). 따라서 추후에는 용출액 분석시 재료의 용매 특성을 고려하여 이에 적합한 분석 장비를 선정하는 것이 신뢰도 높은 결과를 도출하는데 있어서 정확할 것으로 사료된다.
그러나 이러한 한계점에도 불구하고 본 연구의 결과는 증류수에 용출되는 용출액의 성상, pH, 성분 분석에 대한 전문 기술을 제공할 수 있고 본 결과를 바탕으로 추후 활용할 수 있는 방안으로는 의료기기 등의 동물대체시험법 확립을 위한 시험물질 용출방법 및 결과 지침서로 제공될 수 있을 것이다.
Ⅴ. 결 론
본 연구결과는 구강점막안전성 평가의 대체시험법을 위한 치과재료의 시편제작 및 용출액을 분석하기 위하여 심미수복용 복합레진, 의치상용레진, 치과용고무인상재 제품을 각 1종씩 선정하고 제품의 특성에 따라 적절한 조건으로 용출하여 용출액의 성상, 용출 전후의 pH변화, 용출액 내의 성분을 분석하였다. 따라서 이는 의료기기 안전성 평가를 위한 구강점막자극 동물대체시험법 기반 마련을 위한 기초자료로 사용될 수 있고, 치과재료의 안전성 평가 연구를 위한 시험물질을 확보함과 동시에 동물대체시험법에 의한 치과재료 생물학적 안전성 평가 확립을 위한 시험물질 용출 표준 지침서의 근거자료로 제공될 수 있을 것으로 사료된다.
Acknowledgments
* 본 연구는 2014년도 식품의약품안전평가원 용역연구개발과제의 연구 개발비 지원(14181독성국455)에 의해 수행되었으며 이에 감사드립니다.
참 고 문 헌
- 한국식품의약품안전처, (2014), 의료기기 품목 및 품목별 등급에 관한 규정(식품의약품안전처고시 제 2014-110 호 2-163), 식품의약품안전처, p2-163.
-
Al-Hiyasat, AS., Darmani, H., Elbetieha, AM., (2004), Leached components from dental composites and their effects on fertility of female mice, Eur J Oral Sci, 112, p267-272.
[https://doi.org/10.1111/j.1600-0722.2004.00136.x]

-
Al-Hiyasat, AS., and Darmani, H., (2006), In vivo effects of BISGMA-a component of dental composite-on male mouse reproduction and fertility, J Biomed Mater Res A, 78, p66-72.
[https://doi.org/10.1002/jbm.a.30667]

-
Baert, JH., Veys, RJ., Ampe, K., De Boever, JA., (1996), The effect of sodium laury sulfate and triclosan on hamster cheek pouch mucosa, Int J Exp Pathol, 77, p73-78.
[https://doi.org/10.1046/j.1365-2613.1996.00965.x ]

-
Darmani, H., and Al-Hiyasat, AS., (2006), The effects of BIS-GMA and TEG-DMA on female mouse fertility, Dent Mater, 22, p353-358.
[https://doi.org/10.1016/j.dental.2005.04.029]

- Hagino, S., Okazaki, Y., Itagaki, H., (2008), An in vitro tier evaluation for the identification of cosmetic ingredients which are not ocular irritants, Altern Lab Anim, 36, p641-652.
-
Hsu, WY., Wang, VS., Lai, CC., Tsai, FJ., (2012), Simultaneous determination of components released from dental composite resins in human saliva by liquid chromatography/multiple-stage ion trap mass spectrometry, Electrophoresis, 33, p719-725.
[https://doi.org/10.1002/elps.201100571]

- ISO 10993-10, (2010), Biological evaluation of medical devices-Part 10: Tests for irritation and skin sensitization.
- ISO 10993-12, (2012), Biological evaluation of medical devices-Part 12: Sample preparation and reference materials.
- Kenneth J. Anusavice, (2003), Philips’ Science of Dental Materials (11th), Elsevier, p745-755.
-
Kleinsasser, NH., Schmid, K., Sassen, AW., Harréus, UA., Staudenmaier, R., Folwaczny, M., Glas, J., Reichl, FX., (2006), Cytotoxic and genotoxic effects of resin monomers in human salivary gland tissue and lymphocytes as assessed by the single cell microgel electrophoresis (Comet) assay, Biomaterials, 27, p1762-1770.
[https://doi.org/10.1016/j.biomaterials.2005.09.023]

-
Kwon, JS., Lee, SB., Kim, KM., KIM, KN., (2014), Positive control for cytotoxicity evaluation of dental vinyl polysiloxane impression materials using sodium lauryl sulfate, Acta Odontol Scand, 72, p618-622.
[https://doi.org/10.3109/00016357.2013.879996]

-
Lenoir, J., Adriaens, E., Remon, JP., (2011), New aspects of the Slug Mucosal Irritation assay: predicting nasal stinging, itching and burning sensations, J Appl Toxicol, 31, p640-648.
[https://doi.org/10.1002/jat.1610]

-
Mikai, M., Koike, M., Fujii, H., (2006), Quantitative analysis of allergenic ingredients in eluate extracted from used denture base resin, J Oral Rehabil, 33, p216-220.
[https://doi.org/10.1111/j.1365-2842.2005.01561.x]

-
Mitchell, K., Seyoum, A., Bridget, A. B., Philip, W. W., Lori, B., Joseph, K., (2007), Organotypic human oral tissue models for toxicological studies, Toxicol In Vitro, 21, p938-949.
[https://doi.org/10.1016/j.tiv.2007.01.024]

-
Nathalie, A., Carine, T., Cecile, R., Carole, A., Marie-Helene, R., Olivier, D., Jean, P., Marisa, M., Anne de Brugerolle, de Fraissinette, (2010), A catch-up validation study on reconstructed human epidermis (SkinEthicTM RHE) for full replacement of the Draize skin irritation test, Toxicol In Vitro, 24, p257-266.
[https://doi.org/10.1016/j.tiv.2009.08.024 ]

-
Noda, M., Komatsu, H., Sano, H., (1999), HPLC analysis of dental resin composites components, J Biomed Mater Res, 47, p374-378.
[https://doi.org/10.1002/(SICI)1097-4636(19991205)47:3<374::AID-JBM12>3.0.CO;2-7]

- OECD Test Guidelines 439, (2013), In Vitro Skin Irritation: Reconstructed Human Epidermis Test Method.
-
Polydorou, O., Trittler, R., Hellwig, E., Kümmerer, K., (2007), Elution of monomers from two conventional dental composite materials, Dent Mater, 23, p1535-1541.
[https://doi.org/10.1016/j.dental.2006.12.011]

-
Schwengberg, S., Bohlen, H., Kleinsasser, N., Kehe, K., Seiss, M., Walther, UI., Hickel, R., Reichl, FX., (2005), In vitro embryotoxicity assessment with dental restorative materials, J Dent, 33, p49-55.
[https://doi.org/10.1016/j.jdent.2004.08.001]

- W. M. S. Rusell WMS, Burch, RL., (1959), The Principles of Humane Experimental Technique, London, U.K, Methuen.