SLA 처리 티타늄 표면에서의 유전자발현에 대한 상온대기압 플라즈마의 효과
Abstract
Dental implants manufacturers have developed high hydrophilic and rough implant surfaces which in turn exhibited better osseointegration than conventional ones. Based on in vitro studies, sand blast, large grit, acid etching(SLA)-treated surfaces with microstructural characteristics may promote the process of osseointegration. But when the SLA surface is kept dry in the air, it becomes hydrophobic. Appropriate non-thermal atmospheric pressure air plasma jet(air-NTAPPJ) processes render surfaces hydrophilic. The purpose of this research is to air-NTAPPJ on SLA surface treatment to improve the osteogenic functionality. The experiment was carried out through the a cytotoxicity assay and real-time reverse transcriptase-polymerase chain reaction(RT-PCR). The results were that the cell viability and gene expression of ALP, OCN, OPN, and Runx-2 of rMSC enhanced by air-NTAPPJ treated. Thus, air-NTAPPJ application can lead to an improved osseointegration.
Keywords:
atmospheric pressure plasma, SLA-treated surface, osseointegration서 론
상실된 치아를 수복하기 위한 방법으로 임프란트 식립 치료방법이 꾸준히 증가되고 있다(Albrektson와 Wennerberg, 2005). 더불어 성공적인 임플란트 시술을 위해 빠른 골융합을 유도하고 초기 치유기간을 단축시킬 수 있도록 많은 표면 처리 방법들이 개발되고 있다. 빠른 골융합을 위해 임플란트 표면의 형상 및 거칠기, 화학적 성분과 같은 표면 성질은 매우 중요한 요소이다(Le Guéhennec 등, 2007). 특히, 임플란트 표면 형상은 세포의 부착, 증식, 분화와 같은 세포의 거동에 있어 영향을 미치며 결국 골융합에 영향을 미치게 된다. 그리하여 표면의 형상에 있어 거칠기를 증대 시키는 것은 중요한 요소가 될 수 있다. Sul 등(2005)은 1-2 ㎛ 단위의 표면 거칠기를 가진 경우 임플란트 표면 사이에 골이 성장되면서 표면과 골 사이 계면에서 높은 고정력을 보고한 바 있다.
표면 거칠기 및 표면적을 증대시키기 위한 대표적 표면 처리방법으로 샌드블라스팅(sand-blasting) 후 산처리를 하는 표면(SLA surface)처리 방법을 들 수 있다. SLA 표면 처리법은 200-500 ㎛ 단위의 알루미나 입자를 압축공기를 이용하여 표면에 분사 시킨 후 염산(HCl) 또는 황산(H2SO4) 용액에서 산처리하여 표면을 마이크로 단위의 거칠기를 만드는 방법으로 블라스팅 방법과 산처리 방법의 장점을 결합시킨 표면처리 방법이다(Kim 등, 2008). 실제 Yang 등(2008)은 SLA 표면 처리된 표면에서 증가된 골 형성능은 물론 골과의 강한 결합력을 보고한 바 있다.
그러나 이러한 SLA 표면 처리방법의 장점에도 불구하고 마이크로 단위의 거친 표면은 소수성 성질을 가져 빠른 골융합을 위한 표면 개질에 있어 한계로 작용하고 있다. 친수성 표면은 높은 표면에너지를 가지며 세포 부착 및 활성에 있어 소수성 표면 보다 더 높은 활성도를 보인다(Elias 등, 2008). 따라서 SLA 표면의 화학적 성질을 개질하여 표면의 젖음성 및 표면 에너지를 증가시키고자 하고 있다(Rupp 등, 2006). Zaho 등 (2005)은 친수성으로 개질화시킨 표면에서 활성화 된 세포 분화능과 PGE2 와 TGF-β1 골 성장인자가 각 각 10배와 2.5배로 더욱 증가되어 나타났다고 보고하였다.
한편 상온대기압 플라즈마기법은 대기압 하에서 표면에 생체 활성 물질을 코팅하며 이용하는 가스의 종류에 따라 표면을 소수성 또는 친수성으로 개질할 수 있는 표면 처리 방법이다(Choi 등, 2013). Ti 표면위에 상온대기압 플라즈마 처리를 하였을 때 비처리군에 비하여 접촉각이 작아져 친수성이 증가하였다고 보고된 바 있으며(Lee 등, 2013), 이는 상온대기압플라즈마 처리 시 표면의 수산기(OH)를 생성시켜 화학적 성질이 개질되었기 때문이다(Lee 등, 2009).
Seo 등(2013)의 선행 연구에서 SLA 표면처리 후 플라즈마를 조사한 티타늄에서 유의하게 높은 세포 부착율과 증식률을 보인바 있었다.
따라서 본 연구의 목적은 앞선 연구에 이어 순수 티타늄 표면의 거칠기를 증가 시키고자 SLA처리한 뒤 상온대기압 플라즈마기법을 이용하여 표면의 화학적 성질을 친수성으로 개질하여 골형성능을 평가하기 위해 유전자연쇄중합반응 평가를 통해 골 형성능과 관련한 골모세포의 분화능을 평가하는데 있다.
재료 및 방법
1. 시편의 SLA 처리
상용 순수티타늄(NSC CP-Ti, grade IV, Japan)을 직경 10 x 10 mm로 절단하여 sand grit SiC 연마지를 사용하여 #400, #600, #800, #1200, #2000 다섯 단계에 걸쳐 습식연마 하였다. 연마 후 각 시편은 아세톤, 알코올, 증류수에 각각 15분씩 초음파(ultrasonic) 세척하였다. 그리고 블라스팅(blasting) 처리를 위해 시편과 노즐의 거리를 1 cm, 압력은 0.45 MPa로 설정하고 110 ㎛ 크기의 알루미나 입자(aluminum oxide, Al2O3)를 직각방향으로 1분 동안 분사하였다. 그리고 시편은 5분 동안 세척하였다. 블라스팅 처리한 시편은 350 ℃에서 7 % HCl과 27 % H2SO4를 혼합한 용액에 5분 동안 침지시켜 산처리한 뒤 15분 동안 증류수로 다시 표면을 세척하였다. 제작된 시편은 24시간 동안 상온으로 건조시켰으며, 실험 하루 전 시편을 EO gas로 멸균하였다.
2. 상온대기압플라즈마젯(Non-thermal atmospheric pressure plasma jet; NTAPPJ)
본 연구에 사용한 플라즈마 반응장치는 광운대학교 플라즈마 바이오과학 연구센터 (Plasma Bioscience Research Center)에서 개발한 장비이며 Figure 1과 같다.
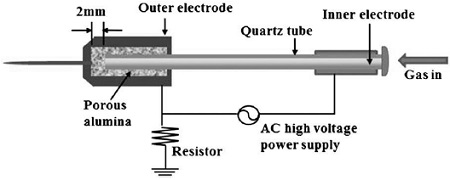
The schematic diagram of non-thermal atmospheric pressure plasma jet designed and manufactured by PBRC (Plasma Bioscience Research Center, Kwangwoon University, Korea, Y.-R. Choi, et al., Thin Solid Films (2013).
플라즈마 중합반응 시 사용한 기체는 압축공기(com- pressed air)이며, 장비 조사구와 SLA 처리된 티타늄(titanium) 시편간의 거리는 3 mm, 장비의 최대 출력 전압은 2.24 kV, 전류는 1.08 mA, 플라즈마 방전세기는 2.4 W, 속도 5 L/분으로 각 시편에 2분 동안 반응시켰다.
4. 세포 배양 및 독성(Cytotoxicity assay) 평가
본 실험에 사용한 세포는 확립된 세포주인 Mouse fibroblast L929(Korea Cell Line Bank, Seoul, Korea)를 3번 계대하여 사용하였다. 세포는 RPMI(1640, Welgene, Korea) 배지에 10 %(W/V) fetal bovine serum(FBS, PAA Laboratoris.inc, A15-751)과 1 % penicillin(Lonza, walkersille MD, USA 0719)을 혼합하여 5 % CO2가 공급되는 37 ℃ 항온기(incubator)에서 배양시켰다. 그 후 상온 대기압 플라즈마 처리 전/후의 시편에 대한 세포 독성평가는 ISO 10993-5를 근거로 진행하였다. 시편 면적당 용출액은 ISO 10993-12를 근거로 산출하여 실험을 진행하였다.
실험군은 두께가 0.5 mm 미만인 1 x 1 시편을 추출비(extraction ratio, 6 cm2/ml)를 맞추어 생리식염수에 넣고 37 ℃에서 72시간 용출하였다. 대조군은 실험군과 같은 온도 및 시간으로 설정하여 시편을 넣지 않은 용매만 사용하였다. SLA처리한 시편을 멸균하여 준비한 후 각 표면 위에 air-NTAPPJ를 2분 조사하였으며, 극한의 상황을 고려하여 10분을 추가하였다.
Cell viability assay kit(WST, Ez-Cytox, Daeillab, Korea)를 사용하여 실험하였다. 먼저 L929 세포 배양액 100 ㎕ (1 x 104 cells/mL)을 96well plate에 분주하고 24시간 동안 5 % CO2가 공급되는 37 ℃ 항온기에서 배양하였다. 그 후 96 well plate에 100 ㎕씩 용출액을 담고 다시 24시간 동안 항온기에서 반응시켰다. 분석시약(assay reagent)를 각 well에 10 ㎕씩 분주하고 4시간 동안 배양하였으며 ELISA reader (Epoch, BioTek, USA)를 사용하여 450 nm에서 흡광도를 측정하였다.
5. 유전자중합연쇄반응
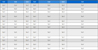
본 실험에서는 Rat Mesenchymal Stem Cells (rMSC, Lonza, USA)을 사용하였다. SLA시편위에 air-NTAPPJ 처리 전과 후의 유전자 중합연쇄반응(Real-time reverse transcriptase- polymerase chain reaction; RT-PCR) 기법을 이용한 분화 표지 유전자 발현을 분석하였다. rMSC의 유전자중합연쇄반응을 위한 primer는 runt- related transcription factor 2 (Runx-2), osteopontin (OPN), osteocalcin (OCN) 이며 house-keeping gene으로 glyceraldehyde 3-phosphate dehydrogenase (GAPDH)을 사용하였으며, 각 유전자의 발현량을 GAPDH의 상대적인 양으로 비교하여 나타내었다. 각 primer sequence는 Table 1과 같다.
SLA 처리된 시편을 24 well plate에 담고 1 x 104 cells/ml의 rMSC를 접종하고 7일, 14일간 각각 배양하였다. 배양한 후 RNA를 분리하고, 역전사 효소(reverse transcriptase)로 역전사하여 cDNA를 합성하였다. 합성된 cDNA를 주형으로 하여 유전자중합연쇄반응을 실시하였다. Trizol 시약 (Sigma-Aldrich Company, St. Louis, MO, USA)를 250㎕ 넣고 cell scraper로 긁어 주었으며, 37 °C in 5 % CO2에서 5분 동안 배양하였다. 그 후 1.5 µL 마이크로튜브에 담고 50 µL 클로로포름(Sigma, USA)을 첨가한 뒤 손으로 10회 inversion 하였다. 그리고 상온에서 3분 동안 방치하고 원심분리(12,000 rpm, 15분, 4 °C)를 수행하고 100 µL씩 상등액을 제거하여 새로운 tube에 옮겨 담았다. 상등액을 넣은 tube에 isopropanol(Sigma, USA)을 100 ㎕ 첨가하고 손으로 10회 inversion한 뒤 상온에서 10분 동안 방치하고 원심분리(12,000 rpm, 15분, 4 °C)를 수행한 뒤 상등액을 제거하였다. 이 tube에 75 % ethanol을 첨가하여 원심분리(12,000 rpm, 15 분, 4 °C)하였다. 분리된 RNA에 dNTP, Buffer RT, Oligo DT 각 3 µL, inhibitor, RTO 각 1.5 µL씩 첨가하여 Omniscript®RTkit (Qiagen, Hilden, Germany) 37 °C 에서 90분 동안 반응하여 RNA를 분리하고 역전사 효소로 역전사하여 complementary DNA(cDNA)를 합성하였다. 합성된 cDNA 2µL에 역전사 primer를 각각 1 µL, 2X SYBR green master mix (Applied biosystem, USA) 10 µL, H2O(RNA free water) 6 µL를 각각 삽입하여 최종 양을 20 µL로 하였다. PCR조건은 95 °C/10분 활성단계(activation step)이며, 단백질 변성은 95 °C/15초, 60 °C/분의 primer extension으로 40 회전 시행하였다.
ABI Prism 7500 machine (Applied Biosystems,z Foster City, CA, USA)를 사용하여 자료를 분석하였다.
6. 통계분석
본 실험결과 분석은 PASW statistics ver 18.0 (IBM CO., Armonk, NY, USA)을 사용하였다. 대조군과 실험군의 유의차를 검증하기 위해 독립표본t-검정을 실시하였으며, 95 %의 신뢰수준으로 양측검정을 실시하였다.
결과 및 고찰
1. 세포 독성
NTAPPJ를 각 2분, 10분 씩 조사한 후 모든 시편에서 세포독성에 미치는 영향에 대해 조사하였다. 세포독성은 ISO 7405에 근거하여 세포 생존률이 80 % 이상일 경우 세포독성이 없다고 판단하였다. 그 결과 대조군과 실험군 모두 세포 독성은 없는 것으로 확인되었으며, 10분 동안 NTAPPJ 조사하였을 때 오히려 세포활성이 더 높게 나타났다(Fig. 2).
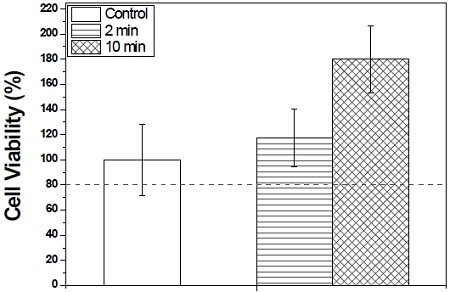
The cytotoxicity of sand blast, large grit, acid etching(SLA)-treated surfaces in Non-thermal atmospheric pressure air plasma jet.
선행 연구에 의하면 DBD 플라즈마를 이용하여 티타늄에 10분 동안 처리 한 결과 세포 단백질인 fibronectin이 증가하였으며 세포의 증식도 증가되었다고 설명하였다(Han 등, 2012). 상온 대기압 플라즈마를 티타늄 표면에 처리한 후 osteoblast의 세포부착과 증식을 향상되었음을 증명한 연구도 확인할 수 있었다(Kawase 등, 2014). 본 연구에서도 시편의 플라즈마 처리는 세포독성에 영향을 주지 않았으며, SLA 표면의 플라즈마 처리는 세포활성 증가에 영향을 주었음을 확인할 수 있었다.
2. RT-PCR
Fig. 3은 공기 NTPPJ 조사 시 RT-PCR을 평가한 결과이다. 플라즈마 처리 한 시편에서 모든 골아세포의 분화 표지 인자에서 air-NTAPPJ 반응 시 유전자 발현(gene expression)이 증가하였으며, 배양한지 7일에서 14일까지 점점 발현이 증가하는 양상이 나타났다(p<0.05). 이 가운데 ALP(alkaline phosphates) 활성은 7일차부터 분화된 대조군에 비하여 실험군 표면에서 크게 증가하였으며, 14일차까지 점점 증가하는 경향이 나타났다(p<0.05). ALP의 활성을 평가한 결과 SLA 표면에 air-NTAPPJ 반응 후 골분화로 진행되고 있다는 것이 증명되었으며 세포외 기질의 광화작용(extracellular matrix mineralization)과 유전자 발현의 중요한 요소로 확인되고 있다(Emanuela 등, 2014). 특히 ALP는 골 형성 초기에 역할을 하는 만큼 7일에 다른 군과 비교하여 가장 높은 활성이 나타났다.
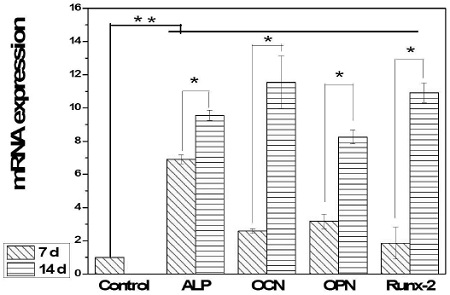
The effect of sand blast, large grit, acid etching(SLA)-treated surfaces in Non-thermal atmospheric pressure air plasma jet by mRNA expression. Significant of differences in comparison with the 7 days and 14 days:*, Significant of differences in comparison with the control and experimental samples: **, p<0.05.
ALP에 이어 OCN(osteocalcin)은 골 형성에 초기와 마지막에 중요한 역할을 하게 되며 골형성에 중요한 상관관계를 가지고 있다(Walsh 등, 2000). 대조군보다 7일부터 유의차 있는 증가를 나타냈으며, 14일에는 특히 높은 차이를 보였다(p<0.05). OPN은 osteoblasts, chondrocytes, osteocytes, osteoclasts등의 다양한 세포에서 나타난다. Integrin을 이용하여 RGD와 결합하여 세포의 신호전달과 이동에 중요한 역할을 하며 수산화인회석(hydroxyapatite) 형성에서도 중요한 역할을 한다(Sonoko 등, 2013). 대조군과 비교하여 OPN은 유의차 있는 증가를 나타내어 골 형성의 중요한 지표를 확인할 수 있었다. Runx 2(runt-related transcription factor 2)는 골아 세포 분화의 전사인자(transcription factor) 이며 (Komori 등, 1997), OCN과 OPN함께 7일, 14일 gene 발현양이 대조군보다 유의차 있는 증가를 나타냈다.
선행 연구에서 상온대기압 플라즈마 처리는 티타늄 시편의 표면의 접촉각이 비처리군에 비하여 작아져 친수성을 증가 시킨다고 하였다(Seo 등, 2013). 이러한 표면의 친수성 증가는 세포 단백질의 흡착, 세포의 부착능력에 매우 중요한 역할을 하는 인자이다 (Choi 등, 2013). 본 연구 결과 SLA 처리된 표면의 air-NTAPPJ 반응 시 세포활성 증가에 영향을 주었다. 따라서 air- NTAPPJ에 의한 rMSC의 분화 촉진 효과와 세포활성 결과는 치과용 티타늄에 새로운 표면처리방법으로 제시 될 수 있다고 사료된다.
결 론
본 연구는 SLA 처리한 티타늄 표면에 친수성을 증대하고자 압축공기 상온대기압플라즈마제트(NTAPPJ)를 조사하였다. 이 때 세포독성 생성 여부 및 세포분화를 각 표지인자를 통해 평가하였으며, 그 결과는 다음과 같다.
- 1) SLA 처리한 임플란트 표면에 압축공기 NTAPPJ 조사하였을 때 L929 세포를 사용하여 독성을 평가한 결과 세포활성은 높게 나타났다.
- 2) rMSC 세포분화에 압축공기 NTAPPJ 조사 시 ALP, OCN, OPN, Runx-2 모두 발현양이 높아 세포분화를 촉진하였다.
이상의 결과로 압축공기-NTAPPJ를 SLA 처리한 임플란트 표면에 조사하였을 때 세포활성 및 분화촉진에 우수한 효과를 나타내어 치과임상에 유용하게 활용될 수 있을 것으로 판단되었다.
Acknowledgments
* 이 논문은 2012년도 및 2010년도 정부(미래창조과학부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(2012R1A1A2008659 및 No. NRF-2010-0027963).
참 고 문 헌
- Albrektsson, T., Wennerberg, A., (2005), The impact of oral implants - Past and future, 1966-2042, J Can Dent Assoc, 71, p327-327d.
-
Choi, YR., Kwon, JS., Song, DH., Choi, EH., Lee, YK., Kim, KN., Kim, KM., (2013), Surface modification of biphasic calcium phosphate scaffolds by nonthermal atmospheric pressure nitrogen and air plasma treatment for improving osteoblast attachment and proliferation, Thin Solid Films, 547, p235-240.
[https://doi.org/10.1016/j.tsf.2013.02.038]

-
Elias, CN., Oshida, Y., Lima, JHC., Muller, CA., (2008), Relationship between surface properties (roughness, wettability and morphology) of titanium and dental implant removal torque, J Mech Behav Biomed Mater, 1, p234-142.
[https://doi.org/10.1016/j.jmbbm.2007.12.002]

- Emanuela, PF., Juliana, CS., Paulo, TO., Clodomiro, AJ., Marcio, MB., Adalberto, LR., (2014), The effect of plasma-nitrided titanium surfaces on osteoblastic cell adhesion, proliferation, and differentiation, J Biomed Mater Res Part A, 102A, p991-993.
-
Han, I., Vagaska, B., Seo, HJ., Kang, JK., Kwon, BJ., Lee, MH., Park, JH., (2012), Promoted cell and material interaction on atmospheric pressure plasma treated titanium, Appl Surf Sci, 258, p4718-4723.
[https://doi.org/10.1016/j.apsusc.2012.01.065]

-
Kawase, T., Tanaka, T., Minbu, H., Kamiya, M., Oda, M., Hara, T., (2014), An atmospheric-pressure plasma treated titanium surface potentially supports initial cell adhesion, growth, and differentiation of cultured human prenatal derived osteoblastic cells, J Biomed Mater Res Part B, 102B, p1289-1296.
[https://doi.org/10.1002/jbm.b.33114]

-
Kim, H., Choi, SH., Ryu, JJ., Koh, SY., Park, JH., Lee, IS., (2008), The biocompatibility of SLA-treated titanium implants, Biomed Mater, 3, p025011.
[https://doi.org/10.1088/1748-6041/3/2/025011]

-
Komori, T., Yagi, H., Nomura, S., Yamaguchi, A., Sasaki, K., Deguchi, K., Shimizu, Y., Bronson, RT., Gao, YH., Inada, M., Sato, M., Okamoto, R., Kitamura, Y., Yoshiki, S., Kishimoto, T., (1997), Targeted disruption of Cbfa1 results in a complete lack of bone formation owing to maturational arrest of osteoblasts, Cell, 89, p755-764.
[https://doi.org/10.1016/S0092-8674(00)80258-5]

-
Le Guéhennec, L., Soueidan, A., Layrolle, P., Amouriq, Y., (2007), Surface treatments of titanium dental implants for rapid osseointegration, Dent Mater, 23, p844-854.
[https://doi.org/10.1016/j.dental.2006.06.025]

-
Lee, EJ., Kwon, JS., Uhm, SH., Song, DH., Kim, YH., Choi, EH., Kim, KN., (2013), The effects of nonthermal atmospheric pressure plasma jet on cellular activity at SLA-treated titanium surfaces, Current Appli Phys, 13, pS36-41.
[https://doi.org/10.1016/j.cap.2012.12.023]

-
Lee, HW., Kim, GJ., Kim, JM., Park, JK., Lee, JK., Kim, GC., (2009), Tooth bleaching with nonthermal atmospheric pressure plasma, J Endo, 35, p587-591.
[https://doi.org/10.1016/j.joen.2009.01.008]

-
Rupp, F., Scheideler, L., Olshanka, N., de Wild, M., Wieland, M., Geis-Gerstorfer, (2006), Enhancing surface free energy and hydrophilicity through chemical modification of microstructured titanium implant surfaces, J Biomed Mater Res A, 76A, p323-334.
[https://doi.org/10.1002/jbm.a.30518]

- Seo, HY., Lee, EJ., Kwon, JS., Im, SY., Kim, KM., Kim, KN., (2013), Effects of non-thermal atmospheric pressure air plasma exposure on SLA-treated implant in relation to cellular activity, J Korean Res Soc Dent Mater, 40, p309-314.
-
Sonoko, N., Manisha, C Y., José, LM., (2013), In Vivo overexpression of tissue‐nonspecific alkaline phosphatase increases skeletal mineralization and affects the phosphorylation status of osteopontin, J Bone Miner Res, 28, p1587-1598.
[https://doi.org/10.1002/jbmr.1901]

- Sul, YT., Johansson, C., Wennerberd, A., Cho, LR., Chang, BS., Albrektsson, T., (2005), Optimum surface properties of oxidized implants for reinforcement of osseointegration: surface chemistry, oxide thickness, porosity, roughness, and crystal structure, Int J Oral Maxillofac Implants, 20, p349-359.
-
Walsh, S., Jefferiss, C., Stewart, K., Jordan, GR., Screen, J., Beresford, JNB., (2000), Expression of the developmental markers STRO-1 and alkaline phosphatase in cultures of human marrow stromal cells: regulation by fibroblast growth factor (FGF)-2 and relationship to the expression of FGF receptors, Bone, 27, p185-195.
[https://doi.org/10.1016/S8756-3282(00)00319-7]

-
Yang, GL., He, FM., Yang, XF., Wang, XX., Zhao, SF., (2008), Bone responses to titanium implants surface-roughened by sandblasted and double etched treatments in a rabbit model, Oral Surg Oral Med Oral Pathol Oral Radiol Endodont, 106, p516-524.
[https://doi.org/10.1016/j.tripleo.2008.03.017]

-
Zhao, G., Schwartz, Z., Rupp, MWF., Geis-Gerstorfer, J., Cochran, DL., Boyan, BD., (2005), High surface energy enhances cell response to titanium substrate microstructure, J Biomed Mater Res A, 74A, p49-58.
[https://doi.org/10.1002/jbm.a.30320]