
망고스틴 과피 에탄올 추출물의 수용성 망고스틴 유도체, 보골지 열매 및 감초 뿌리 에탄올 추출물의 치근관 감염 원인균에 대한 항균 효과
 ; Lee, Kyung-Hyun2, †
; Lee, Kyung-Hyun2, † ; Lim, Yun Kyong2, 3
; Lim, Yun Kyong2, 3 ; Lee, Dae Sung1
; Lee, Dae Sung1 ; Kook, Joong-Ki2, 3, *
; Kook, Joong-Ki2, 3, *
초록
본 연구는 망고스틴(Garcinia mangostana L., mangosteen) 과피 에탄올 추출물의 수용성 알파-망고스틴(α-mangostin) 유도체(수용성 망고스틴 유도체), 보골지(Psoralea corylifolia L.) 열매 및 감초(Glycyrrhiza uralensis, Licorice) 뿌리 에탄올 추출물의 치수 및 치근단 질환 원인균에 대한 항균 활성을 평가하기 위해 수행되었다. 세포 독성 시험은 인간 배아 신장 293 세포(HEK 293)에 처리하여 methylthiazolyldiphenyl-tetrazolium bromide (MTT) 분석법 또는 세포 계수법으로 측정하였다. 항균 시험은 최소성장억제농도(minimum inhibitory concentration, MIC)와 최소살균농도(minimum bactericidal concentration, MBC) 측정법으로 평가하였다. 세포 독성 시험 결과, 3가지 천연추출물의 세포독성이 없는 최고농도는 각각 20, 400, 320 µg/ml였다. 항균 시험 결과, 수용성 망고스틴 유도체 및 보골지 열매 에탄올 추출물은 치수 및 치근단 질환 원인균 35균주(23종)에 대해 Dialister invisus KCOM 1973 균주를 제외한 MIC 및 MBC 값은 각각 1.25–20 µg/ml 및 25–200 µg/ml였다. 감초 뿌리 에탄올 추출물은 35균주 중에서25균주에 대해 40–320 µg/ml의 MBC 값을 보였다. 본 연구 결과, 3종의 천연추출물 중 망고스틴 과피 에탄올 추출물 수용성 망고스틴 유도체가 치수 및 치근단 질환 원인균 35균주에 대해 가장 높은 항균 활성을 나타내어, 근관세척제로 사용될 가능성이 가장 높았다.
Abstract
This study was performed to evaluate the antibacterial activity of water-soluble mangostin derivatives (WsMD) of the ethanol extract of the peel of Garcinia mangostana L. (mangosteen) and the ethanol extracts of the fruit of Psoralea corylifolia L. and the root of Glycyrrhiza uralensis (licorice) against oral bacteria associated with endodontic infections. Cytotoxicity of the three natural products was tested on human embryonic kidney 293 cells (HEK 293) using the methylthiazolyldiphenyl-tetrazolium bromide (MTT) assay or the cell counting method. Antimicrobial activity was evaluated based on the minimum inhibitory concentration (MIC) and minimum bactericidal concentration (MBC). The highest concentrations of the WsMD of the ethanol extract of the peel of mangosteen and ethanol extracts of P. corylifolia L. fruit and licorice root without cytotoxic effects on HEK 293 cells were 20, 400, and 320 µg/ml, respectively. The MIC and MBC values of the WsMD of the ethanol extract of the peel of mangosteen and ethanol extracts of P. corylifolia L. fruit against 35 isolates (23 species) of pulpitis- and periapical disease-causative bacteria were 1.25–20 µg/ml and 25–200 µg/ml, respectively, except for Dialister invisus KCOM 1973. The ethanol extract of licorice root had MBC values of 40–320 µg/ml against 27 of 35 bacterial strains. These results showed that the WsMD of the ethanol extract of mangosteen peel had the highest antibacterial activity among the three natural extracts and suggested it as a potential root canal irrigation agent.
Keywords:
Antibacterial activity, Endodontic infection, Garcinia mangostana L., Glycyrrhiza uralensis, Psoralea corylifolia L.키워드:
항균활성, 치근관 감염, 망고스틴, 감초, 보골지서 론
치수염은 구강 세균과 그의 부산물들이 치수(dental pulp)를 자극하여 진행되고 비가역적인 과정을 거쳐 발생하고, 이러한 치수염이 치근단까지 진행되어 치근단 질환을 유발시키게 된다(1). 그러므로, 치수 및 치근단 질환 치료는 치수 및 치근단 조직을 손상 및 통증 유발에 관여하는 감염된 세균이나 화학적 및 물리적 자극을 유발하는 물질을 제거하는 것이 필수적이다. 하지만, 근관 상아세관 내 세균을 완벽히 제거 또는 사멸하지 못하면, 근관 치료의 실패뿐만 아니라 치근단 치주염의 주요한 원인이 되기도 한다(2–4). 현재, 항균능이 부여된 근관 치료에 사용되는 세척제로 차아염소산나트륨(NaOCl), 과산화수소수(H2O2), 클로르헥시딘 및 요오드-칼륨-요오다이드 등을 사용하고 있다(5, 6). 하지만, 이들 화학제제들은 구강 조직에 대한 부작용을 가지고 있어 사용이 제한적이다(7, 8). 그러므로, 광범위한 항균력을 가지면서, 구강조직에 대한 세포 독성이 없는 근관 세척제를 개발하는 것이 필요하다.
현재 항균능을 갖는 식물 유래 천연물 연구들이 활발히 진행되고 있다(9, 10). 망고스틴(Garcinia mangostana L., mangosteen) 과피 에탄올 추출물에는 사포닌, 탄닌, 폴리페놀, 플라보노이드, 알칼로이드 및 크산톤이 포함되어 있고, 진통, 항종양, 항염, 항산화 작용 및 항균 효능이 있다고 보고되었다(11, 12). 본 연구팀의 선행 연구에서 망고스틴 과피 에탄올 추출물이 치수 및 치근단 질환의 주요한 원인균종인 Enterococcus faecalis를 비롯한 Staphylococcus aureus, Cutibacterium acnes에 대해 우수한 항균능이 있음을 확인하였다(13, 14). 또한, “망고스틴 과피 에탄올 추출물에 함유된 알파-망고스틴(α-mangostin)을 아르기닌(L-arginine)을 첨가시켜 수용성을 부여한 알파-망고스틴 유도체”(“수용성 망고스틴 유도체”)를 MTA에 혼합하여, 항균능이 부여된 MTA 복합체를 개발하였다(15). 보골지(Psoralea corylifolia L.)는 콩과에 속하는 식물로 항균 및 항돌연변이 등 여러가지 생리활성을 갖는 것으로 알려져 있다(16, 17). 감초 (Glycyrrhiza uralensis, Licorice) 뿌리는 항산화, 항염증, 항균 및 항바이러스 등의 활성을 가지고 있어 약용으로 많이 사용되고 있다(18–20). 본 연구는 항균능이 있다고 알려진, 수용성 망고스틴 유도체, 보골지 열매 및 감초 뿌리 에탄올 추출물의 구강 조직 세포에 대한 세포독성이 없는 농도에서 한국인 유래 구강에서 분리된 치수염 및 치근단질환에 관련된 구강 세균 23종(species) 35개 균주를 대상으로 항균능을 조사하여, 이들 천연추출물을 근관 세척제로 사용이 가능한지를 알아보기 위해 시행하였다.
재료 및 방법
1. 실험 재료
본 실험에 사용한 망고스틴 과피 추출물(원산지: 인도)은 Savesta 사(Gujarat, India)에서 구입하여 사용하였다. 망고스틴 과피 에탄올 추출은 80% 에탄올을 용매로 하여 60-80 ℃ 에서 4시간 동안 4회 추출하고 4 ℃에서 3시간 냉각 및 여과한 다음 1, 2, 3, 4회 추출물을 모두 혼합하여 65–80 ℃에서 농축 후 25 ℃에서 1시간 세척하였다. 세척한 시료는 60–80 ℃에서 4시간 농축한 다음 분무 건조기(Mehyun Engineering Co., Ltd., Anyang, Korea)를 이용하여 건조하였으며, 이때 분무건조 조건은 주입온도 90 ℃, 방출온도 140 ℃로 설정하여 건조하였다.
수용성 망고스틴 유도체는 선행 연구(15)에서와 같은 방법으로 준비하였다. 이를 간략히 설명하면, 망고스틴 과피 에탄올 추출물에 아르기닌(Daejung, Siheung, Korea), 정제수를 가하여 50 ℃에서 250 rpm으로 3분 동안 1차 혼합한 후 같은 방법으로 2차 혼합하였다. 2차 혼합액에 알칼리 금속 촉매로 Potassium Hydroxide (Samchun Chemicals Co. Ltd., Pyeontaek, Korea)를 첨가하여 3차 교반 및 혼합한 다음 4 ℃에서 24시간 안정화한 후 동결건조기(MG industry Co., Ltd., Gunpo, Korea)로 건조하여 사용하였다. 수용성 망고스틴 유도체는 멸균된 초순수물(deionized water)로 희석하여 다음 실험들에 사용하였다.
보골지 열매(원산지: 중국)와 감초 뿌리(원산지: 중국)는 ㈜농림생약(Seoul, Korea)에서 구입하여 사용하였다. 보골지 열매와 감초 뿌리를 물로 세척한 후에, 80% 에탄올을 용매로 하여 70 ℃에서 24시간 동안 2회 추출하고, Whatman filter paper (Grade 2, Sigma-Aldrich, St Louis, MO, USA)를 이용하여 여과한 다음, 85 ℃에서 40분간 살균하였다. 살균한 시료는 분무 건조기(Mehyun Engineering Co., Ltd., Anyang, Korea)를 이용하여 건조하였으며, 분무건조 주입온도 180 ℃이고 방출온도 80 ℃였다. 보골지 열매와 감초 뿌리 에탄올 추출물은 유기 용매인 dimethyl sulfoxide (DMSO; Sigma-Aldrich, St. Louis, MO, USA)에 녹여서 아래 실험에 사용하였다.
2. 세포 독성 시험
세포 독성 시험은 한국세포주은행(Korean Cell Line Bank, Seoul, Korea)에서 구입한 human embryonic kidney 293 cells (HEK293) 세포주를 사용하여 시행하였다. HEK 293 세포는 DMEM (GibcoBRL, Gaithersburg, MD, USA) 기본 배지에 10% fetal bovine serum (FBS; HyClone, Logan, UT, USA)과 항생제인 1% penicillin/streptomycin (Invitrogen, Grand Island, NY, USA)을 첨가하여 37 ℃ 세포 배양기에서 배양하였다. 이때 5% CO2 농도와 100% 습도가 유지되도록 하였다. 24-well plate에 HEK 293 세포를 4×104 세포가 되도록 seeding 하여 배양하였으며, plate에 세포가 80% confluence 했을 때, 수용성 망고스틴 유도체를 16, 20, 24, 28, 32, 36, 40 µg/ml, 보골지 열매 에탄올 추출물을 320, 400, 480, 500, 640 µg/ml, 감초 에탄올 추출물을 10, 20, 40, 80, 160, 320, 640 µg/ml으로 최종농도가 되도록 첨가하였다. 각각의 시료는 100배 진한 농도를 만들어 세포 배양액의 1%가 되도록 첨가하였다. 이때 음성대조군은 수용성 망고스틴 유도체에 대해서는 멸균증류수를 넣어준 군으로, 보골지 열매와 감초 뿌리는 1% DMSO가 되도록 한 군으로 정하였다. 이들을 24시간 동안 배양하였다. 그 후 세포 배양 배지만을 제거하고 발색반응에 사용할 Methylthiazolyldiphenyl-tetrazolium bromide (MTT, Sigma-Aldrich) 용액 5 mg/ml을 10%가 되도록 첨가한 배지를 각 well에 넣고, 추가로 4시간 동안 배양하였다. 생성된 formazon 결정을 DMSO (Sigma-Aldrich)로 용해시켜 ELISA reader (Epoch™ Microplate Spectrophotometer: BioTek Instruments Inc., Winooski, VT, USA)기를 이용하여 570 nm 파장에 대한 흡광도를 측정하여, 결과를 분석하였다. 각 반응은 3회 반복 시행하였다.
본 시험에서 사용된 수용성 망고스틴 유도체 용액은 MTT assay 발색반응에 간섭반응을 일으켜서, 선행연구(14)에서 실시한 세포계수법(cell counting assay)을 이용하여 세포 생존율을 측정하였다. 결과는 대조군(멸균 증류수를 넣어준 군)에 대한 백분율을 산출하여 생존한 세포 수의 평균 및 표준편차로 제시하였다. 각 반응은 3회 반복 실시하였다.
3. 세균 및 세균 배양
본 시험에서 사용한 균주는 다음과 같다; Actinomyces naeslundii (KCOM 2027), Schaalia odontolytica (KCOM 1485), Cutibacterium avidum (KCOM 1479), Cutibactrerium acnes (KCOM 1315, KCOM 1466, KCOM 1543, KCOM 1627, KCOM 1899), Dialister invisus (KCOM 1973), Enterococcus faecalis (KCOM 1083, KCOM 1161, KCOM 1162, KCOM 2816, KCOM 2823), Filifactor alocis (KCOM 3031), Olsenella uli (KCOM 2209), Parvimonas micra (KCOM 1535), Porphyromonas endodontalis (ATCC 35406T), Porphyromonas gingivalis (KCOM 2804), Prevotella intermedia (KCOM 2069), Prevotella nigrescens (KCOM 1919), Staphylococcus aureus (KCOM 1025, KCOM 1335, KCOM 1395, KCOM 1455, KCOM 1491), Streptococcus anginosus (KCOM 1467), Streptococcus constellatus (KCOM 1534), Streptococcus gordonii (KCOM 1506), Streptococcus intermedius (KCOM 1545), Streptococcus mitis (KCOM 1350), Streptococcus mutans (KCOM 2084), Streptococcus parasanguinis (KCOM 1585), Streptococcus sanguinis (KCOM 2071), Tannerella forsythia (ATCC 43037T). 이들 균주들은 사람 구강에서 분리 동정된 균주들이며, 한국구강미생물자원은행(Korean Collection for Oral Microbiology, Gwangju, Korea) 또는 American Type Culture Collection (ATCC, Manassas, VA, USA)에서 분양받아 사용하였다.
본 시험에 사용된 Capnocytophaga spp., Cutibactrerium spp., Dialister spp., Porphyromonas spp., Prevotella spp., Campylobacter spp., Olsenella uli, Parvimonas micra 균주들은 Tryptic Soy broth에 0.05% cysteine HCl-H2O, 0.5% yeast extract, 5 µg/ml hemin 및 2 µg/ml vitamin K1이 포함된 배지에서 37 ℃ 혐기성 세균배양기(BACTRONEZ, Sheldon Manufacturing Inc., Cornelius, OR, USA)을 이용하여 혐기성 조건(10% H2, 5% CO2, 85% N2)에서 배양하였다. 그리고 그 외 세균 종은 Brain Heart Infusion (Becton, Dickinson and Company) 배지에 접종하여 37 ℃ 세균배양기에서 배양하였다.
4. 최소성장억제농도(minimum inhibitory concentration, MIC) 및 최소살균농도(minimum bactericidal concentration, MBC) 값
최소성장억제농도(MIC) 및 최소살균농도(MBC) 값 측정은 Clinical and Laboratory Standards Institute (CLSI)에서 제시한 미세희석법을 변형하여 사용하였다(21). 상기의 세포독성 시험 결과 독성이 없는 농도부터 2배씩 단계 희석하여 시험하였다. 항균능을 측정할 세균들을 각자의 배지와 배양 조건에서 하루 동안 배양한 후 1×106 CFU/ml이 되도록 액체 배지로 희석하여 96-well plate에 분주하였다. 수용성 망고스틴 유도체는 멸균된 증류수를 용매로 하고, 보골지 열매와 감초 뿌리는 DMSO를 용매로 하여, 항균 실험에서 테스트하고자 하는 최고 농도보다 100배 높은 농도로 만들어, 세균 배양액이 각각의 용매(물 또는 DMSO)가 1%가 되도록 첨가하였다. 이때 음성대조군은 용매인 물 또는 DMSO를 세균배지에 1%를 첨가한 것으로 하였다. 양성대조군은 ampicillin을 100 µg/ml이 되도록 첨가한 세균배지로 설정하였다. 이들을 37 ℃에서 1–2일 동안 배양하였다. 96-well plate 상에서 육안 측정으로, 세균 성장이 보이지 않는 well의 농도 중, 최소 농도를 MIC 값으로 결정하였다. 그 후, 각 plate에서 10 µl를 취하여 한천배지에 도말하여, 이를 37 ℃에서 1–2일 동안 배양한 뒤 형성된 군락 수를 세었다. 이때, 음성대조군의 자라난 세균 수와 비교하여, 99.9% 이상의 세균이 자라지 않는 농도들 중에서 최소의 농도를 MBC 값으로 판정하였다. 각 반응은 3회 반복 실행하였다.
결 과
1. HEK 293 세포주에 대한 세포 독성
수용성 망고스틴 유도체와 보골지 열매 및 감초 뿌리 에탄올 추출물들의 HEK 293 세포주에 대한 세포독성 실험 결과는 Figure 1에 정리하였다. 수용성 망고스틴 유도체의 HEK 293 세포에 대한 세포독성 시험 결과, 20 µg/ml 농도까지 87% 이상의 세포 생존율을 보였다(Figure 1). 보골지 열매 에탄올 추출물 400 µg/ml 이하의 농도에서, 감초 뿌리 에탄올 추출물은 320 µg/ml 이하의 농도에서 HEK 293 세포에 대해 98% 또는 그 이상의 세포 생존율을 보였다(Figure 1).
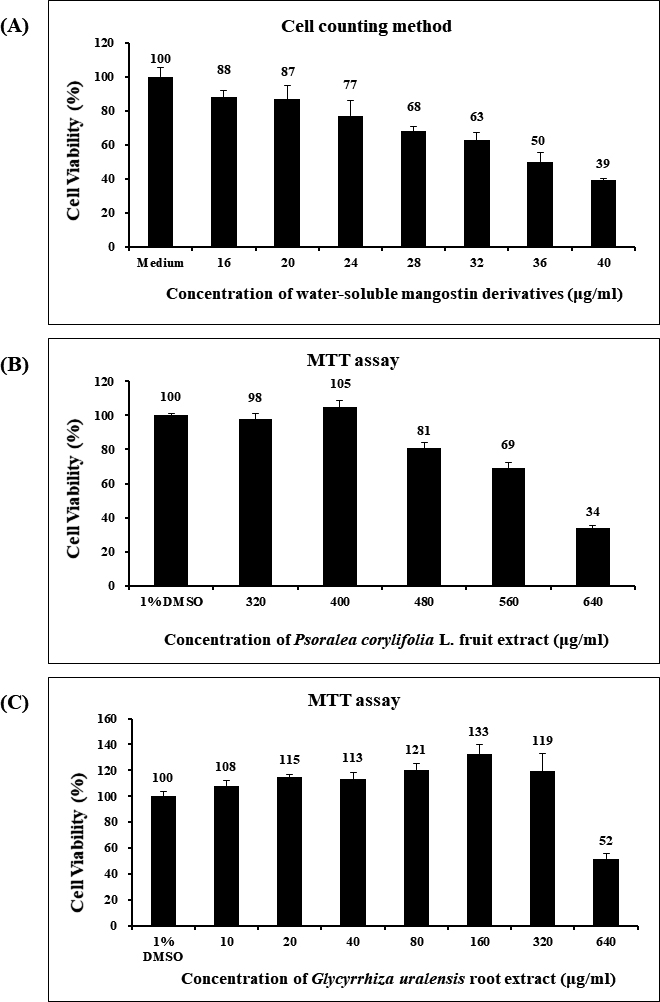
Viability of human embryonic kidney 293 (HEK 293) cells after treatment with the water-soluble mangostin derivatives of the ethanol extract of the peel of Garcinia mangostana L. (A), the ethanol extracts of the fruit of Psoralea corylifolia L. (B), and the root of Glycyrrhiza uralensis (C). The data of all experimental groups are expressed as a percentage compared to the control group.
2. 수용성 망고스틴 유도체와 보골지 열매 및 감초 뿌리 에탄올 추출물의 항균활성 효과
수용성 망고스틴 유도체에 대한 항균능 시험 결과, 본 연구에서 사용된 35 균주(23종)에 대해서 1.25–20 µg/ml 범위에서 MIC 값을, 2.5–20 µg/ml 범위에서 MBC 값을 보였다(Table 1). 보골지 열매 에탄올 추출물의 경우, D. invisus KCOM 1973 균주를 제외한 모든 균주에 대해 25–200 µg/ml 범위에서 MIC 값을, 50–200 µg/ml 범위에서 MBC 값을 나타냈다(Table 1). 감초 뿌리 에탄올 추출물의 경우, E. faecalis 5균주에 대한 항균능은 전혀 갖지 못하였고, S. aureus KCOM 1025, S. anginosus KCOM 1467, S. mutans KCOM 2084 균주들에서 320 µg/ml 농도에서 MIC 값을 가졌지만, 세균 살균능은 갖지 못하였다(Table 1). 감초 뿌리 에탄올 추출물은 상기한 8균주를 제외하고는 20–320 µg/ml 범위에서 MIC 값을, 40–320 µg/ml 범위에서 MBC 값을 보였다(Table 1).
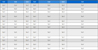
Summary of the antimicrobial activity of water-soluble mangostin derivatives of the ethanol extract of the peel of Garcinia mangostana L. and ethanol extracts of the fruit of Psoralea corylifolia L. and the root of Glycyrrhiza uralensis against the pulpitis- and periapical disease-causative bacteria
고 찰
본 연구에서 수용성 망고스틴 유도체와 보골지 열매 및 감초 뿌리 에탄올 추출물들의 HEK 293 세포주에 대한 세포생존율을 조사한 결과, 망고스틴 과피 에탄올 추출물의 수용성 망고스틴 유도체는 20 µg/ml 농도 이하에서, 보골지 열매 에탄올 추출물은 400 µg/ml, 감초 뿌리 에탄올 추출물은 320 µg/ml 이하의 농도에서 각각 87%, 98%, 108% 이상의 생존율을 보였다(Figure 1). 이러한 세포독성 시험의 결과를 토대로 항균능 실험에서 수용성 망고스틴 유도체, 보골지 열매 에탄올 추출물 및 감초 뿌리 에탄올 추출물의 최고 농도를 각각 20, 400 및 320 µg/ml을 정하여 치수 및 치근단 질환과 관련이 있다고 알려진 35균주(23종)의 구강 세균을 대상으로 항균 시험을 진행하였다. 그 결과, 수용성 망고스틴 유도체는 본 연구에서 사용한 모든 균주에서 항균능을 보였다(Table 1). 보골지 열매 에탄올 추출물은 D. invisus 균주를 제외하고 항균능을 보였다. 반면에, 감초 뿌리 에탄올 추출물은 E. faecalis 5균주를 제외한 모든 균주에서 최소성장억제농도 값을 보였으며, E. faecalis, S. aureus 한 균주(KCOM 1025), S. anginosus, S. mutans 균주들을 제외하고 최소살균농도 값을 가졌다(Table 1). 대표적인 치근단 치주염 유발 및 치료 실패 주요 원인세균으로 알려진 E. faecalis는 치료된 치아에서 가장 흔하게 잔존하며 검출율이 90%에 이른다(21). 본 연구에서 수용성 망고스틴 유도체와 보골지 열매 에탄올 추출물은 모두 E. faecalis에 대해 항균능을 보였다. 반면에 감초 뿌리 에탄올 추출물은 세포독성이 없는 농도에서는 항균능이 없었다. 선행연구 결과에서 망고스틴 과피 에탄올 추출물 자체에서도 한국인에서 분리된 E. faecalis 균주들에 대해서 항균효과가 우수한 것으로 확인되었다(13). 수용성 망고스틴 유도체는 망고스틴 과피 에탄올 추출물에 존재하는 알파-망고스틴에 L-아르기닌을 치환시킨 것으로, 이로 인해 수용성 특성을 갖게 된다. 그러므로, 수용성 망고스틴 유도체는 근관 및 치근단 조직에 더 잘 용해되어, 비수용성인 알파-망고스틴보다 향상된 항균력을 보일 것으로 생각된다. 이러한 연구 결과, 망고스틴 과피 에탄올 추출물의 수용성 망고스틴 유도체, 보골지 열매 에탄올 추출물, 감초 뿌리 에탄올 추출물 순으로 치수 및 치근단 질환 치료 시 근관세척제로 사용이 가능할 것으로 생각된다.
망고스틴 과피 에탄올 추출물 중 크산톤 성분은 진통, 항종양, 항염, 및 항산화 등의 약리작용을 하는 활성성분을 갖고 있을 뿐만 아니라 S. aureus, E. coli, Shigella dysentriae, Flavobacterium, 및 Enterobacter에 대해 항균 효과가 있음이 보고되었다(11, 12). 여러 크산톤 성분 중 알파-망고스틴은 항균능이 우수함이 입증되었다(22). 본 연구에서 수용성 망고스틴 유도체의 항균능은 주로 L-아르기닌으로 치환된 알파-망고스틴에 의한 것으로 생각된다. 이러한 근거는 수용성 망고스틴을 물에 녹일 때, 완전히 물에 녹지 않는 성분들이 있어, 이를 원심분리시켜 제거한 다음 항균실험을 실시할 때에도 동일한 MIC/MBC 값이 조사되었기 때문이다(data not shown). 하지만, 이를 최종 증명하기 위해서는 향후 연구에서 순수한 L-아르기닌으로 치환된 알파-망고스틴을 이용하여 항균능을 측정하는 실험이 필요하다.
보골지(Psoralea corylifolia L.)는 콩과에 속하는 한해살이 개암풀로 P. corylifolia에는 여러 플라보노이드 및 페놀성 물질들을 함유하여 항균 및 항돌연변이 등 여러가지 생리활성을 갖는 것으로 알려져 있다(16, 17). 이러한 성분 중에서 바쿠치올(bakuchiol)은 S. mutans, S. sanguis, S. salivarius, S. sobrinus, E. faecalis, E. faecium, L. acidophilus, L. casei, L. plantarum, A. viscosus, 및 P. gingivalis에 대한 MIC 값이 1–4 µg/ml로 항균활성이 높음이 조사되었다(23). 이러한 연구 결과에 의하면, 보골지 열매 에탄올 추출물의 주요한 항균능을 갖는 물질은 바쿠치올이라고 생각된다. 하지만, 향후 실험에서 보골지 열매 에탄올 추출물의 크로마토그래피 등의 방법을 이용하여 항균능을 갖는 순수한 화합물을 분리 정제하는 연구가 필요할 것이라 판단된다.
감초 뿌리에는 liquiritigenin 및 사포닌 계통의 감미성분인 glycyrrhizin이 표준 물질이며, 항염증, 항균, 항산화 및 항바이러스 등 다양한 활성을 보여 약용으로 많이 사용되고 있다(18, 19). 본 연구에서 감초 뿌리 에탄올 추출물은 그람 양성균인 S. mutans와 E. faecalis에서 MIC 값이 320 µg/ml 이상으로 항균활성이 낮게 나타난 것에 비해, 그람 음성균인 P. endodontalis, P. micra, P. gingivalis 균주에서 20–40 µg/ml으로 항균활성이 높게 나타났다. 하지만, 다른 연구에서는 95% 에탄올로 상온에서 12시간 추출하여 조제한 유럽산 감초 에탄올 추출물은 그람 음성균에 대해서 250 µg/ml 이상으로 항균활성이 낮았으나, S. mutans, S. aureus, L. monocytogenes, 및 B. subtilis 균주에 대한 MIC 값이 25 µg/ml으로 그람 양성균에 대한 탁월한 항균활성을 가진다고 보고 하였다(24). 이는 감초 추출물의 원산지와 추출하는 방법에 따라 차이가 나타난 것이라 생각된다.
결 론
본 연구는 수용성 망고스틴 유도체, 보골지 열매, 및 감초 뿌리 에탄올 추출물을 이용하여 치수 및 치근단 질환 원인균에 대해 항균효과를 조사하여 근관세척제로 사용 가능한지 평가하기 위해 시행하였다. 수용성 망고스틴 유도체, 보골지 열매 에탄올 추출물, 감초 뿌리 에탄올 추출물은 각각 20, 400, 320 µg/ml 이하의 농도에서 87%, 98%, 108% 이상의 세포생존율을 보였다. 천연추출물 3종에 대한 항균활성 결과, 수용성 망고스틴 유도체 및 보골지 열매 에탄올 추출물은 D. invisus KCOM 1973 균주를 제외하고, 감초 뿌리 에탄올 추출물은 8균주를 제외한 모든 치수 및 치근단 질환 원인균 35 균주에 대해 항균 활성을 가졌다. 즉, 3종의 천연추출물 중 수용성 망고스틴 유도체가 가장 높은 항균활성을 보였으며, 본 연구에서 사용된 3개 천연물 중 근관세척제로 사용 가능성이 가장 높았다.
Acknowledgments
본 연구는 (주)메디바이오랩의 연구지원비(2020-0535)에 의해 수행한 결과임.
References
- Cohen S, Burns RB. Orofacial Dental Pain Emergencies. Pathways of the pulp 8th ed., Mosby, Inc., St. Louis, USA. 2002;31-75.
-
Lin LM, Pascon EA, Skribner J, Gangler P, Langeland K. Clinical, radiographic, and histologic study of endodontic treatment failures. Oral Surg Oral Med Oral Pathol. 1991;71(5):603–11.
[https://doi.org/10.1016/0030-4220(91)90371-I]

-
Nair PNR. On the causes of persistent apical periodontitis: a review. Int Endod J. 2006;39(4):249–81.
[https://doi.org/10.1111/j.1365-2591.2006.01099.x]

-
Siqueira JF Jr. Aetiology of root canal treatment failure: why well-treated teeth can fail. Int Endod J. 2001;34(1):1–10.
[https://doi.org/10.1046/j.1365-2591.2001.00396.x]

-
Sharaf NF, Alshareef WA. The comparative evaluation of the post-antimicrobial effect of MTAD® and 2% chlorhexidine against Enterococcus faecalis of permanent teeth with necrotic pulp. Open Access Maced J Med Sci 2019;7(19):3270-5.
[https://doi.org/10.3889/oamjms.2019.570]

-
Holt DM, Watts JD, Beeson TJ, Kirkpatrick TC, Rutledge RE. The anti-microbial effect against Enterococcus faecalis and the compressive strength of two types of mineral trioxide aggregate mixed with sterile water or 2% chlorhexidine liquid. J Endod. 2007;33(7):844-7.
[https://doi.org/10.1016/j.joen.2007.04.006]

-
DeusAviv FP, Ouanounou A. Chlorhexidine in dentistry: pharmacology, uses, and adverse effect. Int Den J. 2022;72(3):269-77.
[https://doi.org/10.1016/j.identj.2022.01.005]

-
Kim MJ, Kim JY Kim, Lim SM. Accidental extrusion of sodium hypochlorite during endodontic treatment in a primary tooth. Korean Acad Pediatr Dent. 2015;42(3):264-9.
[https://doi.org/10.5933/JKAPD.2015.42.3.264]

-
Chandrappa PM, Dupper A, Tripathi P, Arroju R, Sharma P, Sulochana K. Antimicrobial activity of herbal medicines (tulsi extract, neem extract) and chlorhexidine against Enterococcus faecalis in endodontics: an in vitro study. J Int Soc Prev Community Dent. 2015;5(2):S89–S92.
[https://doi.org/10.4103/2231-0762.172952]

-
Vishnuvardhini S, Sivakumar A, Ravi V, Prasad AS, Sivakumar JS. Herbendodontics – phytotherapy in endodontics: A Review. Biomed Pharmacol J. 2018;11(2):1073-82.
[https://doi.org/10.13005/bpj/1468]

-
Jung HA, Su B, Keller WJ, Mehta RG, Kinghorn AD. Antioxidant xanthones from the pericarps of Garcinia mangostana (mangosteen). J Agric Food Chem. 2006;54(6):2077-82.
[https://doi.org/10.1021/jf052649z]

- Chitra S, Krithika MV, Pavithra S. Induction of apoptosis by xanthones from Garcinia mangostana in human breast and laryngeal carcinoma cell lines. Int J Pharma and Bio Sciences. 2010;1(3):1-8.
-
Park TY, Lim YK, Lee DS, Kook JK. Antimicrobial effect of ethanol extract of Garcinia mangostana L. against Enterococcus faecalis isolated from human oral cavity. Int J Oral Biol. 2018;43(3):129-32.
[https://doi.org/10.11620/IJOB.2018.43.3.129]

-
Lim YK, Yoo SY, Park SN, Lee DS, Kook JK. Antimicrobial activity of Garcinia mangostana L. ethanol extract against Cutibacterium acnes and Staphylococcus aureus. Int J Oral Biol. 2019;44(3):101-7.
[https://doi.org/10.11620/IJOB.2019.44.3.101]

-
Park TY, Lim YK, Kim JH, Lee DS, Kook JK. The antibacterial effect of Endoseal TCS mixed with water-soluble mangostin derivatives of Garcinia mangostana L. ethanol extract against Enterococcus faecalis and Staphylococcus aureus. Int J Oral Biol. 2021;46(1):45-50.
[https://doi.org/10.11620/IJOB.2021.46.1.45]

- Shin SY, Bajpai VK, Hou CT, Choi UK, Kim HR, Kang SC. Antibacterial activity of bioconverted linoleic acid produced by Pseudomoneas aeruginosa PR3. Agric Chem Biotechnol. 2005;48(4):167-9.
-
Yin S, Fan C-Q, Wang Y, Dong L, Yue J-M. Antibacterial prenylflavone derivatives from Psoralea corylifolia, and their structure-activity relationship study. Bioorg Med Chem. 2005;12(16):4387-92.
[https://doi.org/10.1016/j.bmc.2004.06.014]

-
Matsuia S, Matsumotoc H, Sonodab Y, Andob K, Aizu-Yokotab E, Satoc T, et al. Glycyrrhizin and related compounds down-regulate production of inflammatory chemokines IL-8 and eotaxin 1 in a human lung fibroblast cell line. Int Immuno pharmacol. 2004;4(13):1633-44.
[https://doi.org/10.1016/j.intimp.2004.07.023]

-
Wolkerstorfer A, Kurz H, Bachhofner N, Szolar OHJ. Glycyrrhizin inhibits influenza a virus uptake into the cell. Antiviral Res. 2009;83(2):171-8.
[https://doi.org/10.1016/j.antiviral.2009.04.012]

-
Ahn SJ, Cho EJ, Kim HJ, Park SN, Lim YK, Kook JK. The antimicrobial effects of deglycyrrhizinated licorice root extract on Streptococcus mutans UA159 in both planktonic and biofilm cultures. Anaerobe. 2012;18(6):590-6.
[https://doi.org/10.1016/j.anaerobe.2012.10.005]

- Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; Approved Standard. Ninth ed. CLSI document M7-A8. USA:Wayne Pennsylvania;2012.
-
Yuanita T, Dina R, Karlina S. Cytoxicity test of NaOCl and Mangosteen (Garcinia Mangostin L.) peel extract used as an irrigation solution in human periodontal ligament fibroblast cells (HPdLFc). Den J (Majalah Kedokteran Gigi) 2018;51(3):133-7.
[https://doi.org/10.20473/j.djmkg.v51.i3.p133-137]

-
Katsura H, Tsukiyama R-I, Suzuki A, and Kobayashi M. In vitro antimicrobial activities of bakuchiol against oral microorganisms. Antimicrob Agents Chemother. 2001;45(11):3009–13.
[https://doi.org/10.1128/AAC.45.11.3009-3013.2001]

- Kim S-J, Shin J-Y, Park YM, Chung KM, Lee JH, Kweon D-H. Investigation of antimicrobial activity and stability of ethanol extracts of licorice root (Glycurrhiza glabra). Korean J Food Sci Technol. 2006;38(2):241-8.