가시광선 매개 ZnO 코팅 TiO2 나노튜브의 항균 효과 평가
초록
본 연구에서는 가시광선 조사 하에서 ZnO가 코팅된 TiO2 나노튜브(ZnO-TNT)의 항균 효과를 평가하였다. TiO2 나노튜브 표면에 ZnO를 화학적 침지 증착 기법을 이용하여 코팅하였으며, 다양한 코팅 시간(1, 3, 5시간)에 따른 항균 효과를 분석하였다. 광학적 특성 평가 결과, ZnO 코팅이 증가할수록 광흡수 특성이 향상되었다. 메틸렌블루광분해 실험을 통해 ZnO-TNT가 가시광선(470 nm) 조사 시 대조군(TiO2 나노튜브)보다 높은 광촉매 활성을 나타내었다. 그람양성균(Staphylococcus aureus) 및 그람음성균(Pseudomonas aeruginosa)에 대한 항균 평가에서, 가시광선 조사 시 모든 ZnO-TNT 실험군이 대조군보다 우수한 항균 활성을 보였으며, 특히 ZnO-TNT-5 실험군에서 가장 효과적인 항균 활성이 확인되었다(p<0.05). Live/Dead assay 및 MTT 분석을 통한 세포 독성 평가 결과, ZnO-TNT 실험군은 생체적합성이 우수함을 나타냈다. 본 연구 결과를 통해, ZnO가 코팅된 TiO2 나노튜브는 가시광선 조사 조건에서 효과적인 항균 활성을 가지며, 향후 의료용 표면 개질 기술 및 바이오소재 응용 분야에서 활용될 가능성이 높음을 확인하였다.
Abstract
In this study, the antibacterial effect of ZnO-coated TiO2 nanotubes (ZnO-TNT) under visible light irradiation was evaluated. ZnO was coated on the surface of TiO2 nanotubes using a chemical immersion deposition technique, and the antibacterial effect was analyzed according to different coating times (1, 3 and 5 hours). Optical characterization revealed that the increase in ZnO coating enhanced light absorption characteristics. Methylene blue photodegradation experiments confirmed that ZnO-TNT exhibited higher photocatalytic activity under 470 nm visible light irradiation compared to the control group (TiO2 nanotubes). In the antibacterial evaluation against Gram-positive Staphylococcus aureus and Gram-negative Pseudomonas aeruginosa, all ZnO-TNT groups exhibited superior antibacterial activity compared to the control group under visible light irradiation, with ZnO-TNT-5 showing the most effective antibacterial activity (p<0.05). The excellent biocompatibility of ZnO-TNT was confirmed through Live/Dead assay and MTT analysis. In conclusion, the findings of this study demonstrate that ZnO-coated TiO2 nanotubes possess effective antibacterial activity under visible light irradiation, highlighting their potential application in medical surface modification technologies and biomedical material development.
Keywords:
Visible light, ZnO, TiO2 nanotubes, Antibacterial effect, Biocompatibility키워드:
가시광선, TiO2 나노튜브, 항균 효과, 생체적합성서 론
나노 소재는 독특한 물리화학적 특성으로 인해 생물의학 및 환경 분야에서 큰 주목을 받고 있다. 그 중에서도 TiO2 나노튜브(TiO2 Nanotubes: TNT)는 광촉매, 항균 및 생체 적합성 특성으로 인해 널리 연구되어 왔다. 특히 가시광선 조사 하에서 광촉매 효율을 향상시키기 위한 유망한 접근법으로 그래핀 산화물, 산화아연(ZnO) 또는 산화세륨 (CeO) 등의 금속산화물을 접목시켜 TiO2의 광촉매 파장 범위를 변형시키는 것이 각광받고 있다(1-3). 이러한 금속산화물들 중에서 와이드 밴드갭 반도체의 특성을 가진 ZnO는 자체적으로 뛰어난 항균 특성으로 잘 알려져 있어 TiO2 기반 나노 구조의 기능성 코팅에 가장 적합하다고 볼 수 있다. 특히 부착형 미생물과 부유형 미생물이 공존하는 공간에서는 ZnO의 자체적인 항균 기능과 가시광 기반의 광촉매 효과로 인한 항균 기능을 복합적으로 사용할 수 있으므로, ZnO와 TiO2 나노튜브(ZnO-TNT)의 조합은 항균 기능을 가진 표면처리 기술에 대한 잠재적인 능력을 가지고 있으며 이러한 특성은 구강 내 환경에서 세균 감염을 줄이고, 치과용 재료의 수명을 연장할 수 있는 표면개질을 위한 혁신적인 기술로 적용될 수 있다(4-6).
일반적으로 ZnO 나노물질의 항균 활성은 광촉매 효과를 기반으로 하는 활성 산소종(reactive oxygen species, ROS) 생성, 표면 전하 상호 작용, 박테리아 막의 기계적 파괴의 기전을 따르거나, 자체적으로 산화 스트레스를 촉진하는 Zn2⁺ 이온을 방출하여 미생물 억제에 기여한다는 특징을 가지고 있다(7, 8). 또한, TiO2는 자외선(ultraviolet, UV)에 노출되면 강력한 살균 효과를 나타내는 하이드록실 라디칼과 슈퍼옥사이드 음이온을 생성한다. 하지만 넓은 밴드갭(~3.2eV)으로 인해 가시광선 아래에서의 활성은 상대적으로 제한적이다(9, 10). 이러한 한계를 극복하기 위해 유사한 밴드갭(~3.3eV)과 고유한 항균 특성을 가진 ZnO를 TiO2와 중첩시켜 밴드갭의 폭을 감소시킴으로써 자외선보다 더 낮은 에너지를 가진 가시광선 조사에서 광촉매 효과에 의한 항균능과 ZnO 자체의 항균능을 동시에 발현할 수 있다(11, 12).
여러 연구에서 ZnO와 TiO2 조합의 유기물 분해 및 항균 특성을 조사하여 다양한 유기물 및 미생물 환경에서의 수처리 정화효과 및 항균효과에 대한 연구결과를 발표하였다(11, 12). 그러나 가시광선 조사에서 ZnO가 코팅된 TiO2 나노튜브(ZnO-TNT)의 시너지 효과는 아직 자세하게 규명되지 않은 상태이다. ZnO와 TiO2 각각의 물질에 대한 선행 연구는 자외선 기반 광촉매 효과에 기반을 두고 있으므로(10, 13-15), 가시광선 조건에서 ZnO-TNT의 효능과 메커니즘에 대한 평가는 아직 제대로 밝혀지지 않았다. 또한 ZnO 코팅 두께, 증착 기술, 구조적 변형이 항균 효율에 미치는 영향은 체계적으로 평가되지 않았다. 따라서, 가시광선 조건에서 실제 항균 기능의 활용화를 위하여 ZnO-TNT 표면처리 기술을 최적화하려는 점에서 기존 연구와 차별화된다.
본 연구의 목적은 ZnO 코팅 조건에 따른 ZnO-TNT의 표면특성분석을 수행하여 가시광선 하에서 가장 광촉매 효과가 우수한 코팅 조건을 선별하여, ZnO-TNT 항균 기능을 극대화하고자 하는 것이다. 또한, ZnO-TNT의 구조적 및 화학적 특성을 분석하여 형태와 항균 효능 사이의 상관관계를 규명하고자 한다. 본 연구에서는 ZnO 코팅 조건이 ZnO-TNT의 표면 특성과 항균 효능에 유의한 영향을 미치지 않는다는 귀무가설을 수립하였다.
재료 및 방법
1. ZnO-TNT 시편 제작
ZnO-TNT는 먼저 티타늄 판(5×5 cm2, 99.5%; Hyundai Titanium Co., South Korea)을 아세톤, 에탄올 및 증류수의 순서로 세척한 후, 0.5 wt% 불산(purity: 48%, Sigma-Aldrich, St. Louis, MO, USA)을 전해질 용액으로 하여 양극산화(20 V, 30분) 하여 성장시켰다. ZnO는 열분해 공정과 함께 화학적 침지 증착기술을 사용하여 100 nm 직경의 TiO2 나노튜브 표면에 다양한 시간 동안 코팅되어 ZnO-TNT 시편을 제작하였다. 먼저 TiO2 나노튜브를 0.1 M 황산(H2SO4, Sigma-Aldrich, St. Louis, MO, USA) 용액에 90분간 담근 다음 70℃ 오븐(JSOF-150, JSR Co., Seoul, Korea)에서 0.05 M 황산아연 7수화물 (ZnSO4·7H2O, Sigma-Aldrich, St. Louis, MO, USA )를 함유한 H2O/에탄올(4:1) 용액에 1, 3, 5시간 동안 각각 담근 후 증류수로 헹군 후 공기 중에서 건조하였다. 그 후 550℃에서 2시간 열처리(JSMF-45T, JSR Co., Seoul, Korea)시켜 ZnO-TNT 이종 구조를 이루는 3종의 실험군 [(ZnO-TNT-1), (ZnO-TNT-3), (ZnO-TNT-5)]과 대조군(TNT)을 제작하였다.
2. 표면특성분석
TiO2 나노튜브 위에 증착된 아연 산화물의 구조 및 형태는 전계방사 주사전자현미경(Field emission scanning electron microscope: FE-SEM, JSM-6360, JEOL Ltd., Tokyo, Japan)으로 관찰(가속 전압: 15 Kv, 배율: ×100,000)하였고, 화학 조성은 에너지 분산형 X-선 분광기(Energy dispersive x-ray spectrometer(EDX); Oxford instruments Analytical 7582, Oxford instruments Co., High Wycombe, UK)로 분석 (가속 전압: 10 Kv)하였다.
시편의 표면 특성은 확산 반사 자외선-가시광선-근적외선 분광광도계(측정 범위: 300-1000 nm; SolidSpec-3700; Shimadzu Co., Kyoto, Japan)를 사용하였고, 확산반사 측정 값은 다음의 공식으로 계산되어 Tauc plot으로 변환되었다(16).
(αhν)1/n = A (hν –Eg)
여기서 α, hν, A, 그리고 Eg는 각각 흡수 계수, 입사광 주파수, 비례 상수, 그리고 밴드갭을 나타낸다. 지수 ‘n’의 값은 전자 전이의 특성을 결정하며, ZnO는 직접 밴드갭의 특성을 나타내지만(17), 주된 나노구조를 구성하는 아나타제(anatase) 결정질 TiO2가 간접 밴드갭을 나타내므로, 본 연구에서는 이에 해당하는 지수 값인 2를 채택하였다(18). Tauc 플롯에서 (αhν)1/n의 선형 외삽을 Y축이 0이 되는 지점까지 연장하면, 시료의 광학적 밴드갭 에너지를 얻을 수 있다.
3. 메틸렌블루(Methylene Blue: MB) 광분해 실험
MB 분해 실험은 470 nm의 가시광선에서 ZnO-TNT 시편을 12 well plate에 1 ppm MB (Sigma-Aldrich, St. Louis, MO, USA) 용액 1 mL에 첨가하였다. 그런 다음 470 nm 가시광선(전력 밀도: 5.5 mW/cm2 , 시편과 LED 사이의 거리 = 4 cm)을 15분, 30분 동안 조사하였다. 가시광선 조사 후, MB 용액의 흡광도는 UV-Vis 분광기(UV mini-1240, Shimadzu Co., Kyoto, Japan)를 사용하여 파장 범위(665 nm)를 기준으로 평균값을 이용하여 분석하였다. MB 용액의 농도는 Beer의 법칙으로 흡광도와 비례하므로 광조사 후 MB 용액의 흡광도(C)를 초기 흡광도(C0)로 나누어 MB 분해 용액농도를 계산하였다. 따라서 측정된 665 nm MB 흡수 파장의 대조군(TNT) 초기 흡광도 대비 광조사 후의 MB 용액 농도를 계산 (C/C0)하여 시간에 따른 MB 광분해 거동을 계산하였다.
4. 집락 형성 단위수(Colony Forming Unit: CFU) 측정
Staphylococcus aureus (ATCC 25923, Manassas, VA, USA)와 Pseudomonas aeruginosa (PA14) 균주를 사용하여 470 nm 가시광선의 광조사 유·무에 따른 항균 효과를 평가하였다. 먼저 박테리아 균주는 37℃ 배양기에서 각각 Trypticase soy agar (TSA, Difco, NJ, USA)와 Luria-Bertani (LB; 1% peptone, 0.5% yeast extract, 0.5% NaCl) 배지에서 24시간 동안 배양하였다. 24시간 배양한 후, 부유 액의 세균 수를 측정하여 1×105 CFU/mL로 세균 농도를 희석시킨 뒤, 시편 위에 50 μL를 떨어뜨리고 다시 37℃ 배양기에서 6시간 동안 배양하였다. 배양 후, 950 μL PBS (Invitrogen, Thermo Fisher Scientific, Waltham, MA, USA)로 시편을 수세하였고, 광분해 초기 반응 효율 평가를 위해 470 nm 가시광선을 15분간 조사 후, 1×PBS를 넣은 균주 액 100 μL 취하여 각각 TSA 배지와 LB 배지에 도말하였고 37℃ 배양기에서 24시간 배양 후, 생성된 세균의 군집 수(CFUs)를 세었다(19).
5. Live/dead assay 및 MTT assay
Live/dead assay는 먼저 시편 위에 인간 중간엽 줄기세포(hMSCs; Lonza, Basel, Switzerland)를 1×104 cells/24 well 농도로 분주하였다. hMSC와 함께 24시간 동안 배양한 후 시편에 470 nm 가시광선을 10분간 조사하였다. 광조사에 의한 광촉매 반응에 의해 생성되는 활성산소종(ROS)은 항균 효과를 유도하지만, 일정 수준 이상이면 정상 세포에도 영향을 미칠 수 있다. 따라서 세포 보호를 위해 광조사 시간을 10분으로 조절하였다. 가시광선 조사 24시간 및 48시간 후, 1×PBS 용액(500 μL)에 희석한 calcein AM (2 μM/mL; Invitrogen, Thermo Fisher Scientific, Waltham, MA, USA) 및 ethidium homodimer-1 (4 M/mL; Invitrogen, μ MA, USA)을 각 well에 첨가하였다. 37℃ CO2 배양기(MCO175, SANYO Electric Biomedical Co., Osaka, Japan)에서 30분 염색 후, 형광 현미경(배율: ×100; CKX41; Olympus Co., Tokyo, Japan)을 사용하여 살아있는(녹색) 세포와 죽은(적색) 세포를 관찰하였다. MTT assay의 hMSC 배양 및 광 조사의 조건 및 절차는 Live/dead 분석과 동일하였다. 가시 광선 조사 24시간 및 48시간 후, MTT (Sigma-Aldrich, St Louis, MO, USA)용액 100 μg/mL을 각 well에 첨가하고, MTT 용액으로 처리한 검체를 5% CO2 인큐베이터에서 37℃에서 배양하였다. 4시간 후, 새로운 well에 검체를 옮긴 후 DMSO (Sigma-Aldrich, MO, USA)를 첨가하여 MTT 용액에서 생성된 포르마잔(formazan)을 용해시켰다. 최종 용액의 흡광도는 ELISA 플레이트 리더(SpectraMAX mini; Molecular Devices, San Jose, CA, USA)를 사용하여 570 nm에서 측정하였다.
6. 통계분석
모든 실험은 3회 반복하여 수행했으며, SPSS Ver. 23.0(SPSS Inc, Chicago, IL, USA)을 이용하여 일원 배치 분산 분석(One-way ANOVA)을 시행하였다. 사후검정으로 Duncan test를 시행하였으며, 유의수준은 0.05로 설정하였다.
결 과
1. ZnO-TNT의 표면특성분석
FE-SEM 결과, ZnO 용액 내 TNT 시편의 침지 증착 시간의 증가에 따른 ZnO-TNT의 구조 및 형태의 두드러진 변형은 관찰되지 않았다. EDX 분석결과, 0.95~3.58 wt% 아연(Zn)의 함량을 확인할 수 있었다(Figure 1, Table 1).
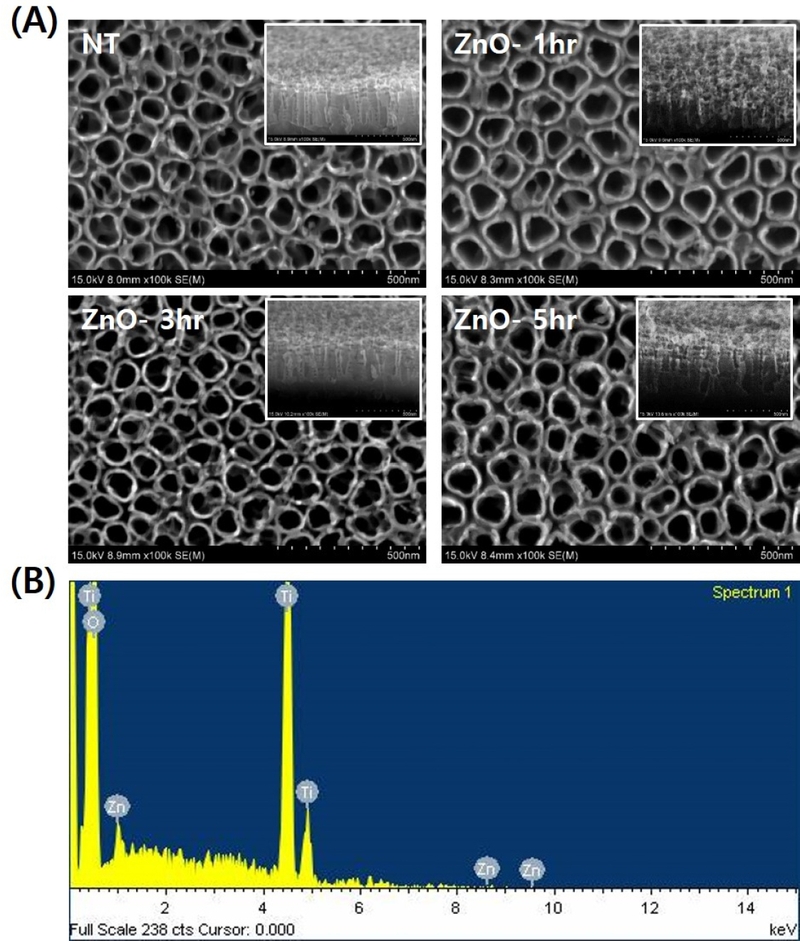
(A) FE-SEM micrographs (×100,000) showing the top view of ZnO-TNT (the inserted top right images display the oblique sectional view) and (B) the surface elements of ZnO-TNT as analyzed by EDX.
ZnO-TNT의 침지 증착 시간에 따른 diffusive UV-Vis-NIR spectra를 측정한 값으로부터 계산된 Tauc 플롯결과, TiO2 나노튜브는 3.2 eV 밴드갭(band gap)을 가지고 있고, ZnO-TNT-1 실험군은 3.2 eV, ZnO-TNT-3 실험군은 2.77 eV, ZnO-TNT-5 실험군은 2.83 eV 밴드갭(band gap)으로 TiO2 나노튜브 표면 위에 ZnO의 침지 증착 시간이 늘어날수록 가시광선 영역의 광 흡수 효율도 같이 증가되고 있는 것을 볼 수 있었다(Figure 2).
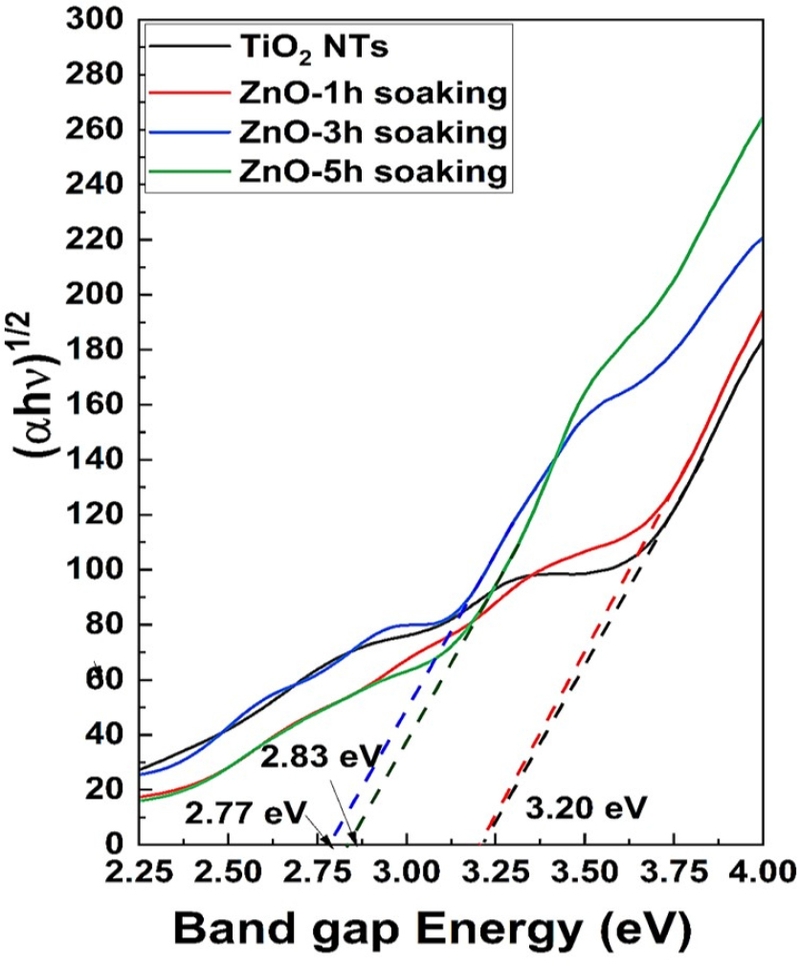
Band gap of experimental groups tested using diffuse reflectance UV–Vis-NIR spectra. As a result of the Tauc plot analysis, the band gap of TNT nanotubes is 3.20 eV, indicating that photocatalytic activity can be expected mainly in the UV region. However, the band gaps of ZnO-TNT-3 and ZnO-TNT-5 decrease to 2.77 eV and 2.83 eV, respectively, showing a photocatalytic effect in the visible light region.
2. 메틸렌블루(Methylene blue: MB)의 광분해 특성
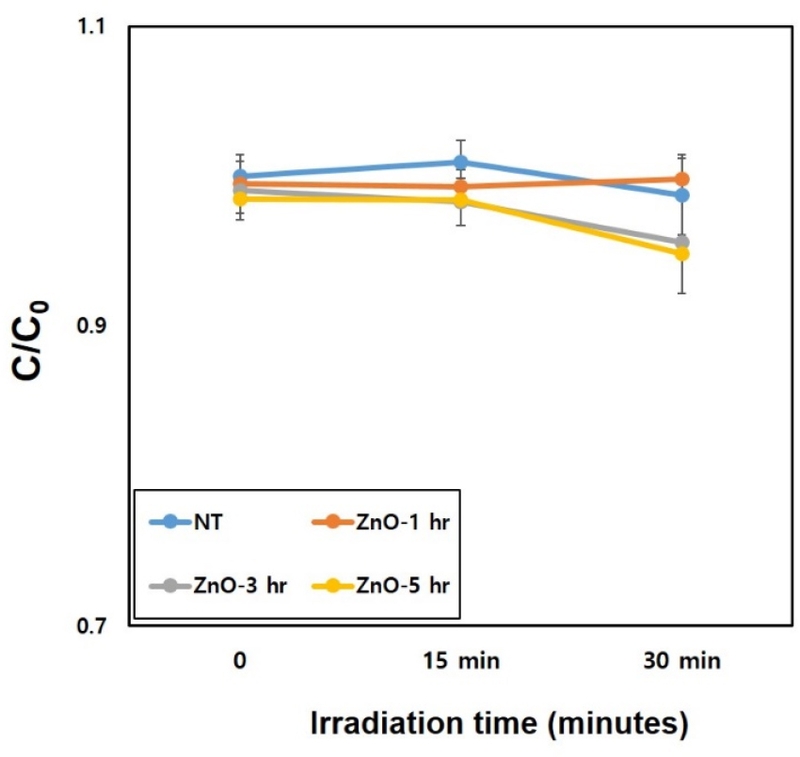
MB 용액과 ZnO-TNT의 광분해 특성을 조사하기 위하여 MB 수용액 상에서 측정한 결과, 470 nm 가시광선 광조사 15분 후 ZnO-TNT시편 모두 대조군(TNT) 보다 낮았지만 통계적인 유의차는 없었다(p>0.05). 또한, 광조사 30분 조사시 ZnO-TNT-5 실험군이 다른 실험군들에 비해서 가장 낮은 광분해 효율을 보였지만 통계적인 유의성은 없었다(p>0.05, Figure 3).
3. 항균능 평가
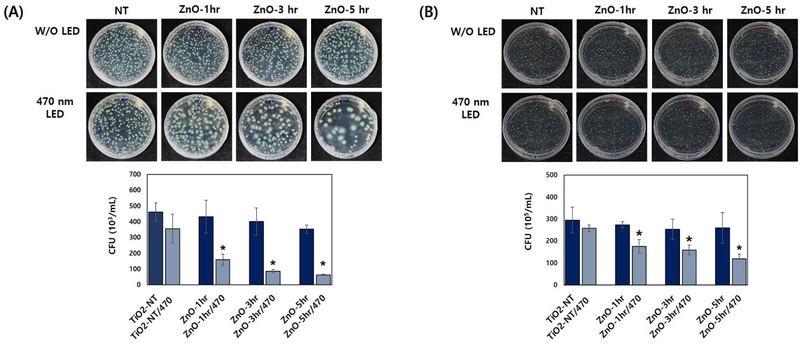
그람음성균 P. aeruginosa 와 그람양성균 S. aureus 에 대한 항균능 평가를 실시한 결과를 Figure 4에 나타내었다. P. aeruginosa CFU 시험 결과, ZnO-TNT의 침지 증착 시간이 증가할수록 대조군(TNT) 보다 낮은 CFU 값을 보였지만 통계적인 유의성은 없었다(p>0.05). 하지만, 470 nm 가시 광선 조사 시, 모든 ZnO-TNT 실험군 CFU 값이 대조군(TNT) CFU 값보다 유의미하게 낮은 값을 보였고, 그 중 ZnO-TNT-5 실험군이 가장 낮은 CFU 값을 보였다(p<0.05, Figure 4). S. aureus CFU 시험 결과, 모든 ZnO-TNT 실험군 CFU 값들이 대조군(TNT)의 CFU 값과 유사한 결과를 나타내었다(p>0.05). 그러나, 470 nm 가시광선 광조사 조건에서는 모든 ZnO-TNT 실험군의 CFU 값들이 대조군(TNT) CFU 값보다 유의미하게 낮았고, ZnO-TNT-5 실험군이 가장 낮은 CFU 값을 보였다(p<0.05, Figure 4).
4. 세포독성 평가
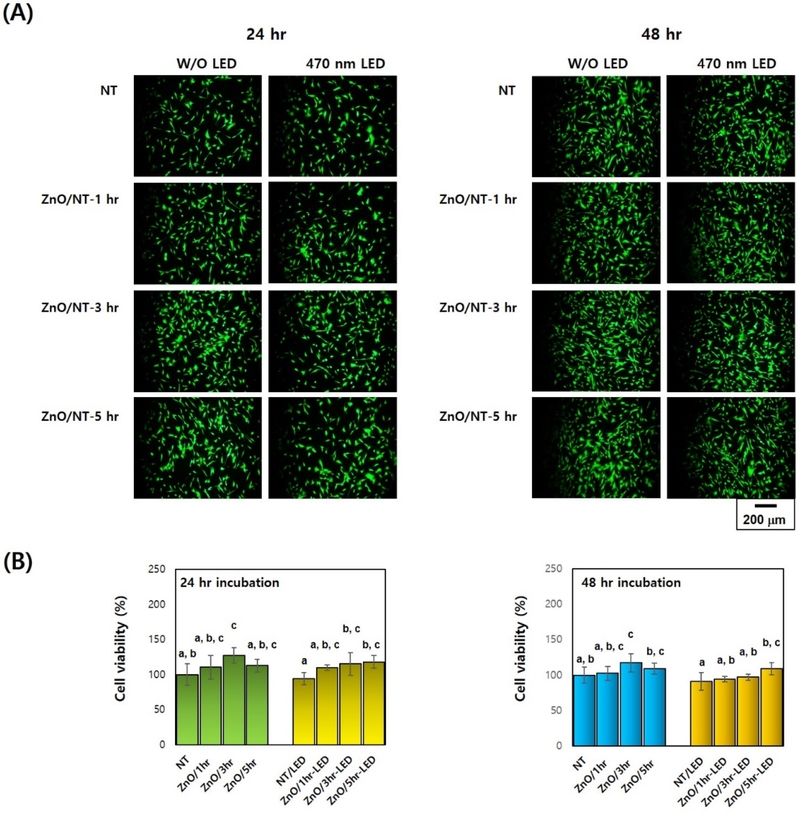
Live-dead Assay를 이용한 470 nm 가시광선 조사(10분) 유무에 따른 ZnO-TNT실험군 시편들의 이미지 분석 결과, 가시광선 조사와 관계없이 hMSC 배양 24시간 및 48시간 배양 후 모든 실험군 간의 손상되거나 죽은 세포(적색 형광)가 관찰되지 않았고, MTT 분석 결과, hMSC 배양 24, 48시간 후 ZnO-TNT-3 실험군이 대조군(TNT) 보다 유의성 있는 세포 증식을 보였고(p<0.05), 470 nm 가시광선을 조사 시 24시간, 48시간 후 대조군(TNT)과 ZnO-TNT 실험군 모두 유사한 경향의 우수한 생체적합성을 나타내었다(p>0.05, Figure 5).
고 찰
본 연구에서는 ZnO 코팅 조건이 ZnO-TNT의 표면 특성과 항균 효능에 유의한 영향을 미치지 않는다는 귀무가설을 수립하였다. 그러나 실험 결과, ZnO 코팅 조건에 따른 ZnO-TNT의 구조적·화학적 특성과 항균 효능 사이에 통계적으로 유의한 차이가 확인되었으며, 이에 따라 귀무가설은 기각되었다.
표면특성분석 결과, ZnO 코팅이 증가함에 따라 TiO2 나노튜브의 광흡수 특성이 변화하였으며, 이는 밴드갭 감소와 관련이 있었다. 특히, ZnO-TNT-3 및 ZnO-TNT-5 실험군에서 TiO2 나노튜브 대비 더 낮은 밴드갭이 측정되었으며, 이는 가시광선 영역에서의 광활성 향상으로 이어질 가능성이 있음을 시사한다.
MB 광분해 실험 결과, 470 nm 가시광선 조사 시 ZnO-TNT 실험군은 대조군(TNT)보다 높은 분해 능력을 보였지만, 침지 증착 시간이 증가할수록 광분해 성능이 증가하는 뚜렷한 경향은 관찰되지 않았다. 이는 ZnO 코팅이 일정 수준 이상 증가할 경우, 광활성 면적 감소 또는 반응성 산소종(ROS)의 생성을 저해할 수도 있다고 추측된다(7, 20).
P. aeruginosa와 S. aureus는 여러 질환을 일으키는 세균으로, 바이오필름 형성과 광범위한 독성 인자의 생성을 통해 병원성을 가지는 것으로 알려져 있다(21, 22). 항균 실험 결과, ZnO-TNT 실험군은 대조군 대비 P. aeruginosa 경우 ZnO-TNT의 침지 증착 시간이 증가할수록 항균 활성에 영향을 미치는 것으로 특히 470 nm 가시광선 조사 시 그 효과가 더욱 증가하였고, ZnO-TNT-5 실험군이 가장 높은 항균 활성을 나타냈다. S. aureus 역시 470 nm 가시광선 조사 시 항균 활성이 증가하였고, ZnO-TNT-5 실험군이 가장 높은 항균 활성을 나타냈다. Rao 등은 항균 활성의 메커니즘을 입자 표면에서 생성된 ROS, Zn2⁺ 이온 방출, 세포막 기능 장애 등으로 보고하여(23) 이와 유사하게 ZnO 코팅층에서 방출되는 Zn2⁺ 이온 및 광촉매 활성에 의한 ROS 생성이 복합적으로 작용하는 것으로 사료되지만 추가적인 연구가 필요하다.
세포독성 평가 결과, ZnO-TNT 실험군은 24시간 및 48시간 동안 hMSC 배양 시 높은 세포 생존율을 유지하였으며, 이는 ZnO-TNT 실험군이 우수한 생체적합성을 나타내었다. ZnO-NPs는 여러 연구에서 인간 세포에 무독성으로 보고되 었으며 이러한 측면은 항균제로 사용되어야 하며 미생물에 유해하며 인간 세포에 대한 우수한 생체적합성을 유지해야 한다고 보고하였다(24, 25). 특히, MTT 분석 결과, ZnO-TNT-3 실험군에서 대조군보다 유의한 세포 증식 효과가 관찰되었는데, 이는 적절한 ZnO 코팅량이 세포 친화적인 환경을 제공할 수 있음을 의미한다.
이상의 결과를 종합하면, ZnO 코팅을 통한 TiO2 나노튜브의 개질은 가시광선 조사 하에서 항균 효과를 극대화할 수 있는 유망한 기술임을 확인할 수 있었다. 그러나 ZnO 코팅 두께 및 증착 시간이 항균 효과와 세포독성에 미치는 영향을 더욱 면밀히 평가할 필요가 있으며, 다양한 환경 조건에서의 실용적 적용 가능성을 추가적으로 연구해야 할 것이다.
결 론
본 연구에서는 ZnO 코팅된 TiO2 나노튜브(ZnO-TNT)의 가시광선 조사 하에서의 항균 효과를 평가하였다. ZnO 코팅이 증가함에 따라 광흡수 특성이 변화하였으며, 특히 470 nm 가시광선 조사 시 5시간 ZnO 용액 내에 나노튜브 시편을 침지시킨 ZnO-TNT-5 실험군에서 가장 우수한 항균 활성이 확인되었다. ZnO-TNT 실험군은 대조군(TiO2 나노튜브) 대비 ZnO 침지 시간 의존적 높은 항균 효과를 보였으며, 이는 ZnO의 자체적인 항균성 및 광촉매 활성 증가에 기인한 것으로 판단된다. 또한, Live/Dead assay 및 MTT 분석을 통해 ZnO-TNT 실험군이 코팅 시간에 상관없이 우수한 생체 적합성을 유지함을 확인하였다. 이상의 결과를 통하여 ZnO-TNT가 항균성이 요구되는 의료 소재의 표면 개질 기술로 활용될 가능성이 있음을 시사하며, 향후 임상적 적용을 위한 추가적인 연구가 필요하다. 특히, ZnO 코팅 두께, 증착 기술, 장기적인 안정성 등에 대한 추가적인 검토를 통해 최적화된 항균 표면 처리 기술을 개발할 필요가 있다.
Acknowledgments
이 논문은 2024년도 ㈜덴티움 재원의 원광대학교 치과대학 발전기금 프로그램으로 지원되었음.
References
-
Moon KS, Bae JM, Choi EJ, Oh S. Titania nanotubes with aminated reduced graphene oxide as efficient photocatalysts for antibacterial application under visible light. Sci Rep. 2025;15(1):6127.
[https://doi.org/10.1038/s41598-025-90270-2]

-
Elzaref AS, Elfeky AS, El-Adawy HA, Awad MA, El-Bahy ZM. Gallium-doped titania nanotubes as advanced photocatalysts and biopesticides: a path to water purification and vector control. Biomass Convers Biorefin. 2024.
[https://doi.org/10.1007/s13399-024-06334-2]

-
Li Y, Liao C, Tjong SC. Recent Advances in Zinc Oxide Nanostructures with Antimicrobial Activities. Int J Mol Sci. 2020;21(22).
[https://doi.org/10.3390/ijms21228836]

-
Xiao FX, Hung SF, Tao HB, Miao J, Yang HB, Liu B. Spatially branched hierarchical ZnO nanorod-TiO2 nanotube array heterostructures for versatile photocatalytic and photoelectrocatalytic applications: towards intimate integration of 1D–1D hybrid nanostructures. Nanoscale. 2014;6(24):14950-61.
[https://doi.org/10.1039/C4NR04886E]

-
Yao S, Feng X, Lu J, Zheng Y, Wang X, Volinsky AA, et al. Antibacterial activity and inflammation inhibition of ZnO nanoparticles embedded TiO(2) nanotubes. Nanotechnology. 2018;29(24):244003.
[https://doi.org/10.1088/1361-6528/aabac1]

-
Aydin EB, Siğircik G, Takci HAM. Antimicrobial properties and corrosion behavior of TiO2 NTs electrodes modified with Ag and ZnO nanorod in simulated body fluid solution. J Mol Struct. 2021;1240:130569.
[https://doi.org/10.1016/j.molstruc.2021.130569]

-
Sirelkhatim A, Mahmud S, Seeni A, Kaus NHM, Ann LC, Bakhori SKM, et al. Review on Zinc Oxide Nanoparticles: Antibacterial Activity and Toxicity Mechanism. Nanomicro Lett. 2015;7(3):219-42.
[https://doi.org/10.1007/s40820-015-0040-x]

-
Liu Y, He L, Mustapha A, Li H, Hu ZQ, Lin M. Antibacterial activities of zinc oxide nanoparticles against Escherichia coli O157:H7. J Appl Microbiol. 2009;107(4):1193-201.
[https://doi.org/10.1111/j.1365-2672.2009.04303.x]

-
Carp O, Huisman CL, Reller A. Photoinduced reactivity of titanium dioxide. Prog Solid State Chem. 2004;32(1):33-177.
[https://doi.org/10.1016/j.progsolidstchem.2004.08.001]

-
Fujishima A, Rao TN, Tryk DA. Titanium dioxide photocatalysis. J Photochem Photobiol C: Photochem Rev. 2000;1(1):1-21.
[https://doi.org/10.1016/S1389-5567(00)00002-2]

-
Karthikeyan K, Chandraprabha MN, Hari Krishna R, Samrat K, Sakunthala A, Sasikumar M. Optical and antibacterial activity of biogenic core-shell ZnO@TiO2 nanoparticles. J Indian Chem Soc. 2022;99(3):100361.
[https://doi.org/10.1016/j.jics.2022.100361]

-
Abd El-Kader MFH, Elabbasy MT, Adeboye AA, Zeariya MGM, Menazea AA. Morphological, structural and antibacterial behavior of eco-friendly of ZnO/TiO2 nanocomposite synthesized via Hibiscus rosa-sinensis extract. J Mater Res and Technol. 2021;15:2213-20.
[https://doi.org/10.1016/j.jmrt.2021.09.048]

-
Mousa SA, Wissa DA, Hassan HH, Ebnalwaled AA, Khairy SA. Enhanced photocatalytic activity of green synthesized zinc oxide nanoparticles using low-cost plant extracts. Sci Rep. 2024;14(1):16713.
[https://doi.org/10.1038/s41598-024-66975-1]

-
Supin KK, PM PN, Vasundhara M. Enhanced photocatalytic activity in ZnO nanoparticles developed using novel Lepidagathis ananthapuramensis leaf extract. RSC Adv. 2023;13(3):1497-515.
[https://doi.org/10.1039/D2RA06967A]

-
Nam Y, Lim JH, Ko KC, Lee JY. Photocatalytic activity of TiO2 nanoparticles: a theoretical aspect. J Mater Chem A. 2019;7(23):13833-59.
[https://doi.org/10.1039/C9TA03385H]

-
Makuła P, Pacia M, Macyk W. How To Correctly Determine the Band Gap Energy of Modified Semiconductor Photocatalysts Based on UV–Vis Spectra. J Phys Chem Lett. 2018;9(23):6814-7.
[https://doi.org/10.1021/acs.jpclett.8b02892]

-
Zhang Y, Wen YH, Zheng JC, Zhu ZZ. Direct to indirect band gap transition in ultrathin ZnO nanowires under uniaxial compression. Appl Phys Lett. 2009;94(11).
[https://doi.org/10.1063/1.3104852]

-
Zhang J, Zhou P, Liu J, Yu J. New understanding of the difference of photocatalytic activity among anatase, rutile and brookite TiO2. Phys Chem Chem Phys. 2014;16(38):20382-6.
[https://doi.org/10.1039/C4CP02201G]

-
Yamamoto O. Influence of particle size on the antibacterial activity of zinc oxide. Int J Inorg Mater. 2001;3(7):643-46.
[https://doi.org/10.1016/S1466-6049(01)00197-0]

-
Kook M, Kaur H, Danilian D, Rosenberg M, Kisand V, Ivask A. Durability of photocatalytic ZnO-based surface coatings and preservation of their antibacterial effect after simulated wear. J Coat Technol Res. 2024;21(3):1005-16.
[https://doi.org/10.1007/s11998-023-00868-2]

-
Pang Z, Raudonis R, Glick BR, Lin TJ, Cheng Z. Antibiotic resistance in Pseudomonas aeruginosa: mechanisms and alternative therapeutic strategies. Biotechnol Adv 2019;1:177-92.
[https://doi.org/10.1016/j.biotechadv.2018.11.013]

-
Mack D, Becker P, Chatterjee I, Dobinsky S, Knobloch JK, Peters G, Rohde H, Herrmann M. Mechanisms of biofilm formation in Staphylococcus epidermidis and Staphylococcus aureus: functional molecules regulatory circuits, and adaptive responses. Int J Med Microbiol. 2004;294:203-12.
[https://doi.org/10.1016/j.ijmm.2004.06.015]

- Rao MC, Ravindranadha K, Rose Mary T. Development of ZnO Nanoparticles for Clinical Applications. J Chem Biol Phys Sci 4. 2014;4(1)469-73.
-
Colon G, Ward BC, Webster TJ. Increased osteoblast and decreased Staphylococcus epidermidis functions on nanophase ZnO and TiO2. J Biomed Mater Res. 2006;78(3):595-604.
[https://doi.org/10.1002/jbm.a.30789]

-
Padmavathy N, Vijayaraghavan R. Enhanced bioactivity of ZnO nanoparticles an antimicrobial study. Sci Technol Adv Mater. 2008;9(3):035004.
[https://doi.org/10.1088/1468-6996/9/3/035004]