
치과용 칼슘 실리케이트 시멘트의 제형과 클로르헥시딘 첨가에 따른 치주인대 줄기세포와 L929 세포의 활성도 평가
초록
본 연구에서는 연고형 칼슘 실리케이트 시멘트(EP)와 분말형 칼슘 실리케이트 시멘트를 각각 멸균 증류수(EW) 또는 클로르헥시딘 용액과(EC) 혼합하여 시멘트의 제형 및 클로르헥시딘의 첨가가 마우스 유래 섬유아세포주인 L929 세포와 인간 치주인대 줄기세포의 활성도에 미치는 영향을 7일 이내에서 알아보고자 하였다. 디스크형(직경 6 mm, 두께 1 mm) 시편의 용출물로 세포독성을 평가하였다. 두가지 세포에 각 군의 용출물을 첨가한 후 1일, 3일, 7일에서의 세포 활성도를 측정하였다. 그 결과 L929 세포에서는 배양 1일차와 3일차에 모든 군에서 대조군과 유의한 차이가 없었으며(p>0.05), 7일차에는 EW군에서 음성대조군보다 유의하게 높은 세포활성도를 나타냈다(p<0.05). 인간 치주인대 줄기세포의 경우 1일차에는 모든 군에서 음성대조군과 차이가 없었고(p>0.05), 3일차에는 모든 실험군에서 세포활성도가 유의하게 감소했으나(p<0.05) 70% 이상을 유지하였다. 7일차에는 EC군은 음성대조군과 유의한 차이가 없었고, EW군과 EP 군은 음성대조군보다 세포활성도가 유의하게 높았다(p<0.05). 위 결과를 종합하면, 모든 실험군은 L929 세포와 인간 치주인대 줄기세포에서 실험 시 모든 시간대에서 음성대조군과 비교해70% 이상의 세포활성도를 보여 생체친화성을 나타내었다. 또한 3일차에서, 인간 치주인대 줄기세포는 L929 세포에 비해 더 민감한 반응을 보였다. 7일차에 L929 세포에서 EW 군과 이간 치주인대 세포에서 EW 군과 EP 군은 음성대조군과 비교하여 더 높은 세포활성도를 보였는데, 이는 시간이 지남에 따라 세포활성도가 증가함을 나타낸다.
Abstract
This study evaluated the time-dependent cell viability of dental calcium silicate cements on two types of mammalian cells according to cement type and addition of chlorhexidine. Discs of 6 mm diameter and 1 mm thickness were made with premixed calcium silicate cement (EP) and powder type cement mixed with distilled water (EW) or mixed with chlorhexidine (EC). Each disc was eluted using culture medium to obtain an extract. Cell viability of L929 mouse fibroblasts and human periodontal ligament stem cells (hPDLSC) was measured at 1, 3 and 7 days after application of the extracts. L929 did not show significant differences in cell viability between negative control and experimental groups on day 1 and 3. The EW group exhibited significantly higher viability than the negative control group with no significant differences from EC and EP groups at day 7 (p<0.05). For hPDLSC, there were no significant differences among the groups on day 1. Experimental groups showed decreased cell viability than the negative control group on day 3. However, cell viability of EW and EP groups was higher than the negative control and EC groups on day 7 (p<0.05). In conclusion, all experimental groups exhibited cell viability above 70% of the negative control in all time period in both cell types, indicating favorable responses. EW showed higher cell viability than the negative control at day 7 in both cells, meaning even promoted cell viability over time in vitro.
Keywords:
Calcium silicate cement, Cell viability, L929, Human periodontal ligament stem cell키워드:
칼슘 실리케이트 시멘트, 세포활성도, 인간 치주인대 줄기세포서 론
치과 치료에서 사용되는 생체재료는 치료 결과와 조직 재생에 중요한 영향을 미친다. 특히, 칼슘 실리케이트 기반 시멘트(Calcium Silicate-Based Cement, CSC)는 근관 충전, 치수 복조 및 치근 천공 복구 등의 치료에서 필수적인 재료로 사용된다(1). CSC는 수화 반응을 통해 칼슘 이온(Ca2⁺)과 실리케이트 이온(SiO44⁻)을 방출하여 조직 재생을 촉진하고, 높은 pH 환경을 조성하여 항균 효과를 발휘하는 것으로 보고되었다(2, 3). 이러한 특성 덕분에 CSC는 치과 임상에서 광범위하게 사용되며, 다양한 생체적합성 개선 연구가 진행되고 있다(4, 5).
CSC의 주요 장점은 우수한 생체적합성, 항균 효과, 높은 밀폐력 및 장기적인 안정성이다(6-8). 높은 pH로 인해 세균 성장을 억제하며, 치수 및 치주 조직의 재생을 촉진하는 기능을 갖는다(9, 10). 또한, CSC는 연조직 및 골조직과의 우수한 결합력을 가지며, 치아 구조와의 접착력도 뛰어나 근관 충전재로 적합하다(11, 12). 그러나 초기 수화 과정에서 발생하는 높은 알칼리성(pH 11~12)은 세포 독성을 유발할 수 있으며, 용출되는 칼슘 이온과 실리케이트 이온의 농도에 따라 세포 생존율이 감소할 가능성이 있다(13). 시간이 지나면서 CSC의 용출 성분이 안정화되지만, 초기에는 급격한 pH 변화와 높은 이온 방출이 발생하여 단기적인 세포 독성 평가가 필요하다(14).
클로르헥시딘(Chlorhexidine, CHX)은 강력한 항균제로, 근관 치료 및 치주 치료에서 감염 예방 목적으로 널리 사용된다(15). CHX는 양이온성 성질을 가지며, 세균의 세포막과 결합하여 세포 투과성을 변화시키고 세포자멸사(apoptosis)를 유도하는 항균 기전을 가지고 있다(16). 이러한 특성으로 인해 근관 감염 예방과 치주 질환 치료에서 효과적으로 사용되지만, CHX의 독성도 보고되고 있다(17). CSC는 주로 물과 혼합하여 사용하지만, CHX과 혼합하였을 때의 세포활성도의 평가가 필요하여 본 연구에서 사용되었다(18).
CSC의 생체적합성을 평가할 때, 단기적인 독성뿐만 아니라 시간에 따른 세포 생존율 변화를 분석하는 것이 중요하다(19). CSC는 경화 초기와 이후의 용출 성분이 달라질 수있으며, 높은 pH와 이온 방출로 인해 초기에는 독성이 나타날 가능성이 있다(20). 시간이 지나면서 용출 성분이 감소하고, 세포 환경이 안정화되면서 독성이 줄어들거나 조직 친화성이 증가할 가능성이 있다(20, 21). 일반적으로 치과재료의 세포독성 평가는 3일 이내의 평가가 많지만, CSC의 경우 그 이후의 변화를 모니터링하는 것이 필요하다. 또한, CHX가 포함된 CSC의 경우 시간이 지나면서 CHX의 방출이 줄어들어 세포 독성이 감소할 수 있으며, 이에 대한 평가도 요구된다.
본 연구에서는 CSC의 용출물이 시간이 지남에 따라 두가지 세포의 세포활성도에 미치는 영향을 평가하고자 한다. 또한, CHX로 혼합한 CSC의 세포 독성을 물과 혼합한 CSC와 비교 분석하여 CHX 첨가가 장기적으로 세포활성도에 미치는 영향을 규명하고자 한다.
재료 및 방법
1. 시편의 제작 및 용출
본 연구에 사용된 시편은 시판용 치과용 CSC인 연고 제형의 Endocem MTA Premixed (EP; Maruchi, Wonju, Korea)을 단독으로 시편을 제조하고, 분말제형의 CSC인 Endocem MTA (Maruchi, Wonju, Korea)는 멸균 증류수를 제조사의 지시대로 0.3 g/120 μL 비율로 혼합하였다(EW). 또한 Endocem MTA에 제조사가 제시한 혼수비에 따라 멸균 증류수 대신 동일한 비율로 chlorhexidine (CHX; Hexamedine, Bukwang, Seoul, Korea)을 혼합하였다(EC). 실리콘몰드를 이용하여 디스크 형태(직경 6 mm × 두께 1 mm)로 시편을 제작하고, 37℃ 상대습도 95%의 조건에서 12시간 이상 경화시킨 후, UV로 30분간 멸균하였다. 세포독성 측정을 위해 각 시편 한 개당 10 mL의 세포배양배지에서 72시간 동안 37℃ 세포배양기에서 용출하였고, 용출 후 필터(0.2 μm, HYUNDAI MICRO Co., Ltd., Seoul, Korea)하여 사용하였다.
2. 세포독성 측정
본 연구에 사용된 세포는 L929 (ATCC, Rockville, MD, USA)와 인간 치주인대 줄기세포(human periodontal ligament stem cell; hPDLSC, Celprogee Torrance, CA, USA)로 각각 10% 우태혈청(fetal bovine serum; FBS, Gibco, Grand Island, NY, USA)과 1% 항생제(penicillin-streptomycin, Gibco, Grand Island, NY, USA)를 포함한 RPMI1640(HyClone, Logan, UT, USA) 배지와 α-MEM(Gibco) 배지에서 배양하였다. 96 well 플레이트의 각 well당 1×104 cells/well의 농도로 접종하여 24시간 배양한 후, 용출액으로 교체하여 1, 3, 7일 동안 배양하였다. 7일 배양을 위해 용출액은 3일에 한번 교체하였다. 각 배양일 후, 세포 활성도(cell viability, %)는 제조사의 매뉴얼에 따라 Cell Counting Kit-8(CCK-8, Dojindo, Rockville, ML, USA)를 이용하여 37℃에서 한시간 반응 후, microplate reader (VERSA max, Molecular Devices, Sunnyvale, CA, USA)로 450 nm 파장에서 흡광도를 측정하였다. 세포만으로 구성된 음성대조군(NC)의 흡광도를 100%로 하여 실험군의 흡광도를 환산하여 나타내었다.
3. 통계분석
세포독성 측정결과에서 각 배양일내 시편 간의 비교에 대한 통계분석은 SPSS 프로그램(SPSS27.0; IBM Corporation, Armonk, NY, USA)을 이용하였다. L929에 대한 세포독성은 Kruskal-Wallis test를 수행하였고, 사후 검정으로는 Mann-Whitney U test와 Bonferroni correction을 이용하였다. hPDLSC에 대한 세포독성은 one-way analysis of variance(ANOVA)를 시행하였고, 사후 검정은 Tukey test로 진행하였다. 모든 실험에 대해 통계적 유의 수준은 0.05로 설정하였다.
결 과
1. L929에 대한 세포독성
L929 세포에 치과용 CSC에 대한 세포독성을 평가하기 위해 제조된 시편에서 RPMI 배지로 추출한 용출물을 처리하여 세포와 함께 배양한 후 세포활성도를 측정하였다. L929 세포에서는 배양 1, 3일차에 모두 아무것도 처리하지 않은 NC 군과 용출물을 처리한 군에서 통계적으로 유의성있는 차이가 없었다(p>0.05). 배양 7일차에는 EW 군에서 NC군보다 유의성있게 높은 세포활성도를 보였으나(p<0.05), EC군과 EP군과는 통계적으로 유의차가 없었다(p>0.05).
2. hPDLSC에 대한 세포독성
hPDLSC 세포에 치과용 CSC에 대한 세포독성을 평가하기 위해 제조된 시편에서 α-MEM 배지를 이용하여 용출한 용출물을 처리하여 세포와 함께 배양한 후 세포활성도를 측정하였다 . hPDLSC 세포에서는 배양 1일차에는 모든 군에서 아무것도 처리하지 않은 NC 군과 유의한 차이가 없었다(p>0.05). 배양 3일차에는 모든 실험군에서 NC군과 비교해 유의성있는 차이를 보였지만(p<0.05), ISO 10993-5의 세포 독성 기준인 70% 미만에 해당하는 군은 없었다(22). 배양 7일차에는 EW군과 EP군은 모두 NC군과 EC군보다 유의성있게 높은 세포활성도를 보였다(p<0.05).
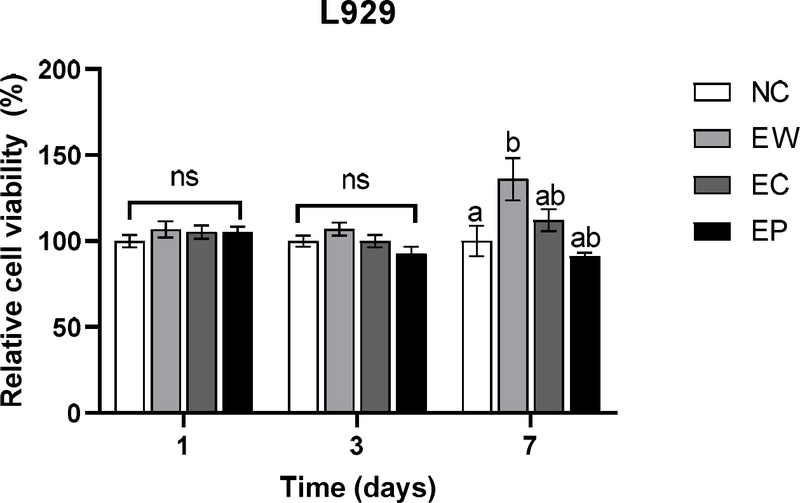
Cell viability on L929 cells. Cell viability was determined with the Cell Counting Kit-8 (CCK-8) assay and measured at 450 nm. All experimental groups had no cytotoxicity against L929 cells on 1, 3, 7 days. Values are presented as the mean ± standard deviation. Different lowercase letters indicate significant differences between groups within the time period by Kruskal-Wallis and Mann-Whitney U test with Bonferroni’s correction (α= 0.05). NC: cell only, EW: Endocem with water, EC: Endocem with Chlorhexidine, EP: Endocem Premixed.
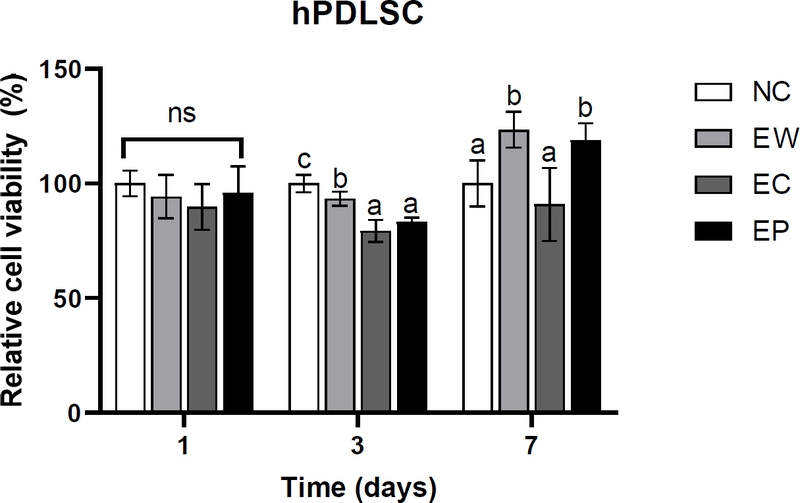
Cell viability on hPDLSC cells. Cell viability was determined with the Cell Counting Kit-8 (CCK-8) assay and measured at 450 nm. All experimental groups showed no cytotoxicity against hPDLSC cells on 1, 3, and 7 days. Values are presented as the mean ± standard deviation. Different lowercase letters indicate significant differences between groups within time period by ANOVA with post hoc Tukey test (α= 0.05). NC: cell only, EW: Endocem with water, EC: Endocem with Chlorhexidine, EP: Endocem Premixed.
고 찰
본 연구에서는 물 또는 CHX과 혼합한 치과용 CSC의 세포활성도를 두 가지 세포에서 7일간 측정하여, 세포의 종류 및 칼슘 실리케이트 시멘트의 제형에 따른 영향과 클로르헥시딘이 미치는 영향을 평가하고자 하였다.
모든 실험군은 두 가지 세포 모두에서, 1, 3, 7일에서 ISO 10993-5의 독성 판별 기준인 음성 대조군 대비 70% 이상의 세포활성도를 보여, 단기 및 장기적으로 양호한 반응을 보였다. 특히, L929 세포에서의 EW군과 hPDLSC 세포에서의 EW군과 EP군은 7일차에 음성대조군 보다 유의성있게 높은 세포활성도를 보여 시간이 지남에 따라 세포활성도가 증가한 것을 알 수 있다.
L929 세포에서는 배양 1일차 및 3일차에 아무것도 처리하지 않은 대조군(NC)과 시멘트 용출물 처리군들 간에 유의미한 차이가 없었다(p>0.05). 이는 초기 72시간 내에 실험에 사용된 CSC에서 용출된 성분이 L929 세포의 활성도에 즉각적인 영향을 미치지 않았음을 시사한다. 실제로 Song 등의 논문에서 MTA가 초기 1-2일 동안은 섬유아세포의 생존율을 유의하게 저해하지 않는 것으로 나타났다(23). 그러나 배양 7일차에는 멸균 증류수로 혼합한 시멘트(EW) 군이 대조군 보다 유의성있게 높은 세포활성도를 나타냈는데, 이는 CSC가 장기간 배양 환경에서 L929 세포의 성장에 긍정적인 영향을 미쳤을 가능성을 시사한다. Jiang 등의 연구에서도 CSC가 14일까지 유의미한 독성을 나타내지 않았음을 보였고, 특정 시멘트(iRootFS)에서 세포 부착성이 높아 일부 특정 CSC가 L929 세포의 부착과 증식을 촉진할 가능성을 나타낸다(24).
hPDLSC 세포에서는 3일차에는 모든 실험군의 세포활성도가 대조군보다 감소하였다. 일반적으로 ISO 10993-5 기준에 따르면 세포활성도가 대조군의 70% 이상을 넘으면 해당 재료는 독성이 없는 것으로 간주되는데(22), 본 연구의 결과에서도 배양 7일차까지 모두 70% 이상을 만족해 시멘트용출 성분이 hPDLSC와 L929의 세포활성도를 현저히 저해하지 않았음을 의미한다. 3일차에 hPDLSC 세포는 L929 세포보다 모든 종류의 실험군에 대해 민감한 반응을 보였는데, 이는 hPDLSC 세포는 줄기세포의 일종으로 주어지는 자극에 L929 세포보다 더 민감하게 반응하기 때문이다(25).
배양 7일차에서는 EW와 EP군이 CHX를 혼합한 시멘트(EC) 군과 대조군보다 유의성있게 높은 세포활성도를 보였다. 이는 CSC에서 용출된 특정 성분이 시간이 지남에 따라 hPDLSC의 생존과 증식에 긍정적인 영향을 미쳤을 가능성을 보여준다(23). 실제로 Ghabraei 등은 MTA를 2% CHX와 혼합할 경우 시간 경과에 따라 hPDLSC의 세포활성도가 유의미하게 감소하여, 7일 배양 시 CHX혼합군이 가장 낮은 세포활성도를 보였다(26). 해당 선행연구와 비교해 보았을 때, 본 연구에서 EC의 세포활성도가 7일 배양 시 EW군이나 EP군만큼 증가하지 않은 현상도 CHX에 의한 세포 독성 효과가 나타난 것으로 보인다. 높은 농도의 CHX는 세포 독성을 유발할 가능성이 있으며, 특히 섬유아세포 및 줄기세포의 증식과 분화를 저해할 수 있다(27). 또한, 장기간 노출 될 경우 세포막의 구조를 변형시키고 조직 재생을 방해할 가능성이 있어, 생체재료와 병용 사용할 경우 주의가 필요하다(28). 하지만 본 연구에서 EC군은 음성대조군과 유의성있는 차이를 보이지 않아 그 효과가 크지 않았는데, 그 이유로는 본 연구에서는 용출물을 이용해 간접적으로 세포활성도에 미치는 영향을 평가하였고, CHX의 농도는 0.12% 인 반면, 선행 연구에서는 2% CHX를 CSC와 직접 혼합하여 세포에 처리했기 때문으로 여겨진다(26).
L929세포와 hPDLSC 모두에서 공통적으로 EW는 7일차에서 높은 세포활성도를 보였는데, CHX의 영향이 없고, EP에 들어있는 DMSO와 같은 성분이 없기 때문이라고 여겨진다(8). 이는 용출물을 통해 세포 활성도를 평가한 다른 연구에서도 희석 비율이 낮은 50%에서 분말제형이 다른 CSC 보다 유의성 있게 높은 결과를 보여 동일한 경향을 보인다(29).
이러한 결과는 CSC의 장기적인 생체친화성 평가가 필요함을 강조하며, 실험군 간 용출 성분의 차이를 보다 정밀하게 분석할 필요성을 시사한다. 향후 연구에서는 EW 및 EP군에서 배양 7일차에 세포활성도가 증가한 기전을 밝히기 위해 각 시멘트의 칼슘 이온 농도 변화 및 기타 생리활성 분자의 방출 양상을 추가로 분석할 필요가 있다. 또한, 동물 모델을 활용한 in vivo 연구를 통해 실제 조직 환경에서의 반응을 평가하고 치과 임상에서의 적용 가능성을 검토해야 할 것이다.
종합하면, 칼슘 실리케이트 시멘트는 초기에는 일시적인 세포 독성을 나타낼 수 있으나 시간이 지남에 따라 이러한 독성이 감소하고 생체친화성이 회복되는 경향을 보였다. 특히 멸균 증류수 혼합 시멘트(EW)와 사전 혼합 시멘트(EP)의 경우 배양 7일차에 대조군보다 높은 세포활성도를 보여 세포 성장에 긍정적인 영향을 미치는 것으로 나타났다. 한편 클로르헥시딘을 첨가한 시멘트(EC)는 7일차에 세포 생존율 이 대조군과 유사한 수준으로 유지되어, 클로르헥시딘 첨가로 인한 세포 독성은 관찰되지 않았다.
결 론
본 연구는 칼슘 실리케이트 시멘트와 이에 클로르헥시딘을 혼합하여 시편을 제작하였고, 이를 이용해 7일간의 세포 독성을 분석하였다. L929 세포에서는 연고제형과 분말제형 모두 독성을 보이지 않았으며, 클로르헥시딘을 포함했을때도 독성을 보이지 않았다 (p>0.05). hPDLSC 세포에서는 3일차에 대조군에 비해 모든 실험군에서 통계적으로 유의성있게 감소했지만 (p<0.05), 7일차에는 회복되어 클로르헥시딘을 포함하지 않은 군들은 오히려 더 높은 세포 활성도를 나타내었다. 클로르헥시딘을 첨가한 군은 멸균 증류수를 첨가한 군에 비해 hPDLSC 세포에서의 세포독성이 3일차와 7일차에서 유의성있게 낮게 나타났는데 (p<0.05), 이는 클로르헥시딘이 유의미한 독성을 나타내는 것으로 보인다. 다만 모든 경우에서 70% 이상의 세포 활성도를 보였기 때문에 실제 임상에서 항균효과를 나타내기 위해 칼슘 실리케이트 시멘트에 클로르헥시딘을 첨가할 수 있는 가능성을 보였다.
Acknowledgments
이 논문은 2024학년도 원광대학교의 교비지원에 의해 수행됨.
References
-
Prati C, Gandolfi MG. Calcium silicate bioactive cements: Biological perspectives and clinical applications. Dent Mater. 2015;31(4):351-70.
[https://doi.org/10.1016/j.dental.2015.01.004]

-
Janini ACP, Bombarda GF, Pelepenko LE, Marciano MA. Antimicrobial Activity of Calcium Silicate-Based Dental Materials: A Literature Review. Antibiotics (Basel). 2021;10(7):865.
[https://doi.org/10.3390/antibiotics10070865]

-
Niu LN, Jiao K, Wang TD, Zhang W, Camilleri J, Bergeron BE, et al. A review of the bioactivity of hydraulic calcium silicate cements. J Dent. 2014;42(5):517-33.
[https://doi.org/10.1016/j.jdent.2013.12.015]

-
Tomas-Catala CJ, Collado-Gonzalez M, Garcia-Bernal D, Onate-Sanchez RE, Forner L, Llena C, et al. Biocompatibility of New Pulp-capping Materials NeoMTA Plus, MTA Repair HP, and Biodentine on Human Dental Pulp Stem Cells. J Endod. 2018;44(1): 126-32.
[https://doi.org/10.1016/j.joen.2017.07.017]

-
Pushpalatha C, Dhareshwar V, Sowmya SV, Augustine D, Vinothkumar TS, Renugalakshmi A, et al. Modified Mineral Trioxide Aggregate-A Versatile Dental Material: An Insight on Applications and Newer Advancements. Front Bioeng Biotechnol. 2022;10: 941826.
[https://doi.org/10.3389/fbioe.2022.941826]

-
Eskandari F, Razavian A, Hamidi R, Yousefi K, Borzou S. An Updated Review on Properties and Indications of Calcium Silicate-Based Cements in Endodontic Therapy. Int J Dent. 2022;2022:6858088.
[https://doi.org/10.1155/2022/6858088]

-
Alsubait S, Albader S, Alajlan N, Alkhunaini N, Niazy A, Almahdy A. Comparison of the antibacterial activity of calcium silicate- and epoxy resin-based endodontic sealers against Enterococcus faecalis biofilms: a confocal laser-scanning microscopy analysis. Odontology. 2019;107(4):513-20.
[https://doi.org/10.1007/s10266-019-00425-7]

-
Moon SH, Shin SJ, Oh S, Bae JM. Antibacterial Activity and Sustained Effectiveness of Calcium Silicate-Based Cement as a Root-End Filling Material against Enterococcus faecalis. Materials (Basel). 2023;16(18):6124.
[https://doi.org/10.3390/ma16186124]

-
Mohammadi Z, Shalavi S, Yazdizadeh M. Antimicrobial activity of calcium hydroxide in endodontics: a review. Chonnam Med J. 2012;48(3):133-40.
[https://doi.org/10.4068/cmj.2012.48.3.133]

-
Rodriguez-Lozano FJ, Collado-Gonzalez M, Tomas-Catala CJ, Garcia-Bernal D, Lopez S, Onate-Sanchez RE, et al. GuttaFlow Bioseal promotes spontaneous differentiation of human periodontal ligament stem cells into cementoblast-like cells. Dent Mater. 2019;35(1):114-24.
[https://doi.org/10.1016/j.dental.2018.11.003]

-
Szliszka E, Czuba ZP, Domino M, Mazur B, Zydowicz G, Krol W. The Effect of Calcium-Silicate Cements on Reparative Dentinogenesis Following Direct Pulp Capping on Animal Models. Molecules. 2021;26(9):2725.
[https://doi.org/10.3390/molecules26092725]

-
Baroudi K, Samir S. Sealing Ability of MTA Used in Perforation Repair of Permanent Teeth; Literature Review. Open Dent J. 2016;10:278-86.
[https://doi.org/10.2174/1874210601610010278]

-
Tsai CL, Ke MC, Chen YH, Kuo HK, Yu HJ, Chen CT, et al. Mineral trioxide aggregate affects cell viability and induces apoptosis of stem cells from human exfoliated deciduous teeth. BMC Pharmacol Toxicol. 2018;19(1):21.
[https://doi.org/10.1186/s40360-018-0214-5]

-
de Almeida-Junior LA, de Campos Chaves Lamarque G, Herrera H, Arnez MFM, Lorencetti-Silva F, Silva RAB, et al. Analysis of the cytotoxicity and bioactivity of CeraSeal, BioRoot and AH Plus((R)) sealers in pre-osteoblast lineage cells. BMC Oral Health. 2024;24(1):262.
[https://doi.org/10.1186/s12903-024-04021-2]

-
Cherian B, Gehlot PM, Manjunath MK. Comparison of the Antimicrobial Efficacy of Octenidine Dihydrochloride and Chlorhexidine with and Without Passive Ultrasonic Irrigation - An Invitro Study. J Clin Diagn Res. 2016;10(6):ZC71-7.
[https://doi.org/10.7860/JCDR/2016/17911.8021]

-
Gomes BP, Vianna ME, Zaia AA, Almeida JF, Souza-Filho FJ, Ferraz CC. Chlorhexidine in endodontics. Braz Dent J. 2013;24(2):89-102.
[https://doi.org/10.1590/0103-6440201302188]

-
Lee HN, Liang C, Liao L, Tian WD. Advances in Research on Stem Cell-Based Pulp Regeneration. Tissue Eng Regen Med. 2021;18(6):931-40.
[https://doi.org/10.1007/s13770-021-00389-2]

-
D browska K, Palaty ska-Ulatowska ą ń A, Klimek L. Evaluation of Biodentine Tricalcium Silicate-Based Cement after Chlorhexidine Irrigation. Appl Sci-Basel. 2024;14(19):8702.
[https://doi.org/10.3390/app14198702]

-
Sanz JL, Guerrero-Girones J, Pecci-Lloret MP, Pecci-Lloret MR, Melo M. Biological interactions between calcium silicate-based endodontic biomaterials and periodontal ligament stem cells: A systematic review of in vitro studies. Int Endod J. 2021;54(11):2025-43.
[https://doi.org/10.1111/iej.13600]

-
Esen M, Guven Y, Seyhan MF, Ersev H, Tuna-Ince EB. Evaluation of the genotoxicity, cytotoxicity, and bioactivity of calcium silicate-based cements. BMC Oral Health. 2024;24(1):119.
[https://doi.org/10.1186/s12903-024-03891-w]

-
Rebolledo S, Alcantara-Dufeu R, Luengo Machuca L, Ferrada L, Sanchez-Sanhueza GA. Real-time evaluation of the biocompatibility of calcium silicate-based endodontic cements: An in vitro study. Clin Exp Dent Res. 2023;9(2):322-31.
[https://doi.org/10.1002/cre2.714]

- International Organization for Standardization. ISO 10993-5:2009, Biological evaluation of medical devices - Part 5: Tests for in vitro cytotoxicity. Geneva: ISO. 2009.
-
Song W, Li S, Tang Q, Chen L, Yuan Z. In vitro biocompatibility and bioactivity of calcium silicate-based bioceramics in endodontics (Review). Int J Mol Med. 2021;48(1):128.
[https://doi.org/10.3892/ijmm.2021.4961]

-
Jiang Y, Zheng Q, Zhou X, Gao Y, Huang D. A comparative study on root canal repair materials: a cytocompatibility assessment in L929 and MG63 cells. THESCIENTIFICWORLDJO. 2014;2014:463826.
[https://doi.org/10.1155/2014/463826]

-
Saber S, Raafat S, Elashiry M, El-Banna A, Schafer E. Effect of Different Sealers on the Cytocompatibility and Osteogenic Potential of Human Periodontal Ligament Stem Cells: An In Vitro Study. J Clin Med. 2023;12(6):2344.
[https://doi.org/10.3390/jcm12062344]

- Sholeh G, Farzaneh A, Ahmad RS, Zahra M. Comparison of cytotoxicity between Mineral Trioxide Aggregate mixed with chlorhexidine and common endodontic regeneration medicaments on periodontal ligament stem cells: an in vitro study. Front Dent. 2023;20(1):e23.
-
Widbiller M, Althumairy RI, Diogenes A. Direct and Indirect Effect of Chlorhexidine on Survival of Stem Cells from the Apical Papilla and Its Neutralization. J Endod. 2019;45(2):156-60.
[https://doi.org/10.1016/j.joen.2018.11.012]

-
Wyganowska-Swiatkowska M, Kotwicka M, Urbaniak P, Nowak A, Skrzypczak-Jankun E, Jankun J. Clinical implications of the growth-suppressive effects of chlorhexidine at low and high concentrations on human gingival fibroblasts and changes in morphology. Int J Mol Med. 2016;37(6):1594-600.
[https://doi.org/10.3892/ijmm.2016.2550]

-
Jang YJ, Kim YJ, Vu HT, Park JH, Shin SJ, Dashnyam K, et al. Physicochemical, Biological, and Antibacterial Properties of Four Bioactive Calcium Silicate-Based Cements. Pharmaceutics. 2023;15(6).
[https://doi.org/10.3390/pharmaceutics15061701]

