타이타늄 표면에 대한 생리활성물질 고정화에 관한 연구
Abstract
The ultimate purpose of the various surface treatment of titanium is improvement of osseointegration of titanium. Recently, the surface treatment of titanium has focused on bioactive molecules deposition, such as RGD, BMP, and growth factor related on osteoblast proliferation and adhesion to enhance the osseointegration when titanium implant was applied in clinically. The RGD motif plays an important role in cell-matrix adhesion and activation of cell proliferation, apoptosis, and differentiation. In this study, after RGD peptide immobilization, the effect of RGD-immobilized titanium surface to osteoblast adhesion and proliferation were evaluated. RGD immobilized titanium by covalent bond promoted the MG63 osteoblast adhesion and spreading. The proliferation of MG 63 cells grown on RGD immobilized titanium was enhanced.
Keywords:
Titanium, Surface treatment, Bioactive molecules, RGD sequence, Osteoblast, Adhesion, ProliferationⅠ. INTRODUCTION
치과용 생체재료인 타이타늄에 최근 수년 동안 다양한 표면처리를 통하여 세포 부착 및 골유착 증가 등의 효과를 극대화 하고자 하는 노력이 많이 시도되어 왔다(Gotfredsen 등, 1990; Jansen 등, 1991; Ikada, 1994; Gustavo 등, 2008; Jimbo 등, 2008; Le Guéhennec 등, 2007). 타이타늄 표면처리 초기에 sandblasting과 같은 물리적인 표면처리에서 진화되어 화학적인 에칭(Herrero-Climent 등, 2013), 화학적 플라즈마 처리(Cunha 등, 2013)등의 방법이 도입되었다. 특히 Lee 등 (2011)은 치과용 타이타늄 임플란트에 하이드록시아파타이트(HA)를 코팅하면, 골아세포의 증식과 분화를 촉진하고, 콜라젠 단백질의 발현도 증가된다고 보고하였다. 그러나 타이타늄 임플란트 표면에 HA 코팅은 표면 거칠기는 증가하지만 접촉각이 커져 세포가 부착되기 힘든 단점이 있다고 보고하였다(Lee 등, 2011). 최근에 Sandrini 등은 생리활성 흉내 물질(biomimetic materials)을 타이타늄에 표면처리하여 골유착(oseointegration)을 증대시키고자 하였으며, Nanci 등 (1988)은 생물학적 분자를 타이타늄 표면에 화학적인 처리를 시도하였다. Nayak 등 (2013)도 타이타늄 표면에 silk protein을 코팅하여 골유착이 증가함을 실험으로 보고하였다. 이러한 시도는 궁극적으로 치과용 임플란트의 골유착성을 증가시켜 결국 임플란트의 시술 성공율을 높이고자 하는 것이다.
많은 학자들은 펩타이드의 일정 서열이 세포의 부착을 통해 세포의 survival과 proliferation에도 영향을 준다고 보고하고 있다.(Xiao 등, 1996; Rezania 등, 1999) 그 중 RGD 서열은 세포막에 존재하는 막단백질인 integrin에 의해 골아세포의 증식을 조절한다고 알려져 있으며(Xiao 등, 1996), 실제 세포막의 세포외기질(extracellular membrane) 단백질은 RGD 서열을 포함하고 있어 세포내외의 신호를 RGD 서열로 인지하기 때문인 것으로 보고되고 있다(Rezania 등, 1999).
본 연구에서는 타이타늄에 골유착성을 증진하기 위하여 생리활성 물질의 하나인 RGD 펩타이드를 화학적인 방법으로 고정하여 골아세포 수준에서 증식에 효과가 있는지 확인하고자 하였다.
Ⅱ. MATERIALS AND METHODS
1. 펩타이드 합성
타이타늄에 고정하고자 하는 펩타이드는 아르기닌(Arginine, R), 글라이신(Glycine, G), 아스파르트산(D, Aspartic acid)의 서열에 형광물질인 fluorescein isothiocyanate (FITC)를 링커로 붙인 FITC-RGD를 ㈜펩트론(대전, Korea)에 의뢰하여 합성하였다. 사용된 펩타이드 서열은 Table 1에 나타내었다.
2. 시편 제작 및 펩타이드 고정화 확인
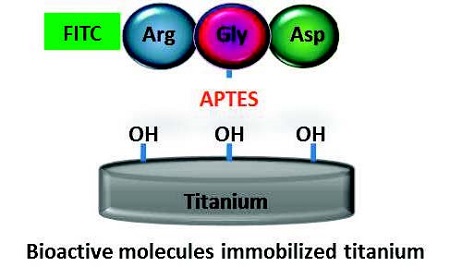
순수 타이타늄 디스크(직경 10 mm, 두께 2 mm)의 표면을 균질화 하기 위하여 SiC 연마지로 연마한 다음, 2.5M NaOH로 80℃에서 24시간 동안 반응시켜 활성화된 TiOH를 제조하였다. 활성화된 타이타늄 시편을 2% 3-aminopropyltriethoxysilane (APTES)/toluene에 담그어 4시간 silanization을 실시하였다(Nayak 등, 2013). 그 이후 1% glutaraldehyde에 4시간 동안 반응시킨 다음, 200 μg/ml 농도의 펩타이드에 24시간 동안 반응 시킨 후 PBS로 세척하여 시편을 준비하였다(Andrea 등, 2007). 펩타이드 고정의 모식도를 Figure 1에 나타내었다. 펩타이트 고정 후 펩타이드 고정화 여부를 확인하기 위하여 형광현미경을 이용하여 분석하였다(Figure 2).
3. 세포배양
사람 유래의 골아세포인 MG-63 세포를 10% FBS, 1% penicillin/streptomycin이 첨가된 alpha MEM medium에 37℃ 5% CO2 incubator에서 배양하여, 세포가 배양접시에 가득 자라면 일주일에 두 번 정도 계대 배양하였다. 실험 시에 Trypsin-EDTA을 처리하여 부착된 세포를 떼어낸 후, 일정 농도의 세포를 개수하여 실험에 사용하였다.
4. 형광 현미경을 이용한 세포 형태 관찰
RGD 펩타이드가 고정된 타이타늄 표면에 사람 유래의 골아세포인 MG63 세포를 5 × 103 cell의 농도로 접종하여 6시간 동안 배양한 다음, 배양 배지를 제거하고 PBS로 수세하였다. 이어서 3.7% formaldehyde solution으로 10분간 고정한 뒤 PBS로 수세한 다음 0.1% Triton X-100으로 5분간 처리하였다. 비특이적 염색을 줄이기 위해 1% bovine serum albumin(BSA)를 포함한 fluorescent phalloidin으로 염색한 다음 PBS로 수세하고 DAPI로 염색한 다음 형광현미경상에서 관찰하였다.
5. 세포증식율
In vitro 상에서 골아세포의 증식율을 확인하기 위하여 mitochondria dehydrogenase에 의해 무색의 WST-8가 오렌지색의 수용성 물질로 환원되는 원리를 이용한 WST assay를 통하여 측정하였다. RGD 펩타이드가 고정된 타이타늄 표면에 MG 63 세포를 3 × 103 cell 농도로 접종한 후, 3일, 5일간 배양한 다음, cck-8 solution(Dojindo Molecular technologies, Inc. USA)을 10μl 첨가하여 4시간 동안 배양한다. 4시간 후 배양액의 흡광도를 Sunrise ® microplate reader(Tecan Austria GmbH, Austria)를 사용하여 450 nm에서 흡광도를 측정하여 세포생존율을 대조군에 대한 상대적 비율로 계산하여 나타내었다.
Ⅲ. RESULTS
1. 화학적 결합 방법에 의한 펩타이드 고정
APTES의 공유결합(Andrea 등, 2007)을 이용하여 펩타이드가 효율적으로 고정화되는지 여부를 FITC 링커가 부착된 RGD를 합성하여 순수 타이타늄에 Figure 1의 모식도와 같이 고정화하여, 형광현미경으로 관찰하였다(Figure 2). APTES 없이 물리적인 방법으로만 고정화한 것에 비해 APTES를 이용하여 화학결합 시킨 경우 형광의 세기가 강하게 나타나 더 효율적인 고정화가 된 것을 확인하였다.
2. 골아세포의 접착
Figure 3은 RGD 펩타이드를 APTES를 이용하여 화학적으로 고정화한 타이타늄 시편에, 사람 유래의 골아세포인 MG63을 접종한 뒤 6시간 후에 세포 핵(nucleus)과 세포질(cytoskeleton)을 형광으로 염색하여 세포를 관찰한 사진이다. 펩타이드를 고정화하지 않은 순수한 타이타늄에 비해 RGD를 고정화한 타이타늄 표면에서 세포의 수가 훨씬 더 많이 부착되었으며, 세포의 퍼짐(spreading)도 더욱 향상된 것을 관찰하였다.

Fluorescent images of the MG63 cells grown on (A) pure titanium and (B) RGD peptide immobilized titanium.
이러한 결과는 Figure 2에서와 같이 화학적 공유결합에 의해 펩타이드가 타이타늄 표면에 많이 고정화되어 Figure 3에서처럼 타이타늄 표면에 골아세포의 부착도 증가된 것으로 판단된다.
3. 골아세포의 증식
RGD 펩타이드가 고정화된 타이타늄 표면에 MG 63 세포를 3×103 cell 농도로 접종한 후, 3일 및 5일간 배양한 다음 세포의 성장율을 WST-8의 환원반응을 이용하여 세포의 증식을 평가하였다. Figure 4에서 보는 바와 같이 RGD가 고정화된 타이타늄에서 자란 골아세포는 타이타늄의 성장율과 비슷하거나 유사한 수준으로 나타나 최소한 RGD 펩타이드에 의한 독성은 없는 것으로 보인다.
Ⅳ. DISCUSSION
타이타늄은 우수한 강도와 생체적합성을 가진 우수한 치과용 임플란트 재료라 할 수 있다. 이러한 타이타늄에 뼈와의 유착을 증대시키기 위한 많은 시도가 이루어지고 있는데, 최근에는 물리적, 화학적 표면처리 외에 생체내에서 세포부착, 증식, 사멸 등을 조절하는 다양한 생리활성물질을 코팅, 고정화하는 연구가 많이 진행되고 있는 추세이다.
본 연구에서는 ECM 단백질에 많이 존재하는 서열로 세포의 부착, 증식, 분화, 사멸 등에 증요한 역할을 하는 RGD서열을 순수 타이타늄 표면에 APTES를 이용한 공유결합 방법으로 고정화하여 골아세포에 미치는 거동을 확인하고자 하였다.
펩타이드가 잘 고정화되었는지를 확인하기 위하여 FITC 링커가 부착된 RGD 서열을 접착제의 한 종류인 APTES를 이용하여 고정화한 결과 단순히 물리적으로 처리한 타이타늄에 비해 더 많은 펩타이드가 고정화되어 있음을 확인할 수 있었다. 또한 그 고정화 내구성도 물리적 고정의 경우보다 더 견고하여 RGD 서열의 효과도 오래 지속될 수 있을 것으로 예상된다.
RGD 서열이 고정화된 타이타늄 시편 위에 사람 유래의 MG63 세포를 6시간 키워서 형광현미경으로 관찰한 결과, 세포의 핵과 세포질의 모양이 또렷하고 세포의 증식이 더 증가한 경향을 나타내었다. 또한 세포의 부착(adhesion)과 퍼짐(spreading)도 순수 타이타늄에 비해 크게 증가되어 골아세포의 초기 부착에 RGD 서열의 고정화가 결정적 역할을 한 것으로 사료된다. 더불어 RGD 펩타이드를 고정화한 타이타늄 표면에서 키운 골아세포가 RGD 펩타이드를 고정화하지 않은 순수한 타이타늄 보다 증식이 시간에 비례하여 촉진되었으며, 독성을 나타내지 않아 적어도 증식이 억제되지는 않는 것을 확인하였다.
이러한 결과는 펩타이드 형태의 생리활성물질로 타이타늄 표면을 처리할 경우 향후 토끼 또는 개의 동물실험 시 골유착에도 우수한 결과를 나타낼 것으로 예상되어 펩타이드 서열 외에 성장인자(growth factor)와 fibronectin, vitronectin (Webster 등, 2001) 등과 같은 세포부착에 유익한 단백질분자의 타이타늄 표면처리법으로 제시될 수 있을 것으로 판단된다.
Ⅴ. CONCLUSION
본 연구는 치과용 임플란트의 주 재료인 타이타늄에 생리활성물질로 알려져 있는 RGD 펩타이드를 화학적 공유결합 방법으로 고정화하여 다음과 같은 결론을 얻었다.
- 1. 치과용 임플란트 타이타늄에 펩타이드를 고정화할 때, 물리적 고정보다 APTES를 이용한 화학적 공유결합을 이용한 고정화가 더 많은 양의 펩타이드를 효율적으로 타이타늄 표면에 도입할 수 있는 것을 확인하였다.
- 2. RGD 펩타이드를 타이타늄에 APTES를 이용하여 고정화하면 RGD 펩타이드를 고정화하지 않은 순수한 타이타늄에 비해 골아세포의 부착(adhesion)과 퍼짐(spreading)이 증가 하는 것을 알 수 있었다.
- 3. APTES를 이용하여 RGD 펩타이드를 고정화한 타이타늄에서 키운 골아세포의 증식률은 RGD 펩타이드를 고정화하지 않은 순수한 타이타늄의 증식율과 비슷한 경향을 나타냄으로서 펩타이드에 의한 세포친화성에 영향이 없고 독성도 없음을 알 수 있었다.
결론적으로, APTES를 이용하여 타이타늄 표면에 RGD 펩타이드를 고정화하면 물리적 고정화보다 효율성이 증대되어 타이타늄 표면에 RGD 시퀀스에 의해 골아세포의 부착 및 퍼짐이 증가 하고, 이는 골과 임플란트의 골유착성(osseointegration) 도 증가시킬 수 있는 소지가 있어 임플란트 식립 시 성공율도 증대시킬수 있을 것으로 판단된다.
References
-
Andrea, Bagno, Piovan Alessandro, Dettin Monica, Chiarion Alessia, Brun Paola, Gambaretto Roberta, Fontana Giovanni, Bello Carlo Di, Palù Giorgio, Castagliuolo Ignazio, (2007), Human osteoblast-like cell adhesion on titanium substrates covalently functionalized with synthetic peptides, Bone, 40(3), p693-699.
[https://doi.org/10.1016/j.bone.2006.10.007]

-
Cunha, A., Renz, RP., Blando, E., de Oliveira, RB., Hübler, R., (2014), Osseointegration of atmospheric plasma-sprayed titanium implants: Influence of the native oxide layer, J Biomed Mater Res A, 102(1), p30-36.
[https://doi.org/10.1002/jbm.a.34667]

- Gotfredsen, K., Hjorting-Hansen, E., Budtz-Jo¨rgensen, E., (1990), Clinical and radiographic evaluation of submerged and nonsubmerged implants in monkeys, Int J Prosthodont, 3, p463-469.
-
Gustavo Mendonça, Daniela B.S. Mendonça, Francisco J.L. Araga˜o, Lyndon F. Cooper, (2008), Advancing dental implant surface technology - From micron-to nanotopography, Biomaterials, 29, p3822-3835.
[https://doi.org/10.1016/j.biomaterials.2008.05.012]

-
Herrero-Climent, M., Lázaro, P., Vicente Rios, J., Lluch, S., Marqués, M., Guillem-Martí, J., Gil, FJ., (2013), Influence of acid-etching after grit-blasted on osseointegration of titanium dental implants: in vitro and in vivo studies, J Mater Sci Mater Med, 8, p2047-2055.
[https://doi.org/10.1007/s10856-013-4935-0]

-
Ikada, , Y., (1994), Surface modification of polymers for medical applications, Biomaterials 15, p725-736.
[https://doi.org/10.1016/0142-9612(94)90025-6]

-
Jimbo, R., Sawase, T., Baba, K., Kurogi, T., Shibata, Y., & Atsuta, M., (2008), Enhanced initial cell responses to chemically modified anodized Ti, Clin Implant Dent Relat Res, 10, p55-61.
[https://doi.org/10.1111/j.1708-8208.2007.00061.x]

-
Jansen, J. A., van der Waerden, J. P., & de Groot, K., (1991), Fibroblast and epithelial cell interactions with surfacetreated implant materials, Biomaterials, 12, p25-31.
[https://doi.org/10.1016/0142-9612(91)90127-V]

-
Le Guéhennec, L., Soueidan, A., Layrolle, P., Amouriq, Y., (2007), Surface treatments of titanium dental implants for rapid osseointegration, Dent Mater, 23(7), p844-854.
[https://doi.org/10.1016/j.dental.2006.06.025]

-
Lee, KW., Bae, CM., Jung, JY., Sim, GB., Rautray, TR., Lee, HJ., Kwon, TY., Kim, KH., (2011), Surface characteristics and biological studies of hydroxyapatite coating by a new method, J Biomed Mater Res B Appl Biomater, 98(2), p395-407.
[https://doi.org/10.1002/jbm.b.31864]

-
Nanci, A., Wuest, JD., Peru, L., Brunet, P., Sharma, V., Zalzal, S., (1988), Chemical modification of titanium surfaces for covalent attachment of biological molecules, J Biomed Mater Res, 40, p324-335.
[https://doi.org/10.1002/(SICI)1097-4636(199805)40:2<324::AID-JBM18>3.0.CO;2-L]

-
Nayak, S1., Dey, T., Naskar, D., Kundu, SC., (2013), The promotion of osseointegration of titanium surfaces by coating with silk protein sericin, Biomaterials, (12), p2855-2864.
[https://doi.org/10.1016/j.biomaterials.2013.01.019]

-
Rezania, A., Healy, KE., (1999), Biomimetic peptide surfaces that regulate adhesion, spreading, cytoskeletal organization, and mineralization of the matrix deposited by osteoblast-like cells, Biotechnol Prog, 15, p19-32.
[https://doi.org/10.1021/bp980083b]

- Sandrini, E., Chiesa, R., Rondelli, G., Santin, M., Cigada, A., (2003), A novel biomimetic treatment for an improved osteointegration of titanium, J Appl Biomater Biomech, 1(1), p33-42.
-
Xiao, Y., Truskey, GA., (1996), Effect of receptor-ligand affinity on the strength of endothelial cell adhesion, Biophys J, 71, p2869-84.
[https://doi.org/10.1016/S0006-3495(96)79484-5]