Evaluation of cytotoxicity of 10 dentin desensitizers
Dentin desensitizer is being widely used to treat hypersensitivity of teeth in dental clinics, and a variety of dentin desensitizers are commercially available. Because dentin desensitizers are applied close to oral tissues including gingiva and pulp, it is necessary to evaluate cytotoxicity of 10 desensitizers to secure the biological safety of the materials. In this study, we investigated cytotoxicity of dentin desensitizers by two different evaluation methods, mitochondrial dehydrogenase activity test with WST-8 and agar diffusion assay with neutral red. In the test with WST-8, Gluma Desensitizer, MicroPrime G, HurriSeal and Cervial Cement showed high cytotoxicity, followed by Zarosen, UltraEZ and Systemp desensitizer. In agar diffusion assay, Gluma Desensitizer, MicroPrime G and HurriSeal exhibited severe cytotoxicity, while other desensitizers showed moderate or mild cytotoxicity. Cervical Cement which exhibited relatively high toxicity in WST-8 assay showed mild cytotoxicity in the agar diffusion assay, of which difference was likely due to the difference of evaluation mechanism between WST-8 and neutral red. The highly cytotoxic Gluma Desensitizer, MicroPrime G, HurriSeal contain both or either of glutaraldehyde and 2-hydroxylethyl methacrylate (HEMA), suggesting that glutaraldehyde and HEMA induced strong cytotoxicity of the desensitizers.
Keywords:
Dentin desensitizer, cytotoxicity, mitochondrial dehydrogenase activity, WST-8, agar diffusion assay, neutral red서 론
상아질 지각과민증은 치아의 손상이나 질병에 의한 것이 아닌 외부 자극으로 발생하는 짧고 강한 통증으로 정의되며, 주로 노출된 상아질에 의해 증상이 나타난다 (Dababneh 등, 1999; Walters, 2005). 상아질 노출의 원인으로서 강한 잇솔질에 따른 만성적 외상, 잦은 위산 역류로 인한 치아 표면의 산 부식, 수복치료 시 치아삭제, 치주질환으로 인한 치은퇴축 및 치근표면 노출 등이 있다 (Addy 등, 1994). 상아질 지각과민증은 성인의 8-35%에서 보고되고 있으며, 연령별로는 주로 성인층에서, 그리고 남성보다 여성에서 다소 많이 발생하는 것으로 알려져 있다 (Chabanski 등, 1997). 또한 평균수명 및 자연치 보존률이 높아짐에 따라 치은 퇴축으로 인한 상아질 노출이 빈번해지고 있는 추세이다.
상아질 지각과민증의 발생기전에 대한 가설로서 modulation theory, transducer theory, direct nerve stimulus theory, hydrodynamic theory 등이 있으며 (Borges 등 2012), 현재 유체 역학설 (hydrodynamic theory)이 가장 유력한 가설로 받아들여지고 있다 (Brännström, 1967). 지각과민증의 치료를 위해서는 상아세관을 봉쇄하거나, 신경전달을 저해하는 방법 등이 임상에서 적용되고 있다. 현재 사용되고 있는 지각과민처치제의 종류에는 불소제재, 옥살산염 (oxalate), 접착레진 등이 있다. 불소제재 지각과민처치제는 불소이온이 상아세액의 칼슘이온과 결합하여 CaF2 결정을 형성하고 상아세관에 침착하여 결과적으로 세관 직경을 감소시키거나 봉쇄하는 효과가 있는 것으로 알려져 있다. 그러나 고농도의 불소를 국소적으로 도포할 경우, 상아질 모세포에 대한 유해가 발생할 수 있을 것으로 지적된 바 있다 (Gangarosa, 1994). 옥살산염 지각과민처치제의 주요성분인 옥살산염 (주로 potassium oxalate)은 상아세액의 칼슘이온과 반응하여 불용성의 칼슘-옥살레이트를 형성하게 되며, 이의 침착은 상아세관을 봉쇄를 유도하는 것으로 알려져 있다. Greenhil과 pashely (1981)은 30% potassium oxalate가 상아질 투과성을 98% 감소시킨다고 하였다. 또한 potassium oxalate의 형태로 제공되는 지각과민처치제에서 발생하는 다량의 potassium 이온은 감각신경을 억제하는 효과가 있어, 지각과민증을 생리적으로 감소시키는 것으로 보고된 바 있다 (Trowbridge와 Silver, l990). 따라서 potassium oxalate는 물리적, 생리적으로 지각과민을 감소시키는 효과가 있다고 할 수 있다. 지각과민처치를 위해 접착 레진이 사용되기도 하며, 이는 전적으로 레진의 중합을 이용한 상아세관의 봉쇄를 목적으로 하고 있다. 그리고 레진과 병행하여 혹은 단독으로 glutaraldehyde가 상아세관의 봉쇄를 목적으로 사용되기도 한다. Glutaraldehyde는 상아세관안의 단백질 침전을 유도하여 세관 직경을 좁히는 결과를 초래하는 것으로 알려져 있다 (Qin 등, 2006). 현재 국내 치과에서 많이 사용되고 있는 지각과민처치제 중 하나인 Gluma Desensitizer (Heraeus Kulzer, Hanau, Germany)는 glutaraldehyde와 2-hydro- xylethyl methacrylate (HEMA)를 포함하고 있으며, 두 성분 모두 상아세관 봉쇄를 유도하는 물질로 사용되고 있다.
위에서 언급한 바와 같이 현재 사용되고 있는 대부분의 지각과민처치제는 상아세관의 봉쇄를 목적으로 하고 있으므로, 적용 시에 치은 및 치수 조직과 접촉할 수 있으며, 구성분의 종류에 따라 접촉부위에 세포독성 등의 위해를 가할 수 있다. 이전의 연구에서 Gluma Desensitizer 등은 세포성장을 억제한다고 보고되었으나 (Wieqand 등, 2008), Camps 등 (2002) 은 0.5 mm 두께의 상아질 slice가 세포와 지각과민처치제 사이에 놓일 경우 세포독성이 발생하지 않는다고 하였다. 이는 치수세포에 대한 지각과민처치제의 세포독성은 상아질에 의해 현격히 감소할 수 있음을 보여준 결과라 할 수 있다. 그러나 Wiegand 등 (2008)은 상아질의 두께가 1 mm 이하의 경우 세포독성이 나타날 수 있다고 하였다. 따라서 상아질의 두께에 세포독성이 반비례하며, 세포독성이 나타나지 않는 상아질의 두께는 실험조건에 따라 달라질 수 있다고 할 수 있다. 본 연구에서는 International Organization for Standard (ISO)에 기술된 방법을 사용하여 지각과민처치제의 객관적인 세포독성 정도를 파악하고자 하였다.
재료 및 방법
1. 지각과민처치제의 시료 준비
본 연구에 사용된 지각과민처치제의 종류와 주요성분은 Table 1에서와 같다. 불소가 포함된 재제로서는 HurriSeal, MicroPrime G, UltraEZ가 있으며, glutaraldehyde는 Gluma Desensitizer, MicroPrime G, Systemp desensitizer에 포함되어있다. 또한 oxalate를 성분으로 하고 있는 지각과민처치제는 BisBlock, MS Coat ONE, Super Seal이 있으며, HEMA와 같은 레진 성분은 Gluma Desensitizer, HurriSeal, MicroPrime G, MS Coat ONE, Systemp desensitizer, Zarosen에 포함되어 있다. 따라서 서론에서 언급한 다양한 종류의 상아질 봉쇄기능 물질들이 한 가지 제품에 복수로 첨가되는 경우가 빈번하다.
세포독성 평가를 위한 시료의 준비는 다음과 같다. 우선 밑면이 편평한 멸균된 유리병에 지각과민처치제를 주입하고, 무균상태에서 건조시킨 후, 추출액으로서 배양액 (10% FBS를 포함한 Eagle‘s Basal Medium)을 첨가하여 37°C에서 72시간 동안 추출하였다. 젤형 (UltraEZ)과 액상/분말 혼합형 (Cervial Cement)의 지각과민처치제는 추출액과의 비율이 0.2 g/ml이 되도록 하였으며, 액상의 경우 5 ul를 주입하여 유리병 밑면에 골고루 퍼지도록 하고, 바닥면을 기준으로 하여 6 cm2/ml이 되도록 배양액을 첨가하였다. 시료와 추출액의 비율은 ISO 10993-12 (2012)에 준하여 결정하였다.
2. WST-8을 이용한 세포독성 측정
본 연구에서는 지각과민처치제 추출액의 연속 희석액에 대한 세포독성 측정 및 한천확산에 의한 세포독성 측정을 수행하였다. 연속 희석액에 대한 세포독성 측정은 [2-(2-methoxy-4-nitrophenyl)-3-(4-nitrophenyl)-5-(2,4-disulfophenyl)-2H-tetrazolium, monosodium salt] (WST-8)이 포함된 Cell Counting Kit-8 (CCK-8) (Dojindo Laboratories, Tokyo, Japan)을 사용하였다 (Lee 등 2009). 음성 대조군으로 재료를 넣지 않은 빈 유리병에서 동일한 조건으로 용출실험을 진행한 배양배지를 사용하였다. 세포는 ATCC CCL 1 fibroblast (NCTC clone 929, L929)를 사용하였으며, L929 세포를 10% FBS가 포함된 Eagle‘s Basal Medium으로 0.8×105 cells/ml가 되도록 희석한 후, 96 well plate에 각 well에 세포 현탁액을 100 μl씩 분주하고 37°C, 5% CO2의 환경에서 배양하였다. 24시간 후 배양액을 200 μl의 지각과민처치제 추출액 혹은 이의 희석액으로 교체하고 다시 24시간 배양하였다. 24시간 경과한 후, 현미경하에서 세포모양의 변화를 관찰하고, 각 well의 배양액을 제거한 후, CCK-8 용액이 10% 포함된 새로운 배양액을 첨가하고 37°C에서 한 시간 배양하였다. 배양액은 450 nm에서 흡광도를 plate reader (Sunrise; TECAN, Salzburg, Austria)로 측정하고, 음성대조군의 흡광도를 100%로 하여 상대값을 상대세포활성도 (relative cell viability)로 하였다.
3. 한천확산법
2.5 x 105 cell/ml의 L929세포 현탄액을 100mm의 culture dish에 10mL 넣고 24h, 37°C, 5% CO2의 조건에서 배양하였다. 멸균된 3% 한천용액과 농도가 2배인 배양액을 45°C가 되도록 한 후, 1:1로 혼합하였다. 세포를 배양한 용기에서 상층의 배양액을 제거하고, 한천배지 3 ml을 첨가하였다. 한천층이 굳은 후, 100%의 지각과민처치제로 적신 직경 7 mm 셀룰로오스 여과필터 (No 5 Whatman celluloser filter, Banbury, UK)를 한천층 위에 위치시켰다. 각 여과필터 사이의 간격은 최소 20 mm 이상으로 하였으며, 음성대조군은 배양액을, 양성대조군은 0.1% zinc diethyldithiocarbamate (ZDEC)에 적신 여과필터를 사용하였다. 37°C, 5% CO2의 환경에서 24시간 배양 후, 시료를 제거하고, 3 ml의 0.02% neutral red를 포함한 phosphate-buffered saline (PBS)를 첨가하고 4시간 배양하였다. 배양 후, PBS를 제거하고 현미경으로 세포의 형태를 관찰하고, clear zone의 크기를 측정하였다. 세포독성 정도의 판별은 ISO 10993-5 (2009)에 근거하여 Table 2의 분류에 따라 시행하였다.
4. 통계 및 LD50
WST-8을 이용한 세포독성 실험 결과는 3번의 독립적인 실험값의 평균과 표준오차로 나타내었다. LD50는 Microsoft사의 Excel 프로그램을 이용하여 결정계수 (R2)가 0.95보다 크도록 추세선 방정식을 구하고, 이를 이용하여 상대세포활성 50%를 유도하는 추출액의 희석배수를 구하였다. 한천확산법에서는 모든 시료에서 3번의 독립적인 실험결과가 같은 반응도를 보였다.
결 과
1.WST-8을 이용한 지각과민처치제 세포독성 측정
지각과민처치제의 용출용액과 이들의 희석액으로 세포독성을 측정하였다. 배양액은 phenol red를 함유하고 있어, 추출액의 대략의 pH를 알 수 있었다. 시험된 10가지 지각과민처치제 중 BisBlock, MS Coat ONE, Super Seal이 강한 산성을 나타내는 황색을 띠었다. Figure 1은 희석액의 세포독성을 나타낸다. 가장 강한 세포독성을 나타내는 것은 Gluma Desensitizer로서, 희석액의 농도가 1.56%에서도 대부분의 세포활성이 영향을 받았다. 다음으로 세포독성이 강한 것은 Miro Prime G이며, 1.56%에서 50% 이하의 세포활성을 보였다. 따라서 Gluma Desensitizer와 Micro Prime G에서는 lethal concentration 50 (LC50)가 1.56% 이하로 나타났다 (Table 3). Cervial Cement와 HurriSeal이 유사한 정도의 세포독성을 보였으며 LC50는 각각 2.2% 및 2.0%이다. UltraEZ와 Zarosen은 희석액의 농도가 12.5%와 25%사이에서 급격한 세포독성의 증가가 보였으며, LC50를 기준으로 할 경우 UltraEZ가 Zarosen보다 약한 세포독성을 나타내었다.
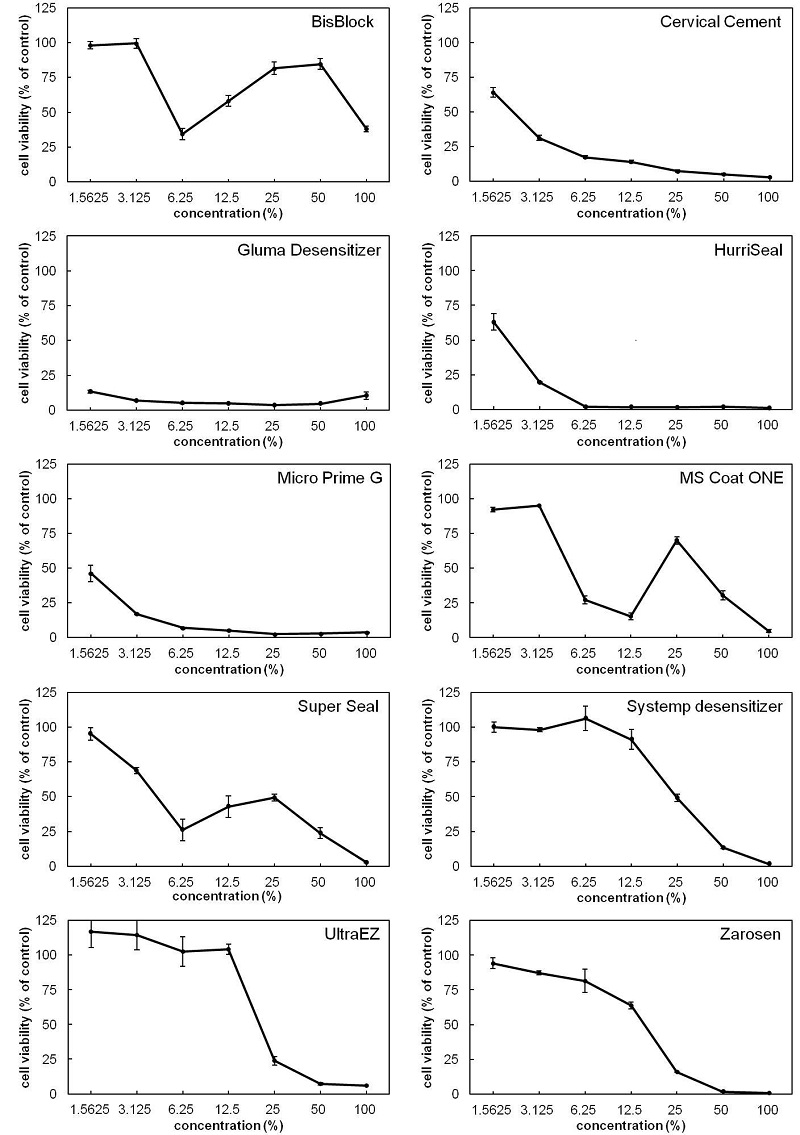
Cytotoxicity of dentin desensitizers-WST-8 assay. Cytotoxicity of the extracts of desentizers were evaluated by using WST-8.
앞서 언급한 oxalate계의 BisBlock, MS Coat ONE, Super Seal은 6.25% 이하의 저농도 구간에서 세포독성이 농도 의존적으로 나타났으나, 이후 고농도의 일부 구간에서 WST-8의 흡광도가 증가가 나타났다. 또한 가장 낮은 농도인 1.56%에서는 세포독성을 보이지 않았으나, 일부 구간에서의 흡광도 증가로 인해 LC50는 구할 수 없었다.
2. 한천확산법에 의한 세포독성 측정
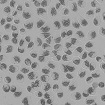
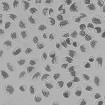
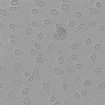
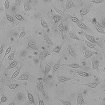
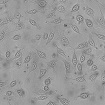
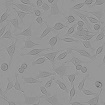
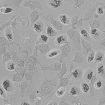
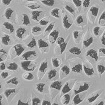
WST-8을 이용한 세포독성 측정 결과에서 나타난 바와 같이 일부 제품 성분의 특수성으로 인해 세포독성이 판별이 불가능하였으며, 이로 인해 제품간의 세포독성 비교가 용이하지 않았다. Table 4는 한천확산법에 의한 세포독성 측정결과를 보여준다. 세포독성의 정도는 Table 2에 설정된 반응도를 기준으로 결정하였다. Table 4의 현미경 사진은 시편 (추출액에 적신 필터) 밑의 세포 (under specimen)와 시편 주변의 세포 (outside specimen)을 보여주고 있다. Neutral red에 의해 강하게 염색되어 있는 세포는 살아있는 상태를 나타낸다. UltraEZ에서는 시편의 밑에 있는 세포가 일부 염색되어 있었으며, 세포의 형태 또한 크게 변형되지 않았다. 따라서 세포독성은 ‘아주 미약 (slight)’으로 판명되었으며, 시험된 지각과민처치제 중 가장 약한 세포독성을 보였다. BisBlock, Cervical Cement, MS Coat ONE, Super Seal, Zarosen은 세포독성이 ‘미약 (mild)’로 나타났다. 따라서 WST-8법으로 세포독성 측정이 불가능하였던, BisBlock, MS Coat ONE, Super Seal은 지각과민처치제 중 중간정도의 세포독성이 있음을 보여주는 결과이다. Systemp desensitizer는 시편의 직하방 뿐 아니라 주변의 세포에도 영향을 주었으며, clear zone의 크기는 10 mm 이하로서 '중증도 (moderate)'로 나타났다. Gluma Desensitizer, Hurriseal, MicroPrime G는 clear zone의 크기가 10 mm 이상으로서 매우 강한 세포독성을 보였다.
고 찰
본 연구에서는 다양한 종류의 지각과민처치제에 세포독성을 측정하였다. 세포 배양액으로 추출시 BisBlock, MS Coat ONE 및 Super Seal의 추출액이 황색으로 변화된 이유는 oxalate에 의한 산성화에 기인하는 것으로 판단된다. 현재까지 다양한 방법의 세포독성 측정 방법이 개발되어 왔으며, 그중 tetrazolium계 화합물을 이용한 MTT, XTT 법은 가장 널리 사용되고 있는 방법이며, 최근에는 감도를 증가시킨 tetrazolium계 WST-8 등이 자주 사용되고 있다. 그러나 Figure 1에서 보이는 바와 같이 oxalate를 함유한 BisBlock, MS Coat ONE 및 Super Seal은 일정 농도의 추출액에서 WST-8의 비정상적인 흡광도 증가가 나타났다. Oxalate의 지각과민 억제효과는 calcium oxalate염이 형성되어 상아세관을 봉쇄함으로서 발생하는 것으로 알려져 있다. 또한 calcium oxalate crystal은 세포막을 파괴함으로서 세포독성을 일으킬 수 있는 것으로 보고된 바 있다 (Guo와 McMartin, 2005). 따라서 세포독성이 발생하는 이유는 배양 중에 형성된 calcium oxalate crystal이 원인으로 판단된다. Oxalate 화합물의 또 다른 특징으로서 환원작용이 알려져 있다. WST-8은 mitochondrial dehydrgenase와 같은 환원 촉매 물질에 의해 환원되어 색변화가 일어나기 때문에, 일정농도 이상의 oxalate에 의해 환원됨으로서 세포활성과 무관한 비정상적인 흡광도 증가가 발생하였을 것으로 추측된다. 그러나, 고농도의 추출액에서는 다시 흡광도가 급격히 감소하였다. 이는 고농도의 oxalate가 calcium 이외의 다른 이온과 결합하여, 결과적으로 배지내에서 oxalate 이온이 제거됨으로서, 이의 환원효과가 사라지기 때문인 것으로 추측된다. 결론적으로 oxalate에 의한 화학적 변화 등으로 인해 WST-8을 이용한 세포독성 측정법은 이러한 제품의 독성 평가에 적합하지 않는 것으로 판단된다.
한천확산법에 의한 측정결과에서는 Gluma Desensitizer, Hurriseal, MicroPrime G가 매우 강한 세포독성을 보였다. 이들 제품은 HEMA를 공통적으로 함유하고 있으므로 HEMA가 세포독성 유발 원인으로 판단된다. 또한 Systemp desensitizer도 중증도의 세포독성을 나타냈다. Systemp desensitizer는 HEMA를 포함하고 있지 않지만 약 5%의 gluataraldehyde를 함유하고 있다. Gluataraldehyde는 세포독성이 매우 강한 물질로 알려져 있으며 (McGregor 등 2006), 독성이 강한 Gluma Desensitizer와 MicroPrime G의 구성분이기도 하다. 특히 gluataral-dehyde와 HEMA를 모두 함유하고 있는 Gluma Desensitizer와 MicroPrime G는 WST-8법에 의한 측정에서 가장 강한 세포독성을 보였다. 그러므로 gluataraldehyde와 HEMA를 동시에 지닌 지각과민처치제는 임상 적용 시 구강조직에 영향을 주지 않도록 주의가 요구된다.
본 연구에서는 WST-8 측정법과 한천확산법의 결과가 반드시 일치하지는 않았다. Cervical Cement와 Systemp desensitizer는 WST-8 측정결과, LC50가 각각 2.2%와 25.1%로서 Cervical Cement의 독성이 현저히 강하게 나타났으나, 한천확산법에서는 Systemp desensitizer의 세포독성이 상대적으로 강하게 발생하였다. 즉 Cervical Cement에서는 미량의 독성이 강한 물질이 용출되고, Systemp desensitizer에서는 다량의, Cervical Cement보다 독성이 적은 물질이 용출되었다고 판단된다. 또한 한천확산법에 사용된 agar가 독성물질의 확산에 영향을 미칠 수 있으므로, WST-8 측정법과 한천확산법 측정 결과의 차이를 초래하였을 가능성도 배제할 수 없다.
본 연구결과에서 나타난 바와 같이 일부 지각과민처치제는 매우 강한 세포독성을 나타내고 있으므로, 동물을 이용한 생체적합성 평가를 통하여, 전반적인 생물학적 안전성의 검증이 요구된다 할 수 있다.
결 론
다양한 지각과민처치제의 세포독성을 측정한 결과, WST-8을 이용한 mitochondrial dehydrogenase 측정법에서는 Gluma Desensitizer, MicroPrime G, HurriSeal and Cervial Cement가 Zarosen, UltraEZ and Systemp dese- nsitizer보다 강한 세포독성을 보였으며, 이는 한천확산법에서도 유사한 경향을 보였다. 단 WST-8법에서 강한 세포독성을 보인 Cervial Cement는 한천확산법에서 경미한 세포독성을 나타냈다. 이는 WST-8과 neutral red의 세포 염색 기전의 차이에 기인하는 것으로 추측된다.
Acknowledgments
본 연구는 2012년도 식품의약품안전청 용역연구개발과제의 연구개발비지원 (12172의료평504)에 의해 수행된 것임.
References
- M Addy, N Pearce, Aetilolgical, predisposing and environmental factors in dentin hypersensitivity, Arch Oral Biol, (1994), 39(Suppl), pS33-S38.
-
AB Borges, DC Barcellos, CRG Torres, ALS Borges, ALM Marsilio, CAT Carvalho, Dentin hypersensitivity-Etiology, treatment possibilities and other related factors: A literature review, World J Dent, (2012), 3, p60-67.
[https://doi.org/10.5005/jp-journals-10015-1129]

-
M Brännström, LA Lindén, A Aström, The hydrodynamics of the dental tubule and of pulp fluid. A discussion of its significance in relation to dentinal sensitivity, Caries Res, (1967), 1, p310-317.
[https://doi.org/10.1159/000259530]

- J Camps, I About, B Van Meerbe다, JC Franquin, Effiency and cytotoxicity of resin-based desensitizing agents, Am J Dent, (2002), 15, p300-304.
-
MB Chabanski, DG Gillam, JS Bulman, HN Newman, Clinical evaluation of cervical dentine sensitivity in a population of patients referred to a specialist periodontology department: a pilot study, J Oral Rehabil, (1997), 24, p666-672.
[https://doi.org/10.1111/j.1365-2842.1997.tb01079.x]

-
RH Dababneh, AT Khouri, M Addy, Dentine hypersensitivity - an enigma? A review of terminology, epidemiology, mechanisms, aetiology and management, Br Dent J, (1999), 187(11), p606-611.
[https://doi.org/10.1038/sj.bdj.4800345]

-
LP Gangarosa Sr, Current strategies for dentist applied treatment in the management of hypersensitive dentine, Arch Oral Biol, (1994), 39(Suppl), p101S-106S.
[https://doi.org/10.1016/0003-9969(94)90195-3]

-
JD Greenhill, DH Pashley, The effects of desensitizing agents on the hydraulic conductance of human dentin in vitro, J Dent Res, (1981), 60, p686-698.
[https://doi.org/10.1177/00220345810600030401]

-
C Guo, KE McMartin, The cytotoxicity of oxalate, metabolite of ethylene glycol is due calcium oxalate monohydrate formation, Toxicol, (2005), 208, p347-355.
[https://doi.org/10.1016/j.tox.2004.11.029]

- ISO 10993-12:2012 Biological evaluation of medical devices - Part 12: Sample preparation and reference materials.
- ISO 10993-5:2009 Biologocial evaluation of medical devices - Part 5: Tests for in vitro cytotoxicity.
-
DH Lee, NR Kim, B-S Lim, Y-K Lee, H-C Yang, Effects of TEGDMA and HEMA on the expression of COX-2 and iNOS in cultured murine macrophage cells, Dent Mater, (2009), 25, p240-246.
[https://doi.org/10.1016/j.dental.2008.05.014]

-
D McGregor, H Bolt, V Cogliano, H-B Richter-Reichhelm, Formaldehyde and glutaraldehyde and nasal cytotoxicity: Case-study within context of the IPCS Framework for analysing the relevance of a cancer mode of action for humans, Crit Rev Toxicol, (2006), 36, p821-835.
[https://doi.org/10.1080/10408440600977669]

-
C Qin, J Xu, Y Zhang, Spectroscopic investigation of the function of aqueous 2-hydroxyethylmethacrylate/ glutaraldehyde solution as a dentin desensitizer, Eur J Oral Sci, (2006), 114, p354-359.
[https://doi.org/10.1111/j.1600-0722.2006.00382.x]

- HO Trowbridge, DR Silver, A review of current approaches to in-office management of tooth hypersensitivity, Dent Clin North Am, (1990), 34, p403-428.
- PA Walters, Dentinal hypersensitivity: a review, J Contemp Dent Pract, (2005), 6(2), p107--117.
- A Wiegand, K Buchholz, C Werner, T Attin, In vitro cytotoxicity of different desensitizers under simulated pulpal flow conditions, J Adhes Dent, (2008), 10, p227-232.