The effect of interconnective micropores of biphasic calcium phosphate scaffold on osteoblast cellular behavior
The objective of this study was to evaluate the effect of interconnective micropore on osteoblast proliferation and spreading. The micropores of scaffold were observed by field emission scanning electron microscope. Surface roughness of slurry coated surface was determined by the atomic force microscope. Contact angle goniometer was used to evaluate differences in contact angle between surfaces. MTT (3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyl tetrazolium bromide) assay was used to measure the cell proliferation. The surface roughness of microporous specimens was higher than that of non-microporous specimen. The contact angles of microporous specimens were lower than that of non-microporous specimen. Cell spread was greater on microporous scaffolds than non-microporous scaffolds. In addition, cell proliferation was increased when cells were cultured on microporous scaffold. The result demonstrated that interconnective micropores of biphasic calcium phosphate scaffold generally improved the response of osteoblast in-vitro. This behavior could be explained by surface roughness and hydrophilicity.
Keywords:
Interconnective micropores, Biphasic calcium phosphate scaffold, Roughness, Contact angle, Proliferation, SpreadingⅠ. 서 론
손상성 장애, 종양제거, 심한 골흡수 등으로 인해 골결손이 발생한 경우, 골결손부의 안정 및 치유를 증진시키기 위해 골 이식 술이 시행되고 있다. 골 이식술은 골 이식 재료의 종류에 따라 자가골 이식, 동종골 이식, 이종골 이식 그리고 합성골 이식 등 크게 4 가지로 분류한다. 이러한 골이식재 중 골유도성과 골형성능이 뛰어난 자가골은 가장 이상적인 골 이식재로 평가되지만, 자가골 채득을 위한 부가적인 수술이 필요하고 이로 인한 합병증과 회복기간의 증가, 많은 골이 필요한 경우 충분한 양을 얻을 수 없으며 채취에 부가적인 수술 시간이 더 소요되는 등의 단점이 있다 (Borstlap 등, 1990; Clavero와 Lundgren, 2003).
이러한 문제점을 극복하고 자가골을 대체하기 위한 다양한 종류의 골이식재의 개발과 연구가 지속되고 있다. 최근까지 많이 사용되고 있는 동종골 이식재는 사체에서 채취하므로 환자의 불편함이나 양의 부족 등의 문제는 극복할 수 있으나 조작이 쉽지 않고, 약 1백만에서 8백만 분에 1의 확률로 질병 감염의 가능성이 있다. 또한, 면역학적 거부현상을 감소시키기 위한 과정에서 골형성 능력이 감소되고 표본별로 골유도 능력에 상당한 차이를 보이는 단점이 있다 (Emmings, 1974; Froum 등, 1995; Wolff 등, 2000). 그리고 이종 골의 경우, 공급과 제조가 용이하지만 동물의 질병 전염 가능성 및 골 유도능이 상당히 떨어지는 단점을 지니고 있다 (Araújo 등, 2009).
최근에는 합성골 이식재에 관한 연구가 광범위하게 이루어지고 있으며, 전세계적으로 골재건 수술에서 사용되는 이식재의 상당부분을 합성골 이식재를 사용 하는 것으로 보고되었다 (Lewandrowski 등, 2000). 합성골 대체재로 가장 일반적으로 이용되는 세라믹 재료 중 인산칼슘 계 재료는 골조직과 치아의 성분 및 구조가 유사하며, 생체친화성을 가지고 있기 때문에 골 이식 재료로서 많은 연구가 이루어져 왔다 (Daculsi 등, 1990; Jarcho, 1981).
최근 가장 각광받는 인산칼슘 계 합성골 이식재인 hydroxyapatite (HA)와 beta-tricalcium phosphate (β-TCP)을 혼합한 biphasic calcium phosphate (BCP) 합성골 이식재에 대한 연구가 활발히 이루어지고 있다. HA는 신생골이 성장할 수 있는 훌륭한 골격을 제공할 수 있으나 낮은 분해능으로 인해 재생능에 있어서는 평가가 회의적이었던 반면, β-TCP는 골결손부위에서 신생골 형성 능력이 있음이 증명되었으나 너무 높은 분해성으로 인해 신생골이 형성되기 이전에 모두 분해가 되어 지지체로서의 역할에는 한계가 있었다 (Daculsi 등, 1989; Gauthier 등, 1998; Karabuda 등, 2001). 따라서, BCP는 안정성 높은 재료인 HA와 생물학적 활성도가 높은 재료인 β-TCP를 적절히 혼합함으로써 합성골의 흡수와 신생골 형성 간에 완벽한 균형을 이룰 수 있을 것으로 생각된다 (Nery 등, 1992; Yamada 등, 1997). HA와 β-TCP의 최적의 혼합비율을 알아내고자 하는 연구에서, HA의 비율이 β-TCP의 비율보다 높은 것이 골결손 내에서 신생골 형성을 촉진한다고 밝혀졌다 (Nery 등, 1992). 일반적으로 60%의 HA와 40%의 β-TCP를 혼합하는 것이 골이식재로서 가장 이상적인 혼합비율이라고 주장하고 있다 (Daculsi, 1990; Nery 등, 1992).
구조적으로는 신생골과 혈관이 형성해 나갈 수 있고 세포들이 이동할 수 있는 거대기공과 그 기공들이 상호 연결성이 매우 중요하다. 아직까지 기공의 크기는 논란의 대상인데, Klawitter와 Hulbert (Klawitter와 Hulbert 등, 1998) 등은 효과적인 뼈의 성장이 이루어지려면 최소한 기공의 크기가 100 µm 이상이 되어야 한다고 주장하였으며 150 µm 일 때 최적이라고 제안하였다. 또한 Chung 등 (Chung 등, 2000)은 다양한 기공 크기를 가진 직선형 다공성 세라믹으로 실험한 결과 50μm 뼈의 성장이 일어났으며, 300 µm에서 가장 왕성한 골 성장이 나타났다고 보고하였다.
이에 부가적으로는 골이식재의 표면특성과 관련된 최근의 연구는 마이크론 단위의 미세다공성구조의 중요성을 강조하고 있다. 직경 10 µm이하의 미세기공은 이식재 내부로의 체액순환을 용이하게 하여 용해와 분해에 영향을 미치고 골재생 과정에서 단백질 흡착, 세포부착과 광물화를 촉진하여 골조직 재생을 향상하는 가장 중요한 표면특성의 하나인 것으로 알려졌다 (Gauthier 등, 1998; Fujibayashi 등, 2004).
본 연구에서는 미세기공에도 거대기공과 같이 상호 연결성이 형성이 된다면 더욱 증진된 결과를 얻을 수 있을 것 이라는 가정을 하고, 상호 연결된 거대 기공과 상호 연결된 미세기공을 함께 가진 스캐폴드를 제작하여 미세기공률에 따른 조골세포의 거동을 평가하였다.
재료 및 방법
스캐폴드 제작
60 ppi (pore per inch) polyurethane (PU) sponge는 표면의 친수화를 위해서 2 wt% NaOH 용액에 20분간 표면처리를 실시하였다. 표면처리 된 스펀지는 표면에 남아있는 잔류 NaOH의 제거를 위해 흐르는 물에 세척 한 후, 증류수에 함침시켜 초음파 세척기에서 세척하였다. Biphasic calcium phosphate (BCP) (Osgen Co., Daegu, Korea) 슬러리는 BCP 분말과 2 wt% polyvinyl alcohol (PVA) (Sigma-Aldrich Co., St. Louis, MO, USA) solution을 1.5:1의 비율로 혼합하여 교반하여 준비하였다.
표면 처리된 PU 스펀지를 준비된 BCP 슬러리에 함침시켜 슬러리가 스펀지 내부로 침투할 수 있도록 스펀지를 여러 번 수축 팽창시켰다. 다음 슬러리로 코팅된 스펀지를 여러 번 짜내어 스펀지의 기공을 막고 있는 잉여 슬러리를 제거하였다. 상온에서 12시간 건조 후, 전기로에서 열처리하였다. 열처리 조건은 300°C 까지는 3°C/min의 승온속도로 승온하고, 스펀지가 가장 급격히 휘발하는 300°C–400°C 구간에서 1°C/min의 승온 속도로 천천히 승온하였다. 다음, 600°C까지 다시 3°C/min의 속도로 승온하고, 600°C에서 1시간 동안 유지한 후 1200°C까지 5°C/min으로 승온 후 3시간 동안 소결하였다.
표면 미세기공 형성
위와 같은 방법으로 소결된 시편을 BCP 분말과 2% PVA solution을 1:3의 비율로 혼합한 점도가 낮은 슬러리에 함침하고 압축공기를 분사하여 잉여 슬러리를 제거함으로써 슬러리를 2차적으로 코팅하였다. 상온에서 12시간 건조한 후, 3시간의 소결 과정을 거쳐 미세 기공이 표면에 형성된 스캐폴드를 제조하였다. 이때 소결온도 조건을 Table 1과 같이 1150°C, 1200°C로 각각 달리하여 미세기공을 조절하였다. 그리고 그에 따라 표면에 형성된 미세기공을 image analyzer로 분석한 결과 미세기공률이 각 조건 별로 5%, 20%를 나타내었고 이를 바탕으로 하여 실험군을 MP5와 MP20으로 명명 하였고, 2차적인 BCP코팅을 하지 않아 미세기공이 형성되지 않은 스캐폴드를 대조군으로 선정하였다.
표면 분석
주사전자현미경(FE-SEM, JSM-6700F, Jeol, Tokyo, Japan)을 이용하여 미세기공이 형성된 표면의 미세한 형태학적 특성을 관찰하였다.
표면의 거칠기를 측정하기 위하여 비접촉모드의 atomic force microscope (AFM, XE-100, Park Systems Corp., Suwon, Korea)를 이용하였다. 이미지는 15 µm × 15 µm 의 scan size와 0.5 Hz scan rate로 수행하였다. 얻어진 AFM 이미지에서 average surface roughness (Ra)와 surface area를 계산하였다.
각 표면의 젖음성을 평가하기 위하여 접촉각을 측정 하였다. 시편에 증류수 3 µl를 떨어뜨린 후, 접촉각 측정장치(OCA 15 plus, Data Physics Instrument GmbH, Filderstadt, Germany)를 이용하여 관찰하였다. 단, 본 실험에서 스캐폴드의 구조적 한계로 인하여 AFM분석과 접촉각 측정은 같은 조건으로 제작된 BCP disc에서 수행하였다.
세포배양
MG63 세포(American Type Culture Collection (Rockville, Maryland, USA)를 10% FBS, 1% penicillin/streptomycin이 첨가된 alpha MEM medium에 37°C 5% CO2 incubator 에서 배양하였다. 세포가 배양 접시에 가득 자라면 Trypsin-EDTA을 처리하여 부착된 세포를 떼어낸 후, 실험에 사용하였다.
전자현미경을 이용한 세포 형태 관찰
제조된 스캐폴드를 1×105cell의 농도로 접종하여 시편 상에서 24시간 동안 세포를 배양하였다. 각각의 시편 상에 배양된 세포는 3% glutaraldehyde 용액으로 2시간 동안 전고정(pre fixation)하고, 1% osmium tetroxide (OsO4)로 2시간 동안 후고정을 하였다. 고정 전후에 PBS buffer로 각 10분씩 2회에 걸쳐 세척하였다. 이러한 과정을 거쳐 고정된 세포를 30%, 50%, 70%, 90%, 및 100% 농도의 에탄올 용액으로 탈수하였다. 임계점 건조를 하기 위하여, CO2 가스와 잘 치환되는 isoamyl acetate 용액을 사용하였다. 먼저 100% 에탄올과 isoamyl acetate가 1:1의 비율로 동량 혼합된 용액에 30분 동안 처리한 후, 다음으로 1:3 비율로 혼합된 용액에 3시간 동안 처리하였다. 뒤 이어 임계점 건조를 하였고, 임계점 건조가 끝난 시편은 Pt 코팅한 후 주사전자현미경을 이용하여 시편 표면상에 세포의 부착 정도를 관찰하였다.
세포 증식률 측정
세포 증식률은 mitochondria dehydrogenase에 의해 노란색의 tetrazolium salt가 보라색의 formazan 결정체로 전환되는 원리를 이용한 MTT assay를 통하여 측정하였다. 12 well plate에 스캐폴드 시편을 놓고, MG63 세포를 1×105씩 접종을 하고 1일, 3일, 7일 씩 배양하였다. 1일, 3일, 7일 간 배양한 세포에 5 mg/mL의 농도로 PBS에 녹인 MTT용액 100 µL를 첨가하고 4시간 동안 37°C incubator에서 배양하였다. 4시간 후 MTT용액이 든 배지를 제거하고 생성된 보라색의 formazan 결정체를 DMSO로 용해시킨 후, Sunrise microplate reader (Tecan Austria GmbH, Grödig, Austria)를 사용하여 570 nm 에서 흡광도를 측정하여 세포 생존율을 나타내었다.
결 과
Figure 1은 주사전자현미경을 이용하여 스캐폴드 표면의 미세구조를 고배율로 관찰한 결과이다. 묽은 슬러리로 2차적인 코팅을 하지 않은 거대기공만 가진 스캐폴드의 표면은 미세기공이 전혀 존재하지 않은 치밀한 구조를 나타내고 있다 (Figure 1(a)). 반면에 2차적인 BCP 코팅을 수행한 스캐폴드는 Figure 1(b)와(c)에서 나타나듯이 미세기공이 형성 되는 것을 관찰 할 수 있었다. 그리고 MP5와 MP20을 비교해 보았을 때, MP20에서 훨씬 많은 미세기공을 관찰 할 수 있었고, 미세기공들이 상호 연결된 상호 연결성을 형성한 것을 관찰 할 수 있었다.
Figure 2와 Table 2에서는 표면의 AFM 이미지와 중심선 평균 거칠기 (Ra) 그리고 표면적을 나타내었다.
2차적인 코팅을 한 표면은 미세기공을 형성하면서 코팅을 하지 않은 표면보다 유의하게 큰 Ra값을 나타내었다 (p' > 0.05). 그리고 표면의 기공률이 증가할수록 Ra값은 증가하는 경향을 보였으며, 그에 따른 표면적도 증가하였다.
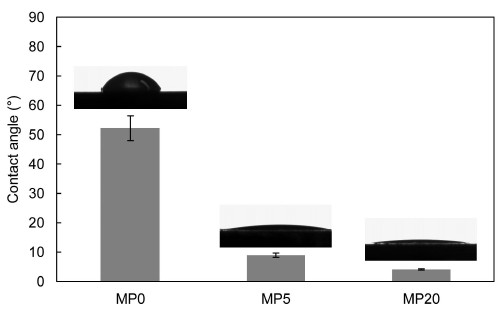
2차적인 코팅을 하지 않은 표면에서는 접촉각이 약 55°로 측정이 되었다. 5%의 미세기공이 형성 된 MP5는 9° 정도로 접촉각이 감소하였다. 그리고 micoporosity가 증가할수록 접촉각은 점점 더 감소하였다 (Figure 3). 이 결과로 표면에 존재하는 미세기공이 표면의 친수적인 성질을 향상시키는 것으로 확인되었다.
Figure 4는 스캐폴드에서 1일 간 배양한 MG63 세포를 주사전자현미경으로 관찰한 사진이다. 관찰 결과 미세기공이 없는 MP0에서는 세포가 둥근 형태를 유지하며 세포 퍼짐이 잘 일어나지 않은 형상을 나타내었다. 반면 미세기공이 형성된 스캐폴드인 MP5, MP20 에서는 세포들이 표면에 넓게 퍼져있는 것을 관찰 할 수 있었고, 퍼진 정도는 미세기공률이 증가할수록 증가하는 것을 관찰할 수 있었다.
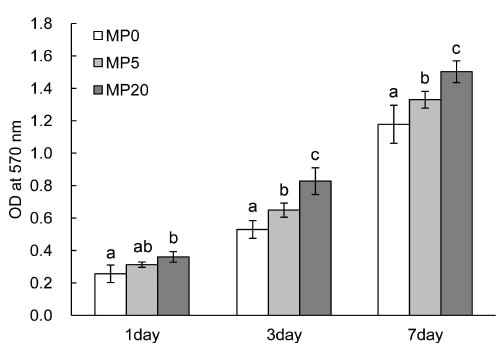
세포증식률은 Figure 5의 결과와 같이, 배양 후 1일, 3일, 그리고 7일 3개의 시점에서 확인하였다. 결론적으로 미세기공이 형성된 시편이 미세기공이 형성되지 않은 시편보다 유의하게 높은 증식률을 나타내었고, 미세기공률이 증가할수록 증식률 또한 증가하는 것을 확인하였다.
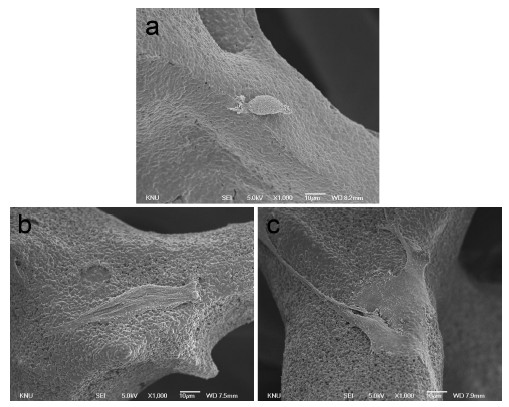
Morphology of MG63 cells cultured on MP0, MP5, and MP20 after 1 day of culture (1,000×, bar 10 μ m).
고 찰
감염성 질환이나 외상, 임플란트 식립과 연관하여 잔존골량이 부족한 경우 결손된 골조직을 회복하기 위해 골이식술을 이용한 재건수술이 시행된다. 가장 이상적인 이식재인 자가골 이식재는 채득을 위한 부가적인 시술부위가 필요하며 이와 연관된 단점으로 인해 여러 종류의 골 대체재에 관해 많은 연구가 이루어져 왔다. 골유도능을 가지는 것으로 알려진 탈회동결건조골과 우골에서 단백질 성분을 제거한 이종골 이식재를 사용한 골재건 수술에서 성공적인 결과가 보고되고 있으나, 질병전염의 가능성을 전혀 배제할 수는 없다는 문제점을 가진다 (Schwartz 등, 1998). 골이식재와 관련된 최근의 연구는 이러한 문제점이 없는 합성골 이식재에 관해 광범위하게 진행되고 있는 추세이다. 골이식재의 골유도능과 관련된 일련의 연구에서 이식재가 이소성골형성 (ectopic bone formation)을 유도하기 위해서 화학적 조성 외에, 미세다공성의 표면구조 를 포함한 특정한 표면형태가 중요한 인자로 작용함이 제시되었다 (Yuan 등, 1998; Habibovic 등, 2005). 골형성과정에서 거대기공 구조의 중요성과 더불어 Yuan 등 (Yuan 등, 1999)은 거대기공 내면에 존재하는 미세기공이 인산칼슘계 세라믹의 골유도능에 있어서 중요한 역할을 하는 것으로 보고하였다. 현재까지 이식재의 골유도능에 관한 정확한 기전은 설명되지 않았지만 칼슘과 인을 함유하는 인산칼슘계 세라믹의 화학적 조성, 상술한 이식재의 미세다공성구조와 적절한 용해도가 이에 기여하는 것으로 여겨진다. 인산칼슘계 세라믹의 화학조성은 생체환경 내 존재하는 성장인자 등의 표면흡착을 조장하여 차후 표면에 부착된 골형성 전구세포들의 조골세포로의 분화를 촉진할 수 있는 것으로 제시되었고 (de Groot, 1998), 이식재 내면의 미세 다공성 표면구조 역시 골형성 과정에 영향을 미치는 성장인자 등의 흡착과 함입을 증가시켜 국소적인 부위에서 골형성에 영향을 미치는 특정수준까지의 골형성 인자들의 농도상승에 기여하는 것으로 알려졌다. 또한 타이타늄 임플란트에서의 연구에서와 같이 분화를 포함한 골형성세포의 반응이 이러한 미세구조에 영향을 받는 것은 잘 알려진 사실이다 (Marinucci 등, 2006; Sammons 등, 2005).
스캐폴드의 미세구조를 관찰하기 위하여 시행된 SEM관찰 결과, MP0에서는 미세기공이 전혀 형성되지 표면형상을 가진다. 이는 입자의 크기가 미세하고 높은 소결온도로 인하여 충분한 입자성장이 일어기 때문으로 보여진다. 이에 반해 MP5와 MP20 의 경우는 묽은 슬러리에 한번 더 코팅이 되면서 소결 과정 중 먼 입자간 거리 때문에 완전한 입자성장이 되지 않아 미세기공을 형성한 것을 확인할 수 있었다. 하지만 MP5는 MP20이 비하여 높은 소결온도에서 제작되었기 때문에 더 많은 입자성장이 일어나 미세기공이 훨씬 적게 나타났다.
스캐폴드의 표면 거칠기를 측정하기 위하여 수행한 AFM 분석 결과, 미세기공이 형성되지 않은 표면에서는 Ra값이 24.4 nm로 미세기공을 형성시킨 MP5와 MP20에 비하여 현저히 낮은 결과를 보였다. 이 결과를 통하여 미세기공형성이 표면에 거칠기를 부여한다는 결과를 얻을 수 있었다.
재료의 접촉각 실험 결과, 미세기공이 형성됨으로서 미세기공이 없는 표면보다 훨씬 더 친수성을 띤다는 결과를 얻을 수 있었다. 표면의 친수성은 단백질의 흡착, 세포의 증식 및 퍼짐에 매우 중요한 역할을 하는 인자이다.
MTT assay 결과 미세기공이 존재하는 스캐폴드에서 유의하게 높은 세포 증식을 나타내었으며, 미세기공률이 증가할수록 세포의 증식률은 더욱 높게 나타났다. 세포의 형상 역시 미세기공이 없는 표면에서는 퍼짐이 거의 일어나지 않은 둥근 형태를 띄고 있었지만, 미세기공이 형성된 표면에서는 세포가 표면에 넓게 퍼져있는 것을 관찰 할 수 있었고, 이 결과 역시 미세기공률이 증가 할수록 더 넓은 면적을 차지하며 퍼짐이 잘 일어난 것을 관찰 할 수 있었다.
결 론
본 연구에서는 sponge method로 제작한 BCP 거대 기공만 가지는 스캐폴드에 BCP 슬러리를 한층 더 코팅시킴으로써 상호연결된 미세기공층을 형성시켜 다음과 같은 결과를 얻었다.
1. 미세기공층이 형성된 스캐폴드의 거칠기가 미세기공이 없는 스캐폴드의 거칠기에 비하여 크게 증가하였다.
2. 미세기공이 없는 표면에서는 접촉각이 55° 정도였는데, 미세기공이 형성됨으로써 접촉각이 유의하게 낮아졌다 (p > 0.05).
3. 골아세포의 증식률과 퍼짐이 미세기공이 형성된 스캐폴드에서 더 잘 일어나는 경향을 보였다.
Acknowledgments
이 논문은 2013학년도 경북대학교 학술연구비에 의하여 연구되었음.
References
-
A Araújo, E Linder, J Lindhe, Effect of a xenograft on early bone formation in extraction sockets: an experimental study in dog, Clin Oral Impl Res, (2009), 20, p1-6.
[https://doi.org/10.1111/j.1600-0501.2008.01606.x]

-
WA Borstlap, KL Heidbuchel, HP Freihofer, AM Kuijpers-Jagtman, Early secondary bone grafting of alveolar cleft defects: A comparison between chin and rib grafts, J Craniomaxillofac Surg, (1990), 18:, p210-205.
[https://doi.org/10.1016/S1010-5182(05)80411-1]

-
BS Chung, CK Lee, KS Hong, HJ Youn, HS Ryu, SS Chung, KW Park, Osteocunduction at porous hydroxyapatite with various pore configurations, Biomaterials, (2000), 21, p1291-1298.
[https://doi.org/10.1016/S0142-9612(00)00030-2]

-
J Clavero, S Lundgren, Ramus or chin grafts for maxillary sinus inlay and local onlay augmentation: comparison of donor site morbidity and complications, Clin Implant Dent Relat Res, (2003), 5, p154-160.
[https://doi.org/10.1111/j.1708-8208.2003.tb00197.x]

-
G Daculsi, RZ LeGeros, E Nery, Lynch, B Kerebel, Transformation of biphasic calcium phosphate ceramics in vivo: Ultrastructural and physicochemical characterization, J Biomed Mater Res, (1989), 23, p883-894.
[https://doi.org/10.1002/jbm.820230806]

-
G Daculsi, N Passuti, S Martin, C Deudon, Rz Legeros, S Raher, Macroporous calcium phsophate ceramic for long bone surgery in human and dogs. Clinical and histologic study, J Biomed Mater Res, (1990), 24, p379-396.
[https://doi.org/10.1002/jbm.820240309]

-
J de Groot, Carriers that concentrate native bone morphogenetic protein in vivo, Tissue Eng, (1998), 4, p337-341.
[https://doi.org/10.1089/ten.1998.4.337]

-
FG Emmings, Chemically modified osseous material for the restoration of bone defects, J Periodontol, (1974), 45, p385-390.
[https://doi.org/10.1902/jop.1974.45.5.2.385]

-
SJ Froum, R Thaler, IW Scopp, SS Stahl, Osseous autografts. I. Clinical responses to bone blend or hip marrow grafts, J Periodontol, (1975), 46, p515-521.
[https://doi.org/10.1902/jop.1975.46.9.515]

-
S Fujibayashi, M Neo, HM Kim, T Kokubo, T Nakamura, Osteoinduction of porous titanium metal, Biomaterials, (2004), 25, p443-450.
[https://doi.org/10.1016/S0142-9612(03)00551-9]

- O Gauthier, JM Bouler, E Agaudo, P Pilet, G Daculsi, Macroporous biphasic calcium phsophate ceramics: influence of macropore diameter and macroporosity percentage on bone ingrowth, Biomaterials, (1998), 19, p133-139.
-
P Habibovic, H Yuan, CM van der Valk, 3D microenvironment as essential element for osteoinduction by biomaterials, Biomaterials, (2005), 26, p3536-3575.
[https://doi.org/10.1016/j.biomaterials.2004.09.056]

- M Jarcho, Calcium phosphate ceramics as hard tissue prosthetics, Clin Orthop, (1981), 157, p259-278.
-
C Karabuda, O Odzemir, T Tosun, A Anil, V Olgaς, Histologic and clinical evaluation of 3 different grafting materials for sinuslifting procedure based on 8 cases, J periodontol, (2001), 72, p1436-1442.
[https://doi.org/10.1902/jop.2001.72.10.1436]

-
JJ Klawitter, SF Hulbert, Application of porous ceramics for the attachment of load bearing orthopedic applications, J Biomed Mater Res, (1971), 2, p161.
[https://doi.org/10.1002/jbm.820050613]

-
K Lewandrowski, JD Gresser, DL Wise, DJ Trantolo, Bioresorbable bone graft substitutes of different osteoconductivities, Biomaterials, (2000), 21, p757-764.
[https://doi.org/10.1016/S0142-9612(99)00179-9]

- L Marinucci, S Balloni, E Becchetti, Effect of titanium surface roughness on human osteoblast proliferation and gene expression in vitro, Int J Oral Maxillofac Implants, (2006), 21, p719-725.
- EB Nery, RZ LeGeros, KL Lynch, K Lee, Tissue response to biphasic calcium phsophateceramic with different ratios of HA/β-TCP in periodontal osseous defects, J Periodontol, (1992), 63, p729-735.
- RL Sammons, N Lumbikanonda, M Gross, P Cantzler, Comparison of osteoblast spreading on micro-structured dental implant surfaces and cell behaviour in an explants model of osseointegration. A scanning electron microscopic study, Clin Oral Implants Res, (2005), 16, p657-666.
-
Z Schwartz, A Somers, JT Mellonig, Ability of commercial demineralized freeze-dried bone allograft to induce new bone formation is dependant on donor age but not gender, J Periodontol, (1998), 69, p47-478.
[https://doi.org/10.1902/jop.1998.69.4.470]

-
S Yamada, D Heymann, JM Bouler, DaculsiG, Osteoclastic resorption of calcium phosphate ceramics with different hydroxyapatite/beta-tricalcium phosphate ratios, J Biomed Mater Res, (1997), 37, p346-352.
[https://doi.org/10.1016/S0142-9612(97)00036-7]

-
H Yuan, K Kurashino, JD de Bruijin, A preliminary study on osteoinduction of two kinds of calcium phosphate ceramics, Biomaterials, (1999), 20, p1799-1806.
[https://doi.org/10.1016/S0142-9612(99)00075-7]

-
H Yuan, Z Yang, Y Li, Osteoinduction by calcium phosphate biomaterials, J Mater Sci Mater Med, (1998), 9, p723-726.
[https://doi.org/10.1023/A:1008950902047]