The diameter effect of TiO2 nanotube on inflammatory response in Raw 264.7 Macrophages
The biological studies related to the diameter of TiO2 nanotube have mainly focused on the biocompatibility and functionality of cells. The purpose of this study was to evaluate the size effect of various TiO2 nanotube diameters on inflammatory responses such as the generation of iNOS, NO and interleukin-1β(IL-1β), and tumor necrosis factor-α(TNF-α) in LPS-stimulated Raw 264.7 macrophages. The adhesion and proliferation of macrophages cultured on 100 nm TiO2 nanotube were significantly higher than those cultured on Ti(P<0.05). The results of nitric oxide(NO) generation from macrophage indicated that the value of 30 and 100 nm TiO2 nanotube had the tendency of reduction and increment, respectively, compared to Ti control group(P>0.05). The mRNA expression of iNOS, IL-1β and TNF-α resulted that the IL-1β (the degree of inflammation response) values of 30 nm TiO2 nanotube was significantly lower than those of Ti(P<0.05). In additions, IL-1β values of 100 nm TiO2 nanotube was significantly higher than those of Ti(P<0.05) Thus, it was concluded that TiO2 nanotube did not have cytotoxicity effect on RAW 264.7 macrophage, but 100 nm TiO2 nanotube had the potential for accelerating inflammation response in Raw 264.7 macrophages. Further investigation is required to resolve detailed mechanisms relating to the morphology and nanostructure of TiO2 nanotube and inflammation response.
Keywords:
TiO2 nanotube, Macrophage, Nitric oxide, iNOS, IL-1β, TNF-α, Inflammatory response서 론
생체적합성과 관련하여 티타늄은 이온의 누출이 적고 부식의 가능성 및 염증반응이 낮은 특징으로 치아나 뼈를 대체 하는 물질로 광범위 하게 사용 되고 있다(Bacchelli 등, 2009; Kubies 등, 2011). 티타늄의 뛰어난 내식성과 생체적합성은 표면에 형성되는 표면 산화층에 기인하는 것으로 자연적으로 생성되는 산화층은 티타늄 표면에 쉽게 제조할 수 있는 티타니아(TiO2)구조를 이루고 있다.
나노기술의 개발은 산업이나 의학에서 나노 입자의 응용을 위한 다양한 가능성을 제공한다(Gwinn과 Vallyathan, 2006; Powell과 Kanarek, 2006). 표백이나 광촉매의 특성 때문에, 티타니아(TiO2)는 종이, 화장품, 식품 등 널리 사용되고 있다(Powell과 Kanarek, 2006). 나노수준의 구조는 표면의 단백질 부착에 영향을 주어 초기 골 형성에 도움을 주며 세포의 증식과 조직 친화성을 촉진시키고 이물반응을 감소시키는데 중요한 역할을 한다고 보고되었다(Mor 등, 2006; Oh 등, 2008). 최근에는 나노구조가 염증성 반응을 촉진한다고 보고되었다(Shin 등, 2010).
티타늄 표면에 의한 염증반응은 세균감염과 같은 외부 자극원인 Lipopolysaccharide (LPS)나 생체 내 대사산물인 arachidonic acid와 같은 내부자극에 대한 생체 조직의 방어기전으로(Trowbridge와 Emling, 1997) 대식세포(macrophage)나 림프구 등 다양한 염증세포가 유입이 된다. 특히 대식세포(macrophage)는 세포 내 다양한 염증매개인자들인 Interleukin - 1β(IL-1β)와 Tumor necrosis factor - alpha(TNF-a) 등과 같은 염증성 사이토카인, nitric oxide(NO)등 다양한 매개물질을 생산하여 감염초기에 생체 방어에 중요한 역할을 하는 세포로 알려져 있다(Higuchi 등, 1990).
Nitric oxide(NO)는 생체 내에서 inducible NO synthase (iNOS)라는 효소의 촉매작용을 통해 생성되는데 이는 염증반응이 유발되는데 가장 중요한 인자 중의 하나로 작용한다. 일반적인 NO의 생성은 바이러스나 세균들의 증식을 사멸시키거나 종양을 제거 하는 등 여러 가지 중요한 세포 내 작용을 하지만, 과량의 NO 생성은 골아 세포의 염증, 조직손상, 혈관확장, 세포사멸 및 만성염증질환 심화 등 인체 면역체계의 이상을 나타난다고 보고되고 있다(Chen 등, 2005; Hines와 Grisham, 2011; Jiang 등, 2011). 또한 Interleukin - 1β(IL-1β)와 종양괴사인자 인 Tumor Necrosis Factor-alpha (TNF-a)는 면역반응과 염증반응을 유도하는 염증 매개 사이토카인으로 각종 염증질환의 발생과 진행에 중요한 역할을 하는 것으로 보고되고 있다(Beutler와 Grau, 1993; Mathiak 등, 2000). 현재까지 TiO2 나노튜브의 다양한 표면 변형과 생물학적 평가 및 의용재료로서의 이용가능성에 대한 연구가 활발히 진행되고 있지만 TiO2 나노튜브와 관련된 초기 염증반응에 미치는 영향에 대한 연구는 아직 불분명하다. 따라서 TiO2 나노튜브에 대한 초기 염증 반응을 평가하기 위해 LPS로 활성화된 RAW 264.7 대식세포에서의 iNOS의 발현과 NO생성 및 염증에 관여하는 대표적인 사이토카인인 Interleukin - 1β (IL-1β)와 Tumor necrosis factor - a (TNF-a)에 미치는 영향에 대해 알아보고자 하였다.
재료 및 방법
1. 시편 제작
티타늄 판(Thickness: 250 μm, purity: 99.5%; Alfa- Aesar, MA, USA)을 아세톤, 에탄올, 및 증류수의 순서로 세척한 후, Perchloric acid, Butoxy ethylene glycol, Methanol을 이용한 전기분해법으로 표면처리를 하고 연마를 수행하여 5 nm 이하의 평탄도(flatness)를 가지는 표면이 깨끗한 티타늄 판을 제조하였다. 전기분해 연마된 티타늄 판을 0.5 wt% 불산(purity: 48%, Sigma, USA)을 전해질 용액으로 하여 30 nm는 5 V, 100 nm는 20 V의 범위에서 60분 동안 양극산화 시켰다. 양극산화 완료 후, 시편을 증류수에 세척하고, 60℃ 오븐에서 24시간 건조한 후, 500℃에서 2시간동안 열처리를 하였다. (공기 중 열처리, 승온 및 냉각속도 = 1 K/min). 열처리된 시편은 1.27 × 1.27 ㎠로 절단하고, 증류수에 시편을 넣은 후, 증류수와 함께 고압증기 멸균시킨 후 시편을 다시 자외선(UV)으로 48시간 동안 2차 멸균 처리하여 TiO2 나노튜브를 제작하였다.
2. 세포배양
실험에 사용한 마우스의 대식세포주인 RAW 264.7 (monocyte)세포는 10% FBS (Gibco BRL, Grand island, N.Y., USA)와 1% antibiotics (Gibco)가 첨가한 DMEM (Dulbecco's Modified Eagle Medium)배지를 배양액으로 37℃, 5% CO2 incubator에서 배양하였다.
3. MTT assay
세포의 부착 및 증식률은 3-(4,5-dimethylthiazol-2-yl)- 2,5-diphenyl-tetrazolium bromide (MTT) assay를 이용하여 측정하였다. 즉 TiO2 나노튜브 위에 RAW 264.7 대식세포를 12well plate에 각각 5×104 cells/well을 분주하고 48시간 동안 배양 후 LPS (1㎍/㎖)를 처리하여 24시간 배양하였다. 배양 후 MTT(Sigma, USA)용액 100 ㎍/ml을 각 well에 첨가하여 37℃에서 4시간 동안 배양하였다. 4시간 경과 후 MTT에 의해 형성된 formazan을 DMSO(Sigma, USA)로 녹이고 microplate-ELISA reader (Spectra MAX 250, USA)를 이용하여 540 nm에서 흡광도를 측정하였다.
4. Nitric oxide(NO) 측정
RAW 264.7 대식세포로부터 생성되는 NO의 양은 세포 배양액 중 존재하는 nitrite 농도를 Choi 등의 방법(Choi 등, 2008)에 따라 Griess reagent 반응법을 이용하여 측정하였다. TiO2 나노튜브 위에 RAW 264.7 세포를 5×104 cells/ml로 조절한 후 12 well plate에 접종하고 48시간 후 LPS (1 ㎍/㎖)를 처리하여 24시간 배양하였다. 생성된 NO 양은 Griess시약 [1%(w/v)sulfanilamide in 2.5 %(v/v) phosphoric acid, 0.2%(w/v)naphylethylene- diamine]을 이용하여 세포배양액 중에 존재하는 NO₂의 형태로 측정하였다. 세포배양 상등액 150㎕와 Griess시약 50 ㎕를 혼합하여 96 well plate에서 10분 동안 반응시킨 후 540 ㎚에서 흡광광도를 측정하였다. Sodium nitrite의 농도별 표준곡선을 이용하여 배양액의 NO 농도를 결정하였다.
5. Real time quantitave RT-PCR
TiO2 나노튜브 위에 RAW 264.7 세포를 5×104 cells/ml로 조절한 후 12 well plate에 접종하고 48시간 후 LPS (1 ㎍/㎖)를 처리하여 24시간 배양하였다. 배양한 후, TRI reagent(Invitrogen, Carsbad, CA, USA)를 사용하여 제조사의 지침에 따라 Total RNA를 분리하였다. TiO2 나노튜브 위에서 배양된 세포를 새로운 12 well plate에 옮겨 1× phosphate buffered saline(PBS, pH7.4)로 두 번 세척 한 후 TRI reagent를 처리 하였다. 이것을 1.5 mL tube에 담고 chloroform(Sigma, USA) 을 100 μL 첨가하여 15초간 vortex 하고 원심분리(11,000 rpm, 15분, 4 ℃)하여 상등 액을 취해 새로운 tube에 옮겼다. 여기에 동량의 isopropanol(Sigma, USA)을 첨가하여 실온에서 10분 간 방치하고 나서 원심분리(11,000 rpm, 10분, 4℃) 한 후 상등 액을 제거하였다. 침전물에 75% 에탄올을 첨가하여 washing한 후 원심분리(9,000 rpm, 5분, 4℃) 후 diethyl pyrocarbonate (DEPC) 처리된 증류수를 첨가하여 58℃ 항온수조에서 5분간 반응시켜 침전물을 녹였다. 분리된 Total RNA 1.5 μg, 0.5 μg Oligo dT (Invitrogen, Carsbad, CA, USA), 0.5 mM dNTP (Invitrogen, USA)를 첨가하여 65 ℃에서 5분간 반응시킨 후 5× First strand buffer, 0.1 M DTT, RNase OUTTM (Invitrogen, USA)를 넣은 후 42℃에서 2분간 반응 후 200 U Superscript Ⅱ reverse transcriptase(Invitrogen, USA)을 첨가하여 42℃에서 50분과 70℃에서 15분간으로 종결시켰다. Total RNA는 역전사 되고 결과물인 cDNA는 Table 1 의 primer들을 합성된 cDNA를 template로 하여 real-time PCR을 수행하였다. 합성된 cDNA 2 μL에 primer (forward, reverse) 1 μL(10 pmol/μL), 2X SYBR green master mix(Applied biosystem, USA) 10 μL를 넣고 최종 volume을 20 μL로 하였다. Denature를 95℃에서 30초, annealing을 60℃에서1분, extension은 72℃에서 30초로 하고 40 cycle의 PCR을 수행하였다. 실험의 정확성을 위해 3회 반복 실험을 하였고 기기는 Applied Biosystems을 사용하였으며 StepOne Plus V.2.2.2 (App- liedBiosystem, USA) software를 사용하여 분석하였다.
6. 사이토카인 생성량 측정
RAW 264.7 대식세포를 5×104 cells/ml로 조절한 후 12 well plate에 접종하고 48시간 후 LPS (1 ㎍/㎖)를 처리하여 24시간 동안 배양하였다. 24시간 후 세포 배양액을 취하여 cytokine을 측정하였다. IL-1β, TNF-α 함량을 EIA kit (R&D Systems, Minneapolis, USA)를 사용하여 측정하였다. IL-1β, TNF-α의 함량은 표준물질의 반응으로부터 얻어진 표준곡선을 이용하여 환산하였다.
7. 통계분석
모든 실험은 3회 이상 반복실험을 하였고 통계분석은 SPSS 프로그램(SPSS 12.0; SPSS GmbH, Munich, Germany)을 이용하여 one-way analysis of variance(ANOVA)를 시행하였다(alpha=0.05).
결 과
1. MTT assay
RAW 264.7 대식세포에 대한 TiO2 나노튜브의 세포 부착 및 증식률을 측정하기 위하여 MTT assay를 수행하였다. 대조군인 Ti와 30 nm, 100 nm 나노튜브 위에 RAW 264.7 대식세포를 LPS(1 ㎍/㎖) 24시간 처리한 결과 대조군인 Ti 보다 30 nm, 100 nm 나노튜브에서 세포 부착 및 증식능이 증가하는 것을 확인하였고(Figure 2), 100 nm 나노튜브 위에 분주된 RAW 264.7 대식세포의 세포 부착 및 증식률은 대조군인 Ti에 비하여 유의차 있게 높은 것이 관찰되었다(P<0.05).
2. Nitric Oxide (NO)
TiO2 나노튜브와 LPS로 유발된 RAW 264.7 대식세포의 nitric oxide(NO)의 생성에 미치는 영향을 비교한 결과(Figure 3), 대조군인 Ti에 비하여 30 nm 나노튜브에서 감소하는 경향을 나타내었고 100 nm 나노튜브에서는 대조군인 Ti에 비하여 NO의 생성이 증가 되었지만 통계적인 유의차는 없었다(P>0.05).

(a) SEM images of self-assembled layers of vertically oriented TiO2 nanotube of different diameters. (b) vertically section of 100 nm TiO2 nanotube (c) horizontal section of transmission electron microscope(TEM).

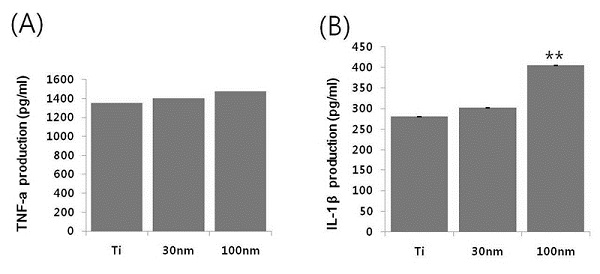
The cytotoxicity of TiO2 nanotube in LPS stimulated Raw 264.7 cells. Significant of differences between Ti vs. 100nm: **, P<0.05
3. iNOS 및 TNF-a 와 IL-1β mRNA 발현
LPS에 의해 활성화된 RAW 264.7 대식세포로부터 생성되는 NO의 합성효소인 iNOS의 유전자 발현에 대한 30 nm, 100 nm 나노튜브와의 영향을 조사하기 위하여 real time RT-PCR을 수행하였다. 그 결과(Figure 4), iNOS의 발현은 대조군인 Ti에 비하여 30 nm 나노튜브에서 증가하는 경향을 나타내었고, 100 nm 나노튜브에서는 감소하는 경향이 있었다. 하지만 나노튜브와의 통계적인 유의차는 발견되지 않았다(P>0.05). iNOS의 발현 외에도 염증성 사이토카인의 발현에 미치는 영향을 조사하기 위하여 대표적인 염증성 사이토카인으로 알려진 TNF-a 와 IL-1β mRNA 발현 양을 측정하였다. TNF-a는 대조군인 Ti에 비하여 30 nm 나노튜브에서 감소하였고, 100 nm 나노튜브에서는 증가하는 경향을 나타내었으나 통계적인 유의차는 발견되지 않았다(P>0.05). 반면에 IL-1β는 대조군인 Ti에 비하여 30 nm 나노튜브에서 유의성 있는 감소를 나타내었다(P<0.05).
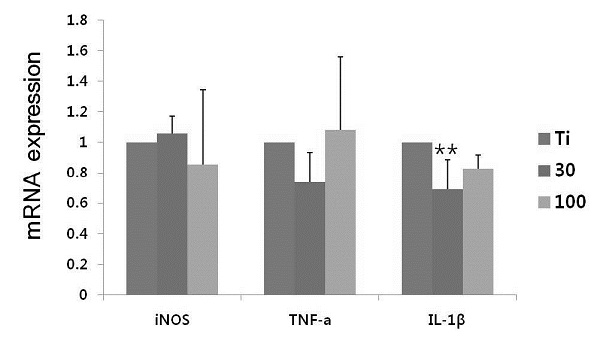
The effect of TiO2 nanotube on LPS - induced iNOS and pro-inflammatory cytokine mRNAs expression. Significant of differences between Ti vs. 30nm: **, P<0.05
4. 염증성 사이토카인(TNF-a 와 IL-1β) 생성
TiO2 나노튜브와 염증성 사이토카인인 TNF-a와 IL-1β의 분비에 미치는 영향을 살펴보기 위해 30 nm, 100 nm 나노튜브 위에 RAW 264.7 대식세포를 LPS(1 ㎍/㎖)로 처리하고, 24시간이 경과한 후 배지에 분비된 TNF-a와 IL-1β의 농도를 ELISA방법으로 측정하였다. 그 결과, LPS로 활성화된 RAW 264.7 대식세포에서의 TNF-a는 대조군인 Ti에 비하여 30 nm, 100 nm 나노튜브에서 증가하였지만 통계적인 유의차는 발견되지 않았고(Figure 5(A) )(P>0.05), 반면에 IL-1β는 대조군인 Ti에 비하여 100 nm 나노튜브에서 유의차 있게 증가함을 확인하였다(Figure 4(B) )(P<0.05).
고 찰
현재까지 TiO2 나노튜브의 다양한 표면 변형과 생물학적 평가 및 의용재료로서의 이용가능성에 대한 연구가 활발히 진행되고 있지만 TiO2 나노튜브와 관련된 초기 염증반응에 미치는 영향에 대한 연구는 아직 불분명하다. 본 연구에서는 TiO2 나노튜브 대한 초기 염증 반응을 평가하기 위해 LPS로 활성화된 RAW 264.7 대식세포에서의 iNOS의 발현과 NO생성 및 염증에 관여하는 대표적인 사이토카인 Interleukin - 1β (IL-1β)와 Tumor necrosis factor - a (TNF-a)에 미치는 영향에 대해 알아보고자 하였다.
티타늄 표면에 의한 염증반응은 세균감염과 같은 외부 자극원인Lipopolysaccharide (LPS)나 생체 내 대사산물인 arachidonic acid와 같은 내부자극에 대한 생체 조직의 방어기전으로(Trowbridge와 Emling, 1997) 대식세포(macrophage)나 림프구 등 다양한 염증세포가 유입이 된다. 특히 대식세포(macrophage)는 세포 내 다양한 염증매개인자들인 IL-1β, TNF-α 등과 같은 염증성 사이토카인, nitric oxide(NO)등 다양한 매개물질을 생산하여 감염초기에 생체 방어에 중요한 역할을 하는 세포로 알려져 있다(Higuchi 등, 1990).
RAW 264.7 대식세포는 생체 내 모든 조직에 골고루 분포되어 있으며 선천성 면역을 담당하는 면역세포이고 병원체 등으로 인한 염증 반응 시에 염증반응에서 중추적인 역할을 하며(Iontcheva 등, 2004), 항염 효과를 평가할 때 염증모델로 많이 이용된다(Bungorn 등, 2009; Min 등, 2012). 이러한 RAW 264.7 대식세포에 대한 TiO2 나노튜브와의 세포 부착 및 증식률을 측정하기 위하여 MTT assay를 수행하였다. 대조군인 Ti와 30n m, 100 nm나노튜브 위에 RAW 264.7 대식세포를 LPS(1㎍/㎖) 24시간 처리한 결과 대조군인 Ti에 비하여 30 nm, 100 nm 나노튜브에서 세포 부착 및 증식률이 증가하는 것을 확인하였고, 100 nm 나노튜브는 유의 차 있게 높은 것이 관찰되었다(P<0.05). 이와 같은 결과는 Burns 등과 Popat 등이 보고한 연골세포, 골세포에서 Ti에 비하여 TiO2 나노튜브가 세포 부착률을 향상시킨다는 연구와 유사한 경향을 나타내었지만, TiO2 나노튜브의 직경이 클수록 오히려 세포의 부착률이 증가하였다. 이것은 세포의 상이성과 다양성 등 실험 변수에 따른 것으로 사료 되고, TiO2 나노튜브는 Raw 264.7 대식세포에 독성을 나타내지 않은 것으로 확인 하였다.
Nitric oxide(NO)는 생체 내에서 inducible NO synthase (iNOS)라는 효소의 촉매작용을 통해 생성되는데, 이는 염증반응이 유발되는데 가장 중요한 인자 중의 하나로 작용한다. 일반적인 NO의 생성은 바이러스나 세균들의 증식을 사멸시키거나 종양을 제거 하는 등 여러 가지 중요한 세포 내 작용을 하지만, 과량의 NO 생성은 골아 세포의 염증, 조직손상, 혈관확장, 세포사멸 및 만성염증질환 심화 등 인체 면역체계의 이상을 나타난다고 보고되고 있다(Chen 등, 2005; Hines와 Grisham, 2011; Jiang 등, 2011). NO는 Larginine으로부터 nitric oxide synthase (NOS)에 의해 만들어지며, endothelial NOS(eNOS), neuronal NOS(nNOS), inducible NOS(iNOS)등 세 가지 형태가 있는데(Stuehr, 1999) 특히 iNOS는 세포내에 존재하지 않으나 LPS나 세균의 lipopeptide등 자극에 의해 다량 생성이 유도됨으로써 염증반응을 촉진하게 된다(Lowenstein, 1992). 염증반응과 관련된 조직 손상에서 NO와 iNOS의 발현이 증가되어 있음이 보고되어 있다(McCartney 등, 1993). 또한 IL-1β와 종양괴사인자인 Tumor Necrosis Factor-alpha (TNF-a)는 면역반응과 염증반응을 유도하는 염증 매개 사이토카인으로 각종 염증질환의 발생과 진행에 중요한 역할을 하는 것으로 보고되고 있다(Beutler와 Grau, 1993; Mathiak 등, 2000). 염증 유발물질로 사용되는 LPS를 이용하여 TiO2 나노튜브가 염증 유발에 미치는 영향을 비교한 결과, 대조군인 Ti에 비하여 30 nm 나노튜브에서 NO의 생성이 감소하는 경향을 나타내었고 100 nm 나노튜브에서는 NO의 생성이 증가 되었지만 통계적인 유의차는 없었다(P>0.05). 또한 LPS에 의해 활성화된 RAW264.7 세포로부터 생성되는 NO의 합성효소인 iNOS의 유전자 발현에 대한 TiO2 나노튜브에서의 염증 유발에 미치는 영향을 조사하기 위하여 real-time RT-PCR을 수행하였다. iNOS의 발현은 대조군인 Ti에 비하여 30 nm 나노튜브에서 증가하는 경향을 나타내었고, 100 nm 나노튜브에서는 감소하는 경향이 있었다. 하지만 나노튜브와의 통계적인 유의차는 발견되지 않았다(P>0.05). 이러한 결과들은 염증 반응 시 TiO2 나노튜브에서의 RAW 264.7 대식세포에 대한 iNOS 유전자의 발현과 NO의 생성에 밀접한 영향을 미치지 않는 것으로 사료된다. iNOS의 발현 외에도 대표적인 염증성 사이토카인 IL-1β는 pro- inflammatory 사이토카인으로서 여러 면역학적 작용들과 연관되어 있고 TNF-a는 면역반응과 염증반응을 매개하는 사이토카인으로 특히 초기 염증반응에 깊이 관여하고 있는 것으로(Tizard, 1986), 다량의 TNF-a는 혈압강하 및 대사 과정의 손상을 유발하는 것으로 알려져 있다(Eigler 등, 1997). 이에 TiO2 나노튜브와 활성화된 Raw 264.7 대식세포에서의 염증반응 시 IL-1β와 TNF-a 의 mRNA 발현과 사이토카인 생성에 미치는 영향을 살펴 본 결과, TiO2 나노튜브와 IL-1β mRNA 발현은 대조군인 Ti에 비하여 30 nm 나노튜브에서 유의성 있는 감소를 나타내었고(P<0.05), 반면에 염증성 사이토카인 IL-1β의 생성에 미치는 영향은 대조군인 Ti에 비하여 100 nm 나노튜브에서 유의차 있게 증가함을 확인하였다(P<0.05).
이상의 결과들은 TiO2 나노튜브의 직경이 클수록 염증 유발을 촉진 시킬 수 있는 가능성이 있지만 더 나아가 복합적인 생물학적 작용의 규명과 신호전달 기전에 관한 추가적인 연구가 필요하다고 사료된다.
결 론
본 연구에서는 TiO2 나노튜브가 염증반응에 있어서 LPS로 활성화된 RAW 264.7 대식세포에서의 iNOS의 발현과 NO 생성 및 염증에 관여하는 대표적인 사이토카인인 Interleukin - 1β (IL-1β)와 Tumor necrosis factor - a (TNF-a)에 미치는 영향에 대해 알아보고자 하여 다음과 같은 결과를 얻었다.
1. TiO2 나노튜브들은 대조군인 Ti 보다 높은 세포 증식 및 부착률이 증가하는 것을 확인하였고, 100 nm 나노튜브에서는 유의차 있게 높은 것이 관찰되었다(P<0.05).
2. TiO2 나노튜브들의 NO 생성은 대조군인 Ti에 비하여 30 nm 나노튜브에서 감소하는 경향을 나타내었고 100 nm 나노튜브에서는 NO의 생성이 증가 되었지만 통계적인 유의차는 없었다(P>0.05).
3. iNOS, IL-1β 및 TNF-a mRNA 발현은 대조군인 Ti에 비하여 IL-1β에서 30 nm 나노튜브의 유의성 있는 감소를 나타내었다(P<0.05).
4. 염증성 사이토카인인 IL-1β와 TNF-a의 생성은 대조군인 Ti에 비하여 IL-1β에서 100 nm 나노튜브의 유의성 있는 증가를 확인하였다(P<0.05).
이상의 결과들은, TiO2 나노튜브는 RAW 264.7 대식세포에 세포독성을 유발하지 않고 30 nm 나노튜브에서의 IL-1β mRNA는 대조군인 Ti에 비하여 유의성 있는 감소를 나타내고, 염증성 사이토카인 IL-1β 생성은 100 nm 나노튜브에서 증가하는 것으로 나타내었다.
Acknowledgments
이 논문은 2012년도 정부(교육과학기술부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(2011-0024067)
References
-
B Bacchelli, G Giavaresi, M Franchi, D Martini, V De Pasquale, A Trire, M Fini, R Giardino, A Ruggeri, Influence of a zirconia sandblasting treated surface on peri-implant bone healing: An experimental study in sheep, Acta Biomater, (2009), 5, p2246-2257.
[https://doi.org/10.1016/j.actbio.2009.01.024]

-
B Beutler, GE Grau, Tumor necrosis factor in the pathogenesis of infectious diseases, Crit Care Med, (1993), 21, p423-435.
[https://doi.org/10.1097/00003246-199310001-00003]

- S Bungorn, J Jintana, W Nawarat, H Doosadee, Anti-inflammatory effect of Streblus asper leaf extract in rats and its modulation on inflammation-associated genes expression in RAW 264.7 macrophage cells, J Ethnopharm, (2009), 124, p566-570.
-
K Burns, C Yao, TJ Webster, Increased chondrocyte adhesion on nanotubular anodized titanium, J Biomed Mater Res, (2009), 88, p561-568.
[https://doi.org/10.1002/jbm.a.31899]

-
RM Chen, TL Chen, WT Chiu, Molecular mechanism of nitric oxide-induces Osteoblast apoptosis, J Orthop Res, (2005), 23, p462-468.
[https://doi.org/10.1016/j.orthres.2004.08.011]

-
HJ Choi, JS Eun, YR Park, DK Kim, R Li, WS Moon, JM Park, HS Kim, NP Cho, SD Cho, Y Soh, Ikarisoside A inhibits inducible nitric oxide synthase in lipopolysaccharide-stimulated RAW 264.7 cells via p38 kinase and nuclear factor-κB signaling pathways, Eur J Pharm, (2008), 601, p171-178.
[https://doi.org/10.1016/j.ejphar.2008.09.032]

-
A Eigler, B Sinha, G Hartmann, S Endres, Taming TNF: strategies to restrain this proinflammatory cytokine, Immunol Today, (1997), 18, p487-492.
[https://doi.org/10.1016/S0167-5699(97)01118-3]

- MR Gwinn, V Vallyathan, Nanoparticles: health effects-prosand cons, Env Heal Per, (2006), 114, p1818-1825.
- M Higuchi, N Higashi, H Taki, T Osawa, Cytolytic mechanism of activated macrophages. Tumor necrosis factor and L-arginine-dependent mechanism acts as synergistically as the major cytolytic mechanism of activated macrophages, J Immunol, (1990), 144, p1425-1431.
-
IN Hines, MB Grisham, Divergent roles of superoxide and nitric oxide in liver ischemia and reperfusion injury, J Clin Biochem Nutr, (2011), 48, p50-56.
[https://doi.org/10.3164/jcbn.11-016FR]

-
I Iontcheva, S Amar, KH Zawawi, A Kantarci, TE Van Dyke, Role for moesin in lipopolysaccharide stimulated signal transduction, Infect Immun, (2004), 72, p2312-2320.
[https://doi.org/10.1128/IAI.72.4.2312-2320.2004]

- JP Jiang, Y Fu, YG Hong, Bovine adrenal medulla 22 attenuates hyperalgesia in the early phase of complete Freund's adjuvant-induced inflammation in rats, Sheng LiXue Bao, (2010), 63, p9-19.
- D Kubies, L Himmlova, T Riedel, E Chanova, K Balik, M Doude rova, J Bartova, V Peskova, The Interaction of Osteoblasts With Bone-Implant Materials: The Effect of Physicochemical Surface Properties of Implant Materials, Physiol Res, (2011), 60, p95-111.
-
CJ Lowenstein, SH Snyder, Nitric oxide, a novel biologic messenger, cell, (1992), 70, p705-707.
[https://doi.org/10.1016/0092-8674(92)90301-R]

- G Mathiak, G Grass, T Herzmann, T Luebke, C Cu-Zetina, SA Boehm, Capase-1-inhibitorac-YVAD-cmk reducesLPS-lethality in rats without affecting haematology or cytokine responses, Br J Pharmacol, (2000), 131, p383-386.
- N McCartney, JB Allen, DE Mizel, JE Albina, QW Xie, CF Nathan, SM wahl, Suppression of arthritis by an inhibitor of nitic oxide synthase, The J Exp Med, (1993), 178, p749-754.
-
KJ Min, KH Cho, TK Kwon, The effect of oxidized low density lipoprotein (oxLDL)-induced heme oxygenase-1 on LPS-induced inflammation in RAW 264.7 macrophage cells, Cel Sign, (2012), 24, p1215-1221.
[https://doi.org/10.1016/j.cellsig.2012.02.001]

-
GK Mor, OK Varghese, M Paulose, K Shankar, CA Grimes, A review of highly ordered, vertically oriented TiO2 nanotube arrays: Fabrication, material properties, and solar energy applications, Sol Eng Mater & Sol cells, (2006), 90, p2011-2075.
[https://doi.org/10.1016/j.solmat.2006.04.007]

-
S Oh, KS Brammer, YS Julie Li, D Teng, AJ Engler, S Chien, S Jina, Stem cell fate dictated solely by altered nanotube dimension, Proc Natl Acad Sci USA, (2008), 106, p2130-2135.
[https://doi.org/10.1073/pnas.0813200106]

-
KC Popat, L Leoni, CA Grimes, TA Desai, Influence of engineered titania nanotubular surfaces on bone cells, Biomaterials, (2007), 28, p3188-3197.
[https://doi.org/10.1016/j.biomaterials.2007.03.020]

- MC Powell, MS Kanarek, Nanomaterial health effects-part 1: background and current knowledge, W.M.J, (2006), 105, p16-20.
-
JA Shin, EJ Lee, SM Seo, HS Kim, JL Kang, EM Park, Nanosized titanium dioxide enhanced inflammatory responses in the septic brain of mouse, Neuroscience, (2010), 165, p445-454.
[https://doi.org/10.1016/j.neuroscience.2009.10.057]

-
DJ Stuehr, Mammalian nitric oxide synthase, Biochem Biophys Acta, (1999), 1411, p217-230.
[https://doi.org/10.1016/S0005-2728(99)00016-X]

- IR Tizard, Immunology: an introduction inflammation, 2nd ed. Saunders College Pubulishing, New York, NY, USA, (1986), p423-441.
-
HO Trowbridge, RC Emling, Inflammation: a review of the process, 5th Ed, Quintessence pub.co, Chicago, (1997).
[https://doi.org/10.1097/00008505-199700630-00025]