
실험용 항균성 불소바니쉬의 최소억제농도와 최소살균농도
초록
본 연구의 목적은 항균물질을 불소바니쉬에 첨가함으로서 Streptococcus mutans (S. mutans)에 대한 항균효과를 더 증가시킬 수 있는지 평가하고자 하였다. Bakuchiol (BAK), Bavachalcone (BCC), Isobavachromene (IBC), Bavachromene (BCM) 5가지 물질 자체(1 mM, 10 mM), 5가지 물질에 바니쉬를 첨가하여 비교 평가하였다. 1.1×1010 CFU/ml의 S. mutans를 사용하여 MIC, MBC Test 를 진행하였고, MTT test를 사용하여 세포독성여부를 평가하였다. 항균물질 자체의 MIC, MBC test 결과 MIC는 BAK, BCC, IBC가 가장 낮았으며(0.015 mM), MBC는 BAK가 가장 낮았다(0.031 mM). 항균 물질을 혼합한 불소바니쉬에서는 BAK의 MIC (0.031 mM)와 MBC (0.062 mM)가 가장 낮았다. MTT test 결과 항균물질 자체에서 1 mM BCM은 가장 높은 세포활성도를 보였다(P<0.05). 항균물질 중 S. mutans에 가장 효과적인 BAK 물질을 불소바니쉬에 적용하여 항균성 불소 바니쉬를 개발할 수 있을 것이라 사료된다.
Abstract
The aim of this study was to investigate the antibacterial effect of fluoride varnish with antibacterial agents on Streptococcus mutans (S. mutans). Experimental fluoride varnish (EFV) with 5% NaF was fabricated. Five antibacterial agents were tested with 1 mM and 10 mM concentrations, respectively: Bakuchiol (BAK), Bavachalcone (BCC), Isobavachromene (IBC), and Bavachromene (BCM). MIC and MBC test was performed by antibacterial agents with and without EFV using 1.1 × 1010 CFU/ml of S. mutans. Cell viability test were performed using MTT test. Statistical analysis was done with ANOVA and Duncan’s multiple range test at α=0.05. In the antibacterial agents without EFV, the MIC of BAK, BCC, and IBC was the lowest (0.015 mM), and the MBC of BAK was the lowest (0.031 mM). For the antibacterial agents with EFV, the MIC (0.031 mM) and MBC (0.062 mM) of BAK was the lowest, respectively. In MTT test, 1 mM BCM showed the highest cell viability (P<0.05). This study suggest that BAK can be applied the fluoride varnish under the control of the concentration to develop antibacterial fluoride varnish.
Keywords:
Fluoride varnish, antibacterial agent, Streptococcus mutans, MIC, MBC, MTT키워드:
불소바니쉬, 항균물질, 최소억제농도, 최소살균농도, 세포활성도서 론
구강 내 세균들 중 주 원인균은 주 원인균은 mutans streptococci 로 알려져 있다. 특히 Streptococcus mutans (S. mutans) 는 치아 우식 유발균의 대표적인 균주로 여겨진다(Walter J, 1986; Kidd E 등, 2013). S. mutans 는 외부로부터 섭취한 음식물에 포함되어있는 sucrose나 glucose를 분해하여 치아우식을 일으키는 중요한 원인으로 알려져 있다(Mikkelsen L 등, 1981). 구강 내 치아는 지속적인 탈회, 재광화 과정을 겪기 때문에 치아우식은 초기단계에서 원인이 제거되면 진행되지 않고, 구강 내 환경이 개선될 경우 법랑질의 재광화가 이루어진다(Tinanoff, 2005).
불소는 치아우식을 예방하는데 효과적이라고 알려져 있다. 불소를 이용한 예방법은 수돗물불소농도조정사업, 불소정제, 불소시럽, 겔, 용액, 치약, 바니쉬 등 현재까지 다양한 불소제품으로 활용되고 있다(Bibby 등, 1947; Kim 등, 2009; Hazelrigg 등, 2003). 전문가 불소도포법과 자가불소도포법으로 나뉘는데, 그 중 전문가 불소도포법은 1943년 처음 임상에 도입되었다(Katsura 등, 2001). 불화석(SnF2)은 치면의 착색 및 쓴맛이 나타나고, 불안정한 단점이 있고, 산성불화인산염(APF)는 수용성으로 타액에 용해가 빠르며 구강 내 적용 후 24시간 이내에 소실된다 (Rølla 등, 1933). 또한 APF 겔은 도포 전 트리이의 준비 및 구강 내를 건조, 격리 및 4분이라는 처치시간 과정이 복잡하여 단점을 보완한 불소바니쉬가 개발되었다(Arends and Schuthof, 1975).
불소바니쉬는 전문가 불소도포제제 중 불소 함량이 가장 높고, 레진 베이스를 기반으로 치아표면에 부착력이 우수하다. 치면에 1회 도포로 빠르게 경화가 되고, 이어 레진이 용해되면서 불소바니쉬에 포함된 불소가 천천히 유리되어 치면에 불소 농도가 오랫동안 유지되어 치면과 타액간의 무기질 교환을 막는 차단막 역할을 하기 때문에 장기간의 치아우식예방 효과가 나타난다(Demito 등, 2004; Todd 등, 1999).
불소바니쉬에 항균물질을 적용하여 항균력을 높이려는 연구는 거의 없는데, 불소바니쉬에 클로로헥시딘을 적용한 오래된 연구가 있다(Emilson, 1977). 클로로헥시딘은 mutans streptococci에 항균성을 나타내며, 치태조절에도 효과적이다. 그러나 클로로헥시딘은 많은 부작용을 야기하고 있다. 구강 내 경조직 및 연조직 그리고 혀 및 보철물 등에 암갈색 착색과, 구강점막의 작열감, 미각이상 등을 유발시킨다(Eriksen 등, 1978; Tredwin 등, 2005). 이같은 단점 때문에 천연 항균물질을 이용한 연구가 많이 진행되고 있다(Araghizadeh 등, 2013; Gonzalez 등, 2013). 하지만 천연 항균물질 자체에 대한 연구는 많으나, 불소바니쉬 자체에 항균물질을 첨가한 연구는 거의 없는 실정이다.
그러므로 치아우식 예방에 효과적인 항균성 불소바니쉬를 개발하기 위해 한국화합물은행(Korea Chemical Bank)에서 100여종 이상의 단일성분인 화합물을 받아 한천배지확산법으로 스크리닝을 진행하였다. 그 중 보골지(Psoralea corylifolia)의 화합물과 그와 비슷한 화학구조식을 보이는 물질들이 S. mutans의 억제에 효과가 있었다. 보골지는 전세계에 약 120여종이 있으며, 아시아 및 유럽온대지역에 자생하는 식물이다. 보골지에는 쿠마린과 플라보노이드 등의 성분이 함유되어있으며(Zhao 등, 2005), 항종양, 항산화, 항전립선증생등의 작용이 있는 것으로 보고되고 있다. 보골지의 구성성분 중 bakuchiol은 구강미생물의 억제에 효과적이라고 보고된 바 있다 (Katsura 등, 2001). 스크리닝 과정에서 bakuchiol외에도 bavachalcone, isobavachromene, bavachromene도 S. mutans의 억제에 효과적임을 관찰하여 이를 이용하여 본 실험을 진행하고자 하였다.
본 연구의 목적은 보골지의 구성성분 중 치아우식 유발균인 S. mutans 에 효과적인 물질 4종(Bakuchiol, Bavachalcone, Isobavachromene, Bavachromene)을 실험용 불소바니쉬에 첨가하여 항균성을 평가하여 항균성 불소바니쉬를 개발하고자 하였다.
재료 및 방법
1. 항균물질
Bakuchiol (BAK ; Santa cruz, CAS No.10309-37-2) Bavachalcone (BCC ; Chemfaces, CAS No.28448-85-3), Isobavachromene (IBC; Chemfaces, CAS No.52801-22-6) Bavachromene (BCM; Chemfaces, CAS No.41743-38-8)이 각각 1 mM and 10 mM 되도록 물질을 DMSO (Dimethyl sulfoxide) 로 희석하였다. 이 때 농도 결정은 물질 스크리닝을 진행한 농도인 1 mM과 이를 10배 높힌 10 mM 농도로 결정하여 실험을 진행하였다. 양성대조군은 Ampicillin 10 ug/ml (Liu 등, 2012), 음성대조군은 PBS (Shin 등, 2017), vehicle control로는 DMSO를 이용하였다.
2. 실험용 불소바니쉬 제작
45 wt.% 로진 (KR-610, Arakawa Co, Japan)을 베이스로 하여, 50 wt.% Solvent (에탄올, absolute ≥ 99.7%, Merck), 5 wt.% NaF 를 넣어 experimental 불소바니쉬 (EFV)를 제작하였다. 위의 재료를 80~100℃에서 물중탕을 하면서 hot plate(RCH-3, Tokyo Rikakikai Co., Ltd., Tokoyo, Japan) 위에서 over-head stirrer (RW20DZM.n, IKA Korea.Ltd,, Seoul, Korea)를 이용하여 240 rpm으로 30분간 혼합하였다.
3. Minimum inhibitory concentration (MIC), minimum bactericidal concentration (MBC) test
치아우식과 관계된 S. mutans를 균주로 사용하여 항균물질에 대한 균의 생장을 억제하는 최소농도를 의미하는 최소억제농도(minimum inhibitory concentration; MIC) 균을 죽이는 약물의 최소농도를 의미하는 최소살균농도(minimal bactericidal concentration; MBC)를 평가하였다. S. mutans는 BHI broth를 배지로 사용하여 균을 활성화시키고 37℃ CO2 incubator에서 24시간 배양 하였다. 그 후 다시 6시간 동안 2차 배양한 후에 96 well plate에 1.1 × 1010 CFU/mL농도로 각 well에 100μL씩 넣었다. 각각의 물질 16 mM을 단계별로 희석하여 well에 넣은 후 다시 24시간 배양 후에 Enzyme-linked immuno-assay reader(Spectra MAX250, Molecular Devices Co, USA)로 600nm에서 흡광도를 측정하여 최소억제농도를 결정하였다. 최소살균농도는 최소억제농도를 포함하여 3개 이상 윗 단계 높은 농도까지 세균액 100μL을 따서 한천배지 plate에 도말하여 콜로니가 생성되지 않은 농도를 최소살균농도(MBC)로 결정하였다.
4. MTT test
L-929 세포를 RPMI(RPMI-1640, Life technologies corporation, NY, USA)에 10% FBS와 항생제(Penicillin Streptomycin, Life technologies corporation, NY, USA)를 첨가한 배지에서 배양하여 96 well plate에 1 x 104 cells/well가 되도록 90 μL씩 분주하였다. 이를 37℃, 5% CO2 배양기(MCO175, SANYO Electric Biomedical Co. Lit, Osaka, Japan)에서 24 시간 배양하여 세포를 부착시켰다.
항균물질 자체의 MTT test에서는 항균물질을 RPMI 배지로 희석하여 10 mM, 1 mM 항균물질 10 μL씩, 대조군에는 RPMI 배지를 10 μL씩 넣었고, vehicle control은 DMSO를 배지로 희석하여 10% DMSO를 사용하였다. 불소바니쉬와 혼합한 항균물질을 항균물질의 MTT test에서는 항균물질을 RPMI 배지로 희석하여 20 mM, 2 mM 항균물질을에 불소바니쉬를 1:1로 섞어 10 mM, 1 mM의 항균성 불소바니쉬를 제작하여 이를 10 μL씩 넣고, vehicle control로 불소바니쉬에 배지로 희석한 10% DMSO를 사용하였다. 37℃ CO2배양기에서 다시 24시간 배양 후 5 ㎎/mL MTT용액을 50 μL씩 첨가하고, 37℃, 5% CO2 배양기에서 4시간 더 배양하였다. 그 후 배지만 제거하고, Isopropanol를 100 μL 넣은 후 shaker로 혼합하여 형성된 청색 formazane 결정을 녹였다. Enzyme-linked immuno-assay reader (Spectra MAX250, Molecular Devices Co.)로 570 nm에서 흡광도를 측정하고, Isopropanol만 넣은 것을 blank로 하였다. 세포활성도는 대조군의 MTT 환원율 100%로 표준화하여 대조군과 비교하여 백분율로 표시하였다. 70% 이상일 경우 독성이 없다고 판단하였다[ISO 10993-5].
결 과
1. MIC, MBC test
항균물질 자체의 MIC는 BAK, BCC, IBC 물질의 MIC가 가장 낮았고(0.015 mM), MBC는 BAK 물질의 MBC가 가장 낮았으며(0.031 mM), BCC 물질이 그 다음이었다(0.062 mM).
불소바니쉬와 혼합된 항균물질에서 MIC는 BAK 가장 낮았고(0.031 mM), 그 다음으로 BCO 물질이(0.062 mM)에서 S. Mutans 균의 성장을 억제하였다. MBC는 BAK 물질이 가장 낮은 농도에서 S. mutans 균의 최저살균농도(0.062 mM)를 보였다.
2. MTT test
항균물질 자체의 MTT test 결과는 Fig. 1 에 나타나있다. 세포활성도는 1 mM 에서는 BCM (78%)이 다른 물질들보다 세포독성이 없다고 여겨지는 ISO 기준인 70% 이상으로 유의성있게 높았다(p<0.05). 10 mM 에서는 BCM (53%)의 세포활성도가 가장 높았다(p<0.05).
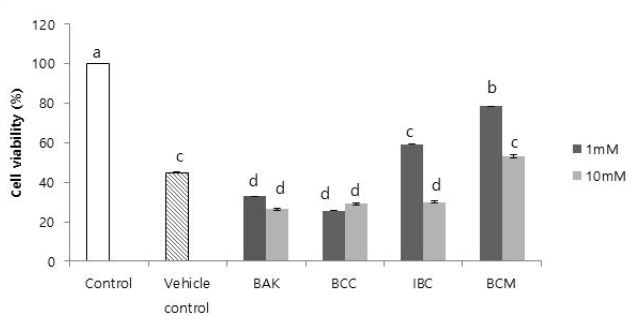
Cell viability was normalized to the 100% conversion of control. Different lowercase letters are significantly different among group by Duncan's multiple range test at ɑ=0.05. Control: RPMI culture medium, Vehicle control: 10% DMSO.
불소바니쉬와 혼합된 항균물질의 MTT test 결과는 Fig. 2에 나타나있다. BCM은 1 mM과 10 mM에서 가장 세포활성도가 높았다. 그 외 다른 실험군은 모두 1 mM, 10 mM에서 vehicle control과 차이가 없었다(p>0.05).

MIC and MBC of antibacterial agents and antibacterial agents with and without fluoride varnish S. mutans
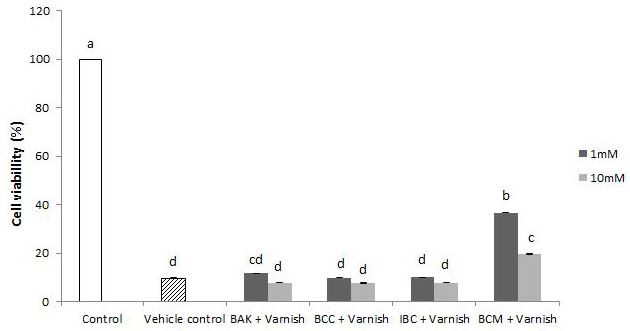
Cell viability of antibacterial agents in fluoride varnish of were expressed as percentage means and standard deviations of MTT conversion, normalized to the 100% conversion of control. Different lowercase letters are significantly different among the all the groups by Duncan's multiple range test at ɑ=0.05. Control: RPMI culture medium, Vehicle control: 10% DMSO in RPMI + Experimental fluoride varnish
고 찰
본 연구에서는 S. mutans에 항균성이 있는 천연물질을 불소 바니쉬에 첨가하여 항균성을 평가함으로써 불소바니쉬 자체보다 S. mutans 에 항균효과가 좋은 항균성 불소바니쉬를 개발하고자 하였다. 보골지의 구성성분인 Bakuchiol, Bavachalcone, Isobavachromene, Bavachromene으로 실험을 진행하였다.
모든 항균물질들은 S. mutans의 억제에 효과가 있었다. 항균 물질 자체의 MIC는 Bakuchiol, Bavachalcone, Isobavachromene이 가장 낮은 농도에서 S. mutans 균의 성장을 억제하였고, MBC는 Bakuchiol 물질이 가장 낮았다. 다른 논문에서도 MIC, MBC test 결과 Bakuchiol 낮은 농도를 보였다 (Katsura 등, 2001). 불소바니쉬와 항균물질을 혼합한 경우도 S. mutans의 억제에 효과가 있었는데, 이때의 MIC, MBC는 Bakuchiol 물질이 가장 낮았다. 본 연구에서는 불소바니쉬와 항균물질을 혼합한 경우 항균물질 자체보다 MIC, MBC의 농도가 높아져 항균력이 감소했음을 알 수 있었다. 그 이유로는 끈적끈적한 고분자 물질인 로진을 베이스로 하는 불소바니쉬에 혼합된 항균물질이 고분자 물질사이를 빠져 나가 항균활성을 보이기가 쉽지 않을 것이라 사료되어 불소바니쉬에 적용된 경우 더 높은 농도가 요구된다.
항균물질의 MTT 시험에서는 1 mM에서 Bavachromene이 다른 물질들보다 유의성 있게 높은 세포활성도를 보였고, ISO의 세포독성판단 기준인 70%을 넘었다[ISO 10993-5]. 항균물질을 불소바니쉬와 혼합한 경우 모두 70% 이하의 세포활성도를 보이고 있었다. 하지만 예비시험에서 임상에 사용이 허가되어 시판되는 불소바니쉬인 V-varnish, Flor-opal, cavity shield 각각 16.79% 15.30% 17.48%의 세포활성도를 보여 본 실험에서 사용된 experimental 불소바니쉬와 유의성있는 차이를 보이지 않았다. 또한 Fig. 2 에서 모든 항균물질과 불소바니쉬를 혼합한 군은 vehicle control인 불소바니쉬 자체와 유의성있는 차이가 없었다. 이는 세포 시험과 usage test의 결과가 일치하지 않는 ZOE와 같은 경우라고 사료된다. ZOE는 생체적합성 실험에서 제1군에서는 강한 독성을 나타내는데, 제3군에서는 실제 동물에 적용 시 독성이 나타나지 않았다(Sakaguchi 등, 2012; Shin 등, 2017). 따라서 불소바니쉬 또한 구강 내에서 오랜 기간 안전하게 사용되고 있는 것으로 보아 항균물질을 불소바니쉬에 혼합한 경우 또한 구강 내에서 안전하게 사용할 수 있으리라 생각된다. 특히 70% 이상의 세포활성도를 보인 Bavachromene은 더욱 안전하다 할 수 있으며, 다른 항균물질들도 농도를 조절하여 추가적인 실험과 특히 usage test를 해볼 필요가 있고, 다른 기타 생체 적합성 실험을 진행하여 그 유용성을 확인해봐야 할 필요성이 있다.
본 연구에서는 S. mutans에 대한 항균성을 시험해본 결과 모든 항균물질은 S. mutans의 억제에 효과가 있었고, 항균물질들을 불소바니쉬에 첨가했을 때도 모두 항균효과가 있었다. 그 중 항균물질 자체와 항균물질들을 불소바니쉬에 첨가했을 때 Bakuchiol 이 가장 효과적인 항균성을 보였다. Bakuchiol을 이용하여 또는 Bakuchiol과 다른 항균물질들과의 혼합을 통하여 이를 불소바니쉬에 응용함으로써 보다 S. mutans의 억제에 효과적인 불소바니쉬를 개발할 수 있을 것으로 사료된다.
결 론
이상의 연구에서 S. mutans에 대한 효과적인 항균물질과 불소바니쉬에 항균물질을 혼합하여 항균성 불소바니쉬를 제작하여 S. mutans에 대한 MIC and MBC test를 실시하여 다음과 같은 결과를 얻었다.
MIC는 항균물질 자체에서 Bakuchiol, Bavachalcone, Isobavachromene 물질이 가장 낮았으며, 항균물질과 불소바니쉬를 혼합하였을 때 Bakuchiol 물질이 가장 낮은 농도에서 항균효과를 보였다. MBC는 항균물질 자체와 항균물질과 불소 바니쉬를 혼합하였을 때 모두에서 Bakuchiol 물질이 가장 낮았다. 세포활성도는 Bavachromene이 가장 높았다. 항균물질 중 S. mutans에 가장 효과적이었던 Bakuchiol을 불소바니쉬에 적용하여 항균성 불소바니쉬를 개발할 수 있을 것이라 사료된다.
Acknowledgments
이 논문은 2015년도 정부(미래창조과학부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(No.2015R1A2A2A01007393) The chemical library used in this study was kindly provided by Korea Chemical Bank (http://www.chembank.org/) of Korea Research Institute of Chemical Technology. The microorganism used in this study was kindly provided by Korean Collection for Type Cultures (http://kctc.kribb.re.kr/)
참고문헌
- Araghizadeh, A, Kohanteb, J, Fani, MM, (2013), Inhibitory activity of green tea (camellia sinensis) extract on some clinically isolated cariogenic and periodontopathic bacteria. Medical principles and practice, Med Princ Pract, 22, p368-72.
-
Arends, J, Schuthof, J, (1975), Fluoride content in human enamel after fluoride application and washing - an in vitro study, Caries Res, 9, p363-72.
[https://doi.org/10.1159/000260178]

- Bibby, BG, DE Roche, E, Wilking, E, (1947), The effect of topical applications of lead fluoride on dental caries, J Dent Res, 26, p446.
-
Demito, CF, Vivaldi-Rodrigues, G, Ramos, AL, Bowman, SJ, (2004), The efficacy of a fluoride varnish in reducing enamel demineralization adjacent to orthodontic brackets: An in vitro study, Orthod Craniofac Res, 7, p205-10.
[https://doi.org/10.1111/j.1601-6343.2004.00305.x]

- Liu, J, Ling, JQ, Zhang, K, Huo, LJ, Ning, Y, (2012), Effect of Sodium Fluoride, Ampicillin, and Chlorhexidine on Streptococcus mutans Biofilm Detachment, Antimicrob Agents Chemother, 8, p4532-535.
- Eriksen, HM, Nordbø, H, (1978), Extrinsic discoloration of teeth, J Clin Periodontol, 4, p229-36.
- Emilson, CG, (1977), Susceptibility of various microorganisms to chlorhexidine, Scand J Dent Res, 4, p255-65.
- Gonzalez, OA, Escamilla, C, Danaher, RJ, Dai, J, Ebersole, JL, Mumper, RJ, Miller, CS, (2013), Antibacterial effects of blackberry extract target periodontopathogens, J periodontal Res, 48, p80-6.
- Hazelrigg, CO, Dean, JA, Fontana, M, (2003), Fluoride varnish concentration gradient and its effect on enamel demineralization, Pediatr Dent, 2, p119-26.
- ISO. Biological evaluation of medical devices Part 5: Tests for in vitro cytotoxicity.
- http://www.iso.org/iso/catalogue_detail.htm%3Fcsnumber=36406
-
Katsura, H, Tsukiyama, RI, Suzuki, A, Kobayashi, M, (2001), In vitro antimicrobial activities of bakuchiol against oral microorganisms, Antimicrob Agents Chemother, 45, p3009-13.
[https://doi.org/10.1128/aac.45.11.3009-3013.2001]

-
Kidd, E, Fejerskov, O, (2013), Changing concepts in cariology: forty years on, Dent Update, 40, 277–78, 280–82, 285–86.
[https://doi.org/10.12968/denu.2013.40.4.277]

- Kim, JB, Paik, DI, et al , (2009), Clinical preventive dentistry, 4th ed, Seoul, Komoonsa, p277-82.
- Shin, KS, Kim, AJ, Oh, SH, Bae, JM, (2017), Development of fluoride varnish with sustained fluoride release and biocompatibility, Kor J Dent Mater, 1, p21-31.
-
Shin, M, Chen, JW, Tsai, CY, Aprecio, R, Zhang, W, Yochim, JM, Teng, N, Torabinejad, M, (2017), Cytotoxicity and Antimicrobial Effects of a New Fast-Set MTA, Biomed Res Int, 2017, p207124.
[https://doi.org/10.1155/2017/2071247]

-
Mikkelsen, L, Jensen, SB, Jakobsen, J, (1981), Microbial Studies on Plaque from Carious and Caries-Free Proximal Tooth Surfaces in a Population with High Caries Experience, Caries Res, 15, p428-35.
[https://doi.org/10.1159/000260548]

- Rølla, G, Ogarrd, B, Cruz Rde, A, (1993), Topical application of fluorides on teeth : new concepts of mechanisms of interaction, J Clin Periodontol, 20, p105-8.
- Sakaguchi, RL, powers, JM, Craig's restcratial dental meterials, 13th ed., Elsevier philadelphia, (2012), p110-16.
- Tinanoff, N, (2005), Association of diet with dental caries in preschool children, Dent Clin North Am, 4, p725-37.
- Todd, MA, Staley, RN, Kanellis, MJ, Donly, KJ, Wefel, JS, (1999), Effect of a fluoride varnish on demineralization adjacent to orthodontic brackets. American journal of orthodontics and dentofacial orthopedics, Am J Orthod Dentofacial Orthop, 116, p159-67.
-
Tredwin, CJ, Scully, C, Bagan-Sebastian, JV, (2005), Drug-induced disorders of teeth, J Dent Res, 84, p596-602.
[https://doi.org/10.1177/154405910508400703]

- Walter J., Loesche, (1986), Role of Streptococcus mutans in Human Dental Decay. Microbiological reviews, Microbiol Rev, 50, p353-80.
- Zhao, LH, Huang, CY, Shan, Z, Xiang, BG, Mei, LH, (2005), Fingerprint analysis of Psoralea corylifolia by HLPC and LC-MS, J Chromatogr, 821, p67-74.
