치과용 지르코니아의 in vitro 및 in vivo 생물학적 평가
Abstract
Recently, zirconia ceramics have been extensively used as the artificial tooth in modern dentistry on account of their excellent mechanical properties and good esthetics. The purpose of this study was to evaluate biocompatibility of zirconia ceramics using agar diffusion test, acute systemic toxicity, intracutaneous test and local lymph node assay(LLNA). For In vitro test, the agar diffusion assay was used sintered zirconia specimens (In-ceram YZ-55, VITA Co., Bad sackingen, Germany) were performed according to ISO 7405. For in vivo test, three different tests were carried out and samples were prepared according to ISO 10993-12 for all of the test. Acute systemic toxicity test and Intracutaneous test, were performed according to ISO 10993-11 and ISO 10993-10. The murine local lymph node assay test was performed according to OECD guide line 442 B. The overall criterion for the cytotoxicity of zirconia sample was '0'. For the acute systemic toxicity test, no symptoms were observed during the visual observation of the animal. For the intracutaneous irritation test, there was no redness and swellings on the reaction sites. The result of LLNA test, the samples extractions in polar solvents showed average OD value of 1.078 and those in non-polar solvents showed average OD value of 1.059. The partially stabilized zirconia materials were proved to be biocompatible. The results of both In vitro and in vivo test concluded that the zirconia materials were biocompatible.
Keywords:
Ziroconia, Biocompatibility서 론
지르코니아 치과보철물은 세라믹 크라운, 임플란트 어버트먼트(abutment)및 고정체(fixture)로 다양한 활용이 증가되고 있다. 특히 심미적인 치과치료에 대한 환자의 요구도 증가와 치과용 지르코니아 CAD/CAM 기술의 개발과 함께 국내, 국외에 많은 개발이 이루어지고 있는 실정이다. 지르코니아는 우수한 기계적 강도, 화학적 안정성, 파절저항 및 생체 적합성을 가지므로 정형외과 영역과 치과분야 다양하게 쓰이며, 특히 치과 보철물로 활용하기 위한 충분한 물성을 갖는 것으로 알려져 있다(Zarone 등, 2011).
치과용 보철물 및 임플란트 어버트먼트로 사용되는 지르코니아 소재는 이트리아 (yttria, Y2O3,)가 첨가하여 안정화된 정방정 지르코니아 (Y2O3, ytrria tetragonal zirconia polycrystal)를 사용하며 높은 강도와 균열 전파에 대한 저항성 (파괴인성)이 매우 높은 것으로 알려져 있다. 하지만 장기간 사용 시 피로에 의한 파절 현상, 멸균소독과정에서 정방정(tetragonal phase)에서 단사정 (monoclinic phase)으로 상전이에 의해 발생하는 강도 저하 즉, 저온열화(low temperature degradation)현상(Hallmann 등, 2011) 및 접착성능에 대한 안정성 등에 대한 충분한 검토가 이루어지지 않아 잠재적인 위험성에 노출되어 있다.
지르코니아 소재는 대표적인 생체 불활성 소재로서 부식이 전혀 일어나지 않는 생체적합성이 우수한 것으로 알려져 있지만, 지르코니아 소재의 생물학적 특성을 평가 할 수 있는 기준은 ISO 10993-5, 10993-10, 10993-11로서, 가이드라인에서 추천되는 모든 항목의 평가가 필요한지에 대한 논란의 여지가 있으며, 치과보철물 및 임플란트 어버트먼트에 적합한 규격인지에 대한 면밀한 검토가 필요하다.
Schley 등의 연구에 의하면 5년간의 임상실험 결과를 면밀히 검토한 결과 지르코니아 소재의 치과용 보철물은 적합한 기계적 물성과 생물학적 안정성을 갖는 것으로 확인 되었다(Sheley 등, 2010). 지르코니아재료의 어떠한 돌연변이 유발성이나 발암성이 있는지 확인하기 위하여 시편을 두께별로 두고 72시간 관찰하였지만 돌연변이를 일으키지 않는다고 하였으며(Covacci 등, 1999), 지르코니아 재료는 조직학적으로, 면역학적으로 IL-6발현이 적게 일어 난 것으로 보고되었다(Hideki 등, 2003).
Nakamura 등에 의하면 지르코니아 소재가 임플란트 어버트먼트로 활용되기에 충분한 기계적 물성과 생물학적 안정성을 갖는 것으로 확인되었지만 5년 이상의 장기간 임상실험에 추가적으로 검토의 필요성을 제시하였다(Nakamura 등, 2010).
현재 지르코니아 소재의 생물학적 특성을 종합적으로 평가할 수 있는 국제 표준화된 단일실험법은 없으며, 각각 특성을 개별적으로 평가할 수 있는 표준화된 실험법을 사용하여 지르코니아 재료의 생체적합성을 평가하고자 하였다.
II. 연구재료 및 방법
1. 연구재료
반 소결 상태의 지르코니아 블럭(In-ceram YZ-55, VITA Co., Bad sackingen, Germany)을 절단하고 소결하여 가로 10 mm x 세로 10 mm x 두께 5 mm로 시편을 제작하였다. 본 동물실험은 연세대학교 임상의학연구센터에서 임상실험 윤리위원회 승인 후 시행하였다(YMC 10-113).
2. 세포독성
지르코니아 재료에 대한 세포의 용해(괴사) 또는 성장저해 및 기타 세포에 미치는 영향을 평가하기 위해 ISO 10993-5에 따라 한천 중층법을 이용하여 세포독성을 평가하였다. L-929 세포 부유 액을 petri-dish에 10 mL(2.5×105cells/mL)씩 분주하여 24시간 동안 37℃, 5% CO2 incubator에서 배양하였다. 배양액의 단층 배양 상태 (배양 용기 면적의 80% 이상)와 세포의 형태를 현미경으로 확인한 후 배양액을 제거하고 RPMI 4 mL+ Agar 5 mL+ FBS 1 mL 을 첨가하고 실온에 보관 하였다. 30분 뒤에 Agar가 굳으면 염색용액 (Neutral red : PBS = 300 μL : 10 mL)을 filtering 하여 약 10 mL 씩 주입 하고 은박지로 밀폐 후 20분 동안 CO2 Incubator에 보관하였다. 현미경으로 염색 여부를 확인한 후 염색약을 제거하고 실험 시편(지르코니아)과 양성 대조군(latex), 음성대조군(slide glass) 시편을 조심스럽게 위치하였다. 24시간 동안 CO2 incubator에서 배양하였다.
3. 급성전신독성(경구투여)
본 실험은 독성이 있는 의료용 생체재료의 용출액 또는 분해산물이 접촉에 의하여 생체내로 흡수될 가능성이 있는 경우, 24시간 이내에 실험동물에 1회 이상 접촉함으로써 발생 가능한 잠재적 위해성을 평가하는 실험(ISO 10993-11)이다. 실험군은 지르코니아 시편 (4.5 g)을 생리식염수 (22.5 mL) 에 넣고 121 ℃에서 1시간 용출하였다. 대조군은 실험재료를 용출할 때와 같은 방법(같은 온도 및 시간)으로 용기 내에 실험재료를 넣지 않고 용매만 넣은 것을 대조군으로 하였다. 실험 동물은 Rat(계통: SD)으로 성별은 Male 5주령, 체중 130-150 g으로 20마리를 선택하였다. 실험 전날 실험 동물을 실험 군과 대조군으로 10마리 씩 나누고 각각 무게를 측정하였다. Intragastric administration needle을 사용하여 실험 군에는 용출물을, 대조군에는 공 실험액을 20 mL/Kg씩 경구 투여하였다. 모든 동물에 대하여 14일 동안 필요에 따라 외관적 이상 및 임상증상, 사망동물 및 이상 징후의 발생여부와 그 정도를 관찰하였다. 14일이 경과하면 부검하여 육안으로 관찰하고 이상이 있을 경우 장기를 적출하여 조직을 병리학적으로 관찰하였다.
4. 피내 반응
실험동물의 피부, 눈 또는 점막과 같은 이식조직이나 적절한 부위에 대하여 의료용 생체재료 또는 그 용출액의 잠재적인 자극성(irritation)을 알아보기 위한 실험으로(ISO 10993-10), 접촉경로 및 접촉시간 등을 고려해서 실시하였다. 시편을 극성용매인 생리식염수와 비극성 용매인 cottonseed oil 각각 121℃에서 1시간 용출하였다. 대조군은 실험재료를 용출할 때와 같은 방법(같은 온도 및 시간)으로 용기 내에 실험 재료를 넣지 않고 용매만 넣은 것을 대조군으로 하였다.
실험동물은 3 kg의 Albino 토끼로 총 2마리를 반입하였다. 동물이 반입되고 1주일 동안 적응기간을 가졌다. 용출물을 주사하기 위하여 마취제와 진정제를 3:2 비율로 1 mL (Zoletil 0.6 mL + Rompun 0.4 mL)을 근육주사 시행한 후 토끼 양쪽 등뼈를 중심으로 약 10 x 15 cm 크기로 털을 제거하였다. 극성용매와 비극성용매에서 추출된 2가지의 용출액을 등뼈를 중심으로 좌우 대칭되게 0.2 mL 씩 5개 부위에 피내주사(26 gauge needle 적용)하였다. 극성용매 실험군과 비극성용매 실험군에 사용되고 실험군의 용출조건과 동일한 조건에서 처리된 각 공실험 용매 0.2 mL을 각 실험군 아래 5개 부위에 실험군과 동일한 방법으로 대조군을 피내 주사하였다. 주사직후 24, 48, 72시간 후에 각각의 주사부위의 홍반과 부종을 관찰하여 Table 2에 따라 기록하였다.
5. 감작성 실험 (LLNA)
피부나 구강 내에 감작반응을 일으키는 알레르기성 접촉 피부염은 의약품 등의 화학물질에 의해 유도 될 수 있으므로 마우스를 이용한 local lymph node assay 방법(LLNA)을 적용하였다(OECD guide line, No. 442 B). 아무런 처치를 하지 않은 군은 A군(무 처치군)으로, 감작반응을 일으킬 수 있는 α-Hexyl Cinnam Aldehyde를 사용한 군은 B군(양성 대조군)으로 적용하였다. 실험재료를 넣지 않고 생리식염수를 사용하여 용출한 공용액은 C군(극성 대조군), 실험재료를 넣고 용출한 것은 D군(극성 실험군)으로 하였다. 실험재료를 넣지 않고 cottonseed oil을 사용한 실험액은 E군(비극성 대조군), 실험재료를 넣고 용출한 것은 F군(비극성 실험군)으로 각각 실험재료를 넣은 것과 넣지 않은 군으로 구분하여 구성하였으며, 용출조건은 고체시료 4.5 g에 용매 22.5 mL을 적용하였다. 실험을 위하여 mouse (계통:Balb/c)를 8-12 주령, 체중 25 g, Female로 30마리를 반입하였다. 모든 군은 121 ℃ 에서 1시간 용출하였다. 실험 첫날 실험물질 군당 5 마리씩 1일 1회 3일 동안 연속해서 마우스 양쪽 귀 배 측에 각각 25 µL씩 분할 도포하여 감작시켰다. 5일째, 림프절세포의 증식정도를 평가하기 위해 BrdU (5-Bromo-2-deoxyuridine) 10 mg/mL solution을 개체 당 0.5 mL 씩을 복강 주사하였다. 복강주사 후 24시간이 지난 시점에 희생하였다. 각 개체별로 분리된 림프 절 세포를 단일세포로 분리하여 BrdU labeling solution를 이용하여 ELISA reader (Molecular Device, USA)로 370 nm (reference 492 nm) 흡광도(OD, optical density)를 측정하였다. 자극지수(stimulation index, SI)는 다음과 같은 방법으로 계산 하였다(OECD Guide line, No. 442 B).
실험결과 자극지수가 3이상 일 때 감작물질로 판명 하였다. 군간의 유의성을 확인하기 위하여 SPSS 19.0K program for Windows(IBM Co., Armonk, NY, USA)를 사용하여 one-way ANOVA로 통계 처리하였다(p<0.05).
III. 결 과
1. 세포독성
양성대조군을 관찰한 결과 시편 주변과 시편 아래 세포가 사멸 된 것으로 관찰되었다. 지르코니아 시편아래의 세포모양은 음성대조군과 유사하게 나타났으며, 세포의 상태 또한 건강한 것으로 나타났다. 세포독성 판정기준이 ‘0’으로 나타난다. 따라서 지르코니아 재료의 세포독성은 없는 것으로 확인되었다(Fig. 1).
2. 급성 전신 독성(경구투여)
실험동물을 1일, 3일, 5일, 7일, 14일에 육안 관찰한 결과 이상증상을 관찰할 수 없었으며 부검 후 간, 신장, 소장, 위, 대장 등의 주요 장기는 이상이 없었으며, 대조군과 유사한 결과를 나타냈다. 지르코니아 재료의 급성 전신 독성은 없음을 확인하였다.
3. 피내 반응
실험동물의 피내주사 부위를 24시간, 48시간, 72시간 관찰 하였으나 홍반과 부종을 관찰 할 수 없었으며 전체 평균은 ‘0’으로 측정되었다. 따라서 지르코니아 재료의 피내 자극반응은 없다고 판정 되었다.
4. 감작성 (LLNA)
LLNA 방법을 통한 감작성 실험 결과는 Fig. 2 와 같다.
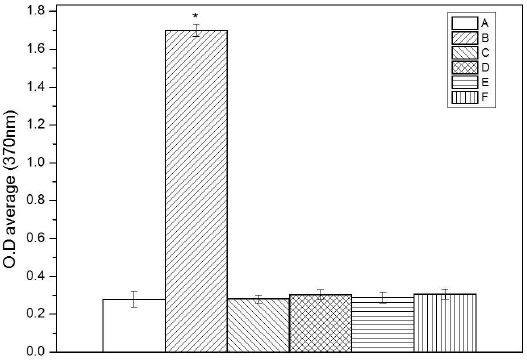
Results of local lymph node assay (*p<0.05). A: non treated, B: positive control(elution in α-Hexyl Cinnam Aldehyde), C: polar control (elution in Nacl), D: polar test (elution in Nacl with specimen), E: nonpolar control(elution in cottonseed oil), F: nonpolar test(elution in cottonseed oil with specimen).
극성용매로 용출한 지르코니아 시편의 자극지수는 극성 실험군 OD 값 평균(0.303)/극성 대조군 OD 값 평균(0.281)을 나누어 계산한 값으로 1.078 로 나타나고 비극성용매로 용출한 지르코니아 시편의 자극지수는 비극성 실험군 OD 값 평균(0.305)/극성 대조군 OD 값 평균(0.288)을 나누어 계산한 값으로 1.059로 나타났다. 양성 대조군(1.699)값은 무 처치군(0.280)으로 나눈 값으로 6.067로 나타났다. OECD guide line 442 B의 양성판정 기준인 3을 참고로 할 때 본 실험조건에서 지르코니아 시편의 극성용매 및 비극성용매의 용출물은 잠재적인 피부 과민반응은 일으키지 않는 것으로 사료 된다(Fig. 2).
IV. 고 찰
지르코니아 재료는 임플란트 보철물의 심미성개선을 위해 티타늄을 대신하여 임플란트 지대주로 점점 사용빈도가 증가되고 있으며, CAD/CAM 기술을 발달로 지르코니아 재료의 수요가 증가하고 있다.
지르코니아의 물리적, 기계적 성질은 다른 세라믹재료보다 우수하여, 이에 대한 연구도 많이 이루어져왔다. 하지만 지르코니아의 재료에 대한 생물학적 평가기준은 ISO에 명확히 제시되어 있지 않으며 선행연구도 부족한 실정이다.
Li 의 연구에 의하면 human fibroblast에 zirconia 0.25 μm, alumina 0.32 μm, tricalcium phosphate 3μm, hydroxyapatite 1.7 μm로 각각 유효한 농도에 적용하여 MTT와 neutral red test를 시행하였다. 그 결과 세포 생존율은 유사하게 나타났으며 지르코니아 재료의 세포독성은 없었음을 확인할 수 있었다(Li 등, 1993). 본 연구에서는 세포에 직접 접촉하여 세포독성을 확인할 수 있는 agar diffusion assay를 시행하였다. 지르코니아 재료는 세포모양과 핵의 염색에 변화가 없음을 확인 할 수 있었으며 음성대조군과 같은 결과를 나타내 지르코니아 재료의 세포독성은 없음을 확인할 수 있었다.
in vivo 실험으로 급성 전신 독성실험, 피내반응 실험, 감작성 실험을 시행하였다. 급성전신독성실험에서는 지르코니아 용출액을 경구 투여하였을 때 이상증상을 확인할 수 없었으며 장기의 이상을 관찰할 수 없었다. Yoichiro의 연구에 의하면 지르코니아 재료를 12개월에 걸친 피하테스트를 통해 지르코니아는 생체 친화성이 저하되지 않고 결합조직을 생성하여 생분해성이 뛰어난 것으로 확인되어 본 연구 결과와 연계할 수 있었다(Yoichiro 등, 1992).
피내반응 실험을 위하여 토끼의 등에 실험물질을 피내 주사를 시행한 후 홍반과 부종을 관찰한 결과 이상반응을 확인할 수 없었다. 선행연구에서는 임플란트 표면에 지르코늄을 코팅하고 토끼에 식립 후 한달 뒤에 조직학적 평가를 시행하였다 임플란트 표면에 toluidine blue로 염색하여 비교한 결과 아무것도 처리하지 않은 대조군은 31%이고 실험군인 test 군은 43% 로 형성되었다. 결과적으로 티타늄 표면에 지르코니아를 코팅한 경우 골 형성유도가 더 잘 나타났다(Sollazzo 등, 2008). 이처럼 지르코니아 재료를 사용하였을 때 실험동물의 이상반응을 확인할 수 없었다.
Welender의 연구에 의하면 임플란트 어버트먼트를 성견에 티타늄, 지르코니아, 금을 식립하여 치유 2개월 후에 결합조직의 구성성분 실험 결과 연조직의 길이는 유사하였으나 지르코니아는 Ti 와 지르코니아계 세라믹에 비해 Au/Pt 합금에서 콜라겐과 세포의 양이 적고 백혈구의 침윤이 많이 나타나는 결과를 나타냈다(Welender 등, 2008).
본 연구에서 감작성 실험을 시행을 위해 귀 뒷면에 물질을 접촉 후 국소림프절 반응을 확인하였다. 지르코니아 재료는 국소림프절 자극반응은 나타나지 않아서 welender의 연구와 상반된 결과를 가져왔으며, 한편 이 결과는 Hideki의 연구에서 지르코니아 재료를 식립한후 조직을 절개한 뒤 염증 전 반응 물질은 IL-1β IL-6, TNF-α 방출량과 골흡수도를 평가한 결과 면역자극반응이 낮게 나타난 것과 유사하였다(Hideki 등, 2003).
20명의 환자를 대상으로 지르코니아와 티타늄 어버트먼트 식립후 3개월 후 연조직을 생검한 결과 건강한 연조직을 확인할 수 있었으며, 지르코니아 재료를 식립하고 12주에 확인해본 결과 식립 주위에 막 두께와 세포의 이상을 찾을 수 없었다(Christel 등, 1989). Schmitter의 연구에서도 zirconia 식립 후 5년 동안 관찰한 결과 물리적 성질과 심미적 성질 만족함을 보였고 과민증이 없었다(Schmitter 등, 2012).
본 연구에서는 지르코니아 재료의 대한 In vitro 와 in vivo 실험 결과, 재료의 생물학적 이상반응은 확인 할 수 없었다. 하지만 모든 생물학적 평가를 하지 못한 것이 이 연구의 한계점이라고 할 수 있다.
V. 결 론
지르코니아 재료를 이용하여 in vitro 와 in vivo 실험을 진행하였다. 본 연구에서 얻어진 결과는 다음과 같다.
- 1) 지르코니아 재료는 세포모양과 형태이상 등의 세포독성이 없었으며 대조군과 비교하여 차이를 보이지 않았다.
- 2) 급성 전신 독성실험 (경구투여) 시행 후 육안관찰로 이상증상을 관찰할 수 없었다. 부검 후 간, 신장, 소장, 위, 대장 등의 주요 장기는 이상이 없었으며 대조군과 실험군은 차이를 보이지 않았다.
- 3) 피내반응 실험 결과, 대조군과 실험군은 홍반 및 부종을 보이지 않았다.
- 4) 감작성 실험 결과(LLNA), 실험군중 극성용매로 용출한 지르코니아 시편의 자극지수는 1.078 로 나타나고 비극성용매로 용출한 지르코니아 시편의 자극지수 1.059로 나타났다. 양성 대조군은 6.067로 나타났다. 본 실험조건에서 지르코니아 시편은 피부 과민반응은 일으키지 않는 것으로 나타났다.
이상의 결과로 치과용 지르코니아 재료의 세포독성이 없었으며, 동물실험에서도 이상반응을 환인 할 수 없었다. 그러나 임상적 효용성을 검증하기 위한 장기적 데이터를 분석하여야 할 것으로 사료된다.
Acknowledgments
* 이 논문은 2010년도 식품의약품평가원에서 시행한 용역연구개발과제의 지원을 받아 수행된 연구임(10172의료기407)
참 고 문 헌
-
Christel, P., Meunier, A., Heller, M., (1989), Mechanical properties and short-term in-vivo evaluation of yttrium-oxide-partially-stabilized zirconia, J Bio Mate Res, 23, p45-61.
[https://doi.org/10.1002/jbm.820230105]

-
Covacci, V., Bruzzese, N., Maccauro, G., Andreassi, Ricci, GA., Piconi, C., Marmo, E., Burger, W., Cittadini, A., (1999), In vitro evaluation of the mutagenic and carcinogenic power of high purity zirconia ceramic, Biomaterials, 20, p371-376.
[https://doi.org/10.1016/S0142-9612(98)00182-3]

-
Hallmann, L., Mehl, A., Ulmer, P., Reusser, E., Stadler, J., Zenobi, R., Stawarczyk, B., Özcan, M., H . Christoph, Hämmerle, F., (2011), The influence of grain size on low-temperature degradation of dental zirconia, J Biomed Mater Res Part B, 100B, p447-456.
[https://doi.org/10.1002/jbm.b.31969]

-
Hideki, W., Shinji, S., Shinji, K., KI, Y., Y. J, Naoki, I., Yukiharu, H., (2003), Biological reaction to alumina, zirconia, titanium and polyethylene particles implanted onto murine calvaria, Biomaterials, 24, p3655-3661.
[https://doi.org/10.1016/S0142-9612(03)00120-0]

- International Organization for standardization, (1999), ISO 10993-5: Biological evaluation of medical devicespart 5 : Tests for in vitro cytotoxicity.
- International Organization for standardization, (2010), ISO 10993-10: Biological evaluation of medical devices-part 10 : Tests for irritation and skin sensitization.
- International Organization for standardization, (2006), ISO 10993-11: Biological evaluation of medical devices-part 11 : Tests for systemic toxicity.
- Keisuke, N., Taro, K., Percy, M., (2010), Zirconia as a dental implant abutment material: a systematic review, Int J prosthodont, 23, p299-309.
-
Li, J., Lie, Y., Hermansson, R., Soremark, R., (1993), Evaluation of biocompatibility of various ceramic powders with human fibroblasts in vitro, Clin mater, 12, p197-201.
[https://doi.org/10.1016/0267-6605(93)90073-G]

- Nakamura, K., Kanno, T., Milleding, P., Ortengren, U., (2010), Zirconia as a dental implant abutment material: A systemic review, Int J Prosthodont, 23, p299-309.
- OECD, (2010), skin sensitization:Local Lymph Node Assay : BrdU-ELISA, Test Guideline No. 442 B, Guidelines for the testing of chemicals.
-
Schmitter, M., Mussotter, K., Rammelsbeg, P., Gabbert, O., Ohlmann, B., (2012), Clinical performance of longspan zirconia frameworks for fixed dental prostheses: 5-year results, J Oral Rehabili, 39, p552-557.
[https://doi.org/10.1111/j.1365-2842.2012.02311.x]

-
Schley, JS., Heussen, N., Reich, S., Fischer, J., Haselhuhn, K., Wolfart, S., (2010), Survival probability of zirconiabased fixed dental prostheses up to 5 yr: a systematic review of the literature, Eur J Oral Sci, 118, p443-450.
[https://doi.org/10.1111/j.1600-0722.2010.00767.x]

-
Sollazzo, V., Pezzetti, F., Scarano, A., Piattelli, A., Bignozzid, CA., Massaria, L., Brunelli, G., Carincif, F., (2008), Zirconium oxide coating improves implant osseointegration in vivo, Dent Mater, 24, p357-361.
[https://doi.org/10.1016/j.dental.2007.06.003]

-
Welender, M., Abrahamsson, I., Berglundh, T., (2008), The mucosal barrier at implant abutments of different materials, Clin Oral Implant Res, 19, p635-41.
[https://doi.org/10.1111/j.1600-0501.2008.01543.x-i2]

-
Yoichiro, I., Yasumasa, A., Hirosama, N., Hiromichi, T., (1992), Tissue compatibility and stability of a new zirconia ceramic invivo, J Prosthet Dent, 68, p322-6.
[https://doi.org/10.1016/0022-3913(92)90338-B]

-
Zarone, F., Russo, S., Sorrentino, R., (2011), From porcelain- fused-to-metal to zirconia: Clinical and experimental considerations, Dent Mater, 27, p83-96.
[https://doi.org/10.1016/j.dental.2010.10.024]