e-PTFE의 산소 및 질소 플라즈마 표면처리에 따른 조골모세포의 증식효과
Abstract
e-Polytetrafluoroethylene (e-PTFE) is a commonly used medical polymer due to its biological stability and excellent mechanical properties such as high hardness and wear resistance. However, the superhydrophobic surface and lack of functional groups to interact with the cellular environment have severely limited its applications in bone or cartilage replacements. In this study, e-PTFE surface was modified by oxygen (O2) or nitrogen (N2) RF plasma treatment in order to improving the hydrophilic property and preosteoblast cell proliferation. After the plasma treatment, e-PTFE surface was characterized by using a contact angle measurement, atomic force microscopy, and scanning electron microscopy. The contact angle of e-PTFE surface was significantly decreased and surface morphology did not changed. The MC3T3-E1 cell proliferation was evaluated by MTT assay. The N2 or O2 plasma- treated e-PTFE groups showed the higher cell proliferation than untreated group. In conclusion, the N2 or O2 gas plasma surface modification used in this study indicates the potential technique as a promising e-PTFE biomedical application.
Keywords:
e-Polytetrafluoroethylene, Plasma surface modification, Contact angle, Preosteoblast cell proliferation서 론
골유도재생술은 골 결손부위 위에 막을 덮음으로써 골 조직이 아닌 인접 조직의 침투를 차단하여 골 조직 생성을 도모하는 술식으로 치과 영역에서 흔히 사용된다(Buser 등, 1993). 이 때 사용되는 차폐막이 가져야할 성질로 차단 능력, 공간유지능력, 세포친화성, 조직유착성, 생체적합성, 그리고 임상적 용이성 등이 있으며, 이에 더하여 골세포 분화와 신생골 형성에 도움이 될 수 있어야 한다(Dahlin 등, 1988). 골유도재생술에 사용되는 차폐막은 주로 비 흡수성과 흡수성으로 나눌 수 있는데, 비 흡수성 차폐막으로서는 expanded polyte- trafluoroethylene (e-PTFE) 가 대표적이다(Nowzari와 Slots, 1995). 비 흡수성 차폐막은 인접 조직의 침투에 대한 차폐 효과가 우수하지만, 생체 내에서 흡수가 되지 않기 때문에 이차적인 제거 수술을 요하는 부담이 있으며 흡수성 차폐막에 비하여 골 형성능이 떨어진다고 여겨져 왔다.
e-PTFE 는 의학 분야에서 널리 사용되는 재료 중 하나로, 생체 내에서 독성이 없고, 잔존물을 남기지 않고, 흡수되지 않는 특성으로 인하여, 골유도 재생술 뿐만 아니라, 인공혈관이나 안면부 중대술을 위한 재료로도 사용된다(Angermayr 등, 2003; Hanke, 2002; Larsen 등, 2006). e-PTFE는 또한 높은 경도와 내마모성을 지니고 있기 때문에 골 조직이나 연골조직을 대체할 재료로 사용될 수 있다. 그러나 e-PTFE 는 소수성이 강하고 생체불활성이 강하여 골 조직 또는 연골조직 대체재로서는 불리한 면이 있다. 이에 대하여 e-PTFE의 소수성과 생체적합성을 개선시키기 위한 연구가 이루어져 왔다.
생체재료의 표면 개질은 재료의 물리적인 특성을 유지하면서 표면의 생체 내 반응을 개선시키기 위한 방법이다(Chu 등, 2002). PTFE의 표면 개질에 대해서 단백질 코팅, 자외선 조사, 이온 주입 그리고 플라즈마 처리 등의 여러가지 방법들이 보고되어 왔다(Bhat 등, 1998; Nishibe 등, 2000; Takahashi 등, 2007; Zhang 등, 2002; Zhu 등, 2004; Zhu 등, 2005). PTFE 인공혈관의 혈전 발생 가능성을 낮추기 위하여 단백질을 코팅하여 혈관 내피세포 성장을 증진시킬 수 있다(Bhat 등, 1998; Nishibe 등, 2000). 그러나 단백질 코팅을 위해서는 소수성인 PTFE에 대한 표면 전처리가 필요한데, 복잡한 단계를 거치며 시간이 많이 소요되는 단점이 있다. 한편, 자외선 조사 처리를 할 때에도 조사 전처리를 요하기 때문에 시간이 소요되는 단점이 있다(Zhu 등, 2005). 또한, 이온 주입은 범용성, 효용성 그리고 환경친화성의 특징을 가진 처리 방법이며, 재료 표면의 형태적 특성과 화학적 특성 모두를 변화시킬 수 있다(Takahashi 등, 2007; Zhang 등, 2002). 그러나 설비 제작 등의 제조비용이 높고, 직선적인 공정(line of sight)을 가지는 특성 때문에 불규칙한 표면에 대한 균일한 처리가 어렵고, 3차원적인 형상을 갖는 소재를 균일하게 처리하기 위해서는 소재를 회전 시키거나 여러 개의 이온빔을 설치해야하기 때문에 제조 단가가 상승하는 단점이 있다(Jun JH 1999). 이와 같은 단점을 극복하기 위하여 최근에 플라즈마 잠김 이온주입법이 개발되었다(Chu 등, 2001; Chu 등, 2004; Conrad JR, 등 1988). 그러나 이 방법도 고가의 장비를 사용해야하기 때문에 Huang 등은 비교적 단순한 구조인 저압 축전 결합형 플라즈마를 이용하여 PTFE을 메탄과 질소가스로 표면개질하여 친수성을 부여하는데 성공하였다(Huang 등, 2013).
따라서 본 연구에서는 e-PTFE에 저온 저압 RF 축전 결합형 플라즈마를 이용한 표면 개질법이 조골모세포의 부착 및 증식을 향상시킬 수 있는가에 대하여 조사하였다.
재료 및 방법
1. e-PTFE 필름
본 연구에서 시편으로 사용된 e-PTFE은 MEGA-Tex™ (Micro-Porous Patch, Think Graft Co., Ltd.) 상업용 제품을 구입하여, KJ 메디텍에서 10 ㎜ × 10 ㎜로 가공하여 사용하였다.
2. 산소 및 질소가스 플라즈마 표면처리
가스 플라즈마 표면처리에는 RF (radio frequency) 13.56 MHz의 축전 결합형 플라즈마(CCP : capacitively coupled plasma) 타입의 장비(Plasmart Inc. Korea)를 사용하였다. 325 mm 직경과 175 mm 높이의 진공 챔버는 로타리 펌프로 최대 10-3 Torr 진공도를 유지한다. 시료대는 상부 전극으로부터 30 mm 떨어진 곳에 위치한다. 플라즈마 표면처리에 사용되는 가스는 고순도 산소(99.99%) 및 질소 가스를 사용하였다. 산소 및 질소 플라즈마 표면처리는 10 sccm의 유량을 흘려주어 챔버 압력을 50 mTorr로 유지한 후, 입력파워 100 W를 인가하여 180 초 동안 각각 동일하게 수행하였다.
3. 표면분석
e-PTFE 표면의 미세구조의 변화는 주사전자현미경(SEM: scanning electron microscopy, SEC, SNE 3200M, Korea)을 사용하여 가속전압 10 kV와 SE 검출모드의 조건으로 관찰하였다. 샘플들은 관찰 전에 sputter-coater (MCM-100)을 이용하여 금 코팅을 하였다. 무 처리 e-PTFE과 산소 및 질소 플라즈마 처리된 e-PTFE 표면 친수성을 평가하기 위하여 60 ℃에서 24 시간 건조한 후 증류수 약 5 ㎕를 시편에 떨어뜨린 후, 접촉각 측정기(GSA, Surfacetech, Korea)로 5 초 후에 접촉각을 측정하였다.
4. 조골모세포 배양
본 실험에 사용된 세포는 생쥐 두개골에서 유래한 조골모세포 MC3T3-E1을 ATCC에 구입하여 사용하였고, 세포 배양은 α-MEM (Alpha Minimum Essential Medium with ribonucleosides, deoxyribonucleosides, 2 mM L-glutamine and 1 mM sodium pyruvate, but without ascorbic acid/GIBCO, Custom Product, Catalog No. A1049001)배지에 growth factor를 제공하는 10% (w/v) fetal bovine serum (PAA Laboratoris.inc A15-751)과 항생제인 amphotericin (Lonza walkersville MD USA 0719)을 혼합하여 5% CO2가 공급되는 37℃, CO2 incubator에서 48 시간 배양하였으며 계대배양을 통해서 얻어진 4 세대 세포를 incubator에서 1 일 동안 배양하여 실험에 사용하였다.
5. 조골모세포 증식 평가 (MTT assay)
배양된 세포는 배지를 모두 제거한 후 PBS를 이용하여 세척하였으며 trypsin/EDTA를 소량 첨가하여 배양접시로부터 분리시켰다. 분리된 세포에 FBS가 포함된 배지를 첨가하여 15 ml 튜브에 옮겨 담은 후 원심분리기를 이용하여 세포를 수집하였다. 세포에 배지를 첨가하여 다시 부유 시킨 후 24 well plate에 담겨진 준비된 샘플에 각각 40000 cell / 200 ㎕의 세포를 파종하였다. 세포는 37℃, 5% CO2 배양기에서 각각 1일, 2일, 3일 동안 배양한 후 MTT를 첨가하여 청자색의 결정이 생성되는 것을 확인한 후 이소프로필알콜(Isopropyl alcohol, Sigma)을 이용하여 용해하였다. 흡광도를 측정하기 위해 반응액을 96-well plate에 각각 200 μL씩 분주한 후 ELISA reader (Thermal Fisher SCIENTIFIC)를 이용하여 540 nm에서 흡광도를 측정하였다.
6. 형광현미경 관찰
무 처리 e-PTFE군과 질소가스 플라즈마 처리군 및 산소가스 플라즈마 처리군이 담겨진 12 well plate에 배양된 MC3T3-E1 세포를 1× 10⁵ cells/mL의 농도로 파종하였다. 세포 파종 후 24시간이 지나면 PBS를 이용하여 2회 세척하였다. Live and Dead Cell staining kit (Biovision #k 501-100)을 사용하여 각 well당 1 ml씩 염색시약을 첨가하여 주었고, 37℃에서 15분 동안 배양하였다. 각각의 3차원 PCL 스캐폴드 샘플을 cover glass 위에 부착하여 형광현미경(Nikon)으로 관찰하기 전까지 4℃에서 보관하였다.
7. 통계분석
모든 실험 데이터는 T-test 분석을 통하여 신뢰도 95% (* p<0.05) 내에서 변수의 비교를 통하여 각각의 유의성 차이를 비교하였다.
결과 및 고찰
1. 표면처리에 따른 표면분석
Fig. 1은 주사전자현미경을 이용하여 산소 및 질소 플라즈마 표면 처리 전, 후의 e-PTFE 표면을 관찰한 결과이다. 세 그룹 모두 전체적으로 1~2 μm의 크기의 규칙적인 기공이 형성되는 것을 확인할 수 있었고, 산소와 질소 플라즈마 표면 처리 후, e-PTFE의 표면인 Fig. 1(b, c)은 무 처리 e-PTFE인 Fig. 1(a)와 비교하여 큰 변화를 관찰할 수 없었다.

SEM images of various e-PTFE surface. (a) nontreated e-PTFE, (b) oxygen plasma treated e-PTFE for 3 min, and (c) nitrogen plasma treated e-PTFE for 3 min.
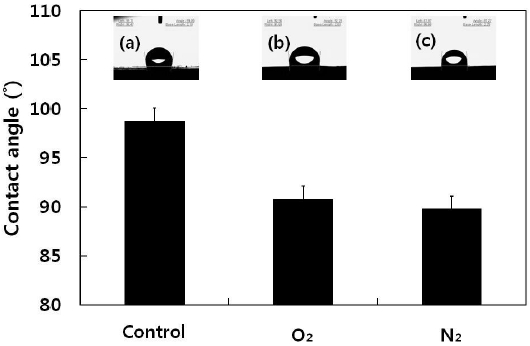
Fig. 2는 접촉각 측정 결과를 나타낸 것이다. 무 처리 e-PTFE의 경우 접촉각이 약 98.75° 로 측정되었고, 산소와 질소 플라즈마 처리를 한 e-PTFE는 각각 90.74°, 89.76° 로 접촉각이 감소하였다. 일반적으로 접촉각이 플라즈마 처리로 인해 감소하는 이유는 플라즈마 처리로 인해 재료의 표면 에너지가 증가하고, 플라즈마 처리 시간에 따라서 재료 표면의 산소나 질소 활성기와 같은 친수성기가 생성되어 시료의 표면 친수성이 증가하였기 때문이다. 하지만 Chun 등의 연구에 따르면 PTFE는 (-CF2-)n 간단한 구조로 이루어진 폴리머이며 C-F의 강한 결합 에너지 때문에 일반적인 표면 개질 방법은 적합하지 않다고 한다. 또한 Nicolas 등의 논문에 의하면, 동일한 가스 표면 처리에서라도 PTFE의 플라즈마 표면 처리 조건에 따라 다양한 접촉각이 나타나는 것을 확인하였다. 이에 e-PTFE의 친수성을 높이기 위해서는 다양한 처리 조건에서의 연구가 필요할 것으로 사료된다.
2. 표면처리에 따른 조골모세포의 증식
Fig. 3 은 e-PTFE 표면에 플라즈마를 표면 처리하여 산소와 질소 플라즈마가 MC3T3-E1 세포 증식에 미치는 영향을 평가하기 위하여 MTT assay를 이용하여 관찰한 결과이다. 이 실험에서 대조군은 무 처리 e-PTFE를 사용하였고, 산소와 질소 플라즈마 처리된 e-PTFE를 실험군으로 사용하였다. MC3T3-E1 세포 증식은 대조군과 실험군 모두 1일, 3일, 6일 동안 배양하였고, 세포배양기간이 증가하면서 실험군의 세포 증식이 증가함을 알 수 있었다.
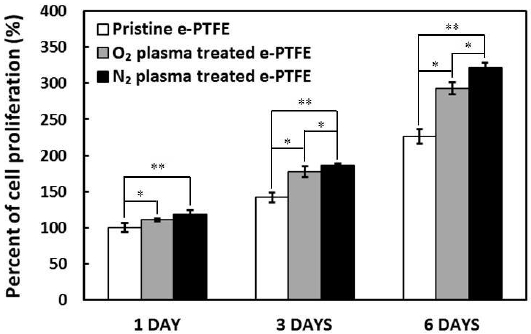
Cell proliferation of MC3T3-E1 cells cultured on the pristine e-PTFE, oxygen plasma treated e-PTFE, and nitrogen plasma treated e-PTFE.
본 연구에서는 산소 플라즈마와 질소 플라즈마 표면 처리를 이용하여 e-PTFE의 표면을 친수성으로 변화시켜 세포 수용기와 표면 관능기와의 상호 작용을 증가시켜 세포 증식을 평가하고자 하였다. e-PTFE의 표면은 플라즈마 내의 이온과 라디칼이 충돌하고 표면 화학종이나 관능기와 반응하여 다른 관능기를 도입 시킨다. 산소 플라즈마와 질소 플라즈마는 극성의 하이드록실기, 카르보닐기, 카르복실기를 도입하고, 고분자 중심의 C-C 결합이나 C-H 결합을 끊는 작용을 한다. 이 작용으로부터 표면 친수성이나 에너지를 증가시켜 생체적합성을 향상시키는 작용을 한다(Yildirim 등, 2008). Gupta 등은 친수성 표면이 소수성 표면에 비해 세포와 조직과의 상호작용이 우수하다는 것을 보고하였다, 접촉각이 낮아진 것으로 미루어 보아 친수성이 향상되었고, 조골모세포가 성장하기에 적합한 표면으로 변화되어 증식에 긍정적인 영향을 미쳤을 것으로 사료 된다(Gupta 등, 2012).
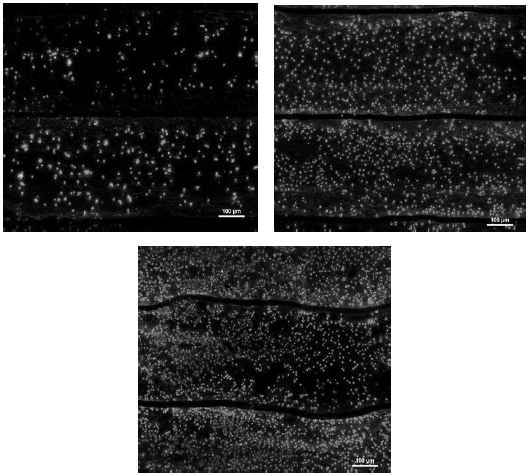
Fig. 4는 Live/Dead 형광 현미경 사진을 나타낸 것이다. 살아 있는 세포는 초록색으로, 죽은 세포는 빨간색으로 염색하여 세포가 살아있는 양을 시각적으로 볼 수 있다. 무 처리 e-PTFE보다 산소와 질소 플라즈마 처리를 한 e-PTFE에서 살아있는 조골모세포의 수가 더 많은 것을 관찰할 수 있었다.
결 론
e-PTPE에 산소 및 질소가스 플라즈마 표면처리를 실시한 후 표면물성의 변화를 관찰하였고, MC3T3-E1 조골모세포를 이용하여 세포증식을 조사하여 다음과 같은 결과를 도출하였다.
- 1) 산소 및 질소가스를 이용한 플라즈마 표면처리 후, e-PTPE는 접촉각이 낮은 친수성 표면으로 표면물성이 변화되었음을 확인 할 수 있었다.
- 2) 산소 및 질소가스 플라즈마 표면처리 후, e-PTFE의 표면형상을 관찰한 결과, 다공성 기공 및 표면형상의 변화가 나타나지 않았다.
- 3) 질소 플라즈마 처리 실험군에서 MC3T3-E1 세포 증식이 가장 우수하게 나타났으며, 플라즈마 처리 실험군은 무 처리 대조군에 비하여 세포증식이 우수하게 나타났다.
이상과 같은 결과들로 미루어 볼 때 산소 및 질소 가스 플라즈마 표면처리 는 e-PTFE가 생체재료로서의 응용성을 확장하는 기술로 각광 받을 것으로 사료된다.
Acknowledgments
This research was financially supported by the Ministry of Knowledge Economy (MKE), Korea Institute for Advancement of Technology (KIAT) and Honam Leading Industry Office through the Leading Industry Development for Economic Region,
참 고 문 헌
-
Angermayr, B., Cejna, M., Koenig, F., Karnel, F., Hackl, F., Gangl, A., Peck-Radosavljevic, M., (2003), Survival in patients undergoing transjugular intrahepatic portosystemic shunt: Eptfe-covered stentgrafts versus bare stents, Hepatology, 38, p1043-1050.
[https://doi.org/10.1002/hep.1840380431]

-
Bhat, VD., Klitzman, B., Koger, K., Truskey, GA., Reichert, WM., (1998), Improving endothelial cell adhesion to vascular graft surfaces: Clinical need and strategies, J Biomater Sci Polym Ed, 9, p1117-1135.
[https://doi.org/10.1163/156856298X00686]

- Buser, D., Dula, K., Belser, U., Hirt, HP., Berthold, H., (1993), Localized ridge augmentation using guided bone regeneration. 1. Surgical procedure in the maxilla, Int J Periodontics Restorative Dent, 13, p29-45.
-
Chu, P., Tang, B., Wang, L., Wang, X., Wang, S., Huang, N., (2001), Third-generation plasma immersion ion implanter for biomedical materials and research, Rev Sci Instrum, 72, p1660-1665.
[https://doi.org/10.1063/1.1340029]

-
Chu, PK., (2004), Recent developments and applications of plasma immersion ion implantation, J Vac Sci Technol, B, 22, p289-296.
[https://doi.org/10.1116/1.1632920]

-
Chu, PK., Chen, JY., Wang, LP., Huang, N., (2002), Plasma-surface modification of biomaterials, Mater Sci Eng, R, 36, p143-206.
[https://doi.org/10.1016/S0927-796X(02)00004-9]

-
Chun, H., Wei, CM., Ching-Yuan, T., Wei-Ting, H., Ruey-Shin, J., (2013), Surface modification of polytetrafluoroethylene membranes by radio frequency methane/nitrogen mixure plasma polymerization, Surf Coat. Tech, 231, p42-46.
[https://doi.org/10.1016/j.surfcoat.2012.03.005]

-
Conrad, JR., Dodd, RA., Worzala, FJ., Qiu, X., (1988), Plasma source ion implantation: A new, cost-effective, non-line-of-sight technique for ion implantation of materials, Surf Coat Tech, 36, p927-937.
[https://doi.org/10.1016/0257-8972(88)90033-3]

-
Dahlin, C., Linde, A., Gottlow, J., Nyman, S., (1988), Healing of bone defects by guided tissue regeneration, Plast Reconstr Surg, 81, p672-676.
[https://doi.org/10.1097/00006534-198805000-00004]

-
Gupta, B., Krishnanand, K., Deopura, BL., (2012), Oxygen plasma-induced graft polymerization of acrylic acid on polycaprolactone monofilament, Eur polym J, 48, p1940-1948.
[https://doi.org/10.1016/j.eurpolymj.2012.07.015]

-
Hanke, CW., (2002), A new eptfe soft tissue implant for natural-looking augmentation of lips and wrinkles, Dermatol Surg, 28, p901-908.
[https://doi.org/10.1046/j.1524-4725.2002.02065.x]

-
Huang, C., Ma, WC., Tsai, CY., Hou, WT., Juang, RS., (2013), Surface modification of polytetrafluoroethylene membranes by radio frequency methane/ nitrogen mixture plasma polymerization, Suf Coat Tech, 231, p42-46.
[https://doi.org/10.1016/j.surfcoat.2012.03.005]

- Jun, JH., (1999), Plasma source ion implantation, Journal of KWJS, 17, p37-44.
-
Kang, MS., Chun, B., Kim, SS., (2001), Surface modification of polypropylene membrane by lowtemperature plasma treatment, J Appl Polym Sci, 81, p1555-1566.
[https://doi.org/10.1002/app.1585]

-
Larsen, CC., Kligman, F., Kottke-Marchant, K., Marchant, RE., (2006), The effect of RGD fluorosurfactant polymer modification of eptfe on endothelial cell adhesion, growth, and function, Biomaterials, 27, p4846-4855.
[https://doi.org/10.1016/j.biomaterials.2006.05.009]

-
Nicolas, V., Delphine, M., Francois, R., (2006), XPS and contact angle study of N2and O2 plasmamodified PTFE, PVDF and PVF surfaces, Surf. Interface Anal, 38, p526-530.
[https://doi.org/10.1002/sia.2255]

-
Nishibe, T., Okuda, Y., Kumada, T., Tanabe, T., Yasuda, K., (2000), Enhanced graft healing of high-porosity expanded polytetrafluoroethylene grafts by covalent bonding of fibronectin, Surg Today, 30, p426-431.
[https://doi.org/10.1007/s005950050616]

- Nowzari, H., Slots, J., (1995), Microbiologic and clinical study of polytetrafluoroethylene membranes for guided bone regeneration around implants, Int J Oral Maxillofac Implants, 10, p67-73.
- Parma-Benfenati, S., Tinti, C., Albrektsson, T., Johansson, C., (1999), Histologic evaluation of guided vertical ridge augmentation around implants in humans, Int J Periodontics Restorative Dent, 19, p424-437.
- Simion, M., Jovanovic, SA., Trisi, P., Scarano, A., Piattelli, A., (1998), Vertical ridge augmentation around dental implants using a membrane technique and autogenous bone or allografts in humans, Int J Periodontics Restorative Dent, 18, p8-23.
-
Takahashi, N., Suzuki, Y., Ujiie, H., Iwaki, M., Hori, T., Yamada, T., (2007), Ion-beam irradiated eptfe as an aneurysm wrapping material, Surf Coat Tech, 201, p8150-8154.
[https://doi.org/10.1016/j.surfcoat.2006.02.068]

- Tinti, C., Parma-Benfenati, S., Polizzi, G., (1996), Vertical ridge augmentation: What is the limit?, Int J Periodontics Restorative Dent, 16, p220-229.
- Yildirim, ED., Gandhi, M., Fridman, A., Guceri, S., Sun, (2008), W. plasma surface modification of three dimensional poly(ε-caprolactone) scaffolds for tissue engineering application, NATO science for peace and security series series A: chemistry and biology, p191-201.
-
Yu, HY., He, XC., Liu, LQ., Gu, JS., Wei, XW., (2008), Surface modification of poly(propylene) microporous membrane to improve its antifouling characteristics in an smbr: O2 plasma treatment, Plasma Process Polym, 5, p84-91.
[https://doi.org/10.1002/ppap.200700051]

-
Zhang, J., Yu, X., Li, H., Liu, X., (2002), Surface modification of polytetrafluoroethylene by nitrogen ion implantation, Appl Surf Sci, 185, p255-261.
[https://doi.org/10.1016/S0169-4332(01)00824-8]

-
Zhu, A., Zhang, M., Zhang, Z., (2004), Surface modification of eptfe vascular grafts with o-carboxymethylchitosan, Polymer International, 53, p15-19.
[https://doi.org/10.1002/pi.1275]

-
Zhu, AP., Ming, Z., Jian, S., (2005), Blood compatibility of chitosan/heparin complex surface modified eptfe vascular graft, Appl Surf Sci, 241, p485-492.
[https://doi.org/10.1016/j.apsusc.2004.07.055]