Ag 코팅 NiTiO 나노튜브의 가시광선 매개 광촉매 활동도 및 항균효과 평가
초록
NiTi 합금 표면에 제조된 NiTiO 나노튜브 구조는 우수한 생체적합성과 반도체 특성으로 인하여 TiO2와 유사한 자외선 매개 광촉매 특성을 가지고 있다. 본 연구의 목적은 NiTiO 나노튜브에서 항균 능력과 플라즈모닉 광촉매 효과를 가지고 있는 은(Ag) 나노입자를 NiTiO 나노튜브 표면에 코팅하여 가시광 매개 광촉매능과 자체 항균능의 시너지 항균 효과를 평가하였다. NiTiO 나노튜브와 Ag-NiTiO 나노튜브를 FE-SEM으로 관찰한 결과, 각각 (42.41±4.33) 및 (50.91±6.59) nm , 높이는 (752.24±23.22) nm를 나타내었다. 확산반사 측정값으로부터 계산된 Tauc 플롯결과, NiTiO 나노튜브는 3.19 eV 밴드갭(band gap)을 가지고 있는 반면 Ag-NiTiO 나노튜브는 2.75 eV를 갖는 것으로 450 nm에 해당되는 광촉매 밴드갭을 나타내어 가시광선 범위에서의 광촉매 효과를 발현하는 것을 확인하였다. Staphylococcus aureus와 Pseudomonas aeruginosa 균주를 이용한 NiTiO 나노튜브와 Ag-NiTiO 나노튜브의 CFU 결과, Ag-NiTiO 나노튜브 실험군에서 유의성 있게 낮았고(p<0.05), 470 nm 가시광선 광조사시 그람양성균 S. aureus에서 Ag-NiTiO 나노튜브와 가시광 매개 광촉매 시너지 효과가 뚜렷하게 나타났다(p<0.05). 인간 중간엽 줄기세포를 이용한 Live-dead assay와 MTT assay 결과, 가시광선 광조사가 세포사멸에는 영향을 미치지 않는 것으로 확인되었다(p>0.05). 따라서 Ag-NiTiO 나노튜브와 가시광선 매개 광기능화의 결합은 치과분야에서 NiTi 임플란트 소재의 항균능을 향상시킬 것으로 기대된다.
Abstract
The NiTiO nanotube structure fabricated on the surface of NiTi alloy exhibits excellent biocompatibility and semiconductor properties, imparting UV-mediated photocatalytic characteristics similar to those of TiO2. The objective of this study was to evaluate the synergistic antibacterial effect and visible-light-mediated photocatalytic activity by coating silver (Ag) nanoparticles onto the surface of NiTiO nanotubes. FE-SEM analysis of NiTiO and Ag-NiTiO nanotubes revealed average diameters of (42.41±4.33) nm and (50.91±6.59) nm, respectively, with a height of (752.24±23.22) nm. Tauc plot analysis derived from diffuse reflectance measurements indicated that NiTiO nanotubes possess a band gap of 3.19 eV, while Ag-NiTiO nanotubes exhibit a reduced band gap of 2.75 eV, corresponding to a photocatalytic response in the visible light range (around 450 nm). CFU results using Staphylococcus aureus, Pseudomonas aeruginosa strains showed significantly lower bacterial counts in the Ag-NiTiO nanotube group (p<0.05), with a marked synergistic photocatalytic antibacterial effect observed in S. aureus under 470 nm visible light irradiation (p<0.05). Additionally, live-dead assays and MTT assays using human mesenchymal stem cells confirmed that visible light irradiation did not significantly affect cell viability (p>0.05). Therefore, the combination of Ag-NiTiO nanotubes with visible light-mediated photocatalysis is expected to enhance the antibacterial properties of NiTi implant materials, offering promising potential for dental applications.
Keywords:
NiTi ally, Ag-NiTiO nanotubes, Visible light mediated antibacterial effect키워드:
NiTi 합금, Ag-NiTiO 나노튜브, 가시광 매개 항균효과서 론
니켈-티타늄(NiTi) 합금은 온도 변화에 따라 원래의 형태로 복원되는 형상 기억 효과와 높은 응력에도 비가역적인 손상 없이 원래 상태로 복원되는 초탄성으로 인해 수술 후 회복 과정에서 발생할 수 있는 물리적 변형을 최소화하며, 관절이나 구강과 같이 반복적인 하중이 가해지는 부위에 임플란트가 파괴되지 않고 장기간 사용할 수 있는 특성으로 인해 치과 및 정형외과와 같은 생물의학 분야에서 사용되는 이상적인 임플란트 재료이다(1,2). 그러나 NiTi 합금의 높은 Ni 함량(~50 at.%)으로 인해, 자발적인 전기화학적 부식으로 기질에서 Ni2+가 방출될 수 있다. 따라서 적절한 표면 개질을 통해 내식성을 더욱 개선하는 것이 필요하며, NiTi를 이식한 후 박테리아의 감염은 임플란트에 대한 또 다른 잠재적 위험으로 NiTi 합금에 우수한 항균 능력을 부여하는 것은 매우 바람직하다.
표면 개질은 임플란트 재료의 내식성과 생체적합성을 개선하는데 일반적으로 사용되는 방법이다(3-7). 이러한 기술은 표면 형태를 통해 또는 표면에 무기 생물학적 활성 요소를 통합하여 Ni 이온의 방출을 다양한 정도로 억제하고 생물학적 기능을 개선하였다(8-11). 특히 양극산화는 생체 의료용 NiTi 합금의 표면 처리에 유망한 기술로(12-14) NiTi 합금에 제조된 NiTiO 나노튜브가 생체적합성과 생물학적 활성을 가지며(10,15), 중요한 것은 NiTiO 나노튜브에서 방출된 Ni2+가 순수 NiTi 합금보다 양이 많지만 세포 기능에 영향을 미치지 않는다는 것을 보고하였다(16,17).
TiO2 나노튜브는 나노 구조의 고유한 특성으로 넓은 표면적을 가지고 있어서 세포의 부착 촉진, 약물 부착 및 방출이 용이하고 체내 환경에서도 화학적, 물리적 안정성을 유지하여 장기적으로 사용할 수 있다(18). 또한 표면 개질 용이성으로 기능성 코팅이나 무기 생물학적 활성 물질의 도입을 통해 항균성, 생체적합성 등 다양한 기능을 부여할 수 있다. 하지만 넓은 밴드 갭(3.2 eV)과 광촉매 활성에 의하여 자외선(~380 nm) 하에서만 가능한 제한점을 가지고 있다(19). 반면 표면 처리를 통해 형성된 NiTi 산화물은 가시광선 영역에 감응할 수 있는 낮은 에너지 밴드갭(2.2 eV)을 가지고 있어 광촉매 활성을 나타낼 수 있다(20,21). 이것은 치과영역에서 사용되는 광파장대(400–600 nm)에서 활용가능성의 기반을 제공할 수 있다.
은(Ag), 금(Au), 산화아연(ZnO)과 같은 금속 나노입자와 그 파생물의 항균 활성은 각각 다양한 특성, 효능 및 활성 스펙트럼을 가지고 있으며 수세기 동안 알려져 왔고 적용되어 왔다(22). 특히 은(Ag)과 같은 무기 생리활성 원소는 안정적이고 저용량에서도 오래 지속되는 효과를 낼 수 있기 때문에 일반적으로 생체재료에 적용된다(23). 항균제로 사용되는 인기 있는 은(Ag) 나노입자는 약물 내성 박테리아에 대한 잠재적인 항균제로 입증되었다(19,24).
기존 연구들에서 NiTi 합금의 내식성과 생체적합성을 개선하기 위해 나노튜브와 금속 나노입자를 활용한 표면 개질 방법이 다양하게 시도되었다. 대부분의 연구는 특정 조건(예: 자외선 하의 TiO2 광촉매 효과)에서만 작동하거나, 항균성과 생체적합성에만 초점을 맞춰 실제 임플란트 환경에서의 적용이 제한적이다. 본 연구는 NiTiO 나노튜브를 제작하여 가시광선에서도 광촉매 활성을 발휘할 수 있는 표면 처리를 도입하여 이러한 한계를 극복하고, 더 나아가 항균성을 강화함으로써, 임플란트의 감염 문제를 해결하고 생체 적합성을 더욱 향상시키는 것을 목표로 하였다.
따라서 본 연구는 NiTi 합금 표면 위에 NiTiO 나노튜브를 제조하고 은(Ag) 나노입자를 코팅하여 표면 분석 및 광학적 특성을 평가하고, 가시광선(470 nm) 기반 광촉매 항균 활성과 생체적합성을 평가하고자 하였다.
재료 및 방법
1. NiTiO 나노튜브의 시편 제작
NiTiO 나노튜브는 Sun 등의 방법을 변형하여 제작하였다(25). NiTi 합금 판(5×5 cm2, 두께 0.127 mm; Thermo Fisher Scientific, Waltham, MA, USA)을 Silicon Carbide paper (#600, #1200 및 #2000)를 사용하여 표면 연마를 수행하였다. 연마 후 NiTi 합금 판을 0.2 w/v% 불화암모늄(NH4F, Sigma-Aldrich, St. Louis, MO, USA)과 1.0 vol.% 탈이온수가 포함된 에틸렌글리콜(Sigma-Aldrich, MO, USA) 전해질 용액에서 양극산화 하였다(전압: 25 V, 시간: 1시간). 양극산화 후, 헵탄(Sigma-Aldrich, MO, USA)으로 5분간 세척한 다음, 초음파 세척기(전력: 100 watt, 주파수: 40 kHz; SD-D200H, Sungdong Co., Seoul, Korea)를 사용하여 탈이온수에서 2차 세척을 실시하였다. 세척된 시편은 60 ℃에서 12시간 동안 건조한 후 400 ℃에서 3시간 열처리하여 NiTiO 나노튜브를 결정화하였다. 결정화된 NiTiO 나노튜브는 이온 플라즈마 스퍼터링(E-1030, Hitachi Co., Tokyo, Japan)을 사용하여, 스퍼터링 시간 1분 Ag가 코팅된 NiTiO 나노튜브(Ag-NiTiO) 시편을 제작하였다(1×1 cm2). 본 연구에서는 두 실험군(NiTiO 나노튜브와 Ag-NiTiO 나노튜브)과 대조군(NiTi 합금)으로 가시광선(470 nm) 광조사 유·무에 따라 광분해, 항균 효과 및 생체적합성을 평가하였다.
2. NiTiO 나노튜브의 특성분석
시편의 표면 특성은 확산 반사 자외선-가시광선-근적외선(diffuse reflectance UV-Vis-NIR) 분광 광도계(측정 범위: 300-1000 nm; SolidSpec-3700; Shimadzu Co., Kyoto, Japan), 전계 방출 주사 전자 현미경(FE-SEM; S-4800; Hitachi Co., Tokyo, Japan)으로 관찰하였다(가속 전압: 15 Kv, 배율: ×100,000). 확산반사 측정값을 Tauc plot으로 변환하여 NiTiO 나노튜브와 Ag-NiTiO 나노튜브의 에너지 밴드 갭을 계산하였다(26-28).
3. 메틸렌블루(Methylene Blue: MB) 광분해 실험
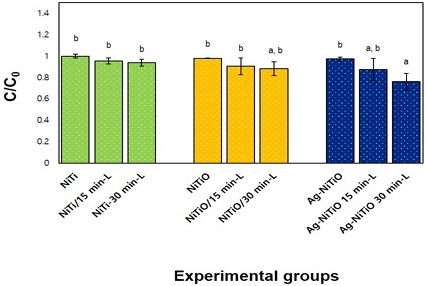
MB 분해 실험은 470 nm의 가시광선에서 NiTiO 및 Ag-NiTiO 나노튜브 그룹의 광촉매 활성을 평가하기 위해 수행하였다. 먼저 시편을 12 well plate에 1 ppm MB (Sigma-Aldrich, St. Louis, MO, USA) 용액 1 mL에 첨가하였다. 그런 다음 470 nm 가시광선(전력 밀도: 5.5 mW/cm2, 시편과 LED 사이의 거리 = 4 cm)을 15분, 30분 동안 조사하였다. 가시광선 조사 후, MB 용액의 흡광도는 UV-Vis 분광기(UV mini-1240, Shimadzu Co., Kyoto, Japan)를 사용하여 최고 파장 범위(665 nm)를 기준으로 3회 측정하여 평균값을 이용하여 분석하였다. MB 용액의 농도는 Beer의 법칙으로 흡광도와 비례하므로 광조사 후 MB 용액의 흡광도(C)를 초기 흡광도(C0)로 나누어 MB 분해 용액농도를 계산하였다. 따라서 측정된 665 nm MB 흡수 파장의 대조군(NiTi) 초기 흡광도 대비 광조사 후의 MB 용액 농도를 계산(C/C0)하여 시간에 따른 MB 광분해 거동을 계산하였다.
4. 집락 형성 단위수(Colony Forming Unit: CFU) 측정
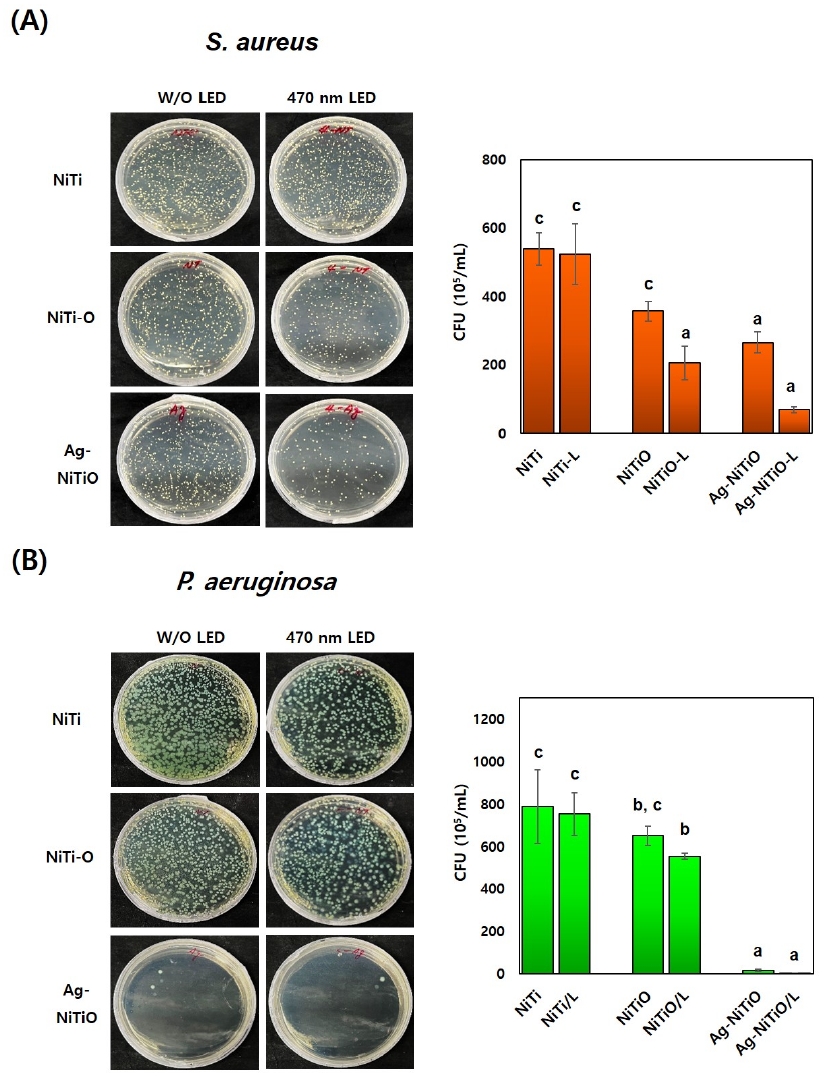
(ATCC 25923, Manassas, VA, USA)와 Pseudomonas aeruginosa (PA14) 균주를 사용하여 두 실험군(NiTiO 나노튜브와 Ag-NiTiO 나노튜브 그룹)과 대조군(NiTi)과의 470 nm 가시광선의 광조사 유·무에 따른 항균 효과를 평가하였다(29). 먼저 박테리아 균주는 37 ℃ 배양기에서 각각 Trypticase soy agar (TSA, Difco, NJ, USA)와 Luria-Bertani (LB; 1% peptone, 0.5% yeast extract, 0.5% NaCl) 배지에서 24시간 동안 배양하였다. 24시간 배양한 후, 부유 액의 세균 수를 측정하여 1×105 CFU/mL로 세균 농도를 희석시킨 뒤, 시편 위에 50 µL를 떨어뜨리고 다시 37 ℃ 배양기에서 6시간 동안 배양하였다. 배양 후, 950 ㎕ PBS (Invitrogen, Thermo Fisher Scientific, Waltham, MA, USA)로 시편을 수세하였고, 470 nm 가시광선을 15분간 조사 후, 1x PBS를 넣은 균주 액 100 µL 취하여 각각 TSA 배지와 LB 배지에 도말 하였고 37 ℃ 배양기에서 24시간 배양 후, 생성된 세균의 군집 수(CFUs)를 세었다. 모든 실험은 3회 반복 측정하여 비교 평가하였다.
5. 세포배양
인간 중간엽 줄기세포(hMSCs; Lonza, Basel, Switzerland)를 이용하여 10 % fetal bovine serum (Gibco™, Thermo Fisher Scientific, Waltham, MA, USA)과 1 % 항생제(Antibiotic-Antimycotic)가 첨가된 alpha modified Eagle's minimum essential medium (Invitrogen, MA, USA)을 사용하여 37 ℃, 5% CO2 배양기에서 2-3일 마다 배지를 교환하였다.
6. Live/dead assay 및 MTT assay
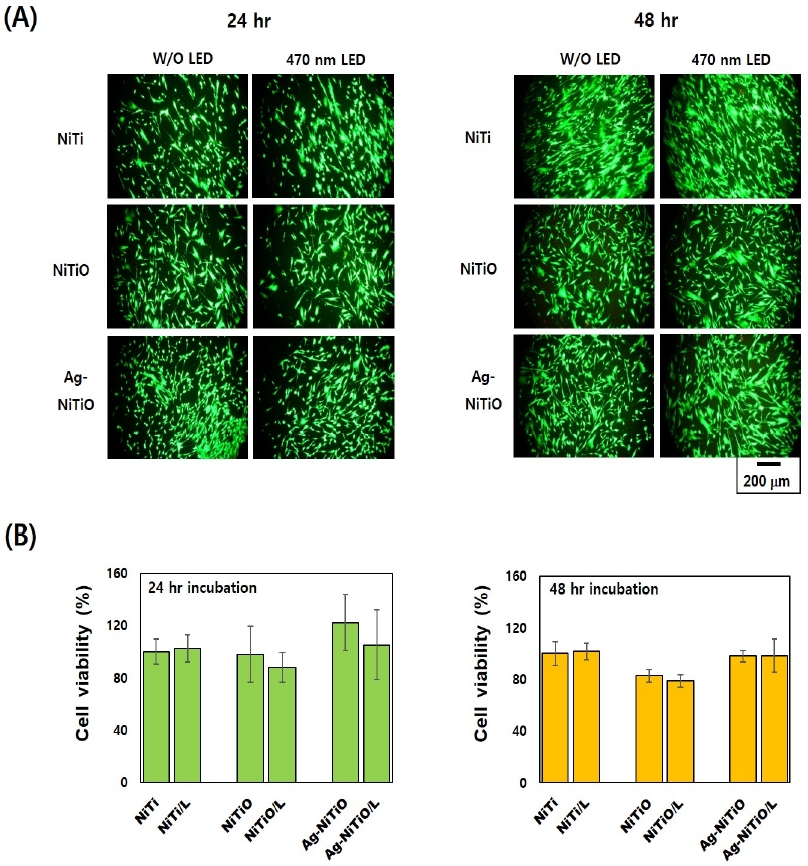
Live/dead assay는 먼저 시편 위에 hMSC를 1×104 cells/well의 농도로 24-well 플레이트에 분주하였다. hMSC와 함께 24시간 동안 배양한 후 시편에 470 nm 가시광선을 10분간 조사하였다. 가시광선 조사 24시간 및 48시간 후, 1× PBS 용액(500 µL)에 희석한 calcein AM (2 µM; Invitrogen, Thermo Fisher Scientific, Waltham, MA, USA) 및 ethidium homodimer-1 (4 µM; Invitrogen, MA, USA)을 각 well에 첨가하였다. 30분 염색 후, 형광 현미경(배율: ×100; CKX41; Olympus Co., Tokyo, Japan)을 사용하여 살아있는(녹색) 세포와 죽은(적색) 세포를 관찰하였다.
MTT assay의 hMSC 배양 및 광 조사의 조건 및 절차는 Live/dead 분석과 동일하였다. 가시광선 조사 24시간 및 48시간 후, MTT (Sigma-Aldrich, St Louis, MO, USA)용액 100 µg/mL을 각 well에 첨가하고, MTT 용액으로 처리한 검체를 5% CO2 인큐베이터에서 37 ℃에서 배양하였다. 4시간 후, DMSO (Sigma-Aldrich, MO, USA)를 검체에 첨가하여 MTT 용액에서 생성된 포르마잔을 용해하였다. 최종 용액의 흡광도는 ELISA 플레이트 리더(SpectraMAX mini; Molecular Devices, San Jose, CA, USA)를 사용하여 570 nm 에서 측정하였다.
7. 통계분석
통계 분석은 SPSS Ver. 23.0 (SPSS Inc, Chicago, IL, USA)을 이용하여 일원 배치 분산 분석(One-way ANOVA)을 시행하였다. 사후검정으로 Duncan test를 시행하였으며, 유의 수준은 0.05로 설정하였다.
결 과
1. NiTiO 나노튜브의 표면 분석
FE-SEM 관찰 결과, NiTiO 및 Ag-NiTiO의 나노튜브 평균 직경은 각각 (42.41±4.33) 및 (50.91±6.59) nm, 높이는 (752.24±23.22) nm를 나타내었다. Ag 나노입자는 크기가 불규칙하고 뭉쳐진 큰 입자의 형태가 두드러지게 관찰되었다(Figure 1). 확산 반사 UV-Vis-NIR 분광 광도 분석결과, 320–370, 420–480, 500–570 및 650–800 nm의 주요 흡수 스펙트럼 확인 할 수 있었다. 가시광선 영역에서의 NiTiO 나노튜브는 380 nm에서 최대 광흡수율 확인 하였고, Ag-NiTiO 나노튜브는 445, 560 nm에서 최대 광흡수율을 나타내었다(Figure 2(A)). 확산반사 측정값으로부터 계산된 Tauc 플롯은 NiTiO 나노튜브는 3.19 eV 밴드갭(band gap)을 가지고 있는 반면 Ag-NiTiO 나노튜브는 2.75 eV를 갖는 것으로 450 nm에 해당되는 광촉매 밴드갭을 나타내어 가시광선 범위에서의 광촉매 효과를 발현하는 것을 확인하였다(Figure 2(B)).

FE-SEM images (x 100,000) of (A) NiTiO nanotubes (top view), (B) Ag-NiTiO nanotubes (top view). Inserted arrow indicates the Ag nanoparticle and the top right image displays the Ag-NiTiO nanotubes (oblique view).
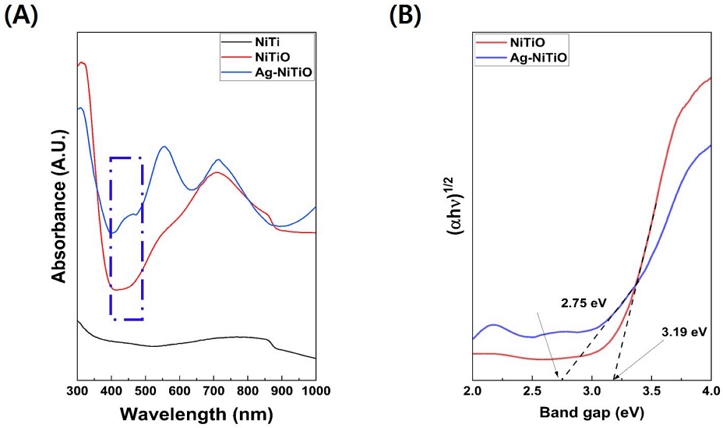
(A) Diffuse reflectance UV–Vis-NIR spectra and (B) band gap of experimental groups tested in this study. Diffuse reflectance UV-Vis-IR spectrophotometry dotted line indicates the light absorbance range of 1min coated Ag-NiTiO NTs was suitable for 470 nm visible light irradiation. As a result of Tauc plot analysis, the band gap of NiTiO nanotubes is 3.19 eV, so photocatalytic activity can be expected mainly in the UV region. However, the bandgap of Ag-NiTiO nanotubes decreases to 2.75 eV and shows a photocatalytic effect in the visible light region.
2. 메틸렌블루(Methylene blue: MB)의 광분해 특성
메틸렌블루(MB) 용액과 NiTiO 나노튜브, Ag-NiTiO 나노튜브 실험군의 광분해 특성을 조사하기 위하여 MB 수용액 상에서 측정한 결과, 470 nm 가시광선 광조사 30분 후 Ag-NiTiO 나노튜브는 대조군(NiTi) 보다 유의성 있게 낮았다(p<0.05). 따라서 Ag 나노입자가 코팅된 NiTiO 나노튜브에 가시광선 광조사를 조사하면 MB 분해에 영향을 미치는 것으로 확인되었다(p<00.05) (Figure 3).
3. 항균능 평가
그람양성균 Staphylococcus aureus (ATCC 25923, Manassas, VA, USA)와 그람음성균 Pseudomonas aeruginosa (PA14) 배양 24시간 후, S. aureus CFU 시험 결과 Ag-NiTiO 나노튜브 실험군이 대조군(NiTi) 보다 낮았으며 470 nm 가시광선을 광조사시 NiTiO 나노튜브, Ag-NiTiO 나노튜브 실험군이 유의성 있게 낮았다(p<0.05) [Figure 4(A)]. P. aeruginosa CFU 시험 결과, NiTiO 나노튜브, Ag-NiTiO 나노튜브 실험군이 대조군(NiTi) 보다 낮았고 특히 Ag-NiTiO 나노튜브 실험군은 470 nm 가시광선을 조사시 모든 실험군 중 유의성 있게 가장 낮은 CFU 값을 보였다(p<0.05) [Figure 4(B)].
4. 세포독성평가
470 nm 가시광선 광조사 유무에 따른 실험군의 생존과 사멸의 이미지 분석 결과, 가시광선 조사와 관계없이 hMSC 배양 24시간 및 48시간 배양 후 모든 실험군 간의 손상되거나 죽은 세포(적색 형광)가 거의 관찰되지 않았다. MTT 분석 결과, hMSC 배양 24시간 후 Ag-NiTiO 나노튜브의 실험군에서 세포의 증식이 증가하였으나 통계적으로 유의한 차이는 없었고(p>0.05), 470 nm 가시광선을 광조사한 hMSC 배양 24시간, 48시간 후 가시광선을 광조사한 군과 광조사하지 않은 군 모두 유의성은 없었다(p>0.05) (Figure 5).
고 찰
NiTi 합금의 자연 산화막은 매우 얇고 자가 치유 능력과 보호 능력이 부족하다는 점에서, 바이오 및 의료 분야에서의 활용에 한계가 있음을 알 수 있다. NiTi 합금의 자가 치유 능력이란 NiTi 합금 표면이 특히 체액과 접촉할 때 높은 안정성을 가진 조밀한 산화막으로 자발적으로 덮인다는 것을 의미하는 것으로 이 막은 NiTi 합금의 생체 적합성을 담당한다. 그럼에도 불구하고 NiTi 임플란트는 환경과 장기간 접촉하면 마모되기 쉽고 기계적 응력은 산화층을 파괴하여 조직과 직접 접촉하여 재료의 전기화학적 부식을 초래할 수 있다(30). NiTi 합금의 표면에 양극산화 처리로 생성된 NiTiO 나노튜브는 이러한 특성을 강화할 수 있는 가능성이 있다. 특히, 나노튜브 구조는 표면적을 크게 확장시켜 항균성 및 생체적합성을 높이는 데 기여할 수 있다(4, 25). 본 연구는 양극산화 기반 표면 개질을 통해 NiTiO 나노튜브를 형성하였고 Ag 나노입자로 코팅하여 표면 특성을 개선하였다. 양극산화는 티타늄과 그 합금의 표면 산화물 층의 두께를 증가시키기 위해 주로 사용되어 온 방법으로, 제조 공정의 매개변수(시간, 전압 및 전해질)를 변경하여 다양한 나노 구조를 갖는 산화물 층을 제조하는 데 널리 사용된다. 양극산화 중 전압이 높을수록 나노튜브의 직경은 증가하고 전해질 내 물의 양(0-2 vol.%)과 양극산화 시간은 나노튜브의 길이에 영향을 미친다(31). 나노튜브 길이가 1 µm 이상일 경우, 임플란트 식립시 박리되기 쉽기 때문에 본 연구에서는 전압은 25 V, 1시간의 양극산화 조건으로 길이가 (752.24±23.22) nm, 직경은 (42.41±4.33) nm 시편을 제조하여 안정성을 유지하도록 하였다. 또한, Ag 나노입자의 크기와 모양이 항균성에 중요한 영향을 미치므로, Ag 나노입자를 1분간 코팅하였다(32).
광 흡수 특성을 알아보기 위하여 확산반사 분광광도계로 분석한 결과, NiTiO 나노튜브의 광 흡수율은 자외선 영역(~380 nm)에서 강하게 흡수할 뿐만 아니라 가시광선(400-700 nm) 영역까지 넓게(broad) 광 흡수 밴드를 관찰할 수 있었다. Ag-NiTiO 나노튜브의 주요 흡수 스펙트럼은 340–370, 420–480, 500–570 및 650–800 nm에서 확인할 수 있었다. 340-370 nm에서 검출된 주요 피크는 NiTiO 나노튜브와 동일한 피크로 NiTiO 나노튜브의 가전자대에서 전도대로의 전형적인 전자 전이에서 비롯된 것으로 추측할 수 있었다. 420-480 nm의 피크는 Ag 나노입자의 국소표면 플라즈몬 모드가 형성된 것이고(33), 520-600 nm와 750-850 nm의 피크는 NiTiO 나노튜브 표면에 Ag가 증착되면서 Ag 나노입자가 커지게 되면서 단축과 장축의 광열 산란으로 광 흡수 파장이 장파장으로 이동하면서 것으로 보였다(34). NiTi 산화물인 NiTiO3는 가시광선 영역에 감응할 수 있는 낮은 에너지 밴드갭(2.2 eV)을 가지고 있어 높은 광촉매 활성을 보인다(20). 본 연구에서도 확산반사 측정값으로부터 계산된 Tauc 플롯결과, NiTiO 나노튜브는 3.19 eV 밴드갭(band gap)을 가지고 있는 반면 Ag-NiTiO 나노튜브는 2.75 eV를 갖는 것으로 450 nm에 해당되는 광촉매 밴드갭을 나타내어 가시광선 범위에서의 광촉매 효과를 발현하는 것을 확인하였다. 이에 470 nm의 가시광선에서 NiTiO 및 Ag-NiTiO 나노튜브 그룹의 광촉매 활성을 평가하기 위해 메틸렌 블루(methylene blue) 광분해 특성을 측정한 결과, 가시광선 광조사 30분 후, Ag-NiTiO 나노튜브 실험군에서 가장 우수한 MB 광분해 활성을 나타내어 광촉매로 활용될 수 있음을 짐작할 수 있었다. 그러나 ISO 10678, Fine ceramics (advanced ceramics, advanced technical ceramics)-Determination of photocatalytic activity of surfaces in an aqueous medium by degradation of methylene blue의 지침서(35)를 보면 광조사의 총 시간을 3시간으로 시험 용액의 완전 탈색에 필요한 시간을 초과하지 않아야 한다고 보고하여 광조사 추가 시간에 따른 광분해 특성에 대한 추가적인 연구가 필요할 것으로 사료된다.
Cioffi 와 Rai는(36) 높은 광촉매 특성은 항균 효율을 개선하다고 보고하였다. Ag 나노입자는 항균제로 사용되는 가장 인기 있는 무기 나노입자로, 다양한 생물 의학적 응용 분야를 가지고 있다(19). Ag 나노입자는 이온 형태와 비교할 때 높은 항균 활성을 보이는 것으로 밝혀졌고(37) 약물 내성 박테리아에 대한 잠재적인 항균제임이 입증되었다(24).
그람양성균 Staphylococcus aureus와 그람음성균 Pseudomonas aeruginosa은 다양한 임상 질환을 일으키는 세균으로, 그람양성균 S. aureus는 바이오필름을 형성하고, 그람음성균 P. aeruginosa는 병원 내 가장 흔한 병원체 중 하나로, 바이오필름의 형성과 함께 광범위한 독성 인자의 생성을 통해 병원성을 가지는 것으로 알려져 있다(38, 39). 따라서 이 연구에서는 항균 활성 시험을 위해 선택하여 사용하였다. 그람양성균(S. aureus)에 대한 CFU test로 항균 효과를 평가한 결과, 470 nm 가시광선 광조사시 Ag-NiTiO 나노튜브 실험군이 가장 유의성 있게 높았고(p<0.05) 그람음성균(P. aeruginosa)에 대한 항균 효과는 Ag-NiTiO 나노튜브 실험군이 다른 실험군에 비해 매우 높은 항균 효과를 보였고(p<0.05) 470 nm 가시광선 광조사시 Ag-NiTiO 나노튜브 실험군이 모든 실험군 중 유의성 있게 가장 낮은 CFU 값을 보였다(p<0.05). 본 연구에서는 NiTiO 나노튜브와 Ag 나노입자의 조합이 그람양성균 S. aureus와 그람음성균 P. aeruginosa에 우수한 항균 효과를 나타내었다. 특히, 470 nm의 가시광선 조사 후 S. aureus 균주에 대한 Ag-NiTiO 나노튜브 실험군에서 뛰어난 항균 효과가 나타났으며, 이는 Ag 나노입자의 플라즈몬 효과와 광촉매 특성이 상호작용하여 시너지 효과를 발휘한 결과로 짐작할 수 있었다. 그러나 P. aeruginosa 균주는 Ag-NiTiO 나노튜브 실험군에서의 시너지 효과가 명확하게 나타나지 않아 추가적인 연구가 필요하다. 또한 이번 결과와 유사하게 Mie 등(40)은 8가지 미생물에 대한 Ag 나노입자의 항균 활성 평가 실험을 한 결과 Ag 나노입자가 그람음성 박테리아에 대해 잠재적인 항균 활성을 보였다고 보고하였고 Bera 등(32)은 그람양성균(Staphylococcus epidermidis 및 Bacillus megaterium)과 그람음성균(P. aeruginosa)에 대한 Ag 나노입자의 크기와 모양이 항균 활성을 제어하고 더 작은 입자가 세포벽을 쉽게 관통하여 향상된 항균 활성을 보인다고 보고하였다. Matejka와 Tokarsk(41)는 자외선(UV)이나 가시광선 광에 의해 항균 활성 효과가 유도되는 경우 금속 또는 금속산화물의 광촉매로 보고하였다.
항균 활성의 중요성에도 불구하고 NiTi 표면의 생체적합성은 상실되어서는 안 된다. Ag 나노입자의 세포독성은 논란의 여지가 충분히 있으며 생물학적 매체에서의 Ag 나노입자 거동에 대한 더 깊은 이해가 필요하다. 특정 농도에서 다양한 독성 수준이 나타날 뿐만 아니라 그럼에도 불구하고 여러 세포에 대한 세포 독성이 검출되지 않는 것으로 보고되었다(42, 43). 본 연구에서는 470 nm 가시광선 광조사 유·무에 따른 실험군의 생존과 사멸의 이미지 분석 결과, 가시광선 조사와 관계없이 hMSC 배양 24시간 및 48시간 배양 후 모든 실험군 간의 손상되거나 죽은 세포(적색 형광)가 거의 관찰되지 않았고, MTT 분석 결과는 24시간과 48시간 배양 후 실험군 간에 유의미한 차이가 없음을 보여주었다(p>0.05). 이와 같은 결과로 보아 NiTiO 나노튜브와 Ag-NiTiO 나노튜브는 세포 독성이 없는 것으로 판단된다.
결 론
본 연구는 NiTi 합금 표면에 NiTiO 나노튜브를 제조하고 Ag 나노입자를 코팅하여 표면 분석 및 광학적 특성을 평가하고, 가시광선 기반 광촉매 항균 활성과 생체적합성을 평가하여 다음과 같은 결과를 얻었다.
- 1. NiTiO 나노튜브와 Ag-NiTiO 나노튜브의 FE-SEM을 관찰한 결과, 평균 직경은 각각 42.41±4.33 및 50.91±6.59 nm, 높이는 752.24±23.22 nm를 나타내었고 Ag 나노입자는 크기가 불규칙하고 나노입자끼리 뭉쳐진 큰 입자의 형태가 두드러지게 관찰되었다.
- 2. NiTiO 나노튜브와 Ag-NiTiO 나노튜브의 메틸렌 블루(methylene blue) 광분해 특성을 측정 한결과, 470 nm 가시광선 조사 30분 후 대조군(NiTi) 보다 Ag-NiTiO 나노튜브 실험군에서 가장 우수한 MB 광분해 활성을 나타내었다(p<0.05).
- 3. 그람양성균 S. aureus를 이용한 CFU 결과, 대조군(NiTi)에 비해 Ag-NiTiO 나노튜브 실험군에서 우수한 항균 효과를 나타내었고, 470 nm의 가시광선 조사시 대조군(NiTi)에 비해 NiTiO 나노튜브와 Ag-NiTiO 나노튜브 실험군에서 항균 효과를 나타내었다(p<0.05).
- 4. 그람음성균 P. aeruginosa를 이용한 CFU 결과, 대조군(NiTi)에 비해 Ag-NiTiO 나노튜브 실험군에서 우수한 항균 효과를 나타내었다(p<0.05).
- 5. MTT 분석 결과, hMSC 배양 24시간 후 Ag-NiTiO 나노튜브의 실험군에서 세포의 증식이 증가하였으나 통계적으로 유의한 차이는 없었고(P>0.05), 470 nm 가시광선을 조사한 hMSC 배양 24시간, 48시간 후 가시광선을 광조사한 군과 대조군 모두 유의미한 차이는 보이지 않아 세포독성은 없는 것으로 보였다(p>0.05).
따라서 본 연구를 통하여 Ag-NiTiO 나노튜브는 그람양성균 S. aureus와 그람음성균 P. aeruginosa에 대해 우수한 항균 효과를 나타내었고 특히, 그람양성균 S. aureus는 Ag-NiTiO 나노튜브와 가시광선 광조사 간의 시너지 효과를 뚜렷하게 나타내어 가시광선 기반 광촉매 항균 활성 효과를 촉진하는 것으로 생체 의학 재료로 치과에서 응용할 수 있는 많은 가능성이 있다고 사료된다.
Acknowledgments
이 논문은 2024학년도 원광대학교의 교비지원에 의해 수행됨
References
-
Li YC, Wang FH, Shang JX. Ab initio study of oxygen adsorption on the NiTi (110) surface and the surface phase diagram. Corros Sci. 2016;106:137-46.
[https://doi.org/10.1016/j.corsci.2016.01.033]

-
Gill P, Musaramthota V, Munroe N, Datye A, Dua Haider W, McGoron A, Rokicki R. Surface modification of Ni–Ti alloys for stent application after magneto electropolishing. Mater Sci Eng C. 2015;50:37-44.
[https://doi.org/10.1016/j.msec.2015.01.009]

-
Jenko M, Godec M, Kocijan A, Rudolf R, Dolinar D, Ovsenik M, et al. A new route to biocompatible Nitinol based on a rapid treatment with H2/O2 gaseous plasma. Appl Surf Sci. 2019;473:976-84.
[https://doi.org/10.1016/j.apsusc.2018.12.140]

-
Wang GF, Li JH, Lv KG, Zhang WJ, Ding X, Yang GZ, Liu XY, Jiang XQ. Surface thermal oxidation on titanium implants to enhance osteogenic activity and in vivo osseointegration. Sci Rep. 2016;6:31769.
[https://doi.org/10.1038/srep31769]

-
Sinha S, Priyadarshani J, Devi KB, Kishore AV, Das P, Chanda A, Das SM. Roy M, Nandi SK. In vivo performance analysis of silanized and coated nitinol wires in biological environment. J Mater Res. 2020;35:1262-270.
[https://doi.org/10.1557/jmr.2020.101]

-
Hanawa T. Titanium–Tissue Interface Reaction and Its Control With Surface Treatment. Front Bioeng Biotech. 2019;7:170.
[https://doi.org/10.3389/fbioe.2019.00170]

-
Cherian AM, Nair SV, Maniyal V, Menon D. Surface engineering at the nanoscale: A way forward to improve coronary stent efficacy. Apl Bioeng. 2021;5:021508.
[https://doi.org/10.1063/5.0037298]

-
Markhoff J, Krogull M, Schulze C, Rotsch C, Hunger S, Bader R. Biocompatibility and Inflammatory Potential of Titanium Alloys Cultivated with Human Osteoblasts, Fibroblasts and Macrophages. Materials. 2017;10(1)52.
[https://doi.org/10.3390/ma10010052]

-
Liu Y, Ren Z, Bai L, Zong M, Gao A, Hang R, et al. Relationship between Ni release and cytocompatibility of Ni-Ti-O nanotubes prepared on biomedical NiTi alloy. Corros Sci. 2017;123:209-16.
[https://doi.org/10.1016/j.corsci.2017.05.006]

-
Hang R, Liu Y, Liu S, Bai L, Gao A, Zhang X, et al. Size-dependent corrosion behavior and cytocompatibility of Ni–Ti–O nanotubes prepared by anodization of biomedical NiTi alloy. Corros Sci. 2016;103:173-80.
[https://doi.org/10.1016/j.corsci.2015.11.016]

-
Abbas A, Hung HY, Lin PC, Yang KC, Chen MC, Lin HC, Han YY. Atomic layer deposited TiO2 films on an equiatomic NiTi shape memory alloy for biomedical applications. J Alloys and Compounds. 2021;886:15.
[https://doi.org/10.1016/j.jallcom.2021.161282]

-
Zhang Z, Wang Q, Xu H, Zhang W, Zhou Q, Zeng H, Yang J, Zhu J, Zhu X. TiO2 nanotube arrays with a volume expansion factor greater than 2.0: Evidence against the field-assisted ejection theory. Electrochem Commun. 2020;114:106717.
[https://doi.org/10.1016/j.elecom.2020.106717]

-
Zhou Q, Tian M, Ying Z, Dan Y, Tang F, Zhang J, Zhu X. Dense films formed during Ti anodization in NH4F electrolyte: Evidence against the field-assisted dissolution reactions of fluoride ions. Electrochem Commun. 2020;111:106663.
[https://doi.org/10.1016/j.elecom.2020.106663]

-
Gao A, Hang R, Bai L, Tang B, Chu PK. Electrochemical surface engineering of titanium based alloys for biomedical application. Electrochim Acta. 2018;271:699-718.
[https://doi.org/10.1016/j.electacta.2018.03.180]

-
Hang R, Huang X, Tian L, He Z, Tang B. Preparation, characterization, corrosion behavior and bioactivity of Ni2O3-doped TiO2 nanotubes on NiTi alloy. Electrochim Acta. 2012;70:382-93.
[https://doi.org/10.1016/j.electacta.2012.03.085]

-
Lee PP, Cerchiari A, Desai TA. Nitinol-based nanotubular coatings for the modulation of human vascular cell function. Nano Lett. 2014;14:5021-8.
[https://doi.org/10.1021/nl501523v]

-
Lee PP, Desai TA. Nitinol-based nanotubular arrays with controlled diameters upregulate human vascular cell ECM production. ACS Biomater Sci Eng. 2016;14:409-14.
[https://doi.org/10.1021/acsbiomaterials.5b00553]

-
Pei DN, Gong L, Zhang AY, Zhang X, Chen JJ, Mu Y, Yu HQ. Defective titanium dioxide single crystals exposed by high-energy {001} facets for efficient oxygen reduction. Nat Commun Oct. 2015;23:8696.
[https://doi.org/10.1038/ncomms9696]

-
Allahverdiyev AM, Abamor ES, Bagirova M, Rafailovich M. Antimicrobial effects of TiO2 and Ag2O nanoparticles against drug-resistant bacteria and leishmania parasites. Future Microbiol 2011;6:933-40.
[https://doi.org/10.2217/fmb.11.78]

-
Qu Y, Zhou W, Ren Z, Du S, Meng X, Tian G, et al. Facile preparation of porous NiTiO3 nanorods with enhanced visible-light-driven photocatalytic performance. J Am Chem. 2012;22(32):16471-6.
[https://doi.org/10.1039/c2jm32044d]

-
Shu X, He J, Chen D. Visible-Light induced Photo-catalyst Based on Nickel Titanate Nanoparticles. Ind Eng Chem Res. 2008;47:4750-3.
[https://doi.org/10.1021/ie071619d]

-
Malarkodi C, Rajeshkumar S, Paulkumar K, Vanaja M, Gnanajobitha G, Annadura I. Biosynthesis and Antimicrobial Activity of Semiconductor Nanoparticles against Oral Pathogens. Bioinorg Chem Appl. 2014;2014:1-10.
[https://doi.org/10.1155/2014/347167]

-
Chen J, Ashames A, Buabeid MA, Fahelelbom KM, Ijaz M, Murtaza G. Nanocomposites drug delivery systems for the healing of bone fractures. Int J Pharmaceut. 2020;585:119477.
[https://doi.org/10.1016/j.ijpharm.2020.119477]

-
Zinjarde SS. Bio-inspired nanomaterials and their applications as antimicrobial agents. Chronicles Young Sci. 2012;3:1-74.
[https://doi.org/10.4103/2229-5186.94314]

-
Sun Y, Rong Y, Zhao Y, Yao X, Hang R. The influence of substrate electropolishing on anodization behavior, corrosion resistance, cytocompatibility and antibacterial ability of NiTi alloy. Mater Lett. 2020;268:127631.
[https://doi.org/10.1016/j.matlet.2020.127631]

-
Tauc J, Grigorovici R, Vancu A. Optical properties and electronic structure of amorphous germanium. Phys Status Solidi B. 1966;15(2):627-37.
[https://doi.org/10.1002/pssb.19660150224]

-
Singh L and Samra KS. Opto-structural characterization of proton (3MeV) irradiated polycarbonate and polystyrene. Radiat Phys Chem. 2008;77(3):252-58.
[https://doi.org/10.1016/j.radphyschem.2007.05.009]

-
Husain S, Alkhtaby LA, Giorgetti E, Zoppi A, Miranda MM. Effect of Mn doping on structural and optical properties of sol gel derived ZnO nanoparticles. J Lumin. 2014;145:132-7.
[https://doi.org/10.1016/j.jlumin.2013.07.003]

-
Rahme LG, Stevens EJ, Wolfort SF, Shao J, Tompkins RG, Ausubel FM. Common virulence factors for bacterial pathogenicity in plants and animals. Science. 1995;268:1899-902.
[https://doi.org/10.1126/science.7604262]

-
Hang R, Zhao F, Yao X, Tang B, Chu PK. Self-assembled anodization of NiTi alloys for biomedical applications. Appl Surf Sci. 2020;517:146118.
[https://doi.org/10.1016/j.apsusc.2020.146118]

-
Alipal J, Lee TC, Koshy P, Abdullah HZ, Idris MI. Evolution of anodised titanium for implant applications. Heliyon. 2021,7(7),e07408.
[https://doi.org/10.1016/j.heliyon.2021.e07408]

-
Bera RK, Mandal SM, Raj CR. Antimicrobial Activity of Fluorescent Ag Nanoparticles. Lett Appl Microbiol. 2014;58:520-6.
[https://doi.org/10.1111/lam.12222]

-
Gupta R, Dyer MJ, Weimer WA. Preparation and characterization of surface plasmon resonance tunable gold and silver films. J Appl Phys. 2002;92:5264.
[https://doi.org/10.1063/1.1511275]

-
Osawa M. Surface-Enhanced Infrared Absorption. Top Appl Phys. 2001;81:163-87.
[https://doi.org/10.1007/3-540-44552-8_9]

- ISO 10678, Fine ceramics (advanced ceramics, advanced technical ceramics)-Determination of photocatalytic activity of surfaces in an aqueous medium by degradation of methylene blue, Geneva, Switzerland, 2010.
-
Cioffi N. Rai M. Nano-antimicrobials, in: Nicola Cioffi, M. Rai (Eds.), Synthesis and Characterization of Novel Nano Antimicrobials, Springer, Berlin Heidelberg, 2012.
[https://doi.org/10.1007/978-3-642-24428-5]

-
Jo YK, Kim BH, Jung G. Antifungal activity of silver ions and nanoparticles on phytopathogenic fungi. Plant Dis. 2009;93:1037-43.
[https://doi.org/10.1094/PDIS-93-10-1037]

-
Pang Z, Raudonis R, Glick BR, Lin TJ, Cheng Z. Antibiotic resistance in Pseudomonas aeruginosa: mechanisms and alternative therapeutic strategies. Biotechnol Adv 2019;1:177-92.
[https://doi.org/10.1016/j.biotechadv.2018.11.013]

-
Mack D, Becker P, Chatterjee I, Dobinsky S, Knobloch JK, Peters G, Rohde H, Herrmann M. Mechanisms of biofilm formation in Staphylococcus epidermidis and Staphylococcus aureus: functional molecules, regulatory circuits, and adaptive responses. Int J Med Microbiol. 2004;294:203-12.
[https://doi.org/10.1016/j.ijmm.2004.06.015]

-
Mie R, Samsudin MW, Din LB, Ahmad A, Ibrahim N, Adnan SNA. Synthesis of silver nanoparticles with antibacterial activity using the lichen Parmotrema praesorediosum. Int J Nanomedicine. 2014;9:121-7.
[https://doi.org/10.2147/IJN.S52306]

-
Mateejka V, Tokarsk J. Photocatalytical nanocomposites. J Nanosci Nanotechnol. 2014;14(2):1597-616.
[https://doi.org/10.1166/jnn.2014.9081]

-
Chernousova S, Epple M. Angew. Silver as antibacterial agent: ion, nanoparticle, and metal. Chem Int Ed Engl. 2013;52:1636-53.
[https://doi.org/10.1002/anie.201205923]

-
Liao J, Anchun M, Zhu Z, Quan Y. Antibacterial titanium plate deposited by silver nanoparticles exhibits cell compatibility. Int J Nanomedicine. 2010;5:337-42.
[https://doi.org/10.2147/IJN.S9518]