
퍼티형과 파우더형 칼슘 실리케이트 시멘트의 세포독성 비교 연구
 ; Dohyun Cho
; Dohyun Cho ; Ji Hyeon Yoon
; Ji Hyeon Yoon ; Yeonjoo Kang
; Yeonjoo Kang ; Quang Canh Vo
; Quang Canh Vo ; Gitae Son
; Gitae Son ; Hongjoo Park
; Hongjoo Park ; Hyeong-Cheol Yang*
; Hyeong-Cheol Yang*
초록
칼슘 실리케이트 시멘트 (CSC)의 세포독성은 시멘트의 경화 정도에 따라 달라질 수 있다. 본 연구에서는 One-Fil PT (OFPT), Well-Root PT (WRPT), 파우더형 칼슘 실리케이트 시멘트 (pCSC)의 경화 시간 및 세포 독성을 평가 비교하였다. 경화시간은 Gillmore 팁을 사용하여 초기 경화시간과 최종 경화시간을 측정하였다. 세포 독성은 한천 확산법으로 혼합 직후와 48시간 경화 후, 용출법으로 12시간, 24시간, 48시간 경화 후 측정하였다. 초기 및 최종 경화 시간은 OFPT, WRPT, pCSC 순으로 길었다. 한천확산법에서는 OFPT와 WRPT가 통계적으로 유의하게(p<0.05) pCSC보다 세포독성이 적었으며, 48시간 경화 후에는 모든 실험군에서 세포독성이 관찰되지 않았다. 용출법에서는 50% 희석된 pCSC 용출물이 세포 생존율을 유의하게 감소시킨 반면, OFPT와 WRPT는 12시간 경화 후 세포독성을 보이지 않았으며, 48시간 경화 후 75% 용출물 농도에서 OFPT는 세포독성을 보였지만 WRPT는 독성이 없는 것으로 나타났다. 이 연구에 사용된 퍼티형 CSC은 pCSC보다 낮은 세포독성을 보였으며, 이는 상대적으로 짧은 경화시간에 기인하는 것으로 판단된다.
Abstract
The cytotoxicity of calcium silicate cement (CSC) may depend on the degree of curing of the cement. The purpose of this study was to evaluate the setting time and cytotoxicity of One-Fil PT (OFPT), Well-Root PT (WRPT), and laboratory-made powder-type calcium silicate cement (pCSC). Initial and final setting times were measured using a Gillmore tip. Cytotoxicity was determined immediately after mixing and after 48 h of setting by the agar diffusion method, and after 12, 24, and 48 h of setting by the extraction method. The initial and final setting times were shorter in the order of OFPT, WRPT, and pCSC. In the agar diffusion method, OFPT and WRPT showed statistically significant (p<0.05) less toxicity than pCSC, and no cytotoxicity was observed after 48 h of setting. In the extraction method, 50% diluted pCSC extract significantly reduced cell viability, while OFPT and WRPT did not show cytotoxicity after 12 h of setting. After 48 h of setting, OFPT was cytotoxic at a concentration containing 75% extract, while WRPT was not toxic. The putty-type CSCs used in this study showed lower cytotoxicity than pCSCs, which is likely due to their relatively short setting time.
Keywords:
Calcium silicate cements, Putty-type, Cytotoxicity, Setting times키워드:
칼슘 실리케이트 시멘트, 퍼티형, 세포독성, 경화시간서 론
포틀랜드 시멘트는 1824년 Aspdin에 의해 처음 발명되었고(1), 초기에는 건축물 자재로 사용되었다. 1878년 Witte는 포틀랜드 시멘트를 이용한 치아 근관 충전을 보고하였다(2). Mineral trioxide aggregate (MTA)는 1993년 Torabinejad가 75 wt.% 포틀랜드 시멘트, 20 wt.% 산화 비스무트, 5 wt.% 황산 칼슘 이수화물, 석고로 이루어진 MTA를 개발하고 근관 충전재로 소개하였다(3). 이후 MTA는 ProRoot MTA (Dentsply, Tulsa, USA)라는 상품명으로 생산되고 있다. MTA는 수분이 있는 상태에서 경화되고 우수한 근관 천공 수리(4), 치근단형성술, 생체 적합성, 경조직 재생능력, 향균 능력을 보여 치수복조술, 근관 실러에 이르기까지 다양하게 적용되어 왔다(5, 6). 그러나 MTA는 경화시간이 길고, 치아의 변색, 조작의 어려움이 있었으며 이러한 단점을 극복하기 위해 다양한 제품이 개발되었다. 긴 경화시간을 극복하기 위해 석고를 제거(7), sodium hypochlorite(8), calcium chloride(9), calcium aluminate를 첨가하거나(10), 입자의 크기를 작게 하였고(11), 세포독성을 보이고 변색을 야기하는 bismuth oxide는 zirconium oxide로 대체하는 방법이 제시되었다(12).
기존 MTA의 분말/액체 시스템은 술자에 따라 민감하고 혼합 비율에 따라 시멘트의 물리화학적 특성이 변한다(13). 균일한 혼합과 조작의 어려움을 극복하기 위해 premixed calcium silicate cements들이 제안되었고 2007년 최초의 premixed calcium silicate cement인 iRoot SP (Innovative BioCeramix Inc., Vancouver, Canada)가 주사기 형태로 출시되었다. 이후 2008년 퍼티형태의 premixed calcium silicate cement인 EndoSequence Root Repair Material (Brasseler, Savannah, USA)이 출시되었다(14).
최근 다양한 형태의 premixed calcium silicate cements들이 개발되었고 One-Fil PT (OFPT) (Mediclus, Cheongju, Korea)는 tricalcium aluminate, tricalcium silicate, dicalcium silicate, zirconium oxide, polyethylene glycol의 화합물이며 2024년 Donfrancesco 등은 단근치에서 치근단 역충전후 변연 적합성과 체적 변화를 관찰한 연구에서 우수한 체적 안정성을 보이고 변연 적합성은 이전 역충전에 사용된 재료와 유사하다고 보고하였다(15). Well-Root PT (WRPT) (Vericom, Chuncheon, Korea)는 calcium sulfate dihydrate, calcium sodium phosphosilicate, zirconium oxide, polyethylene glycol, polypropylene glycol 등의 화합물로 치수복조술에 적용시 우수한 색 안정성을 보인다고 하였다(16). 미성숙 영구치에서 치수절단술에서 WRPT의 적용은 MTA angelus와 비교 시 통계적인 차이가 없다고 보고된 바 있다(17). 또한 WRPT의 미세누출은 적었지만 압축강도 또한 낮은 것으로 보고된 바 있으며(18), Chae 등은 WRPT는 생체적합성과 생물학적 활성 측면에서 ProRoot MTA, Biodentine (Septodont, Saint-Maur-des-fosses, France)과 유사하다고 하였다(19).
퍼티형의 premixed calcium silicate cements는 근단 및 치근의 천공에서 치근 주위의 조직과 직접 접촉하기 때문에 세포독성은 중요한 평가 항목이다. 구강내에서 경화되는 재료는 경화되기 전에 치료 부위에 적용되어 독성성분이 조직으로 방출될 수 있고, 경화 후에도 침출성 독성 물질이 방출될 수 있다. 이러한 이유로 calcium silicate cement (CSC)는 재료의 경화 전과 후에 모두 평가해야 한다(20, 21). 실제로 화학적으로 유사한 성분의 퍼티형과, 페이스트형의 CSC가 경화시간에 따라 독성에 영향을 준다는 보고도 있다(22).
지금까지 경화시간을 고려한 OFPT, WRPT의 독성평가는 거의 없는 실정이다. 한천확산법은 민감도가 낮은 방법이지만 세포의 경화가 진행되는 과정에서 용출 되는 독성 물질을 평가할 수 있다. 이에 반해 용출법은 초기에 경화되는 과정에서 용출물의 독성을 평가할 수 없다. 따라서 본 연구에서는 파우더 형 calcium silicate cement (pCSC)와 퍼티형 시멘트인 OFPT, WRPT에 대하여 한천확산법과 용출법으로 경화시간에 따른 세포독성의 차이를 평가하고자 한다. 본 연구의 귀무가설은 퍼티형과 파우더형 CSC의 세포독성은 차이가 없다는 것이다.
재료 및 방법
1. Calcium silicate cements 디스크 제조 및 용출
pCSC는 이전의 방법에 따라 시약들은 ACS grade를 사용하여 제조하였다(23). Calcium carbonate (CaCO3, Daejung, Siheung, Korea) 71%, silicon dioxide (SiO2, Junsei Co., Tokyo, Japan) 25%, aluminum oxide (Al2O3, Junsei Co.) 4%를 V-mixer (J-VM7, JISICO, Seoul, Korea)에서 혼합하고, 시약:증류수 = 1 : 0.28, 혼수비에 맞춰 혼합하여 원형의 평균 직경 20 mm 클링커(Clinker) 형성한 후, 오븐 (S-model, Hantech, Gunpo, Korea)에서 100℃에서 24시간 동안 건조하였다. 건조된 혼합물을 오븐에서 각각 800–900℃에서 사전 소성하였고 1,300–1,450℃에서 어닐링 하였다. 이후 zirconia 볼을 이용하여 planetary ball mill (PM 400, Retsch, Haan, Germany)에서 그라인딩 처리하고 400 mesh의 vibratory sieve shaker (AS 200, Retsch)를 통과하여 시멘트를 제조하였다. 제조한 pCSC 입자의 직경은 입자 크기 분석기(Mastersizer‑2000MU, Malvern Instruments, Malvern, UK)를 사용하여 측정했다. pCSC 입자의 평균 직경은 (3.21±0.825) µm으로 관찰되었다. 각 재료의 조성은 Table 1과 같다. pCSC 분말은 사용 전 ethylene oxide 가스로 멸균하였다. pCSC 분말과 멸균 증류수를 3:1의 비율로 상온에서 혼합하고, OFPT와 WRPT를 제조사의 지시에 따라 사용하였다. 금속 몰드를 이용하여 디스크 형태로 (직경 20 mm, 두께 1.5 mm) 형성 후 (n=3), 경화시 수분 공급을 위해 24시간 전에 증류수에 침전시킨 경석고 위에서 37℃, 95% 습도 환경에서 12, 24, 48시간 경화한 후, ISO 10993-12에 준하여 용출액을 준비하였다(24).
2. 경화시간 측정
초기 경화시간과 최종 경화시간은 각각 ISO 6876:2012과 ISO 9917-1 : 2007에 따라 측정했다(25, 26). 퍼티형 재료의 수화에 필요한 충분한 수분을 공급하기 위하여 직경 10 mm, 높이 1 mm의 경석고 몰드를 사용하였으며, 석고 몰드를 37℃에서 24시간 동안 물에 담근 다음, OPFT와 WRPT를 몰드에 넣었다. pCSC는 증류수(DW)와 3:1의 비율로 혼합하였다. 초기 경화시간 측정을 위하여 무게 100 g, 직경 2 mm의 Gillmore 팁을 사용하였고, 최종경화시간 측정에는 무게 400 g, 직경 1 mm 팁을 사용하였다. 측정시간 동안 몰드는 습도 95%, 온도 37℃의 인큐베이터에 보관하였다.
3. 한천확산법 시험
한천확산법 측정을 위하여 마우스 배아 유래 섬유아세포(NIH 3T3, ATCC, Manassas, VA, USA)를 fetal bovine serum (FBS, Welgene, Daegu, Korea)과 항생제(Antibiotic-Antimycotic Solution, Welgene)를 포함한 Modified Eagle’s Media (MEM) 배지(Welgene)에 1.5×105/mL 농도로 희석한 후, 6-well plate의 각 well에 2 mL씩 접종하였다. 37℃, 5% CO2 조건하에서 24시간 배양하고 80% 이상의 배양세포 단층형성을 확인한 후, 각 well의 배지를 1%의 한천을 포함한 신선 배지로 교환하였다. 세포염색을 위하여 한천평판에 0.008% Neutral Red (Sigma-Aldrich, St. Louis, USA)를 포함한 phosphate buffered saline (pH 7.4) 2 mL을 넣고 37℃, 5% CO2 조건하에서 30분 배양하였다. 흡수되지 않은 염색액을 제거하고 시료를 평판위에 위치시키고 24시간 배양하였다. 음성대조군과 양성대조군은 각각 High Density Polyethylene Film (Hatano Research Institute, Kanagawa, Japan), ZDEC Polyurethan Film (Hatano Research Institute)을 사용하였으며 세포독성의 판단은 ISO 10993-5에서 제시한 Table 2에 따라 실시하였다(27).
4. 용출법 시험
용출법 측정을 위해 시험물질군을 12, 24, 48시간 동안 경화시키고, ISO 10993-12에 준하여 용출액을 조제하였다(24). 용출은 시료 디스크 1 g 당 5 mL 세포배양 배지에서 3일 동안 37℃에서 실시였다. 용출 완료 후, 배지로 연속 희석하여 100, 75, 50, 25, 10%의 용출 희석액을 조제하였다. 세포독성 측정을 위해 NIH 3T3를 10% FBS와 항생제가 포함된 Dulbecco’s Modified Eagle’s Media (DMEM) 배지(Welgene)로 1 mL당 105개로 희석하고 96 well plate의 각 well에 100 µL 접종하였다. 접종 후 37℃, 5% CO2 조건하에서 24시간 동안 배양하고 배지를 제거 후, 용출액과 용출 희석액을 각 well에 100 µL 첨가하고 24시간 배양하였다. 음성대조군은 용출액이 포함되지 않은 배지를 사용하였다. 세포독성 평가를 위하여 EZ-Cytox Cell Viability Assay Kit (DoGenBio, Suwon, Korea)로 미토콘드리아 dehydrogenase 활성을 측정하였다. 각 well의 배지를 10% EZ-Cytox 용액이 포함된 신선 배지로 교환하고 37℃에서 4시간 반응시킨 후 plate reader (Sunrize, TECAN, Salzburg, Austria)로 450 nm (Reference 650 nm)에서 흡광도를 측정하였다.
세포생존률은 다음의 식에 따라 계산하였다.
- ODs: 시험물질로 처리한 세포의 OD값
- ODnc: 음성대조군으로 처리한 세포의 OD값
5. 통계분석
데이터의 통계 분석은 SPSS Statistics 29.0 (IBM, Armonk, NY, USA)를 사용하여 일원 분산 분석과 Tukey 사후 분석을 통해 통계적으로 검정되었다. 모든 통계적 유의 수준은 p<0.05로 수행하였다. 통계분석이 수행된 실험 결과는 평균 ± 표준편차의 형태로 표현되었다. 경화시간 측정은 독립적인 4회의 시험 결과의 평균이며, 한천확산법 시험과 용출법 시험은 3회의 시험 결과의 평균이다.
결 과
1. 경화시간
초기 경화시간은 OFPT, WRPT, pCSC 순으로 길었으며 각각 (43.4±0.6)분, (57.6±1.8)분, (65.7±1.7)분으로 세 그룹은 통계적으로 유의한 차이를 보였다 (Table 3). OFPT와 WRPT의 최종경화시간은 각각 82.0±1.4분, 87.3± 2.0분으로 유사한 결과를 보였으나, pCSC는 276.2±2.5분으로 퍼티형 시멘트에 비하여 3배 이상의 경화시간이 관찰되었다.
2. 한천확산법
시멘트의 경화시간과 세포독성의 연관성을 알아보고자 경화시간을 달리하여 시료의 독성을 관찰하였다. 세포독성 관찰을 위하여 우선 간접측정방법인 한천확산법을 이용하였으며, 24시간과 48시간 경화한 시료를 사용하였다. 24시간 경화시료의 경우 탈색 zone의 크기가 OFPT는 (1.49±0.10) mm, WRPT는 (1.55±0.76) mm로서 ZDEC 필름 양성 대조군과 유사한 정도의 독성이 나타났다 (Figure 1). pCSC의 탈색 zone의 크기는 2.29 mm로 가장 심한 독성이 발생하였다. 따라서 모든 시험군은 grade 4의 세포독성으로 판단된다. 48시간 경화된 시료의 경우, 모든 시험군의 주변에 zone이 나타나지 않았으며, 시료 밑의 세포 또한 정상적으로 염색이 되었으므로 Table 2의 기준에 의하여 grade 0의 세포독성이라고 할 수 있다. 그러므로 같은 시료임에도 불구하고 경화시간에 따라 grade 0부터 grade 4까지 결과가 달라질 수 있다.
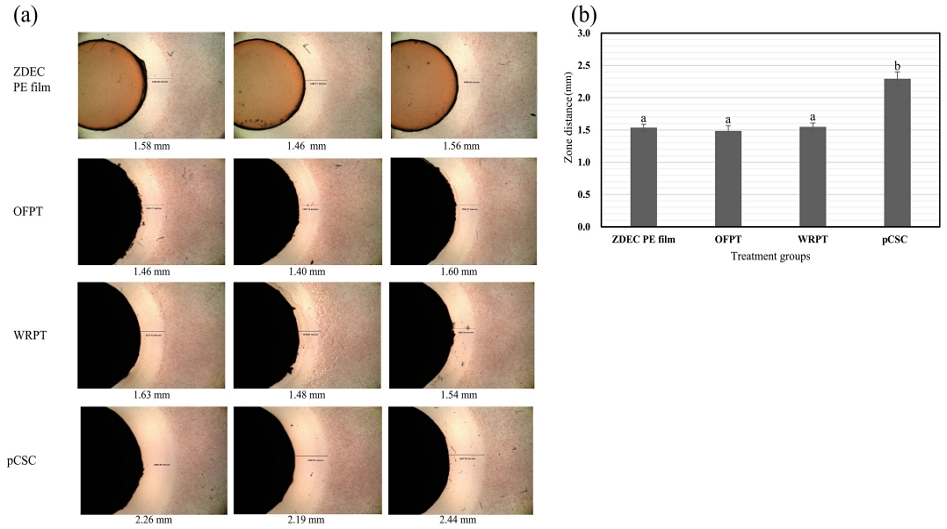
Cytotoxicity agar diffusion assay of calcium silicate cements (CSCs). CSCs were hydrated for 24 h. (a) The cytotoxicity was observed after incubation with CSCs for 24 h. The size of discolored zone was measured microscopically. (b) Average zone distance of three samples. Error bar indicates a standard deviation.a,b Different superscript letters mean significant difference between groups (P<0.05).
3. 용출법
용출법에 의한 세포독성 결과는 Figure 2와 같다. 시료의 경화는 각각 12, 24, 48시간 수행하였다. OFPT는 12시간 경화된 시료의 용출물의 농도가 75% 이상에서 세포독성이 나타났으며, 24시간 경화 조건에서도 유사한 결과를 보였다. 48시간 경화 후에는 75% 농도에서 세포독성이 나타나지 않았으며, 100% 농도에서만 20% 이하로 세포활성이 감소하였다. WRPT는 12시간 경화된 시료의 용출액 농도가 75%에서 약 50%의 세포활성 감소를 초래하였으며, 24시간과 48시간 경화된 시편도 75% 농도에서 세포활성의 감소를 보였다. WRPT의 세포독성은 12시간 경화된 시편의 경우 75% 농도에서 세포독성이 나타났다. 세포독성의 정도는 OFPT 보다 약하게 발생하였다. 24시간 경화된 WRPT는 75% 농도에서 세포의 활성이 약 80% 정도로 약한 세포독성이 나타났으며, 통계적으로는 음성대조군과 유의한 차이를 보이지 않았다. 48시간 경화된 WRPT 시편은 용출액 농도 75%에서 62% 세포활성이 나타났다. 24시간 경화 시편의 결과와 비교 시, 48시간 경화 시편의 세포독성이 약간 강하게 나타났지만, 표준오차의 범위를 고려하여 두 조건의 세포독성의 차이는 크지 않는 것으로 판단된다. 즉, WRPT는 OFPT보다 경화시간의 영향을 적게 받는 것으로 보인다. pCSC는 12시간 경화조건에서 50%의 농도로 세포를 처리한 경우, 세포활성이 12.7%로 감소하였다. 25%에서는 세포독성이 나타나지 않았다. 24시간 경화 시 pCSC는 75% 이상에서 세포독성이 나타났으며, 48시간 경화 후 세포독성은 24시간 경화된 시료와 유사한 결과를 보였다. 시험된 세가지 시멘트 중에서는 pCSC가 세포독성이 가장 강한 것으로 나타났으며, WRPT와 OFPT는 유사한 세포독성을 보였으며, 경화시간에 따른 세포독성의 변화에는 차이를 보였다.
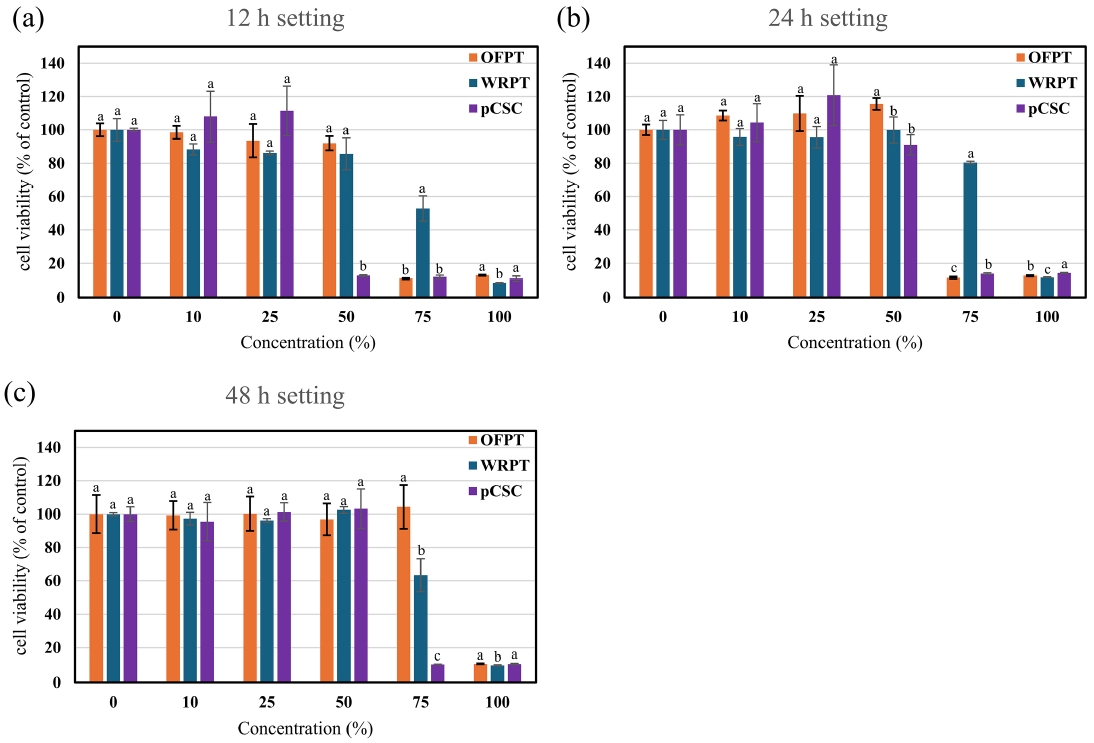
Cytotoxicity extraction assay of calcium silicate cements (CSCs). Extraction of CSCs was performed after setting for 12 h (a), 24 h (b), and 48 h (c). The extraction was serially diluted and cell viability was measured. Each value is an average of three independent experiments. Error bar indicates a standard deviation. a,b,c Different superscript letters mean significant difference between groups(P<0.05).
고 찰
본 연구에서 사용된 퍼티형 시멘트는 polyethylene glycol과 polypropylene glycol 등이 혼합되어 있어 파우더형 MTA와 같이 미리 물과 혼합할 필요가 없다(28). 그러나 재료의 경화를 위해서는 적용된 조직 부위에서 적절한 수분의 공급이 필요하며(29, 30), 충분한 경화가 이루어지지 않을 경우 밀폐능력의 감소, 강도 저하 등이 발생할 수 있다. 특히 근관 역충전의 경우 불충분하게 경화된 재료는 혈액 등에 의해 씻겨질 가능성이 있으므로(8), 신속한 경과가 중요하다 할 수 있다. 본 연구에서 파우더형 시멘트로 제조된 pCSC의 초기 경화시간은 65.7분으로 현재 치과 임상에서 일반적으로 사용되고 있는 파우더형 제품과 크게 차이가 나지 않는 것으로 판단된다. OFPT와 WRPT는 pCSC보다 짧은 초기 경화시간을 보였으며, 특히 최종 경화시간은 파우더형 보다 매우 단축된 경화시간을 나타냈다. 현재 시판되고 있는 파우더형 제품 중에서는 상당히 짧은 경화시간을 보이는 것도 있으나, OFPT와 WRPT가 일반적인 파우더형 시멘트에 비하여 경화시간으로 인한 임상적 문제는 크지 않을 것으로 판단된다. 단, 경화 방법에 따라 경화시간이 달라질 수 있어 이전의 연구 결과와의 직접적인 비교는 용이하지 않으므로 실제 측정을 통한 비교 연구가 더 필요할 것으로 생각된다(30, 31).
구강내에서 경화되는 재료의 경우, 재료 성분의 유출이 시간에 따라 달라질 수 있으므로 경화 전과 후에 대한 독성 평가를 하는 것이 바람직하다(20, 21). 일반적으로 경화 전에 재료의 성분이 더 많이 구강내로 유출될 가능성이 크며, 경화시간이 짧을수록 성분 유출이 적을 것으로 예상된다(22). 따라서 경화시간이 가장 긴 pCSC의 세포독성이 가장 강할 것으로 예측되었으며, 실제로 한천확산법과 용출법 모두에서 가장 강한 세포독성이 보였다(Figure 1, 2). OFPT는 WRPT보다 짧은 경화시간을 나타냈으나, 그 차이는 크지 않았으며, 한천확산법에 의한 세포독성 측정 결과에서는 두 그룹 모두 유사한 정도의 독성을 보였다. 용출법에서는 OFPT는 경화시간이 길어질수록 세포독성이 감소하였으나, WRPT는 48시간까지는 세포독성이 경화시간의 영향을 받지 않았다. 즉, 48시간 경화시에 OFPT는 WRPT에 비하여 세포독성물질의 유출이 신속히 발생하고 경화 후 감소하는 것으로 추측된다. 용출액 농도 100%에서는 세 그룹 모두 48시간 경화 후에도 현저한 세포활성의 저해를 초래하였다. 그러나 한천확산법에서는 48시간 경화된 시편은 탈색 zone이 나타나지 않았다. 따라서 용출법이 한천확산법보다 더 민감하게 세포독성을 검출하였다고 볼 수 있으며(32), 세밀한 독성평가가 요구되는 경우에는 용출법이 적합한 것으로 판단된다. 한천확산법에서는 세포와 시료사이에 있는 아가가 세포독성물질의 확산을 저해할 수 있으므로 용출법보다 세포독성이 낮게 관찰된 것으로 판단된다.
본 연구에서는 귀무가설은 퍼티형과 파우더형 CSC의 세포독성은 차이가 없다는 것이다. 그러나 통계분석결과, 가설은 기각되었으며 퍼티형과 파우더형 CSC의 세포독성은 차이가 있는 것으로 나타났다. 또한 경화시간을 고려하여 퍼티형 시멘트와 파우더형 시멘트의 세포독성을 비교하고자 하였다. 경화시간과 더불어 각 시멘트의 성분은 세포독성의 주요 인자이다(33). 비록 유사한 성분을 가진 시멘트들이지만, 퍼티형 시멘트의 점성을 부여하기 위하여 사용된 물질 등은 세포독성에 영향을 미칠 수 있다. 또한 in vitro에서 나타나는 세포독성이 인체내에서 반드시 유해한 결과를 초래하지는 않으므로 향후, 동물실험에서의 독성시험 평가가 필요할 것으로 보인다. MTA의 세포독성 원인의 하나로 높은 pH가 알려져 있다(33, 34). 퍼티형 시멘트 또한 경화 시 높은 pH가 예상되며, 이로 인해 세포독성이 발생할 수 있다. 따라서 파우더형 시멘트와의 pH 변화의 비교를 통하여 세포독성 차이의 원인을 찾을 수 것으로 기대된다.
결 론
본 연구의 목적은 퍼티형 시멘트와 파우더형 시멘트의 세포독성을 비교하는 것으로 퍼티형 시멘트인 OFPT와 WRPT가 파우더형인 pCSC보다 짧은 경화 시간과 낮은 세포독성을 보였다. 그리고 대체적으로 경화 시간을 늘릴수록 세포독성이 낮아졌다. 단, WRPT는 48시간까지는 세포독성이 경화시간에 의존적이지 않았다. 파우더형 시멘트에 비하여 본 연구에 사용된 퍼티형 시멘트의 낮은 세포독성은 짧은 경화 시간에 기인하는 것으로 추측된다. 마지막으로 경화시간의 차이에 따른 세포독성의 변화를 관찰하기 위하여 한천확산법보다 용출법이 더 민감한 방법으로 판단된다.
Acknowledgments
본 논문은 한국연구재단의 지원을 받아 수행된 기초연구사업임(2021R1A6A1A03039462, 2022R1A2C109198113).
References
-
Trout EA. The history of calcareous cements. Peter Hewlett ML, editor: Butterworth-Heinemann; 2019. 12p.
[https://doi.org/10.1016/B978-0-08-100773-0.00001-0]

- Witte D. The filling of a root canal with Portland cement. J Cent Assoc Ger Dent. 1878;18:153-4.
-
Torabinejad M, Watson T, Ford TP. Sealing ability of a mineral trioxide aggregate when used as a root end filling material. J Endod. 1993;19(12):591-5.
[https://doi.org/10.1016/S0099-2399(06)80271-2]

-
Lee S-J, Monsef M, Torabinejad M. Sealing ability of a mineral trioxide aggregate for repair of lateral root perforations. J Endod. 1993;19(11):541-4.
[https://doi.org/10.1016/S0099-2399(06)81282-3]

-
Torabinejad M, Chivian N. Clinical applications of mineral trioxide aggregate. J Endod. 1999;25(3):197-205.
[https://doi.org/10.1016/S0099-2399(99)80142-3]

-
Parirokh M, Torabinejad M. Mineral trioxide aggregate: a comprehensive literature review-part I: chemical, physical, and antibacterial properties. J Endod. 2010;36(1):16-27.
[https://doi.org/10.1016/j.joen.2009.09.006]

-
Camilleri J. The physical properties of accelerated Portland cement for endodontic use. Int Endod J. 2008;41(2):151-7.
[https://doi.org/10.1111/j.1365-2591.2007.01330.x]

-
Kogan P, He J, Glickman GN, Watanabe I. The effects of various additives on setting properties of MTA. J Endod. 2006;32(6):569-72.
[https://doi.org/10.1016/j.joen.2005.08.006]

-
Abdullah D, Ford TP, Papaioannou S, Nicholson J, McDonald F. An evaluation of accelerated Portland cement as a restorative material. Biomaterials. 2002;23(19):4001-10.
[https://doi.org/10.1016/S0142-9612(02)00147-3]

-
Camilleri J, Montesin FE, Curtis RV, Ford TRP. Characterization of Portland cement for use as a dental restorative material. Dent Mater. 2006;22(6):569-75.
[https://doi.org/10.1016/j.dental.2005.06.005]

-
Saghiri M, Asgar K, Lotfi M, Garcia‐Godoy F. Nanomodification of mineral trioxide aggregate for enhanced physiochemical properties. Int Endod J. 2012;45(11):979-88.
[https://doi.org/10.1111/j.1365-2591.2012.02056.x]

-
Cutajar A, Mallia B, Abela S, Camilleri J. Replacement of radiopacifier in mineral trioxide aggregate; characterization and determination of physical properties. Dent Mater. 2011;27(9):879-91.
[https://doi.org/10.1016/j.dental.2011.04.012]

-
Cavenago B, Pereira T, Duarte MAH, Ordinola‐Zapata R, Marciano M, Bramante CM, et al. Influence of powder‐to‐water ratio on radiopacity, setting time, pH, calcium ion release and a micro‐CT volumetric solubility of white mineral trioxide aggregate. Int Endod J. 2014;47(2):120-6.
[https://doi.org/10.1111/iej.12120]

-
Debelian G, Trope M. The use of premixed bioceramic materials in endodontics. G Ital Endo. 2016;30(2):70-80.
[https://doi.org/10.1016/j.gien.2016.09.001]

-
Donfrancesco O, Zanza A, Reda R, Testarelli L, Relucenti M, Seracchiani M. Comparative evaluation of marginal adaptation and dimensional stability of three bioceramic root repair materials: a VP-SEM analysis. J Compos Sci. 2024;8:294.
[https://doi.org/10.3390/jcs8080294]

-
Jeon J, Choi N, Kim S. Color change in tooth induced by various calcium silicate-based pulp-capping materials. J Korean Acad Pediatr Dent. 2021;48(3):280-90.
[https://doi.org/10.5933/JKAPD.2021.48.3.280]

-
Alnassar I, Altinawi MK, Rekab MS, Alzoubi H, Katbeh I, Altinawi Sr MK. Evaluation of bioceramic putty in pulpotomy of immature permanent molars with symptoms of irreversible pulpitis. Cureus. 2022;14(11):e31806.
[https://doi.org/10.7759/cureus.31806]

-
Jang E, Lee J, Nam S, Kwon T, Kim H. Comparison of microleakage and compressive strength of different base materials. J Korean Acad Pediatr Dent. 2021;48(2):168-75.
[https://doi.org/10.5933/JKAPD.2021.48.2.168]

-
Chae YK, Ye JR, Nam OH. Evaluation of biocompatibility and bioactive potential of Well-Root PT by comparison with ProRoot MTA and Biodentine. J Dent Sci. 2024;19:2218-25.
[https://doi.org/10.1016/j.jds.2024.03.004]

-
Jung S, Libricht V, Sielker S, Hanisch MR, Schäfer E, Dammaschke T. Evaluation of the biocompatibility of root canal sealers on human periodontal ligament cells ex vivo. Odontology. 2019;107:54-63.
[https://doi.org/10.1007/s10266-018-0380-3]

-
Lim M, Jung C, Shin D-H, Cho Y-B, Song M. Calcium silicate-based root canal sealers: a literature review. Rest Dent Endod. 2020;45(3):e35.
[https://doi.org/10.5395/rde.2020.45.e35]

-
Ma J, Shen Y, Stojicic S, Haapasalo M. Biocompatibility of two novel root repair materials. J Endod. 2011;37(6):793-8.
[https://doi.org/10.1016/j.joen.2011.02.029]

-
Son G, Seon GM, Choi SH, Yang H-C, Effects of vehicles on the physical properties and biocompatibility of premixed calcium silicate cements. Dent Mat J. 2024;43(2):276-85.
[https://doi.org/10.4012/dmj.2023-147]

- ISO 10993-12:2021 Biological evaluation of medical devices – Part 12: Sample preparation and reference materials.
- ISO 6876:2012 Dentistry: Dental Root Canal Sealing Materials.
- ISO 9917-1:2007 Dentistry. Water-Based Cements: Part 1. Powder/liquid acid-base cements.
- ISO 10993-5:2009 Biological evaluation of medical devices-Part 5: Tests for in vitro cytotoxicity.
-
Heinemann S, Rössler S, Lemm M, Ruhnow M, Nies B. Properties of injectable ready-to-use calcium phosphate cement based on water-immiscible liquid. Acta biomater. 2013;9(4):6199-207.
[https://doi.org/10.1016/j.actbio.2012.12.017]

-
Duarte MAH, Alves de Aguiar K, Zeferino M, Vivan R, Ordinola‐Zapata R, Tanomaru‐Filho M, et al. Evaluation of the propylene glycol association on some physical and chemical properties of mineral trioxide aggregate. Int Endod J. 2012;45(6):565-70
[https://doi.org/10.1111/j.1365-2591.2012.02012.x]

-
Song M, Lee S-M, Bang J-Y, Kim RH, Kwak SW, Kim H-C. Chemomechanical properties and biocompatibility of various premixed putty-type bioactive ceramic cements. J Endod. 2023;49(12):1713-21.
[https://doi.org/10.1016/j.joen.2023.09.005]

-
Kim H-J, Lee J-S, Gwak D-H, Ko Y-S, Lim C-I, Lee S-Y. In Vitro Comparison of Differences in Setting Time of Premixed Calcium Silicate-Based Mineral Trioxide Aggregate According to Moisture Content of Gypsum. Materials. 2024;17:35.
[https://doi.org/10.3390/ma17010035]

- Shafiee MAM, Asri MAM, Alwi SSS. Review on the In Vitro Cytotoxicity Assessment in Accordance to the International Organization for Standardization (ISO). Malays J Med Health Sci. 2021;17(2):261-9.
-
Bin CV, Valera MC, Camargo SE, Rabelo SB, Silva GO, Balducci I, et al. Cytotoxicity and genotoxicity of root canal sealers based on mineral trioxide aggregate. J Endod. 2012;38(4):495-500.
[https://doi.org/10.1016/j.joen.2011.11.003]

-
Silva EJ, Rosa TP, Herrera DR, Jacinto RC, Gomes BP, Zaia AA. Evaluation of cytotoxicity and physicochemical properties of calcium silicate-based endodontic sealer MTA Fillapex. J Endod. 2013;39(2):274-7.
[https://doi.org/10.1016/j.joen.2012.06.030]

